Тучные клетки и их роль в регуляции гомеостаза реферат
Обновлено: 17.05.2024
Тучные клетки бывают разных видов и от этого зависят морфологические изменения, сопровождающие их дегрануляцию: если в коже тучные клетки выделяют интактные гранулы, которые могут быть фагоцитированы фибробластами, то в легких гранулы тучных клеток растворяются внутриклеточно, и часть мембран гранул вместе с клеточной мембраной формируют каналы, через которые содержимое гранул выделяется наружу. Специфические морфологические, биохимические и функциональные черты тучных клеток диктуются специфическим микроокружением: так, тучные клетки кожи после стимуляции морфином in vitro выделяют медиаторы воспаления, а тучные клетки легких, сердца и желудочно-кишечного тракта - нет.
Конечно, гетерогенность тучных клеток выходит далеко за рамки ответа на опиаты. Кроме антигензависимой дегрануляции тучных клеток, связанной с реакцией ГНТ, существует большое количество либераторов гистамина (токсины, ферменты, лекарства, различные макромолекулы и др.), вызывающих дегрануляцию тучных клеток неиммунологическим путем.
Гистамин считается своеобразным маркером тучной клетки, но последняя выделяет большое количество медиаторов, среди которых лейкотриены С4, Д4, Е4, простагландин Д гепарин, триптаза, причем не исключается, что гистамин и другие цитокины играют роль в генезе хронического воспаления при БА, выделяясь в небольшом количестве даже в фазе ремиссии. Имеются данные об активации тучноклеточной триптазой латентной коллагеназы, что, в итоге, приводит к повреждению соединительной ткани легких. Не исключено, что различные стимуляторы выделения БАВ, воздействуя на тучные клетки, могут избирательно потенцировать выделение или синтез de novo тех или иных медиаторов: так, местное воздействие на слизистую бронхов аденозинмонофосфата достоверно повышает выделение тучными клетками вторичного медиатора-простагландина Д2, но не первичных медиаторов (гистамина и триптазы).
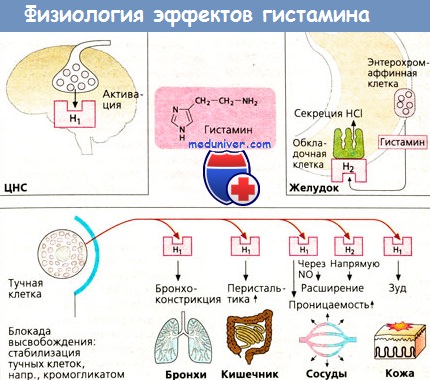
Выделены разные группы больных атопической БА с одинаково повышенным уровнем гистамина и достоверно отличавшихся по уровню гистаминазы; причем эти группы больных отличались также по клинической картине болезни; больные с более высокой активностью гистаминазы были старше, имели более длительный анамнез заболевания и более тяжелое его течение. Участие гистамина в патологических процессах в легких, как органе-мишени, не всегда сопровождается повышением уровня гистамина в крови. Показано, что в ряде случаев уровень гистамина крови после провокации аллергеном был тем меньше, чем большей была гиперреактивность бронхов. Найдено повышение содержания гистамина в конденсате влаги выдыхаемого воздуха и в мокроте больных БА и хроническим бронхитом. В.А. Гончарова и соавт. считают, что из целого ряда БАВ, выявленных в конденсате влаги выдыхаемого воздуха (серотонин, гистамин, ацетилхолин, катехоламины), у больных БА наиболее информативно повышение уровня гистамина.
У больных БА с хроническим бронхитом в ряде случаев продуцентами гистамина могут быть содержащиеся в бронхиальном дереве различные бактерии, а не тучные клетки. Вместе с тем, выделяющийся в легких свободный гистамин ответственен за начало ранней стадии воспаления. У больных БА гистамин не является, возможно, главным медиатором, но все же принимает участие в развитии отека слизистой и бронхоспазма. У некоторых больных гистамин реализует свое действие не только прямым влиянием на бронхи, но также путем усиления генерации фагоцитами активных форм кислорода. Активация тучных клеток может зависеть от тяжести течения БА. Rankin J. et al. не нашли повышения уровня гистамина в содержимом бронхоальвеолярного лаважа у больных легкой БА, в отличие от больных тяжелой БА. Гистамин повышает капиллярную проницаемость, повреждает капиллярную стенку и усиливает деполимеризацию основного вещества соединительной ткани.
Получены данные о повышении гистамином посткапиллярного сопротивления на фоне относительно постоянного значения сопротивления артериальной части сосудистого русла, что приводит к росту капиллярного гидростатического давления и усилению процессов фильтрации в легочный интерстиций. Действуя на Н1-рецепторы бронхов гистамин вызывает бронхоконстрикцию, а действие гистамина на Н1-рецепторы сосудов малого круга вызывает их сужение. Повышение давления в системе легочной артерии под влиянием гистамина связано с увеличением проницаемости гладкомышечных клеток для внеклеточного кальция и мобилизации внутриклеточного кальция. Возможно, легочная гипертензия, возникающая при гипоксической гипоксии, опосредуется тучными клетками, выделяющими гистамин. Гистамин модулирует активность многих клеток, принимающих участие в иммунном воспалении, и оказывает влияние на клеточные иммунные реакции.
Через Н1-рецепторы реализуется провоспалительный эффект гистамина, а все ингибирующие эффекты гистамина на функцию лимфоцитов и противовоспалительное действие реализуются через Н2-рецепторы, и не исключается, что одновременная стимуляция Н1 и Н2-рецепторов на иммунокомпетентных клетках приводит к развитию супрессорной активности, а дефект Н2-рецепторов при аллергических заболеваниях может иметь генерализованный характер и приводить к повышению функциональной активности Н1-рецепторов, усилению воспалительных реакций и увеличению выхода гистамина из тучных клеток. Высказывается предположение, что в ряде случаев для больных БА повышенный уровень гистамина может иметь положительное значение: благодаря существованию двух функционально противоположных типов гистаминовых рецепторов гистамин через отрицательную обратную связь играет роль ограничителя аллергического воспаления, а патологические изменения, вызванные гистамином, возникают лишь при нарушении гомеостатического механизма регуляции через систему Н1 и Н2-рецепторов, т.е. при сдвиге механизмов контроля.
Считается, что у больных аллергическими болезнями, в том числе при БА, гистамининдуцированная супрессия иммунного ответа нарушается из-за уменьшения Н2-позитивных Т-лимфоцитов, вырабатывающих HSF (гистамин-индуцированный фактор супрессии). Несмотря на многообразие действия гистамина и его роль "маркера" тучных клеток, не всегда просто выяснить его значение в патогенезе легочных заболеваний, поскольку в организме гистамин высвобождается при любой травме и находится также вне тучных клеток, являясь постоянной составной частью почти всех органов, тканей, жидких сред и выделений. Помимо тучных клеток, существенную роль в выделении гистамина могут играть базофилы, различающиеся по своей плотности и наличию в них гистамина: несмотря на небольшое содержание в крови, базофилы могут становиться многочисленными в зоне воспаления и играть важную роль в поздней фазе аллергических реакций, а также получены данные о повышенном выходе гистамина из базофилов под действием ФАТ. Существенная роль в генезе различных видов воспаления взаимодействия "тучная клетка - эозинофил" дополняется не менее важной осью "тучная клетка - нейтрофил": медиаторы тучных клеток влияют на выделение нейтрофилами свободных радикалов кислорода, а активированные нейтрофилы стимулируют выделение гистамина из тучных клеток.
Сейчас считается, что тучные клетки играют центральную роль в возникновении бронхообструкции в течение ранней астматической реакции, выделяя гистамин, простагландин Д2, цистеиновые ЛТ, ферменты (триптаза, протеаза), не только вызывающие спазм гладкой мускулатуры бронхов, но также влияющие на сосудистую проницаемость, усиливающие деятельность железистого аппарата бронхов, и разрыхляющие соединительнотканный матрикс. Привлечение различными тучноклеточными медиаторами, такими как ИЛ-3, ИЛ-4, ИЛ-5, нейтрофильный хемотаксический фактор, ФАТ, гранулоцитарно-макрофагальный колониестимулирующий фактор других клеток воспаления, приводит к развитию персистирующей воспалительной реакции в бронхах больных БА, что типично для хронического течения этой болезни, а активация протеазами тучных клеток разных коллагеназ приводит к нарушениям соединительной ткани и способствует не только хронизации воспаления, но и формированию необратимых морфологических изменений.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Цель исследования: В жизнедеятельности всех систем организма, в том числе гомеостаза, защитно-приспособительных реакций, процессов обмена веществ, кровообращения, дыхания и других, важную роль играют соединительная ткань и кровь. Среди различных клеток соединительной ткани особый интерес представляют тучные клетки (ТК), которые выполняют чрезвычайно важные функции: 1) участвуют в формировании и развитии воспалительного процесса; 2) регулируют процесс свертывания крови и обмен жиров; 3) обеспечивают постоянство состава соединительной ткани; 4) передают синтезированные ими вещества другим клеткам (трофоцитоз); 5) регулируют размножение и функцию фибробластов, лейкоцитов; 6) активно участвуют в образовании основного вещества, синтезе меланина, регуляции гомеостаза, иммунных и аллергических реакциях; 7) выделяют биологически активные вещества (гепарин, гистамин, серотонин, дофамин и др.). ТК свои сложные функции выполняют в тесной взаимосвязи с эозинофилами, базофилами, нейтрофилами и другими клетками соединительной ткани. В связи с этим, в последние годы возникло и успешно развивается новое научное направление, связанное с изучением возрастных изменений иммунных и аллергических реакций на клеточном уровне. Долгое время в медицинской науке господствовало мнение, что клетки всегда повреждаются в результате образования иммунного комплекса на поверхности их мембран. Сейчас точно установлено, что образование иммунных комплексов на поверхности клеток-мишеней не всегда сопровождается разрушением клеток. В большинстве случаев отмечается не разрушение, а возбуждение, то есть повышение их функциональной активности [8,43]. Эти сведения открывают новое перспективное направление, позволяющее разрабатывать фармакологические методы управления аллергическими реакциями. Возникает возможность, например, использовать лекарственные препараты, снижающие, то есть тормозящие возбудительные процессы в клетках.
Несмотря на то, что ТК посвящена большая литература многие аспекты их физиологии и патологии остаются нераскрытыми. Так, например, представляет большой научный интерес вопрос о возрастных особенностях реактивности ТК в норме и при аллергических реакциях. Дело в том, что ТК относятся к наиболее реактивным клеткам организма. Они быстро реагируют на различные экзогенные и эндогенные воздействия. Степень реагирования прямо зависит от силы действующего раздражителя. Изучение реактивности ТК в динамике аллергии позволяет определить патологический процесс на ранних стадиях их развития. Выяснение реактивности ТК позволяет косвенно судить об общем состоянии организма в целом. Кроме того, по показателям реактивности ТК можно объективно оценить эффективность применяемой терапии [12,221].
Выявление возрастных особенностей реактивности тучных клеток при аллергических реакциях, на наш взгляд, будет способствовать успешному решению отдельных фундаментальных аспектов Национальной программы М3 РУз по диагностике, лечению и профилактике аллергии [18,191].
Ключевые слова: тучные клетки, соединительная ткань, кровь, диагностика, лечение.
Введение: ТК и их гранулы впервые были описаны Ehrlich в 1877 году [40]. В литературе тучные клетки имеют свои синонимы: гепариоциты, лаброциты, мастоциты, тканевые базофилы. ТК встречаются везде, где имеется рыхлая волокнистая соединительная ткань, часто около мелких сосудов, под эпителием вблизи желез кожи, слизистых и серозных оболочек, в капсуле и трабекулах паренхиматозных органов, в лимфоидных органах и в перитонеальной жидкости. ТК найдены у всех видов млекопитающих и позвоночных. Однако имеются видовые, индивидуальные и возрастные особенности.
Представляет большой интерес обсуждение возрастных изменений ТК. У плода человека ТК появляются уже на 12–14-й неделе в стенке желудка, гортани, трахее и бронхах. До рождения ребенка число ТК в разных органах увеличено до максимального уровня. После рождения (в первые часы) до 70 % ТК находятся в состоянии дегрануляции и общее количество их уменьшается. Это явление связывают с механическим воздействием при родах. Затем с возрастом отмечается увеличение числа ТК. В целом полагают, что после рождения число ТК в соединительной ткани возрастает, а к пожилому возрасту снижается [33]. По мнению некоторых ученых, уменьшение числа ТК с возрастом объясняется блокадой белково-полисахаридного взаимодействия. Что касается показателя заполнения ТК гранулами. то здесь отмечается противоположное явление, то есть с возрастом процесс заполнения ТК гранулами повышается почти вдвое [34,36,42].
ТК принимают активное участие в аллергических реакциях, развивающихся по патогенезу аллергии немедленного (гуморального, химергического) типа. Это объясняется тем, что они относятся к клеткам-мишеням, на цитоппазматической мембране которых фиксируются специфические аллергические антитела (реагены). Избирательная фиксация аллергических антител на клеточной мембране ТК объясняется тем, что там имеются специальные рецепторы, предназначенные для специфических IgЕ — антител. Общее число рецепторов на клеточной мембране достигает 300.000. Рецептор представляет собой гликопротеид с молекулярной массой порядка 50000. Участок, где происходит фиксация антител является С4 домена молекулы IgЕ [13,14,28,44,51].
Аллерген, участвующий в иммунной реакции, должен быть мультивалентным, то есть содержать минимум две молекулы. Моновалентные аллергены не вызывают повышения функциональной активности ТК. Когда происходит фиксация аллергических антител на поверхности клеточной мембраны, ТК автоматически возбуждаются, что приводит к повышению их функциональной активности. Морфологически это проявляется в увеличении размера клетки, которая начинает терять свои очертания и гранулы (дегрануляция). Некоторые ученые ошибочно утверждают, что дегрануляция связана с повреждением клетки. Однако на самом деле, в большинстве случаев, при дегрануляции целостность клетки сохраняется. Об этом свидетельствует наличие следующих трёх способов секреции, то есть выделения биологически активных веществ из ТК [31,46]:
- Экзоцитозная секреция (дегрануляция без разрушения клеток); является переходной формой к апокринному типу секреции.
- Мерокринная секреция (без повреждения клетки), то есть выделение биологически активных веществ без дегрануляции ТК.
- Голокринная секреция, то есть выделение биологически активных веществ при разрушении тучных клеток.
Усиленная дегрануляция является существенным доказательством повышения функциональной активности ТК. Обычно дегрануляция сопровождается процессом восстановления гранул.
Об отсутствии разрушения ТК при аллергических реакциях свидетельствуют также следующие факты:
- Придегрануляции из тучных клеток не выходят АТФ и лактат дегидрогеназа, а также предварительно введенные в клетки радиоактивные вещества ( 4 2 К и 52 Сr).
- Противоаллергические препараты, стабилизирующие мембрану клетки, тормозят высвобождение медиаторов.
Процесс дегрануляции ТК состоит из последовательно развивающихся следующих сложных биохимических и биофизических процессов:
активация фосфолипазы при участии ионов Са 2+ —> аутокаталитическая активация эстеразы —> активация сократительных белков —> сближение и слияние перигранулярных и цитоплазматических мембран —> перемещение гранул к выходу из клетки —> увеличение пространства между гранулами и перигранулярными мембранами —> слияние перигранулярных мембран друг с другом и с общей цитоплазматической мембраной, то есть образование вакуоли —> истончение зон слияния мембраны и основание участков с повышенной проницаемостью, то есть образование пор —> выход гранул через поры во внеклеточную среду —> усиленное поступление ионов Nа + из внеклеточной среды в клетку и вытеснение биологически активных веществ из клетки во внеклеточную среду [9,47,50].
ТК клетки принимают активное участие в механизмах развития многих аллергических заболеваний: анафилактического шока, бронхиальной астмы, аллергического риносинусита, конъюнктивита, атопического дерматита, крапивницы, отека Квинке, пищевой и лекарственной аллергии, инсектной аллергии.
Клинические проявления анафилактического шока зависят от вида млекопитающих: у морских свинок преобладает острая обструкция воздухоносных путей; у кроликов острая легочная гипертензия; у собак сосудистый коллапс. К основным клиническим проявлениям АШ у человека относятся гипотония, вызванная острым периферическим сосудистым коллапсом, дыхательная недостаточность, асфиксия, вызванная ангионевротическим отеком гортани или острым бронхоспазмом. Симптомы АШ обычно проявляются через несколько секунд или минут после повторного контакта предварительно сенсибилизированного организма со специфическим аллергеном. Различие во времени проявления реакции зависит от путей проникновения в организм аллергена: при внутривенном — быстро, подкожном — позже. Основная непосредственная причина гибели организма — дыхательная недостаточность (70 %), сердечно-сосудистая недостаточность (24 %).
Патоморфологические исследования погибших от АШ выявляют — острое вздутие и отек легких: отек гортани, застойные явления во внутренних органах; повышение проницаемости сосудов и кровоизлияния в альвеолах: уртикарные высыпания; ангионевротические отеки. При микроскопическом исследовании выявляют невоспалительный отек, повышенное количество секрета в воздухоносных путях, эозинофильные инфильтраты в стенке бронхов. При летальных исходах от АШ повреждение миокарда отмечается в 80 % случаев.
Бронхиальная астма (БА) типичное аллергическое заболевание, характеризующееся полностью или частично обратимой обструкцией воздухоносных путей, воспалением и гиперреактивностыо бронхов [10,21,231]. В патогенезе бронхиальной астмы большое значение имеют ТК. В результате возбуждения их из-за взаимодействия аллергена со специфическими аллергическими антителами (IgЕ -антитела), отмечается дегрануляция и высвобождающиеся биологически активные вещества вызывают острый бронхоспазм, в результате чего развивается приступ удушья [11.20,38,48].
Патогенез аллергических ринитов определяют ТК, расположенные в больших количествах в слизистой и подслизистой оболочках носа и его придаточных пазух. При повторных воздействиях аллергена отмечается массивная дегрануляция ТК. Высвобождение гистамина и других биологически активных веществ, которые и определяют клиническое течение болезни. Выяснено, что нередко аллергические риносинуситы в последующие годы трансформируются в БА [16.17,29].
ТК играют важную роль в патогенезе аллергического конъюнктивита, крапивницы, отека Квинке, пищевой, лекарственной и инсектной аллергии [35,45]. Они принимают активное участие и в механизме псевдоаллергических реакций [11,37.49,50].
Вывод: Таким образом, анализ современной литературы свидетельствует, что проблема реактивности ТК при аллергии является актуальной. Разрабатываются различные аспекты этой проблемы. Однако мало сведений, посвященных изучению особенностей реактивности ТК при аллергии в онтогенезе. Между тем выяснение возрастных особенностей реактивности этих клеток при аллергических реакциях имеет определенное теоретическое и практическое значение.
Нами установлены возрастные особенности реактивности, количественного содержания, заполнения клеток гранулами, функциональной активности тканевых (брыжейка тонкой кишки) и перитонеальных ТК у интактных морских свинок. Выявлено, что организм морских свинок в раннем постнатальном онтогенезе (новорожденные, двухнедельные) реактивен на экзогенное аллергенное воздействие. Определено, что реактивность ТК морских свинок с возрастом повышается и у одномесячных достигает уровня реактивности половозрелых. ТК морских свинок раннего возраста принимают активное участие в механизмах развития аллергических реакций немедленного (анафилактического) типа [3,4]. Таким образом, очень велика роль ТК в возникновении аллергического раздражении организма с появлением основных признаков.
Основные термины (генерируются автоматически): АША, реакция, активное участие, анафилактический шок, летальный исход, соединительная ткань, бронхиальная астма, вещество, возрастная особенность реактивности, функциональная активность.
Роль тучных клеток в регуляции гомеостаза организма. Локализация тучных клеток, их медиаторы. Секреция медиаторов и их функции. Основные типы тучных клеток. Рецепторы и лиганды, эффекты медиаторов. Участие тучных клеток в патологических процессах.
| Рубрика | Медицина |
| Вид | презентация |
| Язык | русский |
| Дата добавления | 16.01.2014 |
| Размер файла | 2,2 M |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
HTML-версии работы пока нет.
Cкачать архив работы можно перейдя по ссылке, которая находятся ниже.
Подобные документы
Классификация аллергических реакций. Реагиновый механизм на поверхности мембран базофилов и тучных клеток. Реакции замедленного типа. Механизм воздействия попадающего в организм аллергена на сенсибилизированные лимфоциты с секрецией различных медиаторов.
презентация [84,2 K], добавлен 24.05.2014
Понятие о гиперчувствительности – чрезмерном или неадекватном проявлении реакций приобретенного иммунитета. Стадии аллергической реакции. Эффект медиаторов тучных клеток. Диагностика атопий, кожные симптомы. Цитотоксические реакции против эритроцитов.
презентация [4,7 M], добавлен 13.09.2015
Основное свойство стволовых клеток - дифференциация в другие типы клеток. Виды стволовых клеток. Рекрутирование (мобилизация) стволовых клеток, их пролиферация. Болезни стволовых клеток, их иммунология и генетика. Генная терапия и стволовые клетки.
курсовая работа [94,3 K], добавлен 20.12.2010
Понятие и функции стволовых клеток, их типы в зависимости от способов получения, потенциал. Характеристики эмбриональных стволовых клеток. Дифференцировки стволовых клеток костного мозга. Органы и ткани, которые ученые смогли вырастить с их помощью.
презентация [817,5 K], добавлен 04.11.2013
Ознакомление с понятием и историей использования стволовых клеток. Рассмотрение особенностей эмбриональных стволовых клеток, геном которых находится в "нулевой точке", а также соматических - клеток взрослого организма. Основы процесса регенерации.
реферат [22,6 K], добавлен 21.05.2015
Закладка и первичная дифференцировка парафолликулярных клеток щитовидной железы человека, их значимость в регуляции процессов жизнедеятельности. Цитология и физиология С-клеток щитовидной железы. Медуллярный рак как один из видов злокачественной опухоли.
реферат [21,5 K], добавлен 21.03.2011
Роль клеток миелоидного и лимфоидного рядов в функционировании иммунной системы. Комплементарная система как составляющая врожденного иммунитета. Положительная и отрицательная селекция развивающихся Т-клеток в тимусе и вне его. Этапы развития В-клеток.
Рева Г.В. 1 Русакова Е.Ю. 1 Толмачёв В.Е. 1 Первов Ю.Ю. 1 Разумов П.В. 1 Игнатенко К.А. 1 Голенкова Н.А. 1 Погорелый В.В. 1 Игнатьев С.В. 1 Денисенко Ю.В. 1 Рева И.В. 1
Изучена возрастная динамика тучных клеток в системе пародонта у детей. Проведён иммуногистохимический мониторинг тканевых базофилов при патологии пародонта и на фоне применения иммуномодулирующих препаратов. Установлено, что иммуномодулирующие препараты способствуют снижению количества активных тканевых базофилов и ускоряют процессы репаративной регенерации структур пародонта после удаления зубов. Сделан вывод об индуцирующем влиянии иммуномодуляторов на репаративные процессы в пародонте в условиях воспалительных процессов через механизмы снижения проницаемости основного вещества соединительной ткани и усиления синтетических процессов.

1. Роль тучных клеток слизистой оболочки десны в патогенезе воспалительных заболеваний пародонта / Ю.Л. Осипова, Н.В. Булкина, А.Ю. Кропотина, Н.А. Хариш, О.Ю. Гусева, Ю.Н. Альбицкая // Успехи современного естествознания. – 2009. – № 7 – С. 55–56.
3. Galli, S.J., Maurer M., Lantz, C.S. Mast cells as sentinels of innate immunity // Curr. Opin. Immunol. – 1999. – №11. – С. 53–59.
4. Galli, S.J., Nakae, S., Tsai, M. Mast cells in the development of adaptive immune response // Nat. Immunol. – 2005. – №6. – С. 135–142.
5. The significant role of mast cells in cancer / K. Khazaie, N.R. Blatner, M.W. Khan, F. Gounari, E. Gounaris, K. Dennis, A. Bonertz, F.N. Tsai, M.J. Strouch, E. Cheon et al. // Cancer Metastasis Rev. 2011 Mar; 30(1):45–60.
6. Marie Fischer1,2, Ilkka T. Harvima3, Ricardo F.S. Carvalho1, Christine Möller1, Anita Naukkarinen4, Gunilla Enblad2 and Gunnar Nilsson. Mast cell CD30 ligand is upregulated in cutaneous inflammation and mediates degranulation-independent chemokine secretion // J Clin Invest. – 2006. – №116(10). – С. 2748–2756.
7. Mast cell-derived TNF contributes to airway hyperreactivity, inflammation, and TH2 cytokine production in an asthma model in mice / S. Nakae, L.H. Ho, M. Yu, R. Monteforte, M. Iikura, H. Suto, S.J. Galli // Allergy Clin Immunol. – 2007 Jul. – №120(1). –С. 48–55.
8. A critical role for mast cells and mast cell-derived IL-6 in TLR2-mediated inhibition of tumor growth / S.A. Oldford, I.D. Haidl, M.A. Howatt, C.A. Leiva, B. Johnston, J.S. Marshall // J Immunol. – 2010. – Dec 1. – №185(11). – С. 7067–76.
9. Prussin C., Metcalfe D.D. IgE, mast cells, basophils, and eosinophils // J Allergy Clin Immunol. – 2003. – 111 (2 Suppl): S486–94. doi:10.1067/mai. 2003.120.
10. Pulendran B., Ono S.J. A shot in the arm for mast cells // Nat. Med. – May 2008. – №14 (5). – С. 489–90.
11. Saito H. et al. Selective growth of human mast cells induced by Steel factor, IL-6, and prostaglandin E2 from cord blood mononuclear cells // J. Immunol. – 1996. – №157. – С. 343–350.
12. Wilhelm M., Silver R., Silverman A.J. Central nervous system neurons acquire mast cell products via transgranulation // Eur. J. Neurosci. – November, 2005. – №22 (9). – С. 2238–48.
Многолетние наблюдения за больными с поражениями зубов, которые встречаются в детском возрасте, такими, как периодонтит, свидетельствуют о высокой актуальности исследований, ведущихся в направлении поисков ключевого морфологического субстрата, являющегося ведущим в развитии различных патологических процессов в полости рта [1, 9]. Одним из важнейших механизмов, обеспечивающих все этапы перестройки периодонта в онтогенезе человека, является гомеостаз в системе иммунофагоцитарного звена. Несмотря на многочисленность работ, посвящённых изучению тучных клеток в различных тканях и органах [2, 5, 12], их роль в патологии пародонта окончательно не выяснена, отсутствуют данные системных наблюдений тучных клеток в тканях пародонта в условиях физиологической и репаративной регенерации, алгоритм их количественных и качественных изменений на фоне применения иммуномодулирующих препаратов.
Целью нашего исследования является совершенствование методов диагностики, лечения и профилактики стоматологических заболеваний у детей. В связи с этим в работе решались следующие задачи:
провести анализ применения различных иммуномодулирующих лекарственных средств в лечении стоматологической патологии у детей;
разработать алгоритм патогенетически обоснованного лечения и профилактики стоматологической патологии у детей с учётом иммунного гомеостаза пародонта в различных возрастных группах.
Материалы и методы исследования
Клиническая характеристика материала
Обследованы 360 детей Приморского края, проживающих в сельской и городской местности. В комплекс исследования входили методы: эпидемиологический, статистический, лабораторный, анкетирование. Осмотры и лечебные мероприятия проводились в условиях школьных стоматологических и медицинских кабинетов с использованием стерильных наборов пародонтальных зондов и стоматологических зеркал. По клиническим показаниям удаление зубов проведено у 117 детей. Одновременно с экстирпацией производили забор биоптатов пародонта размерами 0,3×0,3 мм. В случаях с предшествующими экстирпации зубов воспалительными процессами в периодонте применяли иммуномодулирующий препарат имудон. Учитывали детей сельской местности и городской. Распределение детей также провели по возрастным группам, рекомендованным ВОЗ (2009).
Подсчёт клеток производили в 100 полях зрения в 60 срезах. При этом подсчитывали общее количество иммуноцитов в поле зрения и анализировали степень их окрашивания.
Фон и неспецифическое окрашивание исключали, строго соблюдая условия окрашивания - температуру, рН, время. Для блокирования неспецифического окрашивания срезы в течение 20 минут инкубировали с неиммунной сывороткой, а уже затем инкубировали с первичными антителами. Для контроля и исключения артефактов при выполнении исследований, часть препаратов обрабатывали дважды только не иммунной сывороткой.
Все статистические данные получены с помощью компьютерного программного обеспечения микроскопа Olympus BX51и цифровой камеры CD25 фирмы Olympus.
Результаты исследования и их обсуждение
Макроскопические анатомические исследования и микроскопическое изучение периодонта приводят к мнению о важнейшей роли его структур в поддержании гомеостаза пародонта. Поэтому полученные в исследовании результаты дают более глубокие представления о структуре, физиологической регенерации, физиологии и роли пародонта в нормальном функционировании. Как и другими исследователями, нами установлено, что периодонт представлен особым видом соединительной ткани, состоящей из клеток и коллагенового волокнистого остова, окружённого аморфным основным веществом. Во все периоды онтогенеза человека формирующийся периодонт человека участвует в трофическом обеспечении метаболических потребностей зубов. Изменение клеточных взаимодействий в системе периодонта - процесс, обеспечивающий регенераторные процессы, как физиологические, так и репаративные [3]. Одним из важнейших механизмов, обеспечивающих все этапы перестройки периодонта в онтогенезе человека, является гомеостаз в системе взаимодействий иммунофагоцитарного звена. Деструкция и инволюция периодонта, нарушение межклеточных взаимодействий в системе периодонта, является одним из пусковых механизмов патологии зубочелюстного аппарата. Иммуномоделирование в механизмах репаративной регенерации периодонта является одним из основных в регуляции взаимоотношений структур пародонта.
Нами установлено, что при удалении зуба альтерация слизистой оболочки сопровождается отёком и выраженной инфильтрацией клеток крови в соединительную ткань пародонта (рис. 1).
Отмечено, что в повреждённую ткань после экстирпации зубов мигрирует большое количество базофилов, идентифицируются тучные клетки (рис. 2).
Дополнительное подтверждение наличия миграции в повреждённую ткань тучных клеток мы получили с помощью метода маркировки CD 204 клеток иммунофагоцитарного звена, соответствующих тучным клеткам (рис. 3).
Тучные клетки периодонта, благодаря наличию в них биогенных аминов, представляют мощное звено, определяющее развитие и регуляцию гомеостатических и компенсаторных механизмов при травме и инфекциях периодонта.
Как и другими авторами, нами отмечено, что коэффициент дегрануляции и коэффициент функциональной напряженности тканевых базофилов в сосудистой и межсосудистой областях периодонта являются критерием устойчивости системы тучных клеток к действию стрессирующего фактора [4, 6]. Критический период их активности отмечается через 20-30 минут после травмы, лабильность системы - через 2-3 часа, истощение компенсаторных механизмов отмечается через сутки после травмы.

Рис. 1. Инфильтрация клеток крови в соединительную ткань пародонта. Микрофото. Ув. Х 200. Окраска г/э. Идентифицируются лейкоциты

Рис. 2. Тучная клетка в пародонте. Микрофото. Ув. Х 400. Окр. метиленовым синим
В процессе патологического процесса в периодонте первоначально происходит активное перераспределение крови, которое определяет защитные гомеостатические механизмы, осуществляемые, в том числе, тучными клетками. Наименьшая устойчивость к действию повреждающего фактора отмечается в зоне верхушки корня зуба, наиболее устойчивой является область периодонта второй трети корня зуба.
Результаты биохимического анализа содержания биогенных аминов в крови человека определяют степень устойчивости к действию стрессирующего фактора. Высокий коэффициент отношения катехоламинов к серотонину является показателем устойчивости клеточных взаимодействий при развитии патологических реакций в системе пародонта и определяет, в конечном итоге, прогноз в течение патологического процесса с вовлечением тучных клеток [10].
Параллельное определение уровня биогенных аминов в крови детей, имеющих патологический процесс в периодонте, является важнейшим показателем степени нарушения периодонтального кровообращения и фактором, определяющим назначение патогенетически обусловленного лечения лекарственными препаратами.

Рис. 3. Тучные клетки в пародонте. Микрофото. Ув. Х 400. Окр. ИГХ
Ранняя коррекция в системе тканевых базофилов, осуществляемая через биогенные моноамины, может быть одним из основных факторов, определяющих исход травматических и инфекционных поражений периодонта, как и других структур организма [8]. В молочных и несформированных постоянных зубах заболевание часто протекает с закрытой полостью зуба и при неглубокой кариозной полости. Также особенностью периодонтита у детей является преобладание гранулирующей формы хронического периодонтита, при этом часто наблюдается патологическая резорбция корней этих зубов. Нами отмечено, что гранулирующая форма периодонтита у маленьких детей сопровождается образованием свища на десне чаще, чем у подростков и взрослых. Отмечается довольно частое разрежение кости в области бифуркации корней, превышающее таковое у верхушки корня на фоне периодонтита.
Нами установлено, что у детей, получивших до экстирпации зуба препараты иммуномоделирующего действия (имудон и др.), имеют повышенные количественные показатели тучных клеток в тканях пародонта, клинически нами установлено более быстрое завершение репаративной регенерации. Это может быть связано с тем, что тучные клетки, выделяя специфические цитокины для привлечения макрофагов, вызывают ускорение процессов фагоцитоза повреждённых тканей [1, 4]. Одновременно они, выделяя медиаторы гистамин и гепарин, изменяющие проницаемость стенки сосудов и межклеточного вещества структур периодонта, способствуют усиленной миграции антиген представляющих и фагоцитирующих иммуноцитов в зону альтерации [7, 12].
Полученные результаты свидетельствуют о важности применения иммуномодулирующих препаратов у детей с патологией пародонта вне зависимости от необходимости проведения экстирпации зубов, как влияющих через тучные клетки на систему клеток иммунофагоцитарного звена и ускоряющих репаративную регенерацию.
Красников Ю.А., д.м.н., профессор кафедры хирургии Дальневосточного федерального университета, г. Владивосток.
Усов В.В., д.м.н., профессор, зав. кафедрой Дальневосточного федерального университета, г. Владивосток.

Тучные клетки (ТК) представляют собой гетерогенное семейство. Один фенотип - ТКт, клетки, которые содержат только один фермент - триптазу; а другой - ТКтх, клетки, содержащие два фермента - триптазу и химазу. Эти субпопуляции охарактеризованы по-разному: ТКт - как клетки, зависимые от иммунной системы (ИС) и, как правило, располагающиеся в участках Т-клеточной инфильтрации; число этих клеток снижается при различных иммунодефицитных состояниях. Современные представления о физиологической роли ТК свидетельствуют об их участии во врождённом и приобретённом иммунитете. Эта роль, в первую очередь, проявляется в защите против различных бактерий и вирусов, и убедительно доказана во многих экспериментах на животных, а также в клинических наблюдениях. ТКтх - клетки, функционирование которых непосредственно не связано с ИС; они участвуют в ангиогенезе, развитии и дифференцировке нервных клеток, тканевом ремоделировании. Фенотип ТК может изменяться в соответствии с микроокружением. Функционирование всех клеток ИС зависит от нейроиммунологических взаимодействий. Можно полагать, что ТК являются одним из наиболее активных участников этого взаимодействия.
Цель работы - анализ современного состояния представлений о взаимоотношения ТК и нервной системы. Установлено, что многие цитокины (ЦК) и медиаторы, продуцируемые ТК, особенно гистамин, ГМ-КСФ, ИЛ-8, ИЛ-13, лейкемический ингибиторный фактор (LIF), фактор роста нервных клеток (NGF), влияют на рост и дифференцировку нервных клеток. Ряд факторов, продуцируемых клетками нервной системы, модулируют функции ТК: субстанция Р, нейротонин и др. Разнообразные факторы тучных и нервных клеток создают своеобразную уникальную систему взаимодействия, значение которой в функционировании ИС и нервной системы очень велико. Действие факторов ТК на нервные клетки очень разнообразно. Так, LIF - полипотентный ЦК, регулирует воспаление и иммунный ответ, играет роль в развитии нейронов, гемопоэзе, метаболизме мозга и острофазного ответа; продукция этого фактора усиливается под влиянием стимуляторов ТК. Выяснено, что особое место во взаимодействии между ТК и нервной системой занимают NGF и гистамин, которые проявляют выраженную биологическую активность в отношении обоих типов клеток. Как оказалось, ТК и нервные клетки экспрессируют рецепторы к ним; NGF продуцируется ТК, эозинофилами, клетками лимфоидной системы, а гистамин - ТК, базофилами, эозинофилами, нервными клетками.
Установлено, что NGF несёт ответственность за выживаемость нейронов, его концентрация увеличивается в участках воспаления параллельно с ростом числа ТК. Он влияет на дифференцировку, хемотаксис и выделение медиаторов преимущественно клетками воспаления и поэтому рассматривается как модулятор воспаления и ремоделирования. Предполагается и его участие в контроле за адренокортикоидной активностью. NGF проявляет себя как фактор дифференцировки ТК, влияет на их выживаемость и функционирование, защищает от апоптоза, увеличивает их число, индуцирует продукцию простагландина Е2 и в низких дозах - LIF, не влияя на пролиферативную активность. Выяснено, что ТК продуцируют и нейтрофины, в частности нейтрофин-4, который, как и NGF, играет важную роль в патофизиологии воспалительных заболеваний.
Если принять во внимание большое количество клеток системы иммунитета, а также нервных, которые экспрессируют рецепторы для гистамина, то не будет ошибочным вывод, что гистамин является важным связующим звеном во взаимоотношениях нервной и иммунной систем. Поэтому не случайно именно с воздействием на рецепторы гистамина с помощью различных фармакологических средств возможна модуляция соответствующих клеток как нервной, так и иммунной системы. Можно констатировать, что ТК являются физиологическим фактором регуляции иммунного и нервного гомеостаза.
Читайте также:

