Становление иммунной системы в онтогенезе реферат
Обновлено: 05.07.2024
В статье рассмотрены аспекты формирования иммунитета в различные периоды жизненного цикла человека. В зависимости от стадии жизненного цикла происходит перераспределение энергии, выделяемой организмом на различные физиологические функции – поддержание метаболизма, рост, размножение, защиту и репарацию.
Ключевые слова: жизненный цикл, иммунитет.
Trotsenko A.A.
Ph.D, Biology, Murmansk Branch of Saint-Petersburg University of State Fire Service of The Ministry of the Russian Federation for Civil Defense, Emergencies and Elimination of Consequences of Natural Disasters
PECULIARITIES OF IMMUNITY FORMATION AT DIFFERENT STAGES OF HUMAN LIFE-CYCLE
Abstract
This article considers the aspects of immunity formation at different stages of human life-cycle. The energy, produced by a human organism for various physiological functions, namely metabolism maintenance, growth, reproduction, protection, reparation is redistributed in accordance with the life-cycle stage.
Keywords: life-cycle, immunity
Защищая организм от инфекционных заболеваний и новообразований в течение жизни, иммунная система выступает основной причиной выживания, а, соответственно, влияет на ход процесса эволюции. Иммунная система призвана также осуществлять контроль над постоянством внутренней среды организма – гомеостазом.
В постнатальном периоде наблюдается активизация специфического иммунитета, что связано с удалением антигенов, переданных трансплацентарно от матери, и с новыми экологическими условиями после рождения. Этим объясняют восприимчивость к респираторными инфекциям детей раннего возраста [1].
Итак, специфические реакции активизируются преимущественно при образовании или проникновении в организм антигенов. В остальные периоды жизненного цикла энергетические затраты на эти функции невелики. Неспецифические же иммунные функции являются очень затратными и потребляют большое количество ресурсов для поддержания нормальной жизнедеятельности в течение всего онтогенеза. Неспецифические реакции плода и новорожденного существенно отличаются от иммунного ответа организма ребенка старшего возраста или взрослого человека как в качественном, так и в количественном отношении. Например, фагоцитарная активность клеток крови, как один из показателей неспецифического иммунитета, у здорового человека – величина сравнительно постоянная. У детей в возрасте до года фагоцитарная активность повышена, а у лиц пожилого возраста понижена. У детей старших возрастных групп фагоцитарная активность существенно не отличается от таковой у взрослых [2, 3].
Эумикробиозы всех полостей, слизистых оболочек, покровных тканей организма формируются в соответствии с индивидуальным развитием человека и иммунотропными экофакторами. Чем моложе ребенок, тем более чувствителен его организм к патогенным факторам внешней среды. Есть мнение, что в раннем постнатальном и пубертатном периодах наблюдается органная и внутрисистемная гетерохрония развития и как следствие – неравномерность развития адаптационных процессов [4]. В эти периоды активизируются специфические реакции крови, в то время как показатели неспецифического иммунитета формируются уже в процессе взросления. Высокий уровень инфекционных заболеваний в младенчестве влияет в дальнейшем на реакции специфического иммунитета при вакцинации в подростковом возрасте. Поэтому и в раннем постнатальном, и в пубертатном периодах жизненного цикла организм чувствителен к патогенной микрофлоре из – за уменьшения энергозатрат на функционирование анатомо-физиологического барьера.
Адаптация организма к факторам окружающей среды сопровождается изменениями неспецифических функций крови и имеет огромное значение как для плода, так и для детей первых дней и месяцев жизни. Поэтому формирование неспецифического иммунитета в эти периоды жизненного цикла более энергетически затратно. В процессе эволюции неспецифические реакции крови значительно усложнились и усовершенствовались. Гемопоэз у детей имеет выраженную склонность к процессам регенерации. У здорового ребенка состав крови постоянен за счет четкой координации процессов кроветворения и кроверазрушения. Лейкоцитарная ткань представляет собой генетически и функционально обособленную систему, тесно связанную с другими тканями организма и выполняющую различные физиологические функции. Материальным субстратом ее являются лейкоциты, которые в зависимости от вида обладают различным строением, химическим составом и ферментативной активностью, обусловленными различием в их происхождении и функциях. Например, количество нейтрофильных лейкоцитов достигает максимума у детей в первые дни жизни, а к 13-15 годам достигает значений взрослого. Свидетельств о половых различиях в количестве нейтрофилов крови нет [3].
Важно отметить онтогенетические особенности биохимических показателей крови. Итак, любая из защитных реакций организма, будь то участие клеток в процессе фагоцитоза, морфологическая перестройка органов лимфатической системы для участия их в иммунологическом процессе или ответная реакция на вирусное заболевание, сопровождается расходом энергии – гликогена. Лимфоциты крови детей богаче гликогеном, в них выше активность ферментов окислительного обмена, чем в лимфоцитах взрослых. Цитотоксическое действие лимфоцитов как участников клеточного иммунитета слабее выражено у новорожденных детей, чем у взрослых. У грудных детей активность, например, щелочной фосфатазы в нейтрофильных лейкоцитах, наоборот, высокая, что объясняется интенсивным ростом организма; однако, в пубертатный период уровень фермента снижается и достигает уровня взрослых. Повышение фермента отмечается при бактериальных воспалениях, интоксикациях, обострении хронической инфекции, ожогах. Щелочная фосфатаза по сравнению с другими гематологическими показателями (эритроциты, лейкоциты, лейкоформула и др.) является более чувствительной к изменениям гомеостаза. Также особенности функциональной (биохимической) активности лейкоцитов объясняются высокой чувствительностью системы крови к влиянию гормонов в пубертатный период [3].
Экологические, социально – экономические и другие факторы способны нарушить процессы перераспределения энергии между иммунными функциями организма. При исследованиях изменений иммунного статуса человека учитывается вклад в эти изменения не только наследственных, экологических и онтогенетических факторов, но и влияние стресса и социально – экономических факторов.
Синергическое влияние недоедания на рост и развитие ребенка хорошо изучено, однако мало данных о роли иммунной системы в этом процессе как посредника. Условия питания в раннем возрасте могут влиять на организацию важных специфических иммунных процессов и клеточного иммунитета. Иммунная функция нуждается в большом количестве ресурсов, но ограничение поступления ресурсов может нарушить функционирование других систем. Клеточный иммунитет и анатомо-физиологический барьер чувствительны к нехватке питательных веществ и макроэлементов. В частности, при нехватке ионов железа повышается количество лимфоцитов в периферической крови и снижается функция анатомо-физиологического барьера.
Потери иммунитета в пользу репродуктивной деятельности у женщин носят прямой характер и требуют больших энергетических затрат при беременности и кормлении грудью, что вызывает снижение Т – лимфоцитов и нейтрофилов в крови и активизацию бактерицидной функции кожи и слизистых оболочек. В то время как у мужчин, ввиду отсутствия детородной функции, энергетические затраты на репродуктивный период могут быть минимальны. Тем не менее, интенсивное развитие и сохранение других характеристик (увеличение мышечной массы, укрепление и закаливание иммунной системы, совершенствование интеллектуального потенциала, повышение стрессоустойчивости и др.) может восприниматься как немалый вклад энергии в генетическую составляющую репродуктивного процесса.
У мужчин с симптомами инфекции нижних дыхательных путей в крови большая концентрация мужского гормона – тестостерона, свидетельствующие о том, что ресурсы необходимые для иммунной защиты, были использованы на поддержание репродуктивной деятельности. Противоположные результаты при изучении взаимосвязи агрессии и иммунной функции мужчин, где связь между иммунитетом и тестостероном носила положительный характер. Стресс разного уровня снижает количество лимфоцитов в периферической крови человека. Однако, данные о влиянии стресса на функционирование неспецифического иммунитета практически отсутствуют. На рисунке 1. представлен примерный вклад некоторых факторов, влияющих в целом на иммунную функцию в течение жизненного цикла человека.

Рис. 1 – Вклад различных факторов в развитие иммунной системы в течение жизненного цикла [5].

Кровь и иммунная система в период раннего эмбриогенеза развиваются параллельно. Возникающие при этом очаги гемопоэза, разделенные в анатомическом пространстве и времени, дают начало циркулирующим и резидентным иммунным клеткам. Предыдущие исследования основывались на животных моделях, которые отличаются от людей как сроками развития, так и набором микроорганизмов, с которыми они взаимодействуют. Определение состава иммунной системы человека в настоящее время возможно благодаря использованию мультиомиксного подхода к единичной клетке. Крупномасштабная одноклеточная геномика, технологии визуализации и инициатива Human Cell Atlas вместе позволили осуществить картирование на уровне развивающейся иммунной системы человека и возникающих в ходе развития свойств. Хотя точные роли специфических иммунных клеток в процессе эмбриогенеза требуют дальнейшего изучения, система в целом проявляет гибкие свойства и высокую чувствительность в соответствии с потребностями развития и проблемами окружающей среды.
Животные модельные системы предоставили фундаментальные доказательства, которые формируют наше понимание процесса развития гемопоэза. Исследования, проведенные на мышах, рыбах данио-рерио и курах, показали, что гемопоэз и иммунногенез происходят в разных анатомических участках (рис. 1). Первые клетки крови развиваются вне зародыша и в условиях тесной связи с эндотелиальными клетками желточного мешка [1]. Эмбриональные гемопоэтические стволовые клетки (ЭГСК), способные репопулировать при трансплантации в организм взрослого хозяина, происходят из области аорто-гонадо-мезонефроса (АГМ) [2]. Печень и костный мозг плода (КМ) впоследствии наполняются как предшественниками, полученными из желточного мешка, так и ЭГСК, поступающими из АГМ [3].
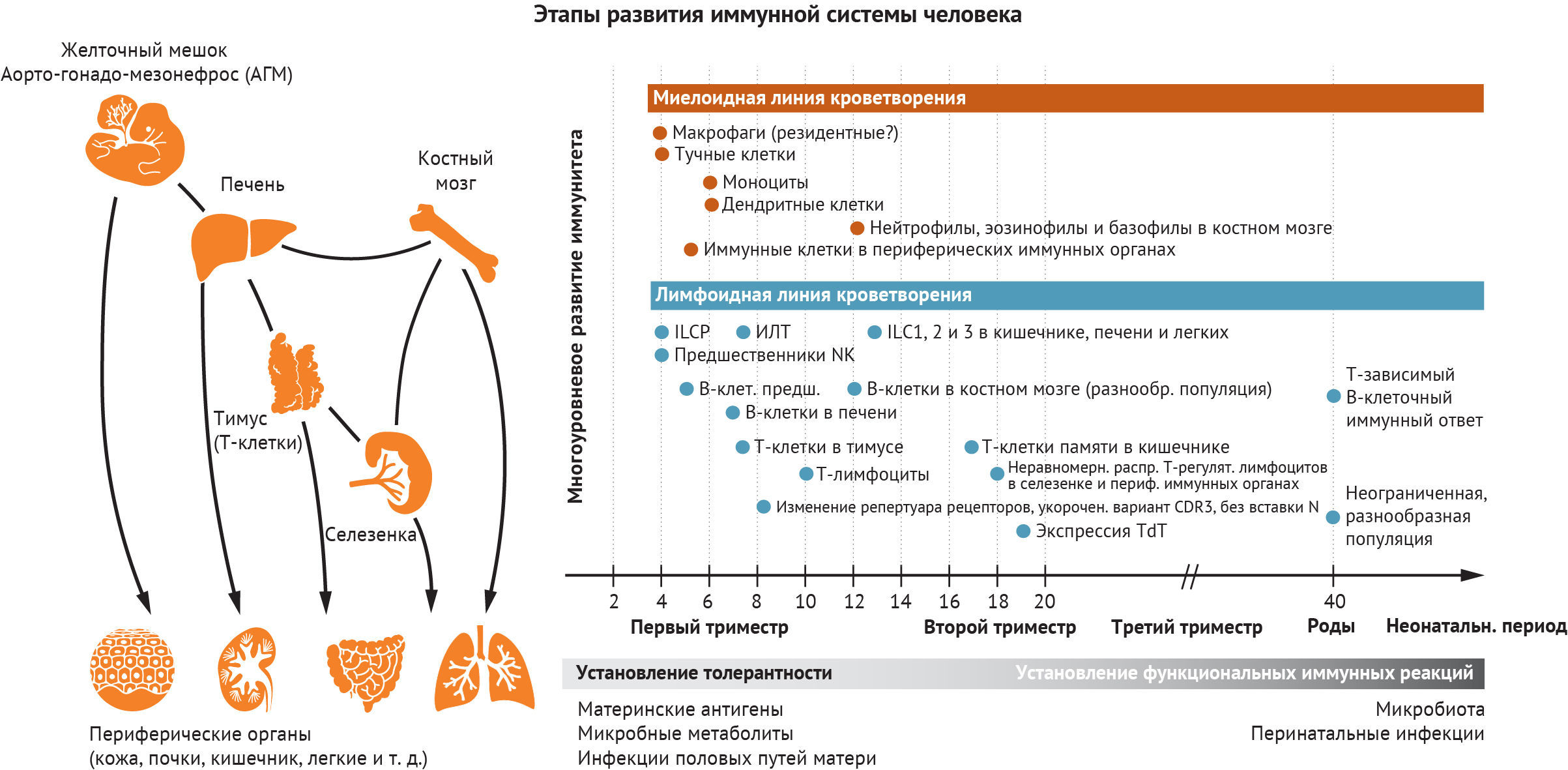
Гемопоэз и развитие иммунной системы в начале жизни происходит в нескольких анатомических пространствах. Основной сайт кроветворения изменяется от внеэмбрионального желточного мешка до внутриэмбрионального АГМ, печени и КМ. Дифференцировка и созревание Т-клеток ограничены тимусом. Иммунные клетки заселяют другие лимфоидные и периферические органы, включая лимфатические узлы, кожу, кишечник, почки и легкие, и адаптируются к среде соответствующего органа. Различные типы иммунных клеток развиваются и созревают на разных стадиях беременности, что необходимо для установления иммунологической толерантности и функциональной реакции на основе потребностей развития. Это подготавливает развивающийся эмбрион и плод к воздействию антигенов как во время беременности, так и после родов. ILCP, предшественник ILC; CDR3, дополнительная определяющая область 3; TdT, терминальная дезоксинуклеотидилтрансфераза.
Для того, чтобы проанализировать развитие элементов крови ииммунной системы в пренатальном периоде, необходимs высокоэффективные средства. Секвенирование РНК единичных клеток (scRNA-seq) стало мощным инструментом для комплексного понимания иммунной системы, позволяя объективно определять состояние клеток и изучать сложные и гетерогенные многоклеточные структуры [5]. Методы капельного секвенирования scRNA-seq, такие как 10X, теперь масштабируются до такой степени, что становится возможным адекватно проанализировать целые органы. Так, авторы создали профили отдельных клеток из желточного мешка и печени для реконструкции раннего кроветворения, из тимуса — для изучения развития Т-клеток, из кожи и почек — для выяснения заселения иммунными клетками периферических органов [4, 6]. Вычислительные методы позволили сравнить состояния клеток в разных тканях и предсказать важнейшие взаимодействия рецепторов и соответствующих лигандов, которые играют критическую роль в формировании судьбы иммунных клеток в определенных тканях [7].
Корреляция с методами визуализации — например, транскриптомикой in situ, — позволила провести комплексную характеристику микроокружения тканей [4, 7–9]. Траектории развития были прослежены по отдельности для каждой ткани, так как клетки просматривались на разных стадиях дифференцировки и путем интеграции образцов из разных гестационных возрастов. Этот метод позволяет осуществить всестороннее изучение внутриутробного развития иммунитета. Между тем, на сегодняшний день сохраняются значительные проблемы в отслеживании происхождения определенных иммунных клеток по отдельным очагам кроветворения. Достижения в секвенировании ДНК единичных клеток в сочетании с аналитическими методами для отслеживания различных клонов могут приблизить исследователей к этой цели.
В этом разделе мы рассмотрим ход развития иммунной системы человека в пространстве и времени. Мы начнем с характеристики типов клеток по мере их появления в желточном мешке или печени плода, а затем рассмотрим тимус как ключевой орган, где происходит развитие Т-клеток. Это, к сожалению, не будет исчерпывающим описанием иммуногенеза, поскольку на сегодняшний день в иммунокомпетентных органах и тканях идентифицировано около 40 различных состояний иммунных клеток. Вместо этого мы сосредоточимся на понимании того, как мультиомиксные подходы к изучению одной клетки продвинули понимание функционирования всей иммунной системы плода человека (рис. 2).
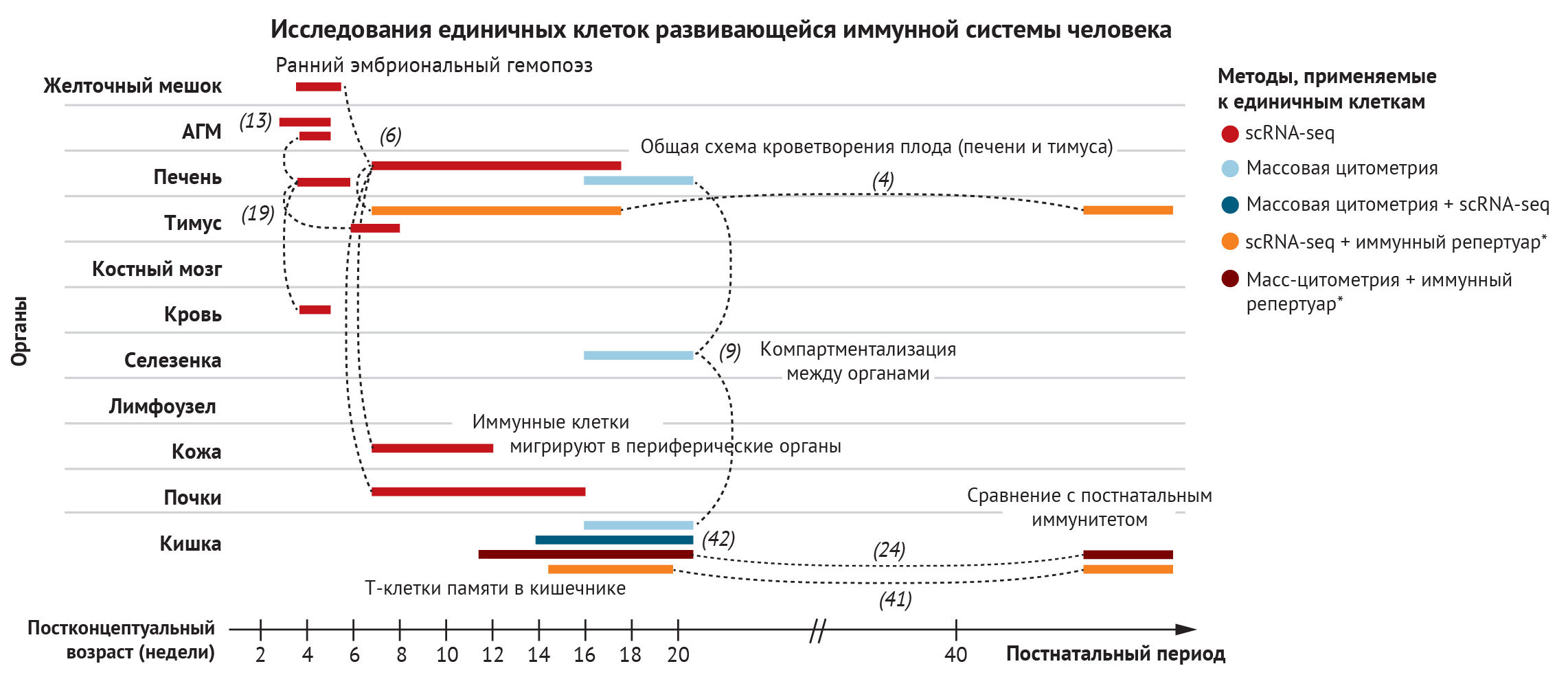
Для создания всеобъемлющего атласа развития иммунной системы человека были применены разнообразные клеточные методы (изображены в цвете). Во многих исследованиях отбирали сразу несколько органов с целью изучения миграции, адаптации и компартментализации иммунных клеток. (Исследования обозначены референс-номером, а пунктирные линии связывают различные органы, отобранные в каждом исследовании).
Желточный мешок и аорто-гонадо-мезонефрос
Анализ эмбрионального желточного мешка человека демонстрирует присутствие ЭГСК-подобных предшественников, макрофагов, тучных клеток (ТК), предшественников натуральных киллеров (NK) и лимфоидных клеток врожденного иммунитета (ЛВИ) наряду с мегакариоцитами и эритроидными клетками уже на четвертой неделе внутриутробного развития (ВУР) [6]. Происхождение макрофагов интенсивно изучалось, потому что тканевые макрофаги возникают независимо от ЭГСК и способны к самообновлению в условиях гомеостаза на мышиных моделях [10]. Тканерезидентные макрофаги в печени, легких, мозге и эпидермисе, как было показано с помощью картирования развития клеток, возникают в процессе гемопоэза в желточном мешке из эритромиелоидного предшественника [11, 12]. И хотя остаточный вклад желточного мешка сохраняется в ряде тканей (например, в печени, головном мозге и эпидермисе), макрофаги постепенно замещаются моноцитами, происходящими из ЭГСК, и в других местах (например, в кишечнике, легких и сердце).
Роль тучных клеток в пренатальном развитии сосудов требует дальнейшего изучения. NK-клетки, предшественники ЛВИ и их общие лимфоидные предшественники могут быть идентифицированы по транскриптому отдельных клеток желточного мешка и печени плода [6, 19]. На более поздних стадиях они обнаруживаются уже с большей степенью разнообразия и дифференцировки в различных фетальных органах [9, 20]. В отличие от материнских децидуальных NK-клеток, роль которых во время беременности хорошо охарактеризована [7, 21], понимание функции фетальных NK-клеток на сегодняшний день ограничено. Хотя NK-клетки плода считаются незрелыми и гипореактивными по сравнению с NK-клетками у взрослых, они уже обладают высокой степенью киллерной активности [22, 23]. Более того, NK-клетки плода или младенца сходны с таковыми у взрослых по целому ряду признаков, что позволяет предположить, что они уже могут реагировать на соответствующие стимулы, такие как, например, вирусная инфекция [23]. Соответственно, NK-клетки в изобилии присутствуют в кишечнике младенцев, содержат цитолитические гранулы, а их способность к дегрануляции превышает таковую у NK-клеток кишечника взрослого человека [20]. В дополнение к NK-клеткам было показано, что и другие типы ЛВИ у плода присутствуют в большем количестве, чем у младенцев [24]. В их числе — клетки-индукторы лимфоидной ткани (ИЛТ), которые играют важнейшую роль в формировании вторичных лимфоидных органов [25, 26]. Взаимодействуя со стромальными клетками, клетки ИЛТ индуцируют положительную обратную связь для привлечения дополнительных клеток ИЛТ и других иммунных клеток, создавая лимфоидное окружение [27]. Таким образом, ЛВИ развиваются у эмбриона человека очень рано и участвуют как в защите тканей, так и в их ремоделировании. В этой наиболее ранней стадии гемопоэза в желточном мешке значительная роль отводится развитию иммунных клеток со структурными и физиологическими функциями наряду с приобретением эмбрионом базового набора врожденных эффекторов иммунитета. Точная роль этих клеток в развитии тканей и участие в прохождении контрольных точек, которые предотвращают повреждающие иммунные реакции в утробе матери, требует дальнейшего изучения.
Печень и костный мозг
Дефинитивные ЭГСК могут генерировать полный набор линий эритроидных, миелоидных, лимфоидных клеток и мегакариоцитов в печени плода, однако нейтрофилы будут отсутствовать до установления гемопоэза в костном мозге (КМ) [28]. В отличие от макрофагов, моноциты и дендритные клетки (ДК) считаются ЭГСК-зависимыми популяциями. У мышей они прослеживаются вплоть до клоногенного предшественника в КМ, называемого предшественником ДК-макрофагов [29]. В процессе человеческого эмбриогенеза первые признаки пролиферации ДК наблюдаются в печени плода уже примерно с 6 недели ВУР [6]. Обычные ДК1, ДК2 и плазмоцитоидные ДК обнаруживаются в тканях плода — включая легкие, селезенку, кожу и тимус — на 12 недели ВУР и являются относительно многочисленными по сравнению с популяцией ДК во взрослых тканях [30]. ДК плода, как и их аналоги во взрослом организме, способны мигрировать, реагировать на Toll-подобные рецепторы и стимулировать пролиферацию и активацию T-клеток [30]. Фетальные ДК обладают особой способностью индуцировать дифференцировку регуляторных Т-лимфоцитов, стимулировать выработку Т-клеточного интерлейкина 4 и ингибировать выработку фактора некроза опухоли альфа (TNF-α) с помощью аргиназы II [30]. Таким образом, ДК играют важную роль в поддержании толерантности во время ВУР. Популяция В-клеток впервые появляется в печени плода с 7 недели ВУР в виде предшественников В-лимфоцитов; зрелые же B-клетки присутствуют только после 9 недели ВУР [6].
Частично это можно объяснить изменением способности ЭГСК продуцировать B-клетки и соответствующего микроокружения печени, необходимого для их дифференцировки [30]. В середине беременности КМ становится основным источником B-клеток, а зрелые B-клетки в изобилии обнаруживаются в селезенке [31]. И хотя разнообразие эмбриональных В-лимфоцитов достигается еще на ранних стадиях [24, 32], формирование герминативных центров подавляется до воздействия антигенов после рождения, что сопровождается активной соматической гипермутацией [33]. Сравнение В-клеток кишечника, полученных от плодов второго триместра, с В-клетками младенцев при помощи масс-цитометрии, комбинированной с анализом репертуара рецепторов В-клеток, хорошо продемонстрировало, что кишечные В-клетки у плода — это, прежде всего, фолликулярные и переходные В-клетки, тогда как плазматические В-клетки в большей степени представлены у младенцев [24]. Другим интересным аспектом дифференцировки В-клеток, который интенсивно изучался на мышиной модели, является поэтапное развитие клеток В-1, сходных с клетками врожденного иммунитета. Они преобладают в начале беременности, а затем появляются и обычные клетки В-2 [34]. Однако окончательно идентичность человеческих B-1-подобных клеток еще не определена [35]. Будущие исследования по созданию клеточного атласа КМ и селезенки плода человека позволят лучше понять онтологию B-клеток, подчеркнув специфические для тех или иных органов различия в нишевых факторах, которые поддерживают дифференцировку B-клеток.
Тимус и периферические иммунные органы
Тимус обеспечивает среду, необходимую для развития Т-клеток. Ранние лимфоидные предшественники, происходящие из печени плода, мигрируют в тимус на 8 неделе ВУР, где они развиваются в наивные Т-клетки [36]. Развитие и созревание вилочковой железы (тимуса) опосредовано взаимодействием между стромальными клетками тимуса и иммунными компонентами и было в значительной степени изучено на мышиных моделях. Комплексное профилирование транскриптома единичных клеточных компонентов развивающегося тимуса человека показало четкую взаимосвязь между эпителиальными клетками тимуса, клетками мезенхимы, ранними предшественниками тимоцитов, развивающимися и зрелыми Т-клетками и другими популяциями иммунных клеток [4, 19]. Количественные соотношения разных клеточных популяций также демонстрируют скоординированные изменения в процессе развития, что еще раз доказывает важность взаимодействий между несколькими типами клеток для правильного развития органов [4]. Исследования клеток печени и тимуса плода позволили подробно описать молекулярные характеристики, сопровождающие переход от ранних предшественников тимуса к наивным Т-клеткам [4, 6, 19]. Ху и его коллеги сосредоточились на составлении молекулярного профиля клеток-предшественниц, населяющих тимус [19]. Группа авторов данного обзора расширила этот анализ до более поздних этапов развития [4].
Вместе эти исследования выявили непрерывный ряд развития от ранних предшественников тимуса до разнообразных типов зрелых Т-клеток. Наивные Т-клетки выходят из вилочковой железы и мигрируют в другие ткани. Циркулирующие Т-клетки обнаруживаются у плода уже через 10–11 недель после функционального развития тимуса [37]. Отсутствие или наличие микроорганизмов в плодном окружении пока остается предметом дискуссий. Хотя считается, что при нормальном течении беременности это окружение, скорее всего, стерильно, ненаследуемые материнские аллоантигены и побочные продукты обмена микробиоты могут потенциально активировать иммунную систему плода. Чтобы избежать аллореактивности, плод должен поддерживать иммунологическую толерантность. Как следствие, наивные Т-клетки, возникающие у плода, с большей вероятностью приобретают судьбу Т-регуляторных по сравнению со наивными Т-клетками взрослого организма [38]. Фетальные регуляторные Т-клетки подавляют пролиферацию и секрецию цитокинов другими фетальными Т-клетками, которые потенциально обладают самореактивностью [39].
Т-клетки памяти были обнаружены в кишечнике плода, что подчеркивает способность фетальных Т-клеток реагировать на чужеродные антигены [9, 24, 40, 421]. Исследования CD4+ T-лимфоцитов кишечника с помощью технологий анализа единичных клеток в сочетании с определением репертуара клеточных рецепторов выявили существование пула T-клеток памяти и регуляторных T-клеток с признаком клональной экспансии, что демонстрирует баланс между активацией и подавлением адаптивного иммунного ответа у плода [24, 42]. CD4+ Т-клетки кишечника также могут играть роль в стимуляции дифференцировки, как показано в случае умеренной экспрессии TNF-α [41]. Таким образом, адаптивный иммунитет плода оказывается значительно более зрелым, чем предполагалось ранее. Области будущих исследований иммунной системы плода включают изучение антигенных сигналов, лежащих в основе активации фетальных Т-клеток, и роли, которую они играют в развитии и защите плода. При помощи такого анализа онтогенеза иммунитета плода во времени и пространстве авторы отмечают появление как врожденных, так и адаптивных иммунных клеток с характерными свойствами, отличающимися от таковых у взрослых. Среди компонентов, отсутствующих в этом обзоре, можно назвать нейтрофилы. Последние данные свидетельствуют о том, что около трети эмбриональных клеток костного мозга являются нейтрофилами или их предшественниками уже к 10–13 неделе ВУР, и доля их увеличивается до двух третей к 21 неделе ВУР [43]. Младенцы, рожденные недоношенными или маловесными, имеют меньшее количество циркулирующих нейтрофилов, более низкий нейтрофильный пул и более высокой риск смерти от сепсиса [44]. Понимание работы нейтрофильного компартмента у плода , даст представление о том, как можно поддерживать иммунную защиту в раннем возрасте.
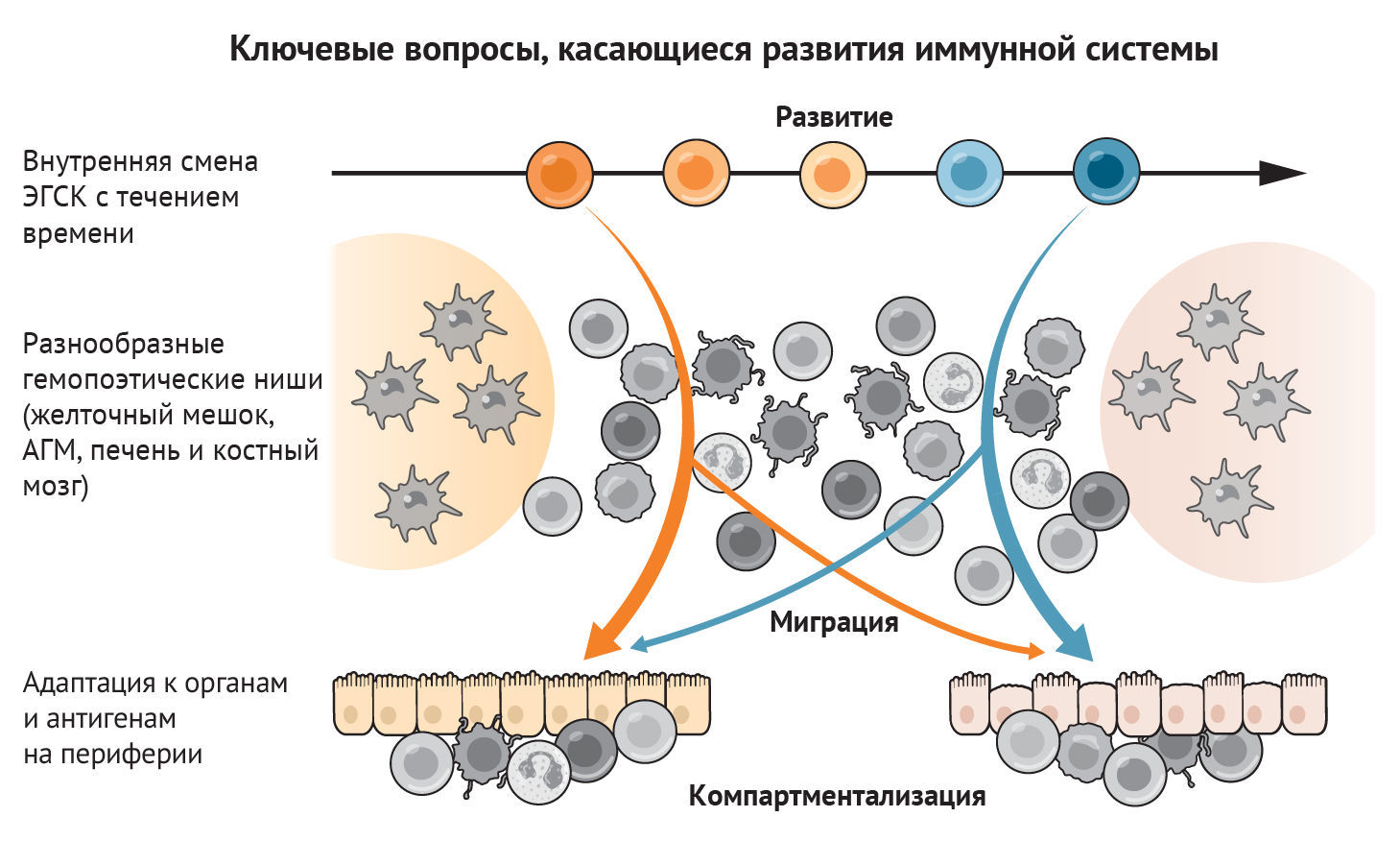
Рисунок 3 | Ключевые вопросы, которые необходимо рассмотреть в будущих исследованиях развития иммунной системы
Диаграмма изображает соответствующие вопросы, касающиеся развития иммунной системы. Как ЭГСК изменяют свой потенциал на протяжении всего развития иммунной системы человека? Чем отличаются различные гемопоэтические ниши друг от друга? Что определяет миграцию иммунных клеток в органы-мишени и как они адаптируются к новой тканевой среде? Методы профилирования отдельных клеток и пространственного профилирования теперь дают ответы на эти вопросы, оценивая иммунную систему в целом и выявляя возникающие свойства клеточного коллектива.
Читайте также:

