Способы получения синтез газа реферат
Обновлено: 05.07.2024
Продуктами реакции являются алканы, алкены и кислородсодержащие соединения, то есть образуется сложная смесь продуктов, характерная для реакции полимеризации. Первичными продуктами синтеза Фишера-Тропша являются aи b-олефины, которые превращаются в алканы в результате последующего гидрирования. Природа применяемого катализатора, температура, соотношение СО и Н2 существенно сказываются… Читать ещё >
- способы получения оксида углерода и синтез-газа
Синтез Фишера-Тропша. Способы получения оксида углерода и синтез-газа ( реферат , курсовая , диплом , контрольная )
Метод Фишера — Тропша по превращению метана в более тяжелые углеводороды был разработан в 1923 г. и реализован в промышленности Германии в 1940;х годах.
Почти все авиационное топливо в этой стране во время второй мировой войны производилось с помощью синтеза Фишера — Тропша из каменного угля. Впоследствии от этого способа изготовления моторных топлив отказались, так как топливо, получаемое при переработке нефти, до последнего времени было экономически более выгодным.
Еще более эффективной представляется конверсия газа в дорогостоящие продукты тонкого органического синтеза.
Конверсию газа в моторное топливо можно в целом представить как превращение метана в более тяжелые углеводороды:
2nСН4 + ½nО2 = СnН2n + nН2О Из материального баланса брутто-реакции следует, что массовый выход конечного продукта не может превышать 89% (17, "https://referat.bookap.info").
Реакция напрямую неосуществима. Конверсия газа в жидкое топливо (КГЖ) проходит через ряд технологических стадий (рис.17). При этом в зависимости от того, какой конечный продукт необходимо получить, выбирается тот или иной вариант процесса.
Синтез Фишера-Тропша может рассматриваться как реакция восстановительной олигомеризации монооксида углерода, при которой образуются углерод-углеродные связи, и в общем виде она представляет собой сложную комбинацию ряда гетерогенных реакций, которую можно представить суммарными уравнениями:
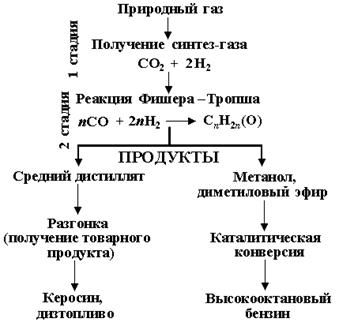
Рис. 17. Принципиальная схема конверсии синтез-газа в жидкие продукты (топливо).
Продуктами реакции являются алканы, алкены и кислородсодержащие соединения, то есть образуется сложная смесь продуктов, характерная для реакции полимеризации. Первичными продуктами синтеза Фишера-Тропша являются aи b-олефины, которые превращаются в алканы в результате последующего гидрирования. Природа применяемого катализатора, температура, соотношение СО и Н2 существенно сказываются на распределении продуктов. Так, при использовании железных катализаторов велика доля олефинов, тогда как в случае кобальтовых катализаторов, обладающих гидрирующей активностью, преимущественно образуются насыщенные углеводороды.
В настоящее время в качестве катализаторов синтеза Фишера-Тропша в зависимости от поставленных задач (повышение выхода бензиновой фракции, увеличение выхода низших олефинов и др.) используются как высокодисперсные железные катализаторы, нанесенные на оксиды алюминия, кремния и магния, так и биметаллические катализаторы: железо-марганцевые, железо-молибденовые и др.
За 70 лет с момента открытия синтеза не утихают споры по поводу механизма реакции. В настоящее время рассматриваются три различных механизма. Первый механизм, называемый карбидным, впервые предложенный Фишером и Тропшем и в дальнейшем нашедший поддержку у других исследователей, предполагает образование С-С-связей в результате олигомеризации метиленовых фрагментов на поверхности катализатора. На первой стадии происходит адсорбция СО и образуется поверхностный карбид, а кислород превращается в воду или СО2:
На второй стадии поверхностный карбид гидрируется с образованием фрагментов СНx (х = 1−3):
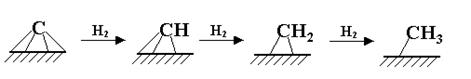
Удлинение цепи происходит в результате реакции поверхностных метила и метилена и далее путем внедрения метиленовых групп идет рост цепи:

Стадия обрыва цепи происходит в результате десорбции алкена с поверхности катализатора:
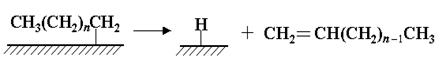
Второй механизм, названный гидроксикарбеновым, предполагает также гидрирование координированного на металле СО с образованием поверхностных гидроксикарбеновых фрагментов, в результате конденсации которых и происходит образование С-С-связей:

Третий механизм, который можно назвать механизмом внедрения, предполагает образование С-С-связей в результате внедрения СО по связи металл-углерод (о способности СО к внедрению по связи металл-алкил говорилось выше):

Накоплен достаточно богатый экспериментальный материал, свидетельствующий в пользу того или иного варианта механизма, однако приходится констатировать, что к настоящему моменту невозможно сделать однозначный выбор между ними. Можно предположить, что в связи с большой важностью синтеза Фишера-Тропша исследования в этом направлении будут интенсивно продолжаться и мы станем свидетелями новых воззрений на механизмы протекающих реакций .
История знает немало примеров, когда в силу острой необходимости рождались новые оригинальные подходы к решению давно существующих жизненно важных проблем. Так, в предвоенной Германии, лишенной доступа к нефтяным источникам, назревал жесткий дефицит топлива, необходимого для функционирования мощной военной техники. Располагая значительными запасами ископаемого угля, Германия была вынуждена искать пути его превращения в жидкое топливо. Эта проблема была успешно решена усилиями превосходных химиков, из которых, прежде всего следует упомянуть Франца Фишера, директора Института кайзера Вильгельма по изучению угля.
Файлы: 1 файл
zhuravl.docx
Введение
История знает немало примеров, когда в силу острой необходимости рождались новые оригинальные подходы к решению давно существующих жизненно важных проблем. Так, в предвоенной Германии, лишенной доступа к нефтяным источникам, назревал жесткий дефицит топлива, необходимого для функционирования мощной военной техники. Располагая значительными запасами ископаемого угля, Германия была вынуждена искать пути его превращения в жидкое топливо. Эта проблема была успешно решена усилиями превосходных химиков, из которых, прежде всего следует упомянуть Франца Фишера, директора Института кайзера Вильгельма по изучению угля. В 1926 году была опубликована работа Ф. Фишера и Г. Тропша "О прямом синтезе нефтяных углеводородов при обыкновенном давлении", в которой сообщалось, что при восстановлении водородом монооксида углерода при атмосферном давлении в присутствии различных катализаторов (железо - оксид цинка или кобальт - оксид хрома) при 270 оС получаются жидкие и даже твердые гомологи метана. Так возник знаменитый синтез углеводородов из монооксида углерода и водорода, называемый с тех пор синтезом Фишера-Тропша. Смесь CO и H2 в различных соотношениях, называемая синтез-газом, легко может быть получена как из угля, так и из любого другого углеродсодержащего сырья
1. Характеристика синтез газа, область применения
В состав синтез-газа входят такие вещества как CO и H2. В зависимости от метода получения синтез-газа соотношение CO:Н2 в нем варьируется от 1:1 до 1:3. В прямой зависимости от применяемого сырья и метода его соотношение компонентов в синтез-газе изменяется в широких пределах. Как правило, процентное содержание веществ в сыром неочищенном синтез-газе следующее:
Стоит заметить, что данное соотношение является весьма приблизительным, поскольку повышением температуры в процессе синтеза можно увеличить количество СО, а увеличив давление можно повысить содержание Н2 и СН4.
Также, помимо данных веществ синтез-газ может содержать и другие вещества – инертные газы (N2) и серосодержащие соединения (H2S), если исходное сырье содержало серу. От не нужного присутствия в синтез-газе таких веществ как углекислый газ и сера избавляются путем очистки селективными растворителями.
Первым известным человечеству способом получения синтез-газа была газификация каменного угля. Данный способ был осуществлен в Англии еще в 30-е годы XIX века, и во многих странах мира до 50-х годов XX века. Впоследствии данная методика была вытеснена методами, основанными на использовании нефти и природного газа. Однако в связи с существенным сокращением мировых нефтяных ресурсов, значение процесса газификации каменного угля снова стало возрастать. К тому же, благодаря такому необходимому процессу как переработка ТБО, ученые научились добывать синтез-газ из новых, нетрадиционных источников.
Сегодня существуют три основных метода получения синтез-газа.
1. Газификация угля. Данный процесс основан на взаимодействии каменного угля с водяным паром и происходит по формуле:
Данная реакция является эндотермической, и равновесие при температуре 900-1000 по шкале Цельсия сдвигается вправо. Разработаны различные технологические процессы, использующие парокислородное дутье, благодаря которому наряду с упомянутой реакцией параллельно протекает экзотермическая реакция сгорания угля, которая обеспечивает необходимый тепловой баланс. Ее формула:
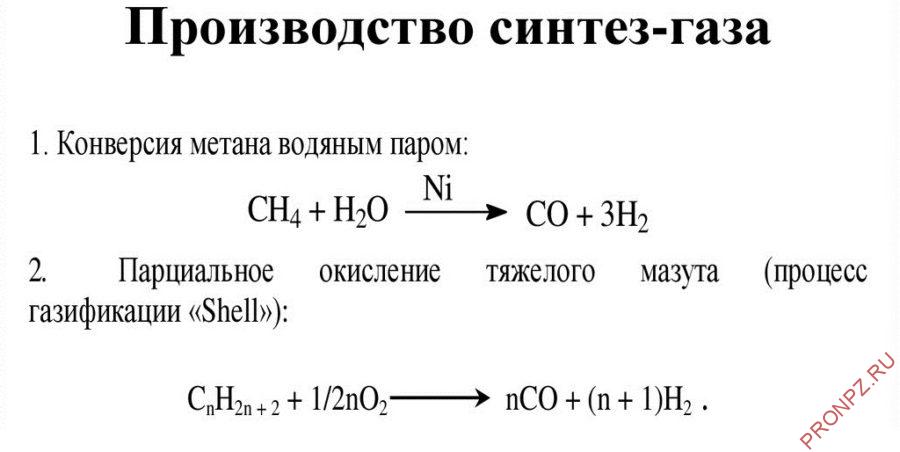
2. Конверсия метана. Данная реакция взаимодействия водяного пара и метана проводится при повышенной температуре (800-900 градусов) и давлении при присутствии никелевых катализаторов (Ni-Al2O3). Формула данного процесса:
Также в качестве сырья в данном способе вместо метана можно использовать любое сырье, содержащее углеводород.
3. Парциальное окисление углеводородов. Данный процесс, происходящий при температурах выше 1300 градусов заключается в термическом окислении углеводородов. Формула данной реакции:
Данный способ применим к любому сырью, содержащему углеводороды но наиболее часто используется высококипящая фракция нефти - мазут.
Сегодня производство синтез-газа постоянно совершенствуется, поскольку востребованность данного сырья неизменно растет с каждым годом. В настоящее время учеными разрабатываются проекты подземной газификации угля, то есть планируется, что получение синтез-газа будет происходить непосредственно в пласте угля глубоко под землей. Интересен тот факт, что подобную идею уже высказывал известнейший русский ученый Д.И. Менделеев, причем более 150 лет назад.
Также благодаря современным разработкам сегодня синтез- газ научились получать газификацией не только угля и нефти, но и более нетрадиционных источников углерода, вплоть до бытовых и сельскохозяйственных отходов. Таким образом, сегодня мусороперерабатывающие заводы способны добывать такое ценное сырье как синтез газ в процессе утилизации отходов.
Сегодня синтез-газ используется в химической промышленности для получения различного сырья. Кроме этого, он также используется в качестве экологически чистого источника тепла и энергии. Сжигая синтез-газ можно получить достаточно большое количество тепла, которое можно использовать в самых различных целях.
Кроме этого, синтез газ используется в качестве исходного сырья для метилового спирта и синтетического жидкого топлива, которое по своим характеристикам ни в чем не уступает традиционному.
2. Химизм получения с указанием роли катализатора
Углекислотная конверсия метана в синтез-газ СО + Н2 - одна из важнейших химических реакций, пригодная для промышленного получения водорода и дающая начало синтезу углеводородов (жидкое топливо) и других технически ценных продуктов.
В промышленности используется практически лишь метод паровой конверсии. Реакцию проводят на нанесенном Ni-катализаторе при высокой температуре 700 - 900 °С Катализаторы, используемые для конверсии углеводородов легко отравляются сернистыми соединениями. В исходном сырье в качестве примесей могут быть сероводород и органические соединения серы (меркаптан, сероуглерод, сульфидоксид углерода, дисульфиды и тиофен).
Основная реакция, лежащая в основе этого метода, состоит в конверсии углеводородов водяным паром на катализаторе Ni на Al2O3:
Реакция сильно эндотермична, и ее равновесие смещается вправо лишь при повышении температуры. Чтобы увеличить степень конверсии метана, процесс ведут при 800 -900 °С в избытке водяного пара. При атмосферном давлении этот избыток невелик (2: 1), но повышение давления неблагоприятно влияет на состояние равновесия, и в этом случае приходится работать с объемным отношением пара к метану, равным 4: 1. Кроме конверсии метана протекает также конверсия оксида углерода :
Эта реакция экзотермична, и ее равновесие при повышении температуры смещается влево, причем избыток водяного пара вызывает повышенное образование диоксида углерода. Конверсия оксида углерода протекает быстро, и состав конвертированного газа определяется ее равновесием. При конверсии метана водяным паром получается газ с большим отношением Н2 : СО (как минимум 3: 1) , в то время как для органического синтеза требуется синтез-газ с отношением Н2 : СО от 1: 1 до (2,0: 2,3) : 1. Этого отношения можно добиться, во-первых, подвергая конверсии жидкие углеводороды и, во-вторых, добавляя при конверсии к водяному пару диоксид углерода, который также конвертирует углеводороды:
СН4+ СО2 = 2С0 + 2Н2, - ∆H 0 298 = - 247 кДж/моль.
Последняя реакция эндотермична, и ее равновесие смещается вправо при достаточно высокой температуре . Она протекает медленнее, чем конверсия водяным паром. Ввиду высокой эндотермичности конверсию углеводородов проводят в трубчатых печах.
Гомологи метана (этан, пропан, бутан и др.) взаимодействуют с водяным паром при более низких температурах, чем метан. Однако в конечной газовой смеси при температурах 400-500 "С содержится значительное количество метана как вследствие равновесия реакции метана с водяным паром, так и в результате гидрирования алифатических углеводородов:
С6Н6 + 9Н2 > 6СН4,
С3Н8 + 2Н2 > ЗСH4
Исходя из экономических соображений, связанных с использованием энергии сжатия природного газа, а также для уменьшения размеров аппаратуры и увеличения скорости процесса конверсию метана целесообразно проводить при повышенных давлениях (2,0-4,0 МПа). Это позволяет достигать любой степени превращения метана при более высоких температурах.
3. Характеристика катализатора
оксид Ni на носителе Al2O3
Кольца от светло-серого до темно-серого цвета
Насыпная плотность, кг/дм3
Массовая доля мелочи и гранул с дефектом, %, не более
Размеры гранул, мм, в пределах:
Механическая прочность, разрушающее усилие при раздавливании на торец, среднее, МПа, не менее
Массовая доля серы в пересчете на SO3,%, не более
Массовая доля никеля в пересчете на оксид никеля (NiO), %
Термостойкость: число теплосмен от 1000°С до комнатной температуры на воздухе без разрушения гранул, не менее
Активность: остаточная доля метана при конверсии с водяным паром природного газа при соотношении пар:газ=2:1 в объемной скорости 6000 час,%, не более при температуре:
500°С: 35
4. Этапы подготовки катализатора к работе
Известен промышленный катализатор для паровой конверсии природного газа ГИАП-8 [1] cодержащий активную часть, включающую оксид никеля и γ-оксид алюминия в качестве диспергатора и носитель-оксид алюминия, при следующем содержании компонентов, мас. Оксид никеля 6,26-8,97 γ-Al2O3 1,22-1,76 Носитель .
Катализатор получают пропитыванием носителя раствором азотнокислых солей никеля и алюминия с последующей сушкой и прокаливанием в окислительной атмосфере при температуре 400-450 о С.
Недостатком этого катализатора являются низкая стабильность и коксостойкость при паровой конверсии гомологов метана (т.е. сырья с углеродным числом больше 1).
В свежем катализаторе никель находится в виде окислов. Катализатором же ускоряющим реакции конверсии метана, является металлический никель. Поэтом, перед началом процесса конверсии катализатор необходимо восстановить газом, содержащим водород NiO + H2 = Ni + H2O. Катализатор восстанавливается водородом полностью при температуре 300 — 400°С в течение 2—4ч. При отсутствии водорода катализатор можно также восстановить рабочей смесью (метан и водяной пар или метан, водяной пар и кислород) при 750 — 850°С.
Если никель находится не в виде окислов, а в виде их соединении с окисью алюминия (шпинели), то для его восстановления требуется более высокая температура (800 900°С). В этом случае процесс восстановления протекает медленнее. Никель-алюминиевая шпинель (голубовато-зеленоватого цвета) образуется при нагревании катализатора до температуры выше 600°С в среде, не содержащей восстановителей (Н2 и СО).
Эффективность работы катализатора определяется остаточным содержанием метана в конвертированном газе при определенном количестве подаваемого исходного газа. Нагрузка на катализатор характеризуется объемной скоростью. Объемной скоростьюназывается количество кубометров исходного газа (сухого), проходящего через 1 м3 катализатора в час. Объемная скорость выражается в ч-1. В промышленных условиях катализатор конверсии метана работает в интервале объемных скоростей 250 — 400ч-1 при 600—1000°С.
Активность никелевого катализатора может снижаться вследствие присутствия в газе соединений серы: Н2S, CS2 и COS. Вещества, снижающие активность катализатора, называются каталитическими ядами. Процесс отравления катализатора Н2S протекает по схеме Ni + H2S = NiS + H2.
Образовавшийся сернистый никель уже не способен ускорять реакцию конверсии метана, в связи с чем активность катализатора снижается. Проведенными исследованиями установлено значительное влияние температуры на отравление катализатора соединениями серы. Показано, что при температуре, равной 600°С, наличие даже небольших количеств соединений серы в газе (5мг/м3 серы) приводит к необратимому отравлению и полной потере активности катализатора. С повышением температуры отравляемость катализатора этими соединениями уменьшается. Так, при температуре 700 — 800°С отравление катализатора происходит в значительно меньшей степени и активность его может быть восстановлена в процессе конверсии метана, не содержащего соединений серы. При 850°С и содержании в газе 5 — 7 мг/м3 серы заметного отравления катализатора не наблюдается.
История человечества знает довольно много примеров, когда в силу необходимости рождались кардинально новые подходы к решению существующих жизненно важных проблем. Например, в Германии в промежуток между первой и второй мировыми войнами, лишенной доступа к крупным нефтяным источникам, назревал серьезный дефицит топлива, которое было необходимо для функционирования гражданской и военной техники.
Располагая существенными запасами ископаемого угля, Германия начала искать пути его трансформации в жидкое топливо, пригодное для двигателей внутреннего сгорания. Эта проблему удалось решить благодаря усилиям превосходных химиков, из которых отдельного упоминания заслуживает Франц Фишер, директор Института кайзера Вильгельма по исследованию угля.

В 1926 году Ф. Фишер и Г. Тропш опубликовали работу "О прямом синтезе нефтяных углеводородов при нормальном давлении", где сообщалось, что при восстановлении монооксида углерода водородом при нормальном атмосферном давлении в присутствии катализаторов при температуре в 270 градусов по шкале Цельсия можно получить жидкие и твердые гомологи метана.
Так на свет появился знаменитый способ синтеза углеводородов из монооксида углерода, называемый с тех пор методом Фишера-Тропша. Благодаря данному методу смесь водорода и угарного газа в различных соотношениях может легко быть получена как из каменного угля, так и из любого другого сырья, содержащего углерод. Полученную в результате данного процесса смесь газов начали называть синтез-газом.
Состав синтез-газа
Как мы уже упомянули выше, в состав синтез-газа входят такие вещества как CO и H2. В зависимости от метода получения синтез-газа соотношение CO:Н2 в нем варьируется от 1:1 до 1:3. В прямой зависимости от применяемого сырья и метода его соотношение компонентов в синтез-газе изменяется в широких пределах. Как правило, процентное содержание веществ в сыром неочищенном синтез-газе следующее:
Стоит заметить, что данное соотношение является весьма приблизительным, поскольку повышением температуры в процессе синтеза можно увеличить количество СО, а увеличив давление можно повысить содержание Н2 и СН4.
Также, помимо данных веществ синтез-газ может содержать и другие вещества – инертные газы (N2) и серосодержащие соединения (H2S), если исходное сырье содержало серу. От не нужного присутствия в синтез-газе таких веществ как углекислый газ и сера избавляются путем очистки селективными растворителями.
Способы получения синтез-газа
Первым известным человечеству способом получения синтез-газа была газификация каменного угля. Данный способ был осуществлен в Англии еще в 30-е годы XIX века, и во многих странах мира до 50-х годов XX века. Впоследствии данная методика была вытеснена методами, основанными на использовании нефти и природного газа. Однако в связи с существенным сокращением мировых нефтяных ресурсов, значение процесса газификации каменного угля снова стало возрастать. К тому же, благодаря такому необходимому процессу как переработка ТБО, ученые научились добывать синтез-газ из новых, нетрадиционных источников.
Сегодня существуют три основных метода получения синтез-газа.
1. Газификация угля. Данный процесс основан на взаимодействии каменного угля с водяным паром и происходит по формуле:
Данная реакция является эндотермической, и равновесие при температуре 900-1000 по шкале Цельсия сдвигается вправо. Разработаны различные технологические процессы, использующие парокислородное дутье, благодаря которому наряду с упомянутой реакцией параллельно протекает экзотермическая реакция сгорания угля, которая обеспечивает необходимый тепловой баланс. Ее формула:
2. Конверсия метана. Данная реакция взаимодействия водяного пара и метана проводится при повышенной температуре (800-900 градусов) и давлении при присутствии никелевых катализаторов (Ni-Al2O3). Формула данного процесса:
CH4 + H2O → CO + 3H2 .
Также в качестве сырья в данном способе вместо метана можно использовать любое сырье, содержащее углеводород.
3. Парциальное окисление углеводородов. Данный процесс, происходящий при температурах выше 1300 градусов заключается в термическом окислении углеводородов. Формула данной реакции:
CnH2n + 2 + 1/2nO2 → nCO + (n + 1)H2 .
Данный способ применим к любому сырью, содержащему углеводороды но наиболее часто используется высококипящая фракция нефти - мазут.
Производство синтез-газа
Сегодня производство синтез-газа постоянно совершенствуется, поскольку востребованность данного сырья неизменно растет с каждым годом. В настоящее время учеными разрабатываются проекты подземной газификации угля, то есть планируется, что получение синтез-газа будет происходить непосредственно в пласте угля глубоко под землей. Интересен тот факт, что подобную идею уже высказывал известнейший русский ученый Д.И. Менделеев, причем более 150 лет назад.
Также благодаря современным разработкам сегодня синтез-газ научились получать газификацией не только угля и нефти, но и более нетрадиционных источников углерода, вплоть до бытовых и сельскохозяйственных отходов. Таким образом, сегодня мусороперерабатывающие заводы способны добывать такое ценное сырье как синтез газ в процессе утилизации отходов.
Применение синтез-газа
Сегодня синтез-газ используется в химической промышленности для получения различного сырья. Кроме этого, он также используется в качестве экологически чистого источника тепла и энергии. Сжигая синтез-газ можно получить достаточно большое количество тепла, которое можно использовать в самых различных целях.
Кроме этого, синтез газ используется в качестве исходного сырья для метилового спирта и синтетического жидкого топлива, которое по своим характеристикам ни в чем не уступает традиционному.
Получение
Существуют два основных метода получения синтез-газа – конверсия метана с водяным паром и парциальное (частичное) окисление. Оба метода довольно просты.
Конверсия метана с паром
Конверсия с паром состоит в пропускании метана или нафты и водяного пара над никелевым катализатором. Реакция протекает за счет разрушительной силы высоких температур и давлений, и ее следует проводить в реакторах, аналогичных печам крекинга. При этом происходят побочные процессы, при водящие к образованию СО2 и углерода. Углерод откладывается на катализаторе и дезактивирует его.
Парциальное окисление метана
Другой метод — это парциальное (частичное) окисление метана. Процесс проводят при высоких температурах без катализатора. Метод парциального окисления обычно используют для превращения более тяжелых видов сырья — от нафты до остаточного топлива — в тех случаях, когда в распоряжении нет природного газа и легких углеводородов (этана, пропана и бутана). В обоих процессах выход суммы СО и Н2 составляет 90 – 95%.
В качестве побочного продукта получают СО2, который можно удалить либо экстракцией растворителем, либо можно ввести в реакцию с водяным паром дополнительное количество метана, что даст СО и Н2. Эта реакция протекает при высоких температурах и давлениях и в присутствии никелевого катализатора.
Транспортировка
Обычно установка по производству синтез-газа бывает интегрирована в структуру завода, на котором он перерабатывается.
Единственным приемлемым способом транспортировки синтез-газа является его транспортировка по трубопроводам.
Применение
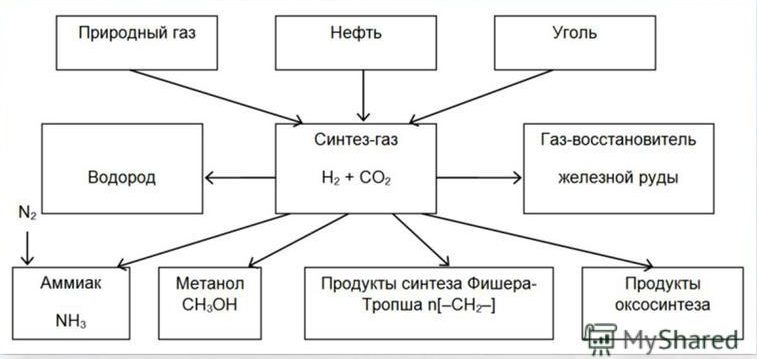
Получение и применение синтез-газа
Получение аммиака
Наиболее важной областью применения синтез-газа является производство аммиака – NH3.
Смесь азота и водорода пропускают над железным катализатором (который содержит оксид алюминия в качестве промотора). Реакция проходит в очень жестких условиях — при температуре 420 С и давлении 280 атм.
Большая часть установок по производству аммиака снабжена оборудованием для отделения СО от сырья, так как СО может отравлять катализатор. Чаще всего с этой целью СО обрабатывают водяным паром для получения СО и Н2. Диоксид углерода удаляют экстракцией этаноламином, а Н2 направляют на рециркуляцию.
Получение метанола
С 1923 г. метанол производится в промышленности из синтез-газа; в настоящее время большую часть метанола получают именно таким методом. По нескольким причинам эти установки обычно строят вблизи установок для производства аммиака или даже объединяют с ними.
Технология и оборудование аналогичны, и в производстве метанола можно использовать СО2, образующийся при синтезе аммиака. В этом случае СО2 вводят в реакцию с метаном и водяным паром над никелевым катализатором, приводящую к образованию дополнительного количества СО и Н2, которые затем взаимодействуют, давая метанол.
Процесс проводят при давлении 67 – 100 атм. И температуре 200 – 260оС на катализаторах на основе оксидов меди и цинка.
Синтез Фишера-Тропша
Каталитическое гидрирование оксида углерода (синтез Фишера-Тропша) для получения углеводородов, в частности парафинов, в основном нормального строения и олефинов, является гетерогенной реакцией. Проводится она преимущественно над кобальтовыми или над железными катализаторами с использованием возможно более чистых смесей оксида углерода и водорода. Оптимальные рабочие температуры синтеза различны для различных катализаторов.
Никелевые и кобальтовые катализаторы дают оптимальные результаты при 170-205, железные — при 200-325°С. Синтез на никелевых катализаторах ведется практически только при нормальном давлении, так как при повышенном давлении резко усиливается образование карбонилов.
На железном и кобальтовом катализаторах можно работать без образования карбонилов при давлениях до 20 атм.
Считается, что при синтезе по Фишеру-Тропшу на железных катализаторах оксид углерода гидрируется с образование метиленовой группа, которая затем полимеризуется. Оксид углерода конвертируется в углекислоту. При этом кислород оксида углерода связывается, образуя воду. Этим реакциям благоприятствуют более высокая температура синтеза на железных катализаторах и активность железа по отношению к реакции конверсии.
С технической точки зрения решающее значение при синтезе Фишера-Тропша имеют, во-первых, очень большая теплота реакции каталитического гидрирования оксида углерода и, во-вторых, необходимость очень точного соблюдения постоянной температуры синтеза. В противном случае значительно возрастает нежелательное образование метана. Кроме того, при высоких температурах наблюдается отложение углерода на катализаторе, приводящее к быстрой его дезактивации.
Читайте также:

