Смерть клетки апоптоз реферат
Обновлено: 05.07.2024
Автор: Заболоцкая Валерия Михайловна
Должность: преподаватель
Учебное заведение: ГБПОУ ДЗМ
Населённый пункт: Москва
Наименование материала: статья
Тема: "Некоторые аспекты по теме "Некроз и апоптоз"
Раздел: среднее профессиональное
– генетически запрограммированная физиологическая гибель
клетки. Например, гибель неоплодотворенной яйцеклетки, гибель эритроцита
через 120 дней жизни и т.д. Апоптоз – это сконструированный процесс под
строгим генетическим контролем, чтобы не навредить окружающим клеткам.
Для осуществления данного процесса требуется энергия.
Значение апоптоза: поддержание баланса между размножением и смертью
клеток, запрограммированное обновление тканей.
1. Гибель целой группы клеток в
одном участке органа
1. Гибель одиночных клеток,
2. Патологический процесс
2. Физиологический процесс
4. Возникает из-за действия внешних
4. Генетически запрограммированная
5. Активация собственных ферментов
5. Без активации гидролаз
6. Требует затрат энергии организма
рубцовая соединительная ткань
7. После апоптоза восстанавливаются
клетки аналогичные погибшим
8. Нет клинических проявлений
Механизм апоптоза:
Начинается с ядра клетки – запускают апоптоз ферменты, которые
присутствуют в ядре каждой клетки и до момента апоптоза находятся в
неактивном состоянии – ферменты разрезают молекулы ДНК на куски –
далее куски ДНК сворачиваются и уплотняются – ферменты повреждают
оболочку ядра – затем нарушают целостность клеточной мембраны –
повреждение мембраны является сигналом для макрофагов – макрофаги
фагоцитируют фрагменты клетки.
Механизм некроза:
клетки и ее структур – из разрушенных лизосом выходят собственные
пищеварительные ферменты клетки (гидролазы) – гидролазы разрушают все
В зависимости от причин различают следующие виды некроза:
Травматический - возникает при действии физических факторов.
Токсический – возникает под действием токсинов, кислот, щелочей,
Трофоневротический – возникает при нарушении иннервации тканей, что
ведет к сосудистым нарушениям и необратимым изменениям в тканях.
Сосудистый – возникает при нарушении кровоснабжения органа вследствие
тромбоза (закупорка сосуда тромбом) или эмболии (закупорка сосуда
эмболом – кусочек жира при переломе или пузырек воздуха при инъекции).
Формы некроза: сухой некроз, влажный некроз, инфаркт и гангрена.
Сухой некроз протекает с преобладанием процессов уплотнения тканей. К
сухому некрозу относится творожистый (развивается при туберкулезе, когда
омертвевшая ткань белесоватая и крошится как творог) и фибриноидный
некроз (возникает при пропитывании соединительной ткани фибриногеном,
который превращается в фибрин, оседает на волокнах, уплотняет и
Влажный некроз протекает в тканях с большим количеством воды, когда
ткань расплавляется. Например, расплавление серого вещества головного
– некроз тканей, возникший при нарушении кровообращения
любого органа (тромбоз, эмболия, спазм артерии).
Некротизированные участки черного цвета, так как гемосидерин (пигмент
эритроцитов) окисляется с образованием сернистого железа.
Различают три вида гангрены:
Сухая гангрена - сопровождается мумификацией, частая локализация –
Влажная гангрена – сопровождается инфицированием некротизированной
Пролежень – развивается на участках тела, подвергающихся наибольшему и
Апоптозом называется запрограммированная клеточная гибель. Этот процесс играет важную роль в росте и развитии организма, т. к. по мере созревания тканей некоторые клетки должны погибнуть, чтобы уступить место более дифференцированным и специализированным.
Если клетка не умирает и становится бессмертной, может развиться злокачественная опухоль. Впервые апоптоз был описан в 1970-е годы, но только в последнее время исследователи осознали его важную роль для развития организма, дифференцировки тканей и малигнизации.
Интерес к апоптозу возрос, когда выяснилось, что этот процесс находится под контролем генов, вовлеченных в злокачественную трансформацию, т. е. онкогенов, протоонкогенов и генов-супрессоров. Очевидно, что многие из этих генов активны во время развития организма.
Полагают, что изучение апоптоза и путей его регуляции позволит понять механизмы развития организма и старения. Утрата клеточного контроля над программированной клеточной гибелью ведет к развитию опухолей.
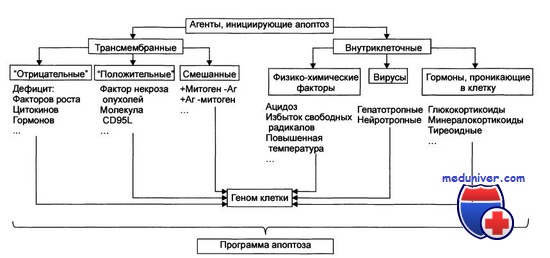
Стадия инициации апоптоза
Апоптоз — особый вид клеточной гибели, ответственный за устранение клеток в нормальных тканях. Тем не менее этот процесс наблюдается и при патологических процессах. Гистологически проявляется уменьшением клетки, буллезным разрушением клеточной мембраны и конденсацией клеточного ядра.
В итоге образуются апоптотические тельца, содержащие неповрежденные органеллы; окружающие клетки фагоцитируют эти тельца. Апоптоз не сопровождается воспалением, что отличает его от некроза. Последний сопровождается набуханием клетки, разрушением всех ее структур и развитием воспалительного ответа.
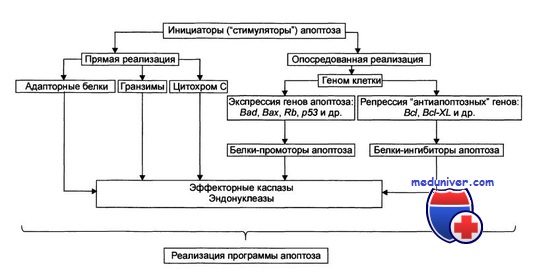
Стадия программирования апоптоза
Апоптоз играет важную роль в нормальном росте организма, а также в развитии и прогрессировании злокачественных опухолей. Спонтанный апоптоз встречается в злокачественных клетках и даже замедляет их рост.
Интенсивность этого процесса возрастает при облучении опухоли, проведении гормоно- и химиотерапии, при нагревании опухоли. В злокачественных опухолях апоптоз представляет механизм уничтожения клеток, в которых произошли канцерогенные изменения ДНК.
Однако если он заблокирован или подавлен мутациями контролирующих его генов, например BCL2 или ТР53, то эти клетки получают возможность свободно делиться и неограниченно накапливать мутации. Такая генетическая нестабильность — ранний этап развития злокачественных опухолей.
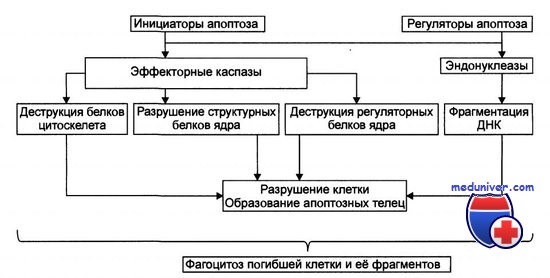
Стадия реализации апоптоза
Многие из современных методов лечения, например лучевая и химиотерапия, направлены на уничтожение клеток за счет повреждения их ДНК. Мутации гена BCL2 или ТР53 ухудшают эффективность лечения, т. к. подавляют клеточную гибель.
Более глубокое понимание процессов запрограммированной клеточной гибели может привести к разработке новых, более эффективных методов лечения. Ингибиторы апоптоза (например, протоонкоген BCL2) могут быть ответственны за развитие резистентности к противоопухолевым препаратам, позволяя выживать клеткам с патологической ДНК.
Вероятно, в дальнейшем будут выявлены и другие механизмы подавления апоптоза. Не следует думать, что этот процесс отражает нечто иллюзорное в биологической литературе, а термин принят только для описания отличной от некроза клеточной гибели. Апоптоз — фундаментальный процесс, контролируемый на молекулярном уровне, и можно надеяться, что его удастся расшифровать и использовать для медицинских нужд. Возможные механизмы апоптоза представлены на рисунке.
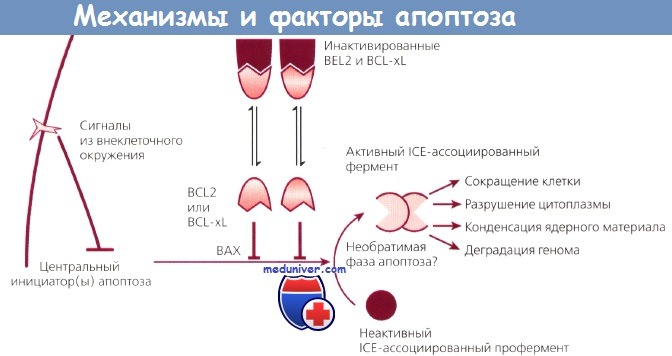
Возможные механизмы апоптоза и факторы, его контролирующие.
Внеклеточный сигнал запускает каскад событий, вовлекающий молекулы BCL2, BCL-xL и ВАХ.
Это ведет к наступлению программированной гибели клетки.
Этот механизм может быть заблокирован на любом из множества этапов, в результате чего клетка становится бессмертной.
ICE - интерлейкин-1b-превращающий фермент.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021


39 километров кишечника
Любая популяция клеток регулируется тремя процессами, одинаково важными: деление, дифференцировка — превращение молодых клеток в зрелые (при этом их количество может как увеличиваться, так и уменьшаться) и гибель клеток. Тело взрослого человека состоит из десятков триллионов клеток, и ежедневно каждый из нас теряет десятки миллиардов из них, в пересчете на вес — примерно килограмм. Само собой разумеется, потерю восполняют новые клетки, так что мы не теряем по килограмму в день. (Кстати, жировые клетки, которым желают погибели многие худеющие, с возрастом могут прибавляться в числе, а умирают неохотно.) Все мы знаем, как слущивается и обновляется поверхностный слой кожи — эпидермис. В числе наиболее активно гибнущих — клетки эпителия кишечника: на протяжении жизни человека они заменяются примерно 4000 раз. Если бы старые клетки не погибали, то за 70 лет наш кишечник достиг бы длины 39 км! Активно обновляются и клетки костного мозга — за те же 70 лет организм производит их около трех тонн. Еще один пример — тимус, в котором рождаются и созревают клетки иммунной системы. Примерно 90% тимоцитов — так называют лимфоциты, пока они находятся в тимусе, — в нем же и погибают, и лишь 10% выходит за его пределы.
В индивидуальном развитии человека или любого другого существа тоже не обойтись без программируемой гибели клеток. Хрестоматийный пример апоптоза — исчезновение хвоста у головастика; интересно, что этот процесс вместе с другими метаморфозами регулируется изменением уровня тироидного гормона в крови. А чтобы у животного сформировались пальцы на лапе, должны исчезнуть клетки, расположенные между зачатками пальцев (рис. 1). Программируемая гибель клеток участвует и в созревании половых органов, и в развитии мозга. Погибшие при апоптозе клетки организма должны быть съедены соседними клетками либо макрофагами — профессионалами пожирания. Благодаря этому апоптоз почти никогда не сопровождается воспалением. Подробнее об этом можно прочитать в недавно опубликованных статьях (H. Yamaguchi et al., 2014, Apoptosis: Keeping inflammation at bay, eLIFE, 3:e02172; D. Wallach, A. Kovalenko, 2014, Apoptosis: Keeping inflammation at bay, eLIFE, 3:e02583).
Рис. 1. Апоптоз во время нормального развития конечности мыши. Клетки, подвергшиеся апоптозу, ярко окрашены. Справа — та же конечность день спустя (W. Wood et al., “Development”, 2000, 127:5245–5252)
Очевидно, что смерть клеток должна строго регулироваться, они должны погибать в определенное время и в определенном месте, иначе в организме воцарится хаос.
Бабочка и червь
Тогда же, в 60-е, биолог Сидней Бреннер, выходец из Южной Африки, работавший в Великобритании, предложил новый модельный объект для исследования индивидуального развития организмов — червячка Caenorhabditis elegans, обитающего в почве. Эти крошечные существа интересны тем, что тела взрослых особей состоят из строго определенного числа клеток, участь каждой из которых предопределена. Через четыре десятилетия, в 2002 году, Сидней Бреннер вместе с Робертом Хорвитцом и Джоном Салстоном получили Нобелевскую премию по физиологии или медицине за идентификацию генов нематоды, контролирующих развитие органов и программируемую гибель клеток.
Пересадки на путях гибели
Механизмы регуляции клеточной смерти оказались весьма сложными, и, несмотря на колоссальный прогресс в этой области, многое остается непонятным. Необходимо детально разобраться в сигнальных путях, приводящих к гибели клетки. Сейчас считается, что существует основной, сердцевинный (коровый) путь с ответвлениями, которые ведут или к специфическим механизмам гибели клеток в отдельных тканях, или к патологиям.
Номенклатурный комитет по исследованию гибели клеток, в который я имею честь входить, по совокупности морфологических и биохимических изменений выделил четыре типичных вида клеточной смерти — апоптоз, некроз, аутофагию и корнификацию (ороговение), а также восемь атипичных видов. Каждый из них протекает по своему пути. При этом нельзя сказать, что типичные важнее атипичных, они просто лучше изучены.
Несколько лет назад Европейский союз выделил 12 миллионов евро на поддержку исследовательского проекта, в котором участвовали биологи- экспериментаторы, врачи, специалисты по математическому моделированию из 12 стран. Мне посчастливилось руководить этим проектом. Его задачей было исследовать сигнальные пути, ведущие к апоптозу и другим типам гибели клеток при ВИЧ-инфекции и онкологических заболеваниях, в частности раке легких, а также в нормальных клетках. (Выбор пал на эти заболевания не только из-за их большой значимости: при СПИДе наблюдается избыточная гибель клеток, при раке — недостаточная.) Эксперименты проводили на клеточных культурах человека, на модельных организмах — дрожжах, нематоде C. elegans и мышах, выполняли также клинические испытания. Проект завершился в 2013 году; в результате удалось получить тесты для выявления патологий и разработать подходы к новым методам терапии.
Что касается теоретического выхода — итоговая схема путей клеточной гибели (рис. 2) довольно сложна, и рассказать о ней полностью в короткой статье невозможно. И все же нетрудно заметить, что перспективных мишеней для воздействия довольно много (на схеме они обозначены минусами). На этих этапах клеточную смерть можно остановить или, если заменить минусы плюсами, ускорить.

Рис. 2. Схема путей, по которым сигнал апоптотической гибели доходит до митохондрий и дальше распространяется по клетке, заканчиваясь распадом хроматина и фрагментацией ядра. Важную роль в прохождении апоптотического сигнала играет активация каспаз, семейства протеолитических ферментов.
Hsp — белки теплового шока, Cyt. c — цитохром c; подробнее о каспазах, белках семейств Bcl-2, IAP, а также SMAC, иначе называемом Diablo, см. в тексте
Одна из сложностей состоит в том, что белки, участвующие в регуляции гибели клеток, выполняют и другие функции. Это и понятно: трудно представить, чтобы рациональная природа создала специальную систему исключительно для умерщвления клеток. По логике вещей, составляющие этой системы должны в норме делать какую-нибудь полезную работу, а при необходимости мобилизоваться, чтобы убрать патологические клетки. Такая многофункциональность усложняет терапию: воздействуя на звено апоптозного пути, важно не помешать работе этого компонента в нормальной ткани.
Почетное место в апоптотической форме клеточной гибели занимают каспазы — семейство из тринадцати белков, разделенных на две группы, которые участвуют в развитии апоптоза или воспаления. Каспазы относятся к протеазам — ферментам, расщепляющим другие белки, причем результаты этой их активности могут быть самыми разными, даже когда речь идет об одном и том же ферменте, но в разных тканях и при различных условиях. Так, при окислительном стрессе каспаза 1 расщепляет интерлейкин 1В, превращая его в активную форму. (Интерлейкины играют центральную роль в иммунных и воспалительных процессах.) Это может быть причиной ишемии в клетках печени и миокарда; на клеточном уровне происходит апоптоз, который в случае нарушений фагоцитоза может трансформироваться в некроз. В печеночной ткани та же каспаза может расщепить белок, приводя к переключению апоптотической программы в аутофагическую, а затем и к геморрагическому шоку. С другой стороны, если полностью убрать этот белок, это вызывает гибель клеток печени по типу некроза.
В 1990–2000-е годы многие фармацевтические фирмы вкладывали огромные деньги в разработку ингибиторов каспаз. Теперь практически все прекратили работу в этом направлении, поскольку ингибиторы оказались токсичными, — именно потому, что блокируют нормальную функцию каспаз в клетках. В настоящее время ингибиторы каспаз используют лишь в экстренных ситуациях, например при остром циррозе печени, когда необходимо как можно скорее остановить разрушение ткани. Другой пример — такое тяжелое заболевание, как болезнь Крона: хроническое воспаление всех отделов желудочно-кишечного тракта, от полости рта до прямой кишки, с образованием свищей, инфекционными осложнениями и прочими проблемами. При лечении болезни Крона (а также ревматоидного артрита и язвенного колита) хорошо показал себя препарат инфликсимаб, в России известный как ремикейд, — он действует как раз через каспазу-1.
Белки семейства IAP — ingibitors of apoptosis proteases — в соответствии с названием, ингибируют апоптотические протеазы, то есть каспазы, тем самым выключая апоптоз. В нормальных клетках белки IAP может обезвредить митохондриальный белок SMAC (second mitochondria-derived activator of caspases) — он выходит из митохондрий, соединяется с IAP и убирает их функцию. Логично было использовать этот эффект для терапии. И действительно, низкомолекулярные миметики SMAC (небольшие молекулы, имитирующие функцию этого белка) показали себя достаточно эффективными при терапии глиомы — опухоли мозга (рис. 3). По некоторым обмолвкам врачей в российских СМИ можно предположить, что подобными препаратами (но, конечно, не только ими) лечили в США певицу Жанну Фриске.
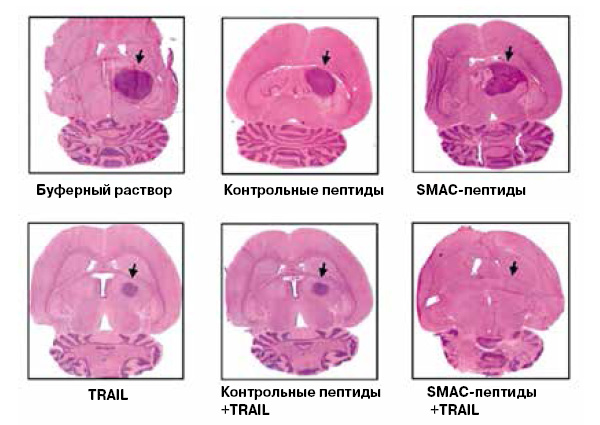
10.1038/nm735). В настоящее время данные миметики SMAC находятся на третьей фазе клинических испытаний" border=0 >
Рис. 3. Подобные SMAC вещества (пептиды или низкомолекулярные органические соединения) делают злокачественную опухоль мозга — глиому чувствительной к терапии белком TRAIL, цитокином из семейства факторов некроза опухолей, а также к многим химиотерапевтическим препаратам (не указаны на рисунке). Только при их совместном действии глиома в мозге подопытных мышей исчезает полностью, ее клетки гибнут по пути апоптоза (S.Fulda et al, Nature Medicine, 2002, 8 (8), 808–815, DOI:10.1038/nm735). В настоящее время данные миметики SMAC находятся на третьей фазе клинических испытаний
Следующий важный элемент схемы — Bcl-2. Перенос его гена с одной хромосомы на другую (транслокация) ассоциируется с лимфомой В-клеток. Отсюда название белка и его гена — аббревиатура B cell lymphoma. В 80-е годы ХХ века австралийский биолог Дэвид Во с коллегами показал, что этот белок работает как антиапоптотический, препятствуя гибели В-клеток; вскоре это подтвердили и другие исследователи. Таким образом, впервые было доказано, что белки, участвующие в негативной регуляции гибели клеток, могут работать как онкогены: если апоптоз блокирован и дефектные клетки не погибают, заболевание развивается.
С этой публикацией связана интересная история. Дэвид Во в то время был аспирантом в Институте медицинских исследований Уолтера и Элизы Холл в Мельбурне. Его научный руководитель, доктор Сьюзен Кори, результаты Дэвида по Bcl-2 встретила холодно. Но Дэвид, будучи упорным человеком, отправился за поддержкой к своему второму руководителю — доктору Джерри Адамсу, и тот решил, что работа заслуживает внимания. Интрига заключалась в том, что второй руководитель был мужем первого. Итогом рабочих и, возможно, внерабочих дискуссий стала совместная публикация руководителей и аспиранта (D. L. Vaux, S. Cory, J. M. Adams, Nature, 1988, 335, 440–442).
Интересно, что аутофагия в опухоли может как подавлять ее развитие, так и способствовать ему. Однако совокупность последних данных говорит о том, что можно заставить аутофагию работать только на гибель опухоли. Не исключено, что удастся как-то использовать связь между аутофагией и апоптозом, переключения между этими двумя маршрутами.
Возможности аутофагии в борьбе с онкологическими заболеваниями наши лаборатории в МГУ и в Каролинском институте изучают совместно с клиницистами из Российского онкологического научного центра имени Н. Н. Блохина. Идея выглядела парадоксально: не стимулировать, а подавить аутофагию в клетках опухоли. Известно, что при этом в клетке накапливаются активные формы кислорода (АФК) и она становится более чувствительной к инициации процесса гибели. Мы попытались проверить это на практике и убедились, что идея работает: ингибирование аутофагии на определенных участках привело к накоплению АФК, и, если в этот момент подействовать специфическими противоопухолевыми препаратами, можно эффективно убить опухоль. Замечу, что эта работа была выполнена только на аденокарциноме легкого, мы не проверяли результаты ни на каких других видах новообразований, и наше представление о механизме пока остается рабочей гипотезой.
Характерный пример — рак легкого. Это название объединяет по крайней мере четыре разных заболевания: мелкоклеточный и немелкоклеточный рак, который, в свою очередь, делится еще на три вида: аденокарциному, плоскоклеточный и крупноклеточный рак. Это деление отнюдь не формальное: у них абсолютно разные генетические основы, биохимия, этиология, общего — только локализация в легком. Конечно же и лечить их нельзя одинаково.
Нужно учитывать еще и такой фактор, как индивидуальная чувствительность больных к терапии. Около 15 лет назад в США был создан препарат для лечения аденокарциномы и других немелкоклеточных раков, получивший название Иресса (гефитиниб). Испытания на клетках в культуре и на животных показали хорошие результаты, и, поскольку рак легких очень распространен в Японии, американское Агентство по контролю пищевых продуктов и лекарств (FDA) решило проводить третью фазу клинических испытаний именно там. Примерно треть пациентов с аденокарциномой легкого отвечала на терапию — великолепное достижение. Но когда FDA допустило этот препарат к применению в США, произошло фиаско: эффект был всего у 2% больных. Дело в том, что Иресса — ингибитор рецептора эпидермального фактора роста EGF, известного как онкоген, а при аденокарциноме могут быть мутации в гене этого белка. В Японии определенная мутация, ранее не известная, встречалась у 30% пациентов, а в Америке приблизительно у 2% — им-то и помогал препарат. Не случайно Евросоюз поддерживает сейчас большую программу персональной медицины. Программа весьма дорогостоящая, но без нее не продвинуться вперед.
Автор: Заболоцкая Валерия Михайловна
Должность: преподаватель
Учебное заведение: ГБПОУ ДЗМ
Населённый пункт: Москва
Наименование материала: статья
Тема: "Некоторые аспекты по теме "Некроз и апоптоз"
Раздел: среднее профессиональное
– генетически запрограммированная физиологическая гибель
клетки. Например, гибель неоплодотворенной яйцеклетки, гибель эритроцита
через 120 дней жизни и т.д. Апоптоз – это сконструированный процесс под
строгим генетическим контролем, чтобы не навредить окружающим клеткам.
Для осуществления данного процесса требуется энергия.
Значение апоптоза: поддержание баланса между размножением и смертью
клеток, запрограммированное обновление тканей.
1. Гибель целой группы клеток в
одном участке органа
1. Гибель одиночных клеток,
2. Патологический процесс
2. Физиологический процесс
4. Возникает из-за действия внешних
4. Генетически запрограммированная
5. Активация собственных ферментов
5. Без активации гидролаз
6. Требует затрат энергии организма
рубцовая соединительная ткань
7. После апоптоза восстанавливаются
клетки аналогичные погибшим
8. Нет клинических проявлений
Механизм апоптоза:
Начинается с ядра клетки – запускают апоптоз ферменты, которые
присутствуют в ядре каждой клетки и до момента апоптоза находятся в
неактивном состоянии – ферменты разрезают молекулы ДНК на куски –
далее куски ДНК сворачиваются и уплотняются – ферменты повреждают
оболочку ядра – затем нарушают целостность клеточной мембраны –
повреждение мембраны является сигналом для макрофагов – макрофаги
фагоцитируют фрагменты клетки.
Механизм некроза:
клетки и ее структур – из разрушенных лизосом выходят собственные
пищеварительные ферменты клетки (гидролазы) – гидролазы разрушают все
В зависимости от причин различают следующие виды некроза:
Травматический - возникает при действии физических факторов.
Токсический – возникает под действием токсинов, кислот, щелочей,
Трофоневротический – возникает при нарушении иннервации тканей, что
ведет к сосудистым нарушениям и необратимым изменениям в тканях.
Сосудистый – возникает при нарушении кровоснабжения органа вследствие
тромбоза (закупорка сосуда тромбом) или эмболии (закупорка сосуда
эмболом – кусочек жира при переломе или пузырек воздуха при инъекции).
Формы некроза: сухой некроз, влажный некроз, инфаркт и гангрена.
Сухой некроз протекает с преобладанием процессов уплотнения тканей. К
сухому некрозу относится творожистый (развивается при туберкулезе, когда
омертвевшая ткань белесоватая и крошится как творог) и фибриноидный
некроз (возникает при пропитывании соединительной ткани фибриногеном,
который превращается в фибрин, оседает на волокнах, уплотняет и
Влажный некроз протекает в тканях с большим количеством воды, когда
ткань расплавляется. Например, расплавление серого вещества головного
– некроз тканей, возникший при нарушении кровообращения
любого органа (тромбоз, эмболия, спазм артерии).
Некротизированные участки черного цвета, так как гемосидерин (пигмент
эритроцитов) окисляется с образованием сернистого железа.
Различают три вида гангрены:
Сухая гангрена - сопровождается мумификацией, частая локализация –
Влажная гангрена – сопровождается инфицированием некротизированной
Пролежень – развивается на участках тела, подвергающихся наибольшему и
Читайте также:

