Система комплемента иммунология реферат
Обновлено: 05.07.2024
Иммунная система работает, чтобы уничтожить антигены, используя иммунные клетки и особые молекулы. Завершение иммунного ответа происходит, когда антиген изолирован или уничтожен. Память о нем сохраняется для быстрой реакции при новой встрече.
Антитела
Антитела – главный молекулярный компонент гуморального иммунного ответа. Они секретируются плазматическими клетками, образованными из В-лимфоцитов. Распознают последовательности белков, полисахаридов и других структур конкретного антигена, точно соединяются с ним по поверхностным свойствам, подходя как ключ к замку. Благодаря наличию сходных структур, один и тот же вид антител перекрестно реагирует на разные антигены. По строению антитела представляют собой иммуноглобулины Ig нескольких классов.
Иммуноглобулин М IgM – первый вид антител, который формируется после встречи с новым антигеном. Циркулируя по крови, он связывает антиген и активирует комплемент, облегчая фагоцитоз. Каждый IgM связывает много антигенов, но эти связи непрочные. Он неидеально подходит к замку и больше похож на грубую заготовку ключа, поэтому часто бывают перекрестные реакции с другими антигенами.
Иммуноглобулин А IgA присутствует в небольшом количестве в крови, но работает преимущественно в виде секреторного sIgA на поверхностях слизистых оболочек и в секретах (слюна, слезная жидкость, молозиво).
Иммуноглобулин D IgD связан с IgM на поверхности молодых В-лимфоцитов. Его уровни в крови очень низкие, а функция не известна.
Иммуноглобулин Е IgE присутствует в крови, на слизистых оболочках дыхательных путей и желудочно-кишечного тракта в небольшом количестве. Он обладает высоким сродством к рецепторам тучных клеток и базофилов. Если антиген взаимодействует с IgE на поверхности этих клеток, происходит их дегрануляция. Это выход содержимого гранул клеток, вызывающих острую аллергическую воспалительную реакцию.
Система комплемента
Система комплемента – это особый тип молекул (белки, ферменты и их предшественники), которые помогают в иммунном ответе. Система комплемента связывает врожденный и приобретенный иммунитет, т.к. участвует в фагоцитозе, выработке антител, уничтожении чужеродных клеток.
Компоненты системы комплемента выполняют множество функций: стимулируют хемотаксис (направленное движения лейкоцитов к антигенам), запускают дегрануляцию тучных клеток независимо от связывания антигена с IgE, помогают фагоцитирующим клеткам связывать антигены (опсонизация) и многое другое. Компоненты комплимента обозначаются буквой С и цифрой, обозначающей очередность их открытия (от С1 до С9), просто буквами (фактор B, фактор D) или имеют название (пропердин).
Активация комплимента происходит под действием иммунных комплексов, образованных связками антиген-антитело, либо же в ответ на крупные антигены и белки острой фазы.
Врожденный и приобретенный дефицит компонентов комплемента существенно снижает устойчивость организма к инфекционным агентам.
Белки воспаления
Воспаление – это местная и общая реакция организма в ответ на раздражитель. Его цель устранить причину повреждения и восстановить ткань в месте повреждения. Раздражители бывают механическими (травма), химическими (ожог, кислоты), инфекционными (бактерии, вирусы и их токсины), иммунными (комплексы антиген-антитело, комплемент).
Белки острой фазы – белки плазмы, уровень которых резко повышается или, в некоторых случаях, понижается при ответе на поражение тканей. Образуются они преимущественно в печени под действием высоких уровней ИЛ-1, ИЛ-6, ФНО-альфа в крови. Наиболее резко повышаются уровни:
Альфа-1 кислого гликопротеина
Сывороточного Р-компонента амилоида
Они повышаются через несколько часов после начала воспаления, способствуют активации комплемента, облегчают фагоцитоз, помогают ограничивать повреждение тканей, повышают сопротивляемость организма к инфекциям, способствуют заживлению тканей и прекращению воспаления. Альфа-1-кислый гликопротеин также является транспортным белком.
К белкам острой фазы воспаления относят фибриноген, ферритин, гаптоглобин, церулоплазмин и другие белки. Например, фибиронген помимо основной функции формирования тромба и остановки кровотечения, которые способствуют заживлению тканей, способен также усиливать фагоцитоз. Уровни фибриногена увеличиваются при воспалении и являются основной причиной повышения скорости оседания эритроцитов (СОЭ) в анализах.
Измерение уровней белков острой фазы указывают на воспаление, инфекцию или травму, но не помогают определить причину их возникновения.
В крови содержится еще много других молекулярных компонентов, которые участвуют так или иначе в воспалении и иммунном ответе. Дисбаланс их работы способствует либо чрезмерному ответу с поражением собственных тканей, развитием аутоиммунной патологии, либо наоборот, слабому ответу с развитием хронического воспалительного процесса.
Комплемент представляет собой систему каскадно-действующих пептид-гидролаз, получивших обозначение от С1 до С9. Установлено, что большая часть компонентов комплемента синтезируется гепатоцитами и другими клетками печени (около 90 %, СЗ, С6, С8, фактор В и др.), а также моноцитами/макрофагами (С1, С2, СЗ, С4, С5).
С1-компонент представлен в плазме крови тремя белками (Clq, Clr, С Is).
Наиболее сложной из них является молекула Clq (рис. 1), состоящая из 18 полипептидных цепей трех типов (по 6 цепей А-, В- и С-типов). Все 18 цепей своими коллагеноподобными N-конца-ми (78 остатков аминокислот) образуют канатообразную спирально закрученную структуру, от которой расходятся в разные стороны С-концевые участки цепей (103—108 аминокислотных остатков), завершающиеся глобулярными головками, которые могут взаимодействовать с комплементсвязывающими участками Сн-доменов антител (в составе иммунного комплекса АГ—AT).
В норме все компоненты комплемента — неактивные или малоактивные соединения, но могут последовательно активироваться за счет отщепления или присоединения пептидных факторов (например, С2а, C2b, C4a, C4b и др.) и факторов активации (факторов В и D, липополисахаридов, гликолипидов, антител и др.) — продукт одной реакции катализирует последующую. Катаболизм компонентов комплемента самый высокий по сравнению с другими белками сыворотки крови, с обновлением в течение суток до 50 % белков системы комплемента.

Рис. 1. Молекула Clq-компонента комплемента (электронная микроскопия)
Молекула состоит из шести терминальных субъединиц, соединенных центральной единицей (из Schaechter M., Medoff G., Eisenstein В. Mechanisms of microbial diseases, 2 nd ed, Williams & Wilkins, 1993)
Активация комплемента может происходить двумя основными путями: альтернативным — без участия антител и классическим — с участием антител (рис. 2).




Рис. 2. Активация системы комплемента (из Schaechter M., MedoffG., Eisenstein В. Mechanisms of microbial diseases, 2 nd ed, Williams & Wilkins, 1993)
Альтернативный путь более древний. В его основе лежит способность некоторых микроорганизмов активировать СЗ-конвертазу (СЗЬВЬ) путем связывания ее на углеводных участках своей поверхностной мембраны с последующей стабилизацией СЗ-кон-вертазы белком пропердином (Р). Про-пердин способен связываться с поверхностью бактериальной клетки и инициировать при этом фиксацию на ней СЗ-конвертазы и присоединение к комплементу дополнительных молекул СЗЬ. СЗЬ способен закрепляться как на поверхности микроорганизма, так и на рецепторах фагоцитов (нейтрофилов и макрофагов), выполняя роль опсонина, усиливающего фагоцитоз различных бактерий. Образовавшийся комплекс СЗЬВЬР обладает функцией СЗ-конвертазы. Формирование СЗ/С5-конвертаз при альтернативном пути активации комплемента происходит при участии факторов В, D, Р в присутствии ионов Mg 2+ и регулируется некоторыми факторами (Н, I и др.) инактивации.
Стабилизированная на мембране активная конвертаза расщепляет СЗ — один из компонентов системы комплемента, содержащийся в крови в наибольшей концентрации, что ведет к цепной реакции активации других компонентов комплемента.
В результате действия СЗ/С5-кон-вертаз вначале при участии СЗ-конвертазы происходит расщепление СЗ-компонента, содержащегося в крови в наибольшей концентрации, что ведет к цепной реакции активации других компонентов комплемента, а последующее сформирование С5-конвертазы ведет к расщеплению С5-компонента на более крупный (С5Ь) и мелкий (С5а) фрагменты. С5Ь связывается с комплексом компонентов комплемента на клеточной мембране, а С5а остается в жидкой фазе, обладая хемотаксической и анафилактогенной активностью.
С5Ь-фрагмент обладает способностью связывать компонент С6 с образованием комплекса С5Ь — С6, к которому быстро присоединяется С7, а затем С8. Комплекс С5Ь — С6, 7, 8 проникает внутрь липидного бислоя мембраны. На завершающем этапе к С8 присоединяются 12—20 молекул С9, что завершает формирование высокоактивного литического комплекса (А. А. Ярилин, 1999), формирующего трансмембранный канал, через который внутрь клетки поступают ионы водорода, натрия и вода, что ведет к набуханию и лизису клетки. С9-белок, гомологичный перфорину, способный к полимеризации при контакте с фосфолипидами мембраны, ответствен за формирование трансмембранного канала цилиндрической формы, наружная поверхность которого образована гидрофобными, а внутренняя (обращенная в полость канала) — гидрофильными участками.
Классический путь активации комплемента возник для усиления фагоцитоза в отношении микроорганизмов, которые не запускают альтернативный путь, т. е. не имеют на мембране полисахаридного участка связывания СЗ-конвертазы. Главная особенность этого пути — взаимодействие антигена и антитела с образованием иммунного комплекса (АГ—AT), активирующего компоненты комплемента (С1, С2, С4), которые, в свою очередь, формируют СЗ-конвертазу (С4Ь2а), расщепляющую СЗ-компонент.
В Сн4-доменах IgM и Сн2-доменах IgG имеются участки, обладающие сродством к Clq (только в составе иммунных комплексов). Clq связывается не менее чем с двумя Сн4-доменами одной и той же молекулы IgM и с Сн2-до-менами одновременно двух молекул IgG, в связи с чем комплементактиви-рующая активность IgG ниже, чем у IgM. С комплементсвязывающими участками антител (IgM, IgGl, IgG3 и IgG2) взаимодействуют концевые (глобулярные) участки Clq, что ведет к активации молекулы Clq, приобретающей свойства сериновой пептидгидро-лазы. Clq-пептидгидролаза активирует Clr, который участвует в активации Cls. В результате образующиеся при активации и расщеплении Clr- и Cls-фрагменты встраиваются в Clq, располагаясь между его глобулярными участками (головками). При этом формируется комплекс Clqrs, обладающий активностью трипсиновой пептидгидролазы, катализирующей расщепление С4 (на С4а- и С4Ь-фрагменты) и С2 (на С2а- и С2Ь-фрагменты). Следствием взаимодействия Clqrs, C4b и С2а в присутствии ионов Са 2+ является образование комплекса С4Ь2а, обладающего свойствами и активностью СЗ-конвертазы, расщепляющей СЗ, и участвующего в формировании С5-конверта-зы (С4Ь2аЗЬ). Дальнейшая активация комплемента по классическому пути полностью совпадает с альтернативным путем и завершается формированием мембраноатакующего комплекса С5Ь — 6789 и лизисом клеток.

Рис. 3. Аналогичные этапы активации комплемента по классическому, лектиновому и альтернативному механизмам:
Таким образом, принципиальных биохимических различий между классическим и альтернативным путями активации комплемента, по существу, нет, тем более что факторы В и С2, участвующие в активации СЗ по альтернативному и классическому путям, сходны между собой (по размеру, строению, фрагментам расщепления, механизму действия). Есть мнение, что, возможно, факторы В и С2 возникли в результате дубликации одного гена (В. В. Чиркин и др., 1999). Однако по клиническим проявлениям различия между этими путями весьма существенны. При альтернативном пути в циркуляторном русле значительно увеличивается содержание осколков белковых молекул с высокой биологической активностью, для нейтрализации которых включаются сложные механизмы, что повышает возможность развития вялотекущего, зачастую генерализованного воспалительного процесса. Классический путь наиболее безвреден для организма. При нем на микроорганизмы одновременно воздействуют и фагоциты, и антитела, которые специфически связывают антигенные детерминанты микроорганизмов и активизируют систему комплемента, способствуя тем самым активации фагоцитоза. При этом уничтожение атакуемой клетки происходит одновременно при участии и антител, и комплемента, и фагоцитов, что внешне может никак не проявляться. В связи с этим классический путь активации комплемента считается более физиологическим путем обезвреживания и утилизации антигенов, чем альтернативный.
Помимо двух основных путей возможны и другие механизмы активации комплемента. В частности, существует вариант классической активации комплемента — лектиновый путь активации (рис. 3), который можно трактовать и как самостоятельный (А. А. Ярилин и др., 1999; А. Ройт и соавт., 2000). Как известно, лектинами называют белки, способные специфически соединяться с определенными группами углеводов. Запуск лектиново-го пути активации комплемента связан с одним из лектинов — маннозосвязывающим белком (МСБ, содержится в сыворотке крови в концентрации 0,1 — 5,0мкг/мл). МСБ имеет очень сходную с Clq структуру хотя негомологичен ему; является Са - зависимым, обладает сродством к маннозе, которая в свободной форме присутствует на микробных клетках, но не на клетках макроорганизма. Связавшись с маннозосодержащей клеткой, МСБ приобретает способность, подобно Clqrs, активировать С4 и С2.
Дальше лектиновый и классический пути активации совпадают (А. А. Яри лин, 1999). Возможно, что лектиновый путь активации комплемента в филогенезе появился позднее альтернативного, но раньше классического. В отличие от альтернативного лектиновый путь, как и классический, включает активацию С4 и С2, но без участия антител, а с участием лишь одного МСБ. Не исключено, что появление в процессе эволюции Clq, подобного маннозосвязывающему белку, но способного приобретать активность пептидгидролазы, инициирующей каскад реакций активации комплемента лишь после взаимодействия с антигенами, привело к возникновению более эффективного классического пути активации комплемента, что значительно расширило возможности для активации комплемента у позвоночных.
Классический путь активации комплемента может также запускаться С -реактивным белком, комплексом гепарина и протамина, некоторым гликолипидами, пептидгидролазами при некоторых формах острой воспалительной реакции (пепсином, трипсином, калликреином, лизосомальными и бактериальными ферментами) на какой-либо стадии от С1 до С5.
Воронин Е.С., Петров А.М., Серых М.М., Девришов Д.А. – Иммунология /Под ред. Е.С. Воронина. – М.: Колос-Пресс, 2002. – 408с.
Кульберг А.Я. /Учебное пособие – Молекулярная иммунология – М.: Высш. Шк., 1985. – 287с.

Система комплемента — комплекс белков, постоянно присутствующих в крови, которые выполняют ряд важнейших функций. На данный момент комплекс насчитывает более трех десятков белковых молекул, среди которых основные белки — С1, С2, …, С9, а также ряд белков-регуляторов. Комплемент принято относить к факторам врожденного иммунитета, выполняющим защитную функцию, однако при определенных обстоятельствах сбой работы системы комплемента может стать звеном патогенеза некоторых заболеваний.
Вначале разберем механизмы работы системы комплемента, после чего рассмотрим их клиническое значение.
Активация системы комплемента
Существует три пути активации данной системы: классический, альтернативный и лектиновый. Все они приводят к ключевому событию: формированию С3-конвертазы.
В классическом варианте комплемент активируется через IgG и IgM, которые формируют иммунные комплексы с антигенами. Комплекс С1 (состоящий из q, r и s субъединиц) связывается с Fc-фрагментом иммуноглобулина. Происходит активация C1, комплекс приобретает протеолитическую активность и активирует C4 и C2. Последние формируют ключевой ферментативный комплекс — С3-конвертазу.
При альтернативном пути активация комплемента происходит без участия антител. Инициируют его поверхностные молекулы микробов и их внеклеточные структуры — например, углеводороды, полисахариды и т. д. С3 в клетках постоянно (даже когда нет активации системы комплемента) претерпевает диссоциацию на С3а и С3b, но в очень малых количествах.
Когда в клетке появляется инициирующий фактор (предположим, это бактерия), С3b связывается с ее поверхностными молекулами. К этому комплексу присоединяются другие молекулы-регуляторы: фактор В, фактор D, пропердин. Так появляется еще одна форма С3-конвертазы.
Лектиновый путь активируется через лектин, связывающий маннозу (фактор врожденного иммунитета — MBL) или группу лектинов Ficolin, которые связывают молекулы на поверхности патогенов — дрожжей, бактерий, паразитов и вирусов. MBL и Ficolin постоянно циркулируют в крови в виде MBL-ассоциированного комплекса (MASP). Когда MASP связывается с вышеназванными молекулами, комплекс претерпевает изменения конформации и активирует уже знакомый путь C4 и C2, что приводит к формированию С3-конвертазы, как и в классическом случае.
Итак, вне зависимости от пути активации различия оканчиваются на формировании ключевого фермента — С3-конвертазы. Последняя расщепляет С3 на два фрагмента: С3а и С3b. Отметим, что С3b выполняет функцию опсонина, С3а — анафилотоксин, способный воздействовать на тучные клетки с высвобождением гистамина.
Однако С3b также способен присоединиться к С3-конвертазе и модифицировать ее, превратив в С5-конвертазу. Этот фермент проделывает то же самое с С5, образуя С5а и С5b. По аналогии, С5а — анафилотоксин, С5b — опсонин.
И снова С5b присоединяется к С5-конвертазе, вовлекая в каскад С6–С9 с формированием т. н. мембраноатакующего комплекса (MAC) [1].
.
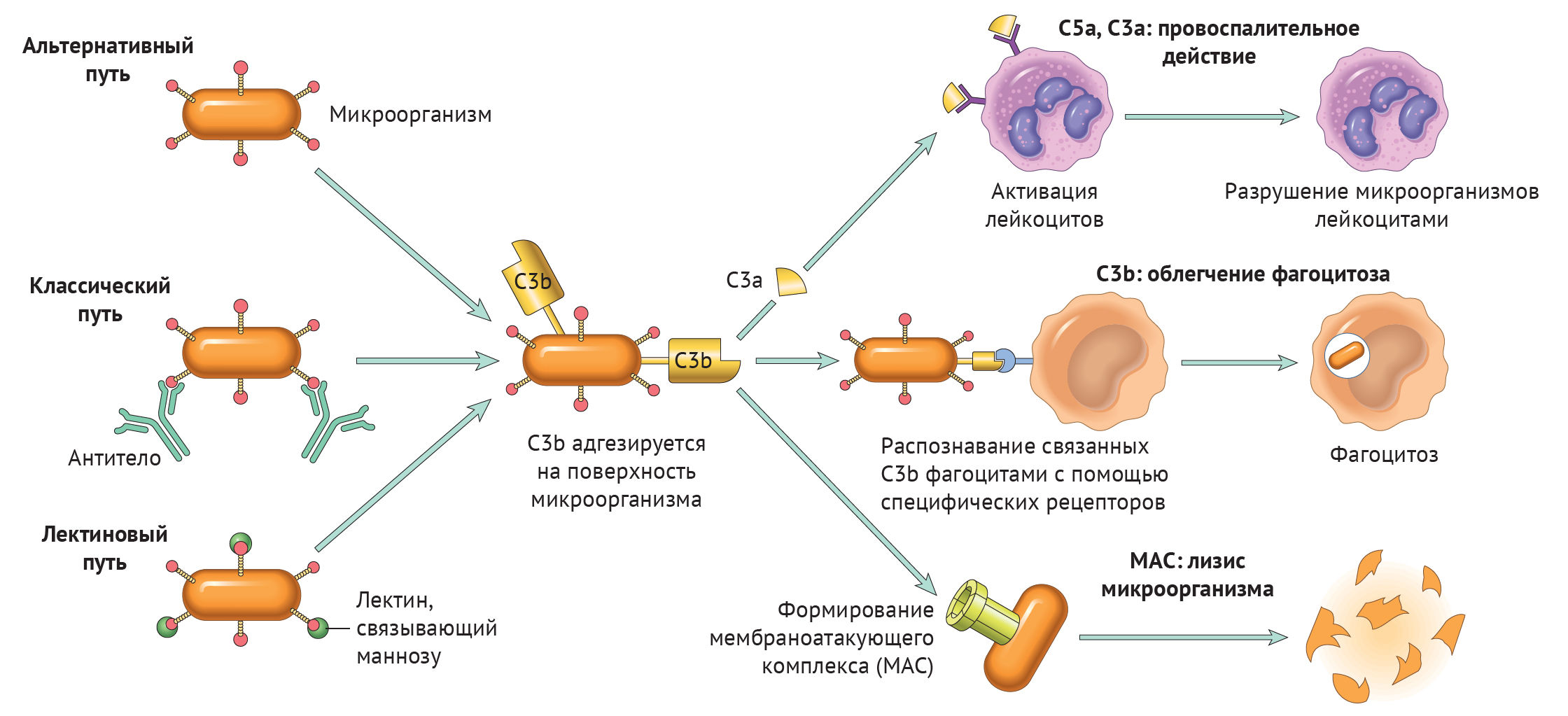
Таким образом, систему комплемента можно разделить на три функциональные группы: анафилотоксины, опсонины и мембраноатакующий комплекс — МАС.
.

Анафилотоксины
К ним относятся С3а, С4а и С5а. В целом, их роль сводится к провоспалительному действию, что выражается в повышении проницаемости сосудов микроциркуляторного русла (МЦР), вазоконстрикции. В нейтрофилах, эозинофилах и макрофагах анафилотоксины инициируют респираторный взрыв, в базофилах и тучных клетках — высвобождение гистамина. Кроме того, анафилотоксины регулируют синтез эозинофильного катионного белка, адгезию и хемотаксис эозинофилов [2].
В здоровом организме роль анафилотоксинов по большому счету этим и ограничивается. Однако в случае реакций гиперчувствительности данные молекулы могут стать ключевым звеном патогенеза. Одним из наиболее ярких примеров является бронхиальная астма.
Эпителий и гладкомышечные клетки дыхательных путей содержат рецепторы к анафилотоксинам — C3aR и C5aR. При аллергических реакциях происходит активация системы комплемента, который в свою очередь активирует иммунокомпетентные клетки (ИКК), среди которых — нейтрофилы, эозинофилы, макрофаги, дендритные клетки. Последние под влиянием стимула (например, аллергена) способны в свою очередь вновь активировать комплемент — так замыкается порочный круг.
Помимо поддержания системного воспаления, анафилотоксины ответственны и за ремоделирование дыхательных путей. Под их влиянием происходит гиперплазия мерцательного эпителия и гладкомышечных клеток, неоваскуляризация и фиброзирование паренхимы [3,4].
Также анафилотоксины играют важную роль в патогенезе синдрома системного воспалительного ответа (SIRS). При сепсисе, когда микробы в больших количествах попадают в кровоток, происходит системная активация цитокинов, хемокинов и, конечно, системы комплемента. Повышение концентрации анафилотоксинов при сепсисе, к слову, считается неблагоприятным прогностическим фактором [5].
В случае с сепсисом и SIRS анафилотоксины становятся звеном патогенеза. Наибольшая роль в данной ситуации принадлежит С5а. Предположительно, избыточный синтез этого белка приводит к дисфункции нейтрофилов, апоптозу лимфоидных клеток, способствует развитию кардиомиопатий, ДВС-синдрома и полиорганной недостаточности.
В связи с этим постепенно разрабатываются препараты, ингибирующие синтез С5а. На биологических моделях было показано, что блокада данного фактора действительно улучшает прогноз при сепсисе и SIRS [6].
МАС
Данный комплекс может формироваться на поверхности грамотрицательных бактерий и напрямую участвовать в их уничтожении (более всего действие МАС направлено против Neisseria). Описаны также случаи образования МАС на поверхности грамположительных бактерий, паразитов и мембране собственных клеток. Состоит он из последних 5 белков комплемента: С5 — С9.
Специфического рецептора, инициирующего образование комплекса, нет. Белки комплемента адгезируются на наружной поверхности клеточной стенки бактерии, после чего комплекс приобретает ферментативную активность и перфорирует мембрану. Нарушается концентрация ионов и воды — клетка погибает [7].
Не допустить образование МАС на собственных клетках помогает рецептор CD59. Генетический дефект CD59 приводит к появлению пароксизмальной ночной гемоглобинурии [7]. А поскольку МАС способен поддерживать системное воспаление, он также вовлекается в патогенез различных воспалительных заболеваний (см. ниже).
Возрастная макулярная дегенерация
Возрастная макулярная дегенерация (ВМД) — основная причина слепоты у пациентов старше 50 лет в цивилизованных странах. В макуле (как и во всей сетчатке) происходят дистрофически-дегенеративные процессы, вследствие чего нарушается способность фокусировать свет в определенной точке, в результате исчезает ясность и четкость зрения. Существует две формы ВМД: влажная (быстро прогрессирующая, экссудативная) и сухая (атрофическая форма). Иногда выделяют рубцовую форму, которая скорее является завершающей стадией заболевания.
Одним из ключевых звеньев этиопатогенеза ВМД является дефект фактора комплемента H — одного из основных регуляторов системы комплемента. Функция его заключается в ингибировании С3-конвертазы (если точнее — является кофактором для протеазы, которая осуществляет катализ С3-конвертазы). Существует несколько форм гена фактора Н, один из наиболее известных — Y402H, который существенно повышает риск развития ВМД. Есть и другие, более редкие варианты [9].
В случае влажной формы ВМД происходит неоваскуляризация сетчатки — аномальное разрастание сосудов под действием VEGF (фактор роста эндотелия сосудов). В опытах было показано, что высвобождение VEGF и неоваскуляризация невозможны без действия MAC [10].
Также в обоих вариантах ВМД важная роль приписывается локальному хроническому воспалению под воздействием системы комплемента. Установлена взаимосвязь между активацией комплемента (особенно по альтернативному пути) и риском развития ВМД [10].
Разумеется, эти данные невозможно было проигнорировать, вследствие чего начали разрабатывать ингибиторы факторов системы комплемента для предотвращения ВМД. На данный момент существуют и моноклональные антитела (анти-фактор D, Экулизумаб), и рекомбинантный фактор Н, и антагонисты различных белков системы комплемента, но пока ни один из них не рекомендован для лечения ВМД [10].
Болезнь Альцгеймера
Воспалительный процесс в нервной ткани сегодня рассматривается как основное патогенетическое звено в развитии БА и других нейродегенеративных заболеваний. Также существуют данные, что прием противовоспалительных препаратов (НПВС) существенно снижает риск развития БА [11].
Однако помимо воспалительных цитокинов, важная роль в развитии локального воспаления принадлежит и системе комплемента. В ликворе пациентов с болезнью Альцгеймера обнаруживается повышенная концентрация С3 в сравнении со здоровыми пациентами. Также активность системы комплемента у пациентов с БА существенно выше [12].
Наследственный ангионевротический отек
НАО — редкое и потенциально фатальное заболевание, этиологическим фактором которого является генетический дефект (НАО 1 типа) или дисфункция (НАО 2 типа) ингибитора С1-компонента комплемента (iС1). В норме iС1 — регулятор, который блокирует весь путь активации системы комплемента. При его дефиците происходит гиперактивация начальных компонентов комплемента, следствием чего является повышение проницаемости сосудов, что приводит к различным отекам.
Проявляется НАО в основном в возрасте после 20 лет отеками конечностей, реже — шеи и лица, которые длятся 1–3, максимум — 7 дней, после чего самостоятельно проходят. Сначала пациент может их даже не замечать, однако со временем частота и выраженность отеков нарастают, может происходить отек слизистой ЖКТ, что проявляется болью, тошнотой, иногда — клиникой острого живота. Наиболее опасен отек гортани, который может сопровождаться асфиксией.
Но ситуация с лечением не так уж и плоха. Ингибитор С1 можно вводить внутривенно для профилактики приступов, для купирования — подкожно [13,14].
Пароксизмальная ночная гемоглобинурия
ПНГ — редкое заболевание, в основе которого лежит клональная экспансия гемопоэтических клеток с мутацией PIGA. Результатом данной мутации является недостаточность ГФИ-заякоренных белков, а именно — CD55 и CD59 (гликозилфосфатидилинозитол или ГФИ-якорь — гликопептид, присоединяющийся к белкам в процессе посттрансляционных модификаций).
Проявляется заболевание гемолитической анемией, костномозговой недостаточностью, тромбофилией.
В норме CD55 ингибирует С9-компонент и предотвращает формирование МАС, а CD59 — ингибирует образование С3-конвертазы и предотвращает протеолиз С3-компонента.
Патогенез начинается с внутрисосудистого гемолиза, который происходит ввиду дефицита CD55. На поверхности эритроцитов с мутацией формируется С3-конвертаза, которая запускает дальнейший синтез МАС. Образование последнего ничего не сдерживает из-за дефекта CD59. МАС перфорирует мембрану эритроцита, и клетка погибает.
Все клинические проявления — гемоглобинурия, анемия (апластическая), тромбоз/эмболия, гастроинтестинальные и неврологические симптомы, так или иначе, являются следствием данного механизма [15,16].
В качестве лечения используется трансплантация гемопоэтических клеток, гемотрансфузии, симптоматическая и поддерживающая терапия. Также достаточно перспективным является использование ингибиторов системы комплемента, например, Экулизумаба (Солириса), который, по данным некоторых публикаций, устраняет все значимые симптомы заболевания [15].
Однако по данным Кохрейна, доказательную базу Экулизумаба нельзя назвать достаточной [17].
Атипичный гемолитико-уремический синдром
Для АГУС характерными симптомами являются гемолитическая анемия, тромбоцитопения и почечная недостаточность с уремией. Этиологией данного заболевания могут быть различные генетические дефекты регуляторов системы комплемента.
Зачастую это мутация CFH, отвечающего за экспрессию уже знакомого читателю фактора Н. Таких мутаций существует более 80, они могут быть наследственными или спорадическими. Также встречаются мутации генов, ответственных за фактор В, С3-компонент комплемента, тромбомодулин и др. [18].
В лечении АГУС также может быть использован экулизумаб [19], однако и здесь ощущается нехватка доказательной базы. В основном же терапия АГУС осуществляется с помощью гемотрансфузий/плазмообмена, диализа, почечной трансплантации — и снова ни одна из названных процедур не способна избавить пациента от болезни [18]. Таким образом, наиболее перспективна разработка ингибиторов системы комплемента и проведение РКИ с их участием.
Помимо перечисленных заболеваний, система комплемента принимает непосредственное участие в патогенезе аутоиммунных кожных заболеваний [20], воспалительных заболеваний почек [21], разнообразных аллергических и аутоиммунных заболеваний.
Разработка ингибиторов комплемента уже сегодня является перспективным направлением, а некоторые препараты данной группы (экулизумаб) уже могут применяться в ряде случаев.
Компоненты системы комплемента выполняют множество биологических функций (например, стимуляция хемотаксиса, запуск дегрануляции тучных клеток независимо от иммуноглобулина E [IgE]).
Активация комплемента
Пути активации комплемента
Классический, лектиновый и альтернативный пути сходятся в 1, в котором СЗ-конвертаза расщепляет СЗ на СЗа и СЗb. АТ = антитело; АГ = антиген; C1-INH = С1- ингибитор; MAC = комплекс мембранной атаки; MASP = MBL-ассоциированная сериновая протеаза; MBL = маннозосвязывающий лектин. Верхняя черта означает активацию.
Компоненты классического пути обозначаются буквой С и цифрой (например, С1, С3), обозначающей очередность их идентификации. Компоненты альтернативного пути часто обозначаются буквами (например, фактор B, фактор D) или имеют название (например, пропердин).
Активация классического пути может быть
антитело-зависимая, возникающая при взаимодействии C1 с антиген-IgM или агрегированными антиген-IgG комплексами
АТ-независимая, возникающая когда полианионы (например, гепарин, протамин, ДНК и РНК из апоптотических клеток), грамотрицательные бактерии или связанный С-реактивный белок реагируют непосредственно с С1

Этот путь регулируется С1-ингибитором (C1-INM). Наследственная ангиоэдема Наследственный ангионевротический отек И наследственный, и приобретенный ангионевротический отек (приобретенный дефицит ингибитора С1-белка) вызваны дефицитом или дисфункцией ингибитора комплемента 1 (С1), белка, участвующего в регуляции. Прочитайте дополнительные сведения ассоциирована с генетической недостаточностью С1-INH.
Активация лектинового пути – АТ-независимый процесс; он возникает, когда маннозосвязывающий лектин (МСЛ), протеин сыворотки, связывается с маннозой, фруктозой или N-ацетилглюкозаминовыми группами на клеточных стенках бактерий и дрожжей или на вирусах. В остальном этот путь структурно и функционально напоминает классический путь.
Активация альтернативного пути осуществляется тогда, когда компоненты поверхностей клеток микроорганизмов (например, клеточных стенок дрожжей, липополисахариды клеточной стенки бактерий [эндотоксин]) или иммуноглобулин (например, нефротический фактор, агрегированный IgA) расщепляют небольшое количество С3. Этот путь регулируется пропердином, фактором Н, и фактором, ускоряющим некроз (CD55).
Эти три пути в итоге сходятся в один, где СЗ-конвертаза расщепляет СЗ на СЗа и СЗb (см. рисунок Пути активации комплемента [Complement activation pathways] Пути активации комплемента Система комплемента – каскад ферментов, облегчающих борьбу с инфекционным процессом. Многие белки комплемента присутствуют в сыворотке крови в качестве предшественников ферментов (зимогенов). Прочитайте дополнительные сведения ). Расщепление С3 может привести к образованию комплекса атаки на мембрану (МАС), цитотоксическому компоненту системы комплемента. МАС является причиной лизиса чужеродных клеток.
Фактор I с кофакторами, включая мембранный кофакторный белок (CD46), инактивирует C3b и C4b.
Дефекты и дефицит системы комплемента
Недостатки или дефекты в конкретных компонентах комплемента связаны с конкретными нарушениями; ниже приведены примеры:
Дефицит С1, С2, С3, MBL, MBL-ассоциированной серин-протеаза (MASP-2), фактора Н, фактора I или рецептора комплемента 2 типа (CR2): повышение риска рецидивирующих бактериальных инфекций

Дефицит C5, C9, фактора B, фактора D или пропердина: восприимчивость к нейссериальным инфекциям Менингококковая инфекция Менингококки (Neisseria meningitidis) – это грамотрицательные кокки, которые вызывают менингит и менингококкемию. Симптомы обычно тяжелые, включают головную боль, тошноту, рвоту, светобоязнь. Прочитайте дополнительные сведения

Дефекты С1, С4 и С5: системная красная волчанка Системная красная волчанка (СКВ) Системная красная волчанка – хроническое мультисистемное воспалительное заболевание аутоиммунной природы; поражает преимущественно молодых женщин. Наиболее часто заболевание проявляется артралгиями. Прочитайте дополнительные сведения

Мутации генов фактора В, фактора Н, фактора I, кофактора мембранных белков (CD46) или С3: развитие атипичного варианта гемолитико-уремического синдрома Гемолитико-уремический синдром (ГУС) Гемолитико-уремический синдром (ГУС) является острым скоротечным заболеванием, для которого характерна тромбоцитопения, микроангиопатическая гемолитическая анемия и острое поражение почек. ГУС. Прочитайте дополнительные сведения
Биологическая активность системы комплемента
Компоненты системы комплемента выполняют и другие биологические функции, которые реализуются рецепторами комплемента (CR) на различных типах клеток.
CR1 (CD35) способствует фагоцитозу и участвует в выведении иммунных комплексов.
CR2 (CD21) регулирует продукцию АТ В-лимфоцитами и является рецептором вируса Эпштейна – Барр.
CR3 (CD11b/CD18), SR4 (CD11c/CD18) и рецепторы C1q играют роль в фагоцитозе.
С3а, С5а и С4а (слабо) проявляют анафилатическую активность: они вызывают дегрануляцию тучных клеток, ведущую к повышению проницаемости сосудов и сокращению гладкой мускулатуры.
С3b работает в качестве опсонина, покрывая микрооорганизмы и, тем самым, усиливая их фагоцитоз.
С3d усиливает продукцию АТ В-лимфоцитами.
С5а является хемоаттрактантом нейтрофилов. Он контролирует активность нейтрофилов и моноцитов и может стать причиной повышенного слипания клеток, дегрануляции и высвобождения внутриклеточных ферментов из гранулоцитов, продукции токсических метаболитов кислорода и других действий, связанных с клеточным метаболизмом.
Читайте также:

