Шартты патогенді бактериялар реферат
Обновлено: 02.07.2024
Серрации являются условно-патогенными микробами, вызывающими у человека гнойно-воспалительные заболевания различной локализации. Частота выделения серраций и их этиологическая роль возрастают при госпитальных инфекциях. Наличие патогенных свойств у бактерий рода Serratia обусловливает их способность вызывать инфекционный процесс. Патогенные свойства придают бактериям способность преодолевать защитные барьеры организма человека, распространяться в его тканях, подавлять неспецифическую и специфическую реактивность организма. Целью данного исследования было изучение патогенных свойств клинических штаммов бактерий рода Serratia. В данной работе было исследовано 58 клинических штаммов бактерий рода Serratia, выделенных из различного патологического материала: испражнений, мочи и гнойного отделяемого. Определяли индекс адгезивности исследованных бактерий, гемагглютинирующую способность, адсорбцию бактериями красителя конго красного. Исследовали антилизоцимную активность и гемолитическую способность. Все изученные штаммы характеризовались высоким персистентным потенциалом. Большинство изученных клинических штаммов бактерий рода Serratia обладали следующими патогенными свойствами: адгезивной, гемагглютинирующей, антилизоцимной и гемолитической активностью. Особенно сильно была выражена адгезивная активность у бактериальных культур серраций, выделенных из испражнений и гнойного отделяемого. Подавляющее большинство исследованных клинических штаммов обладало способностью агглютинировать эритроциты человека и эритроциты барана. Уровень антилизоцимной активности клинических штаммов серраций, выделенных из мочи и гнойного отделяемого, был несколько выше, чем у штаммов, выделенных из испражнений. Наиболее выраженно гемолитическая активность проявилась у штаммов серраций, выделенных из гнойного отделяемого.

1. Mahlen S.D. Serratia infections: from military experiments to current practice. Clin. Microbiol. Rev. 2011. vol. 24. no. 4. P. 755-791.
2. Bertrand X., Dowzicky M.J. Antimicrobial susceptibility among gram-negative isolates collected from intensive care units in North America, Europe, the Asia-Pacific Rim, Latin America, the Middle East, and Africa between 2004 and 2009 as part of the Tigecycline Evaluation and Surveillance Trial. Clin.Ther. 2012. vol. 34. no. 1. P. 124-137.
3. Sader H.S., Farrell D.J., Flamm R.K., Jones R.N. Antimicrobial susceptibility of Gram-negative organisms isolated from patients hospitalized in intensive care units in United States and European hospitals (2009-2011). Diagn.Microbiol Infect Dis. 2014. vol. 78. no. 4. P. 443-448.
4. Sader H.S., Castanheira M., Farrell D.J., Flamm R.K., Jones R.N. Ceftazidime-avibactam activity when tested against ceftazidime-nonsusceptible Citrobacter spp., Enterobacter spp., Serratia marcescens, and Pseudomonas aeruginosa from Unites States medical centers (2011-2014). Diagn Microbiol Infect Dis. 2015.vol.83. no. 4. P. 389-394.
6. Samonis G., Vouloumanou E.K., Christofaki M., Dimopoulou D., Maraki S., Triantafyllou E. Serratia infections in a general hospital: characteristics and outcomes. Eur. J. Clin.Microbiol. Infect Dis. 2011.vol.30. no. 5. P. 653-660.
7. Wu Y.M., Hsu P.C., Yang C.C., Chang H.J., Ye J.J., Huang C.T. Serratia marcescens meningitis: Epidemiology, prognostic factors and treatment outcomes. J. Microbiol. Immunol. Infect. 2013. vol. 46. no. 4. P. 259-265.
8. Габидуллин З.Г., Савченко Т.А., Габидуллин Ю.З., Туйгунов М.М., Булгаков А.К., Давлетшина Г.К., Суфияров Р.С., Усманова И.Н., Хуснаризанова Р.Ф. Условно-патогенные грамотрицательные и грамположительные бактерии: учебное пособие для студентов. Уфа: Издательство ГБОУ ВПО БГМУ Минздрава России. 2014. С.7-11.
9. Брилис В.И., Брилене Т.А., Ленцнер Х.П., Ленцнер А.А. Методика изучения адгезивного процесса микроорганизмов // Лабораторное дело. 1986. №4. С.210-212.
Особую значимость среди бактериальных инфекций имеют нозокомиальные заболевания [1]. С каждым годом число возбудителей внутрибольничных инфекций (ВБИ) увеличивается в основном за счет условно-патогенных микроорганизмов. Ведущую роль играют стафилококки (до 60% всех случаев ВБИ), представители грамотрицательной микрофлоры, аскомицеты рода Candida [2, 3]. Главной особенностью возбудителей внутрибольничных инфекций является их выраженная вирулентность и устойчивость к антибактериальным препаратам и дезинфектантам [4, 5]. В последние годы наряду с вышеперечисленными возбудителями ВБИ все чаще выделяются представители рода Serratia [6, 7].
Серрации – условно-патогенные микробы, вызывающие у человека гнойно-воспалительные заболевания различной локализации. Наиболее изученным видом является Serratia marcescens. В настоящее время бактерии рода Serratia marcesens описаны как возбудители диарейных заболеваний у человека, инфекций мочевыводящих путей, менингита, артрита, сепсиса [8]. Постоянный мониторинг изменяющихся биологических свойств выделенных клинических изолятов является одним из важнейших этапов эпидемиологической работы, в связи с чем актуально исследование постоянно меняющихся свойств бактерий этой группы.
Целью данного исследования было изучение патогенных свойств клинических штаммов бактерий рода Serratia.
Материал и методы исследования. В работе использовано 58 клинических штаммов, отнесенных на основании биологических свойств к роду Serratia. Штаммы Serratia были выделены из различного патологического материала: из испражнений (15 штаммов) от пациентов с кишечными инфекциями, мочи (20 штаммов) от больных с уретритами и гнойного (раневого) отделяемого (23 штамма) от пациентов с абсцессами и флегмонами мягких тканей.
Способность к адгезии у бактерий изучали с помощью формалинизированных эритроцитов человека. Определяли основные показатели адгезии. Вычислили индекс адгезивности микроорганизмов. По данному показателю все бактерии разделили на 4 группы: 1 – неадгезивные (индекс адгезивности 4,0).
Адсорбцию бактериями красителя конго красного выявляли на 1,5%-ном мясопептонном агаре с добавлением 0,02% казаминовых кислот и 0,01% конго красного.
Способность к гемагглютинации у бактерий определяли в реакции гемагглютинации с 3%-ной взвесью свежих эритроцитов человека и барана, которую проводили на панелях из органического стекла.
Для выявления D-маннозорезистентной гемагглютинации во взвесь эритроцитов добавляли 1,5% D-маннозы [9].
Антилизоцимную активность изучали по методике О.В. Бухарина. Исследования антилизоцимной активности проводили в диапазоне концентраций от 1 до 6 мкг/мл. В качестве тест-культуры использовался штамм Micrococcus luteus var. Lysodeikticus № 2665. Гемолитическую способность бактерий определяли на мясопептонном агаре с 3–5% отмытых в растворе Хенкса эритроцитов кролика. Для выявления тиолзависимых гемолизинов использовался мясопептонный агар с 0,002% L-цистеина.
Статистическую обработку проводили стандартными методами.
Результаты исследования и их обсуждение
Исследование адгезивных свойств бактерий рода Serratia выявило, что адгезивные штаммы с индексом адгезивности выше 2,5 составили 70,6% (41 штамм) из общего количества изученных штаммов, из которых 13 штаммов серраций (86,7%) были выделены из испражнений, 18 штаммов серраций (78,3%) были выделены из гнойного отделяемого, 10 штаммов серраций (50%) были выделены из мочи.
Все адгезивные штаммы разделили на две группы: высокоадгезивные и со средней степенью адгезивности. К штаммам, обладающим высоким индексом адгезивности (более 4), отнесли 3 штамма серраций (20%), выделенных из испражнений, 5 штаммов серраций (21,7%), выделенных из гнойного отделяемого, все адгезивные штаммы (10 бактериальных культур), выделенные из мочи.
Сренеадгезивными оказались 23 штамма (39,7%). Индекс адгезивности у них составил от 2,5 до 4. Среди выделенных из испражнений штаммов со средним показателем ИАМ было 10 штаммов (66,7%), а выделенные из гнойного отделяемого составили 13 штаммов (56,5%). Все остальные штаммы были отнесены к низкоадгезивным с индексом адгезивности микроорганизмов от 1,76 до 2,5. 40 штаммов (68,9%) из всех изученных клинических культур серраций обладали способностью адсорбировать конго красный. Из выделенных из испражнений такой способностью обладало 14 штаммов (93,3%), 10 культур серраций, выделенных из мочи (50%), а среди выделенных из гнойного отделяемого это свойство было выявлено у 16 штаммов (69,6%) (табл. 1).
Вы можете изучить и скачать доклад-презентацию на тему Патогенді кокктар. Презентация на заданную тему содержит 14 слайдов. Для просмотра воспользуйтесь проигрывателем, если материал оказался полезным для Вас - поделитесь им с друзьями с помощью социальных кнопок и добавьте наш сайт презентаций в закладки!

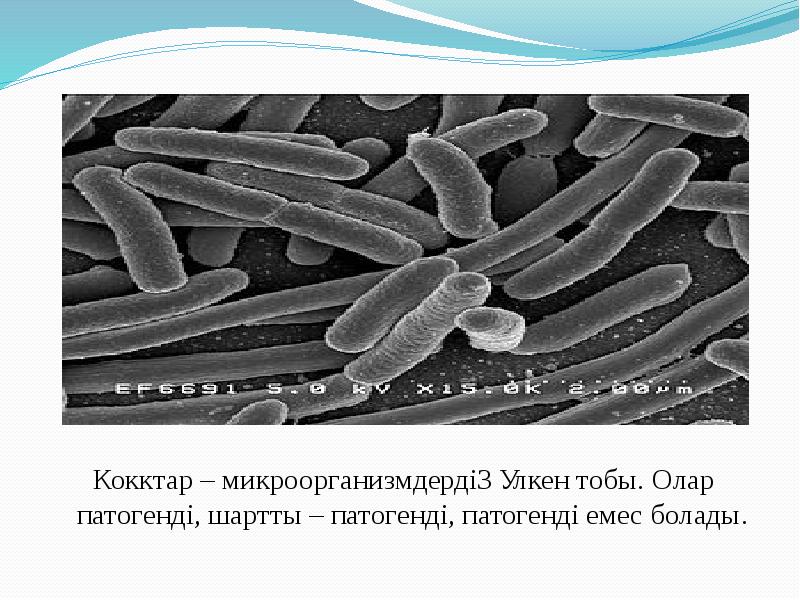



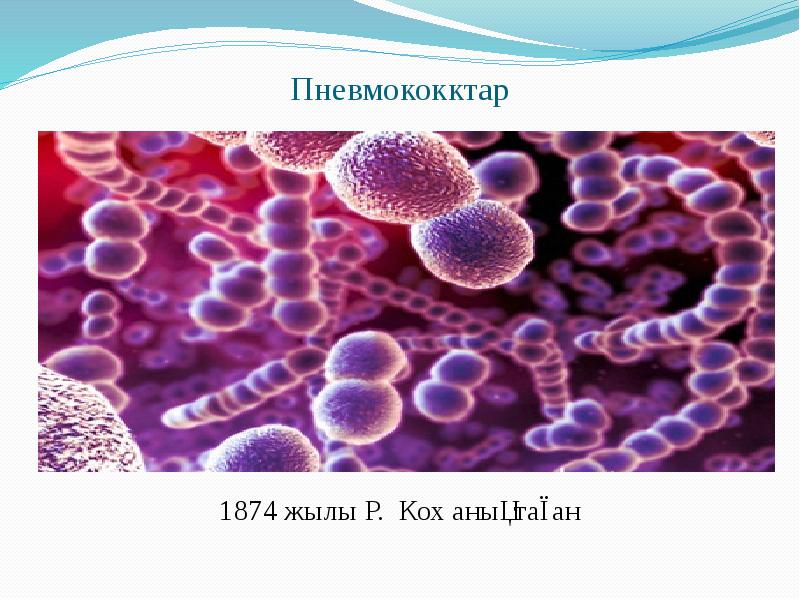
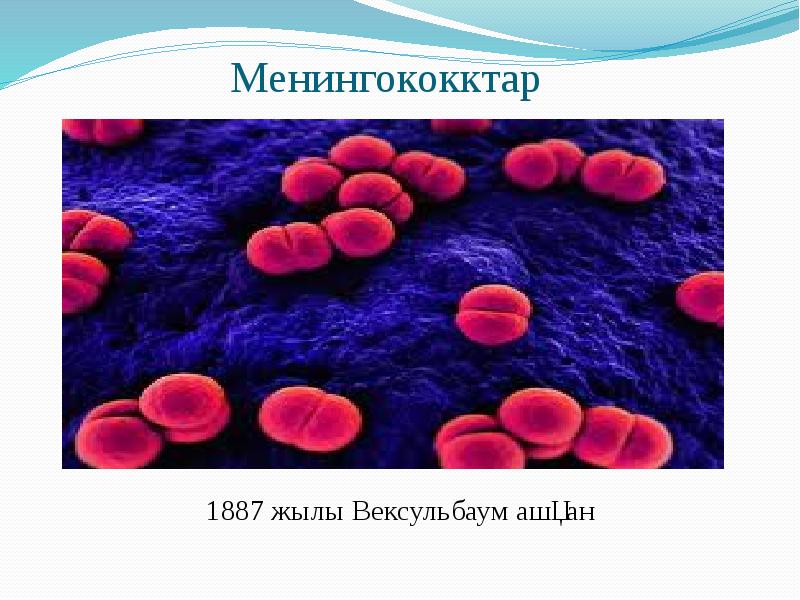
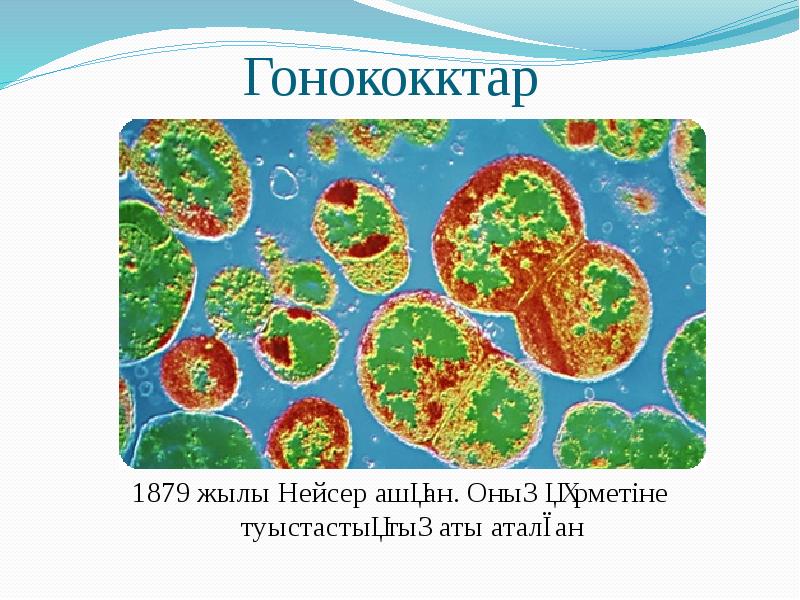
Тақырыбы: Патогенді кокктар Орындаған: 15-700-32 топтың 2 курс студенті Сабитбек Г.А. Қабылдаған: Аймагамбетова Б.Б.
Кокктар – микроорганизмдердің үлкен тобы. Олар патогенді, шартты – патогенді, патогенді емес болады. Кокктар – микроорганизмдердің үлкен тобы. Олар патогенді, шартты – патогенді, патогенді емес болады.
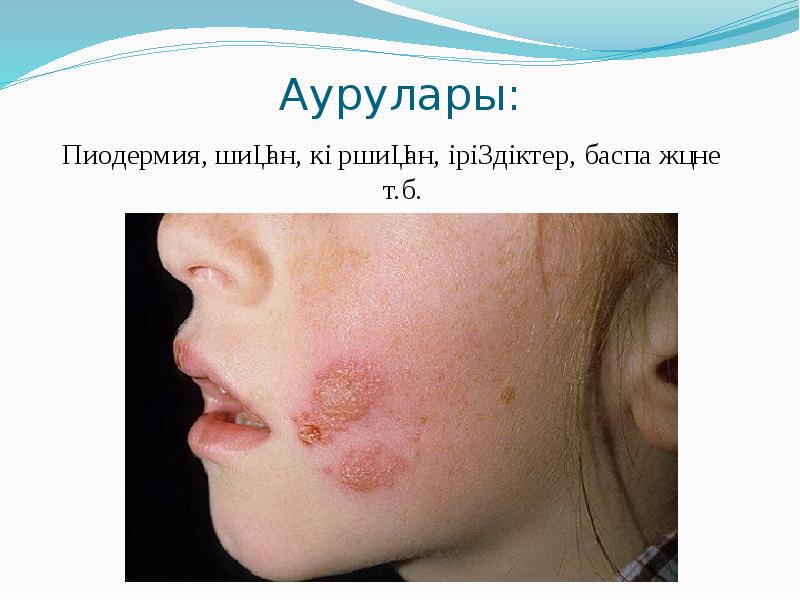
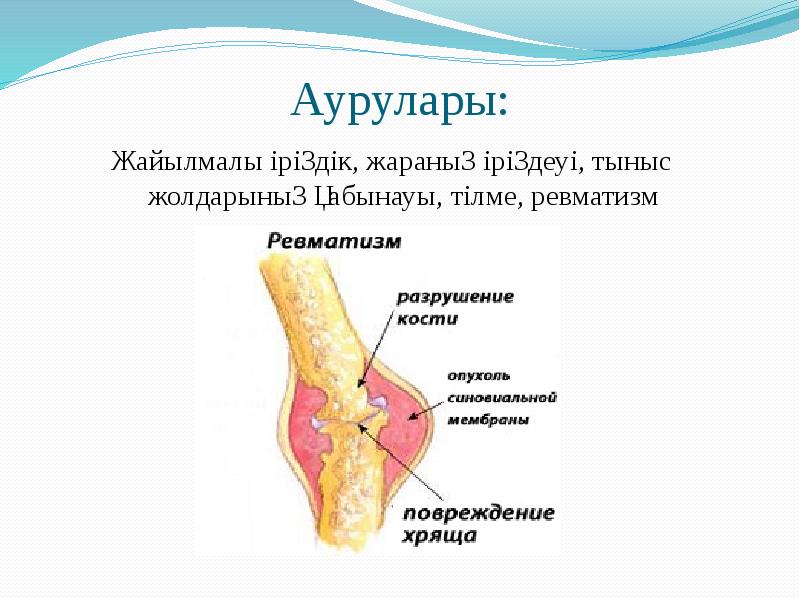
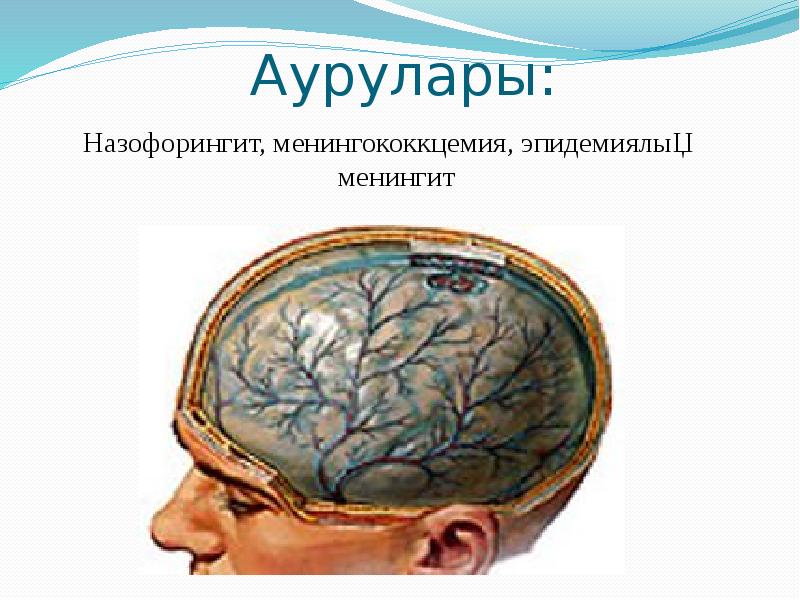
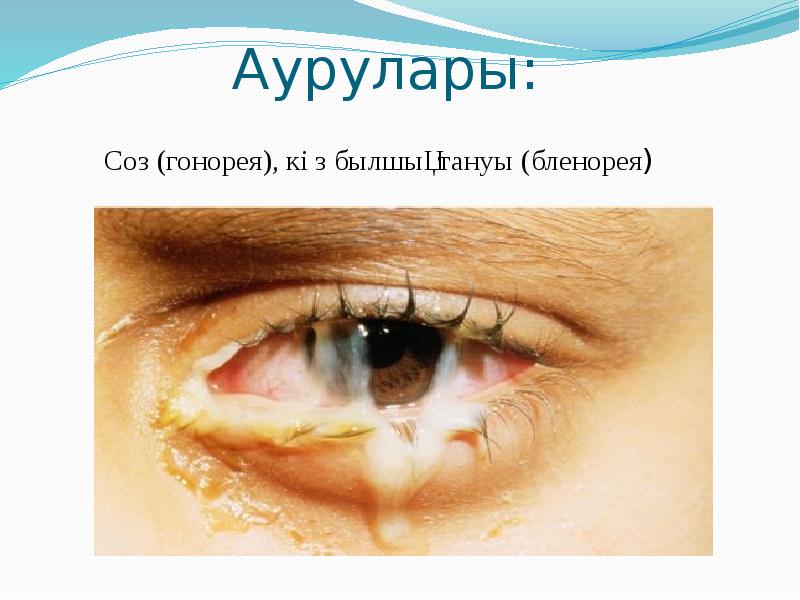
Берджи жіктеуі бойынша патогенді кокктар 3 тұқымдастыққа біріктіреледі: 1) Micrococcaeae-Stafhyloccuc туыстағына стафилококктар жатады. 2) Steptococcaceae-Steptoccoccus туыстағына стрептококктар мен пневмококктар жатқызылады. 3) Neisseriaceae-Neisseria туыстағына минигококктар мен гонококктар жатқызылады.
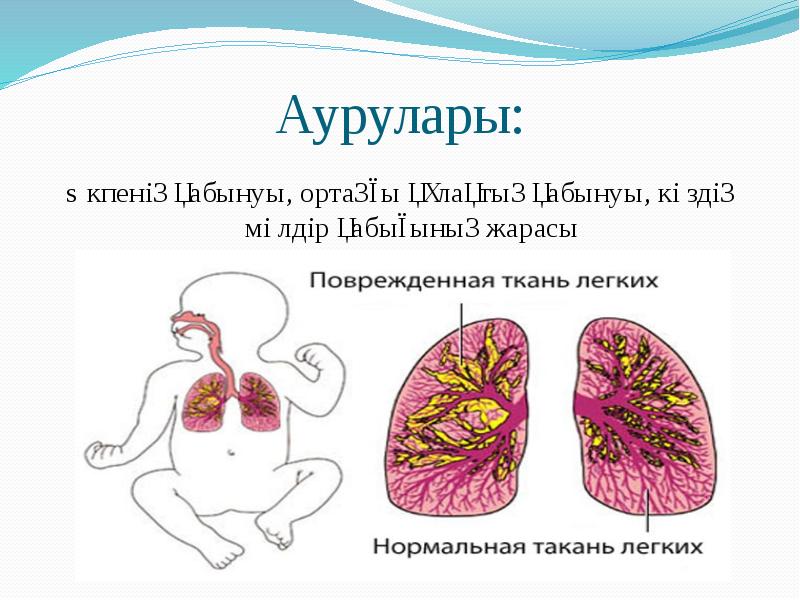
Патогенді кокктардың жалпы белгісі іріңді – процесі ауруларды тудырады. Барлық патогенді кокктар қозғалмайды, спора түзбейді, ал пневмококктар капсула түзуі мүмкін. Патогенді кокктардың жалпы белгісі іріңді – процесі ауруларды тудырады. Барлық патогенді кокктар қозғалмайды, спора түзбейді, ал пневмококктар капсула түзуі мүмкін. Тинкториальдық (боялуы) қабілетіне қарай : Грам “оң” және “теріс”болады. Патогенді кокктар бір – бірінен қоректік орталарда өсуі және биохимиялық қасиеттері бойынша ажыратылады.

Энтеробактерии (лат. enterobacteriaceae) — семейство грамотрицательных (как и другие протеобактерии) палочкообразные (бациллы), споронеобразующие бактерии, длиной 1-5 мкм, со жгутиками для передвижения. Эти бактерии — факультативные анаэробы, расщепляют углеводы с образованием муравьиной кислоты и других конечных продуктов формиатного брожения. Некоторые из них могут разлагать лактозу.
Множество представителей семейства являются частью микрофлоры кишечника человека и животных. Они представляют большое число нормальной микрофлоры человеческого организма и значительное количество патогенных микробов: сальмонелла, кишечная палочка, чумная палочка и др. Энтеробактерии определяют в различных отделах желудочно-кишечного тракта здорового человека: в тощей кишке – от 0 до 103 КОЕ/мл, в подвздошной — от 10 2 до 10 6 КОЕ/мл. В норме в составе факультативной микрофлоры кишечника они не должны превышать количество 10 4 КОЕ/г.
Другая часть этих бактерий обнаруживается в воде и почве или паразитирует на различных растениях и животных. Хорошо изучена кишечная палочка — модельный организм, используемый в молекулярной биологии и генетике, в связи с изученностью её генетики и биохимии.
Энтеробактерии в воде и почве месяцами остаются жизнеспособными, но за несколько минут гибнут от дезинфектантов и при очень высоких температурах через 1 час.
Эти бактерии вырабатывают сахаролитические, протеолитические и др. ферменты, определение которых имеет таксонометрическое значение. Образуют индол, а глюкозу, лактозу, маннит ферментируют до кислоты и газа.
Факторами патогенности являются:
- эндотоксин, который освобождается после разрушения микробных клеток и адгезины,
- цитотоксин,
- экзотоксин.
Бактерии могут проникать в макрофаги и размножаться в них. Патологический процесс усугубляется на фоне снижения активности фагоцитоза, падения барьерной функции тканей. Снижение в кишечнике полезной нормофлоры и нарушение колонизационной и защитной функции может приводить к проникновению в лимфу и кровь. Коли-бактериозы возникают при снижении количества полезной микрофлоры кишечника и иммунитета. После перенесённого заболевания невосприимчивость не формируется.
Какие заболевания вызывают энтеробактерии?

энтреробактерии e.coli
Группа энтеробактерий включающая: сальмонеллы, шигеллы, эшерихии, клебсиеллы, собственно энтеробактер, серрации, протей, морганеллы, провиденции и иерсинии в норме обитают в желудочно-кишечном тракте человека, но при снижении защитных свойств слизистой кишечника, могут вызывать инфекции желудочно-кишечного тракта или других органов.
Энтеробактерии — представители родов citrobacier, ewardsiella, enterobacter, escherichia, hafnia, klebsiella, proteus, providencia, salmonella, serratia, yersinia вызывают инфекции мочеполовой системы (в том числе циститы, пиелонефриты, цервициты и т.п.). До 80% бактерий, обнаруживаемых в моче — энтеробактерии.
Энтеробактерии становятся причиной различных заболеваний человека. Условно – патогенные бактерии вызывают гнойно-воспалительные процессы различной локализации: как эндогенные процессы — развиваются инфекции мочевыводящих путей (уретрит, цистит, пиелонефрит), половой системы (вагинит, трихомиоз, цервицит), дыхательных путей (пневмония), желудочно-кишечного тракта (холециститы, сальмонеллез, дизентерия, чума) и другие, так называемые коли-бактериозы, а как экзогенные – нагноение ран. Разные формы ОКЗ – острых кишечных заболеваний обусловлены патогенным действием различных энтеробактерий и чем агрессивнее токсины бактерий, тем тяжелее состояние, особенно у маленьких детей.
Escherichia coli – кишечная палочка в норме определяется в желудочно-кишечном тракте и синтезирует секреторные иммуноглобулины и колицины. Они тормозят рост некоторых патогенных энтеробактерий и препятствуют проникновению их в слизистую оболочку стенки кишечника. E. сoli участвует синтезе витамина К (свертываемость). Некоторые патогенные штаммы кишечной палочки могут поражать слизистую кишечника, что проявляется кровавым водянистым поносом или диареей путешественников.
У детей диарея, вызываемая патогенной энтерогеморрагической кишечной палочкой, может осложняться гемолитико-уремическим синдромом и почечной недостаточностью. Эта бактерия может поражать кровь, желчный пузырь, легкие, мочевыводящие пути и кожу. У новорожденных детей, особенно недоношенных, кишечная палочка может стать патогенным возбудителем бактериемии и менингита.
Инфекции, обусловленные клебсиеллами (Klebsiella), энтеробактериями (Enterobacteriaceae) и серрациями (Serratia), обычно встречаются в больницах, чаще при снижении способности бороться против инфекций. Эти бактерии также часто поражают мочевыводящие, половые органы. Пневмония, вызванная клебсиеллами, наиболее распространена у больных сахарным диабетом и у злоупотребляющих алкоголем и имеет часто тяжелое течение.
Симптоматика инфекций, вызываемых энтеробактериями.
Симптомы инфекционного заболевания могут быть различны, в зависимости от места развития воспалительного процесса, однако все больные жалуются на общую слабость, повышение температуры, проявления интоксикации и боли в месте заболевшего органа. Для определения патогенных энтеробактерий обязательно нужно сдать анализы – кровь, мочу, мокроту, мазки или кал, в зависимости от локализации воспалительного процесса, пройти до обследование, для выявления функциональных нарушений.
Важно соблюдать правила личной гигиены, следить за качеством, чистотой овощей-фруктов, питаться, учитывая индивидуальные особенности, избегать контакта с инфекционными больными и поддерживать свой иммунитет в норме.
Как быстро восстановиться после инфекции?
Восстановление и сохранение достаточного количества полезной нормофлоры кишечника – лакто- и бифидобактерий, способствует защите слизистой кишечника от проникновения патогенных бактерий и их токсинов в кровь и лимфу, выведению токсинов, созданию среды, в которой патогенные микроорганизмы не могут продолжать свою жизнедеятельность и выводятся из организма человека. Важно, что продукты жизнедеятельности полезных бактерий помогают иммунитету сохранять активность в борьбе с вредными бактериями.
Синбиотический биокомплекс Нормофлорины – содержащий живые активные лакто- и бифидобактерии и их метаболиты с противовоспалительным, антисептическим, иммуногенным и питательным действием на слизистые за многие годы зарекомендовал себя, как активный помощник и борец против патогенных бактерий для малышей и взрослых, беременных и больных с различными заболеваниями. Достаточно быстро при употреблении Нормофлоринов снимается интоксикация и восстанавливается функция кишечника, общее самочувствие.
Рекомендуется: как можно раньше начать принимать Нормофлорины в возрастных дозировках – Л – за 10-15 мин до еды утром (+ обед при запорах), Д – обед или вечер за 20 мин до еды, Б – на ночь или в микроклизме. Длительность приема 3-4 недели, до полного восстановления функции кишечника и улучшения общего самочувствия. Желательно 10-14 дней натощак принимать сорбенты – для выведения токсинов – зостерин или пекто, они уменьшают гнилостные, бродильные процессы, повышенное газообразование, улучшают работу кишечника.
Важно закрепить эффект восстановления микрофлоры, улучшить работу поджелудочной железы, печени, кишечника, иммунитет – для этого хорошо далее в течение месяца использовать функциональное питание – Гармония жизни. В её составе также содержатся живые полезные лакто- и бифидобактерии, их метаболиты и пектин. Вкусно, полезно и эффективно!

Про ацинетобактер знают все, кто в том или ином виде работает в стационарах. Ацинетка очень быстро заместила собой всю предыдущую внутрибольничную микрофлору и фактически вышла на первый план самых проблемных внутрибольничных микробов.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: врач – клинический фармаколог Трубачева Е.С.
Если еще каких-то 7 лет назад ацинетобактер была зверем, о котором знали реаниматологи крупных больниц да клинические фармакологи, то менее пяти лет назад ситуация кардинально изменилась – теперь про ацинетку знают все, кто в том или ином виде работает в стационарах. Она очень быстро заместила собой всю предыдущую внутрибольничную микрофлору и фактически вышла на первый план самых проблемных внутрибольничных микробов, заняв чуть ли не основную нишу ВБИ.
Автор сразу хотел бы предупредить, что речь здесь пойдет не столько об Acinetobacter baumannii, сколько о семействе ацинетобактеров, ибо клиническую значимость имеет не только вышеупомянутый возбудитель.

Ацинетобактеры являются представителями тройки основных опасных возбудителей согласно определению ВОЗ. Двух других представителей из этого списка мы уже обсудили: это синегнойная палочка и энтеробактерии (клебсиелла, кишечная палочка, энтерококки). Именно для этой могучей тройки в первую очередь и должны разрабатываться новые антибиотики, но пока с этим как-то не очень.
Микробиологические аспекты
Поэтому будем изучать врага в лицо
Теперь посмотрим на, можно сказать, типичных представителей семейства Acinetobacter spp. Необходимо отметить, что продемонстрированные ниже возбудители выделены из ран, полученных в результате ДТП в летнее время, причем у пациентов, которые длительное время не лечились антибиотиками, то есть оба зверя являются дикими.
На первом фото лечащему врачу повезло, так как ему достался возбудитель, чувствительный ко всему возможному арсеналу антибиотиков, которые в принципе могут повлиять на данный микроб.
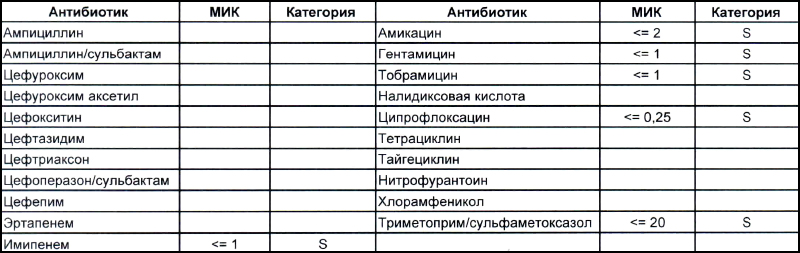
На второй антибиотикограмме возбудитель тоже получен из раны, ни разу не леченной антибиотиками, а также сам больной длительное время ничего антибактериального не употреблял. Данный случай очень хорошо демонстрирует то, что мы обсудили раньше, – только по антибиотикограмме в случае ацинеток трудно сказать, внутрибольничный возбудитель вызвал гнойно-воспалительный процесс или дикий уличный.
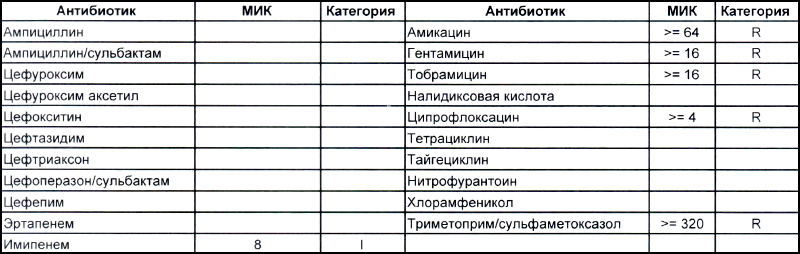
В научно-исследовательском институте, который может провести генетическое исследование возбудителя, смогут выяснить полностью, дикий это штамм или внутрибольничный, а мы, работающие на земле, скорее всего, не ответим на этот вопрос. Правда, у нас теперь СК все про всех знает, и автор уже давно ждет, когда очередного несчастного еще и в такого рода заражении обвинят.
Следует отметить, что обе эти картинки не отменяют факта наличия внутрибольничного заражения как первым штаммом (горшки с цветами помним?), так и вторым, в который под действием использующихся в больнице антибиотиков может выродиться первый. Ациентка, как и предыдущие обсуждаемые возбудители ВБИ, так же не имеет крылышек и ножек, ее точно так же переносят на руках и плохо обработанном медицинском оборудовании (эндоскопы, точнее, бронхоскопы, это просто бич крупных стационаров). Поэтому только внутриведомственный микробиологический надзор и работа над соблюдением санэпидрежима помогает удержать и эту зверюгу в хоть каких-то приемлемых рамках.
Клинические аспекты
Что способен вызвать ацинетобактер?
- Раневую инфекцию
- Инфекции кровотока
- Инфекции дыхательных путей – в первую очередь, внутрибольничную пневмонию, часто вентилятор-ассоциированную, особенно так называемую позднюю (более семи суток на ИВЛ). Здесь он делит пальму первенства с синегнойкой и MRSA
- Внутрибольничные менингиты
- Инфекции мочевыводящих путей, чаще всего ассоциированные с использованием эндоскопического оборудования
- Перитониты у пациентов на перитонеальном диализе
- Почти полный набор инфекций, связанных с установкой имплантов или протезов
В общем, как вы можете видеть, ацинетка способна загубить на корню любой врачебный труд, так как инфекции, ей вызванные, имеют высокий процент летальности у пациентов, имеющих факторы риска развития подобной инфекции.
К факторам риска относятся:
Чем лечить?
Как вы могли убедиться, лечить ацинетку эмпирически (а это возможно только при тщательном внутрибольничном мониторинге), и даже с использованием диско-диффузионного метода, не очень-то и получится. Точнее, не получится совсем. Нужны аппаратные методы диагностики, чтобы точно знать, с чем вы имеете дело. И внутрибольничный мониторинг тоже крайне необходим, особенно если неферментеры сеются массово, чтобы знать — заполз ли возбудитель с улицы или уже свой зверинец развели. Во втором случае только мыть-мыть и еще раз мыть всю больницу полностью, а не только одно отделение, а также переходить на полностью одноразовые расходники, и к аппаратам ИВЛ тоже. Автор понимает, что при этих словах или в монитор захочется плюнуть, или помидором тухлым швырнуть, благо сезон пока не закончен.
Так как лечить?
В рамках клинических рекомендаций по той нозологии, которая у вашего пациента имеется, выложенных здесь, всегда только комиссионно, с привлечением клинических фармакологов и клинических микробиологов. И мойте руки после каждого подобного пациента очень тщательно — это ваша личная техника безопасности.
Лактозонегативные энтеробактерии. Общее понятие

Запор может быть признаком повышения лактозонегативных энтеробактерий.
Лактозонегативные энтеробактерии – это группа условно-патогенных микроорганизмов различной степени патогенности.
При нормальных показателях эта микрофлора не оказывает пагубного влияния на организм. Но при дисбактериозе, количество представителей этой флоры увеличивается, вызывая нарушения в работе ЖКТ и прочих органов и систем.
Нормой у детей и взрослых считается показатель не более, чем 10*4 на 1 г каловых масс. Изменение цифр в большую сторону свидетельствует о нарушении иммунитета. Признаки превышения показателей лактозонегативных энтеробактерий:
- нарушение дефекации – как запор, так и понос;
- появление подозрительных включений в каловые массы, слизи зеленого или желтого цвета;
- боли в эпигастрии;
- метеоризм и вздутие;
- отрыжка и срыгивание пищи;
- повышения температуры не наблюдается;
- развитие аллергических реакций;
- лактозная недостаточность.
У малышей с тяжелыми формами иммунодефицита может наблюдаться проникновение патогенов в кровь сквозь стенки кишечника. Это представляет угрозу для жизни карапуза.
Лактозонегативные энтеробактерии – типичные представители
Кишечная палочка — представитель группы лактозонегативных энтеробактерий.
В бланке анализа вы увидите общие показатели этой группы и отдельно по каждому виду микроорганизмов. В группу лактозонегативные энтеробактерии входят:
- гемолизирующая кишечная палочка;
- клебсиеллы;
- протеи;
- хафнии;
- серрации;
- энтеробактеры;
- цитробакеры.
Некоторые из них в небольших количествах являются нормальными обитателями кишечника, другие – не должны присутствовать в микрофлоре человека.
Гемолизирующая кишечная палочка

Кишечная палочка может вызвать перитонит.
Кишечная палочка – это сборное название группы из более 100 разновидностей этого микроорганизма. Этот микроорганизм может жить только в бескислородной среде. Определенные штаммы являются симбионтами человека.
Они обитают в кишечнике и участвуют в процессах переваривания пищи. Некоторые виды палочки Эшериха являются патогенами.
Например, гемолизирующая ее разновидность. Хотя этот штамм может существовать и ничем себя не обнаруживать. Как только иммунитет падает, кишечная палочка начинает размножаться и может вызвать следующие заболевания:
- патологии мочевыводящей системы – пиелонефрит, цистит, уретрит;
- заболевания репродуктивной системы – аднексит, кольпиты, орхиты;
- перитонит;
- септические заболевания;
- менингит.
Симптоматика дисбактериоза с преобладанием гемолизирующей палочки Эшериха:
- нарушение дефекации;
- вздутие;
- отрыжка;
- общая слабость;
- утомляемость;
- лихорадка;
- у малышей в фекалиях обнаруживается слизь зеленого цвета;
- снижение показателей АД.
При поражении прочих систем симптоматика будет отвечать тем заболеваниям, которые вызывала кишечная палочка.
Клепсиелла

Клепсиелла вызывает пневмонию.
Клепсиеллы – это собирательное название штаммов условно-патогенных микроорганизмов. Относятся к факультативным анаэробам.
То есть могут жить как в присутствии кислорода, так и без него. Разновидности этого микроорганизма могут вызвать следующие патологии:
- легкие – вызывает пневмонию;
- конъюнктивит;
- пищеварительная система;
- менингит;
- заболевание мочеполовой сферы.
В 1 г. каловых масс должно быть не более 10*5 микроорганизмов. Клепсиеллы являются типичными представителями внутрибольничных инфекций. Источником инфицирования является носитель микроорганизма. С момента заражения до первых симптомов может пройти несколько недель.
При поражении легких наблюдается повышение температуры, кашель поначалу сухой, затем влажный с отхождением зловонной мокроты с кровью. Без лечения развивается сепсис. Смертность составляет 36%. При локализации очага в носу наблюдается зловонные ринореи, заложенность носа, температура. При поражении системы ЖКТ развивается симптоматика острого колита или энтероколита.
Протеи

При увеличении протогенов в организме возникает дисбактериоз.
Протеи – группа факультативно анаэробных микроорганизмов. В небольших количествах обитает в кишечнике человека.
Допустимое количество составляет не более 10*4 шт. на 1 г. фекальных масс. Источником инфекции является больной человек. С момента заражения до появления первых симптомов от 6 часов до 3 суток.
При поражении желудка и кишечника развивается расстройства дефекации, повышается температура тела, частое испражнение крайне зловонными фекальными массами. Кроме этого, развивается острый энтероколит.
При незначительном повышении количества патогенов развивается дисбактериоз. Основной признак поражения протеем – это водянистый зловонный стул более 2 раз в сутки.
При попадании в мочевыводящую или репродуктивную системы наблюдается симптоматика, характерная для воспалительных процессов в этих органах.
Хафнии или гафнии
Хафнии – микроорганизмы, относящиеся к классу энтеробактерии. В настоящее время описан всего 1 вид Н. alvei. Относится к факультативным анаэробам и редко проявляет патогенные свойства. Способна вызывать обострение хронических заболеваний ЖКТ, мочевыводящей системы, септические патологии.
Этот микроорганизм трудно диагностировать, также он редко выступает единственной причиной заболевания. Признаки поражения гафнией сходны с симптоматикой сальмонеллеза – высокой температурой, болями. Зачастую этот патоген путают с кишечной палочкой.
Лечение заболеваний, вызванных хафнией, затрудненно, так как микроорганизм устойчив к антибиотикам последних поколений включая цефаллоспорины.
Серрации

Энтеробактер — обитает в толстом кишечнике человека.
Серрации – это широко распространенный микроорганизм. Является факультативным анаэробом и образует природный краситель красного цвета.
До 60 годов прошлого столетия колонии серрации использовались в качестве красящего вещества для проверки циркуляции воздуха.
Доказано, что 10% внутригоспитальных инфекций вызывают именно эти микроорганизмы. Смертность при поражении этой бактерией составляет 26%.
Серрации способны к передаче через предметы гигиены, катетеры, некачественно обработанный медицинский инструмент, руки медицинского персонала.
Энтеробактеры
Энтеробактер – обитает в толстом кишечнике человека. Считается условно-патогенной бактерией и способен вызывать различные заболевания системы ЖКТ, мочевыводящей и дыхательной системы.
В анализе мочи этот микроорганизм должен содержаться не более 10*5 шт. на 1 мл биологической жидкости. В анализе кала – не более 10*4. Если в моче повышен уровень лейкоцитов, то уровень энтеробактера 10*4 единицы является критичным. Признаки поражения энтеробактером:
- тошнота;
- рвота;
- повышение температуры;
- озноб;
- лихорадочное состояние;
- боли в поясничной области.
Лечение проводится при помощи антибиотиков, бактериофагов, препаратов, улучшающих микрофлору организма.
Цитробактеры

При поражении цинтробактером появляются боли в животе.
Цинтробактер – в норме обитает в кишечнике человека. Но при этом является возбудителем гастроэнтеритов, урологических заболеваний, воспалительных процессов в мозге, сепсиса.
Эти бактерии вызывают тяжелейшие отравления при нарушении технологии приготовления пищи.
Возбудители передаются контактным и орально-фекальным путем. При поражении цинтробактером появляются следующие симптомы:
- признаки гастрита – тошнота, рвота;
- боли в животе;
- повышение температуры до 38 градусов;
- стул может быть до 10 раз в сутки;
- в фекальных массах обнаруживают слизь.
Бактерия поддается лечению антибиотиками, бактериофагами. Дополнительно показано назначение пробиотиков.
Как выявить патогены?
Для диагностики дисбактериоза следует провести исследование каловых масс. Правила подготовки к исследованию:
- Забор материала проводят до начала приема антибактериальных препаратов или в промежуток между лечебными курсами. Последний прием антибиотиков должен быть не ранее, чем за 12 часов до забора.
- Аналогичная тактика при приеме препаратов, улучшающих микрофлору человека.
- За 3 суток исключить пищу, вызывающую брожение, алкогольные напитки, слабительные препараты.
- Для исследования требуется кал после естественной дефекации. Не годятся фекальные массы, полученные при промывании кишечника и после слабительных препаратов.
- Собранные фекалии следует доставить в лабораторию не позднее чем через 2 часа после забора проб. При подозрении на поражение других систем организма проводится бактериальный посев мочи, крови, спинномозговой жидкости.
Лактозонегативные энтеробактерии – это нормальные обитатели нашего организма. Но они могут быть смертельно опасными. Поэтому при хронизации заболеваний воспалительного характера следует сдать анализы и определить возбудителя.

Подробно о кишечной палочке — в тематическом видеоролике:
Читайте также:

