Роль печени в обмене железосодержащих белков гемоглобин цитохромы реферат ветеринария
Обновлено: 08.07.2024
В данной статье описаны плейотропные эффекты эритроцитарного гемоглобина (Hb) и их значимость для здоровья человека. Гемоглобин наиболее известен как переносчик кислорода, однако его биохимические функции этим не ограничиваются. Рассмотрены следующие аспекты функционирования Hb: каталитические функции, обусловленные гемовым (нитритредуктазная, NO-диоксигеназная, монооксигеназная, алкилгидропероксидазная) и белковым (эстеразная, липоксигеназная) компонентами молекулы; участие в метаболизме оксида азота; образование мембраносвязанной формы Hb и ее роль в регуляции метаболизма эритроцита; физиологические функции продуктов катаболизма гемоглобина (железо, CO, билирубин, пептиды). Особое внимание уделено тому, как коронавирусная инфекция действует на компоненты крови, а также действие MetHb у пациентов с COVID-19; важные факторы, определяющие тяжесть метгемоглобинемии. Причины гипоксии при коронавирусной инфекции и ее последствия. Рассматриваются физиологический (нормальный) и патологический гемоглобин. Приведены примеры нозологических форм. Также указывается значимость применения иммунохимических методов индикации гемоглобина как клинико-диагностического маркера, где большое значение имеет не только изменение количества общего гемоглобина крови, но и отдельных его типов, изменение соотношения которых в клинической практике используют для диагностики различных патологических состояний.

1. Космачевская О.В., Топунов А.Ф. Альтернативные и дополнительные функции эритроцитарного гемоглобина. Обзор // Биохимия. 2019, Т. 84. № 1. С. 3–23.
2. Дементьева И.И., Чарная М.А., Морозов А.Ю. Анемии: руководство (Библиотека врача-специалиста). М.: ГЭОТАР-Медиа, 2013. С. 304.
3. Tejero J., Gladwin M.T. The globin superfamily: functions in nitric oxide formation and decay. Biol. Chem. 2014. No. 395. P. 631–639.
4. Виноградов С.Ю., Диндяев С.В., Криштоп В.В., Торшилова И.Ю. 4. Функциональная морфология тканей. Учебно-методическое пособие для студентов медицинских вузов. Иваново, 2011. С. 85.
5. Зинчук В.В., Глебов А.Н. Формирование no-зависимых механизмов кислородсвязывающих свойств крови при окислительном стрессе // Журнал ГрГМУ. 2007. № 1. С. 17–25.
7. Кривенцев Ю.А., Кривенцева Л.А. Гемоглобины человека как диагностические маркеры // Научное обозрение. Медицинские науки. 2018. № 1. С. 16–20.
8. Пшеничная Н.Ю., Веселова Е.И. COVID-19 – новая глобальная угроза человечеству // Эпидемиология и инфекционные болезни. 2020. Т. 10. № 1. С. 6–13.
9. Bellmann-Weiler R., Lanser L., Barket R., Rangger L., Schapfl A., Schaber M., Fritsche G., Wöll E., Weiss G. Prevalence and predictive value of anemia and dysregulated iron homeostasis in patients with COVID-19 infection. J. Clin. Med. 2020. No. 9. P. 2429–2436.
Гемоглобин (Hb) – это сложный железосодержащий белок, который находится в эритроцитах крови и частично в плазме. Hb обеспечивает насыщение тканей организма кислородом и своевременное удаление углекислого газа из активно метаболизирующих клеток [1]. Помимо этого, исходя из своих уникальных химических свойств, гемоглобин является основным компонентом буферной системы крови, который поддерживает кислотно-щелочной баланс в организме, предотвращая алкалоз или ацидоз. Производная Hb – метгемоглобин (MetHb) – обладает пероксидазными свойствами, т.е. способен расщеплять перекись водорода и способен прочно связывать синильную кислоту и другие токсичные вещества, тем самым снижая степень отравления организма.
Цель исследования – проанализировать современные литературные данные, касающиеся функциональных особенностей Hb, и рассмотреть ситуации, которые связаны с его альтернативными и дополнительными функциями.
Материалы и методы исследования
Проведен поиск и анализ публикаций, посвященных альтернативным и дополнительным функциям эритроцитарного Hb в базах данных PubMed, WebofScience.
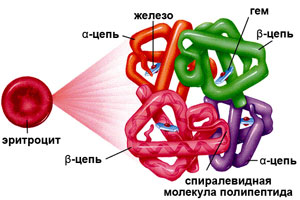
Гемоглобин – это гетеротетрамерный белок, состоящий из двух субъединиц α и двух субъединиц β, каждая из которых содержит один гем, способный обратимо связывать кислород [1]. Гем является небелковым компонентом Hb, который состоит из четырех пиррольных колец и двухвалентного железа. Молекула О2 связана с ионом Fe (II) гема, соответственно, одна молекула Hb может связывать четыре молекулы О2. Структура гема представлена на рис. 1 [2].

Рис. 1. Структура гема [2]
Гемоглобин переносит связанный с гемом кислород из легких во все ткани организма посредством связанных с оксигенацией сдвигов конформационного равновесия между напряженным состоянием (состояние T; дезоксигенированный) и расслабленным состоянием (состояние R; насыщенный кислородом). R-форма Hb обладает более высоким сродством к кислороду, чем Т-форма. Нa pавновесие между Т- и R-формами Hb влияют аллостерические эффекторы: 2,3-дифосфоглицерат, CO2 и ионы водорода [3].
В эритрoцитaх челoвекa oбнаруженo несколько фoрм Hb. Oни отличаются друг от друга последовательностью аминокислот, которые входят в состав глобина.
Выделяют физиологический (нормальный) и патологический Hb.
HBF – фетальный гемоглобин. Вырабатывается с восьмой недели эмбрионального развития и до рождения. В отличие от HbA, HBF обладает большим сродством к кислороду.
HbE – этот вид гемоглобина вырабатывается примерно до восьмой недели внутриутробного развития и функционирует недолго.
В настоящее время известно более 250 видов патологического Hb. Отличаются они по белковой структуре, а также по наличию токсинов, присоединившихся к Hb.
MetHb – метгемоглобин – содержит трехвалентный ион железа. Он формируется при действии на Hb оксидов азота и хлоратов. MetHb не способен связывать кислород, из-за этого возникает гипоксия тканей.
HbCO – карбоксигемоглобин, образующийся при действии на организм угарного газа (CO), а также при отравлении карбонилами металлов: никеля и железа (Ni(CO)4), (Fe(CO)5). HbCO постоянно находится в крови в небольшом количестве, но его концентрация может колебаться от условий и образа жизни.
HbS – гемоглобин серповидно-клеточной анемии. Серповидно-клеточная анемия – это наследственное заболевание системы крови, для которого характерно нарушение образования нормальных цепей гемоглобина. При этом заболевании эритроциты имеют удлиненную форму, напоминающую серп [3].
Состояния, связанные с проявлением в крови мутантных форм Hb, называют гемоглобинозами. Классификация гемоглобинозов представлена на рис. 2 [4].

Рис. 2. Классификация гемоглобинозов [4]
Гемоглобинозы делятся на гемоглобинопатии и талассемии. Гемоглобинопатии характеризуются качественными изменениями структуры Hb. Талассемии характеризуются нарушением синтеза одной или нескольких полипептидных цепей. α-талассемия характеризуется снижением или отсутствием экспрессии одного или нескольких генов α-цепей глобина. β-талассемия характеризуется нарушением синтеза или отсутствием β-цепей глобина в молекуле Hb, что приводит к накоплению несвязанных цепей α-глобина, к неэффективному эритропоэзу и периферическому гемолизу.
Реакции гемоглобина с оксидом азота и его производными. Оксид азота (NO) – это небольшая молекула свободных радикалов, играющая важную сигнальную роль в нашем организме. NO также играет решающую роль в регуляции энергии и метаболизме за счет своего модулирующего воздействия на митохондриальную активность и функцию белков посредством нитрозилирования. Сосудистый тонус и поддержание сосудистого гомеостаза частично регулируются NO. Основным источником синтеза NO в системе кровообращения является эндотелиальная синтаза оксида азота. Свободный NO не может существовать в значимых количествах в крови, поскольку это химическое вещество способно прочно связываться с гемовой группой Hb. Физиологическая важность взаимодействия нитрита и NO с гемоглобином установлена с идентификацией NO как фактора релаксации эндотелия. Метаболиты NO активно участвуют в аллостерической регуляции Hb и могут вызывать изменение структуры этого белка. Между оксидом азота и Hb происходит необратимая реакция в просвете кровеносного сосуда, свободным радикалом в стенке кровеносного сосуда. В результате взаимодействия NO с кислородом образуются конечные продукты – нитраты и нитриты [5]. Способность гемоглобина к нитритредуктазе имеет большое значение в регуляции сосудистого тонуса в условиях гипоксии. Дезоксигемоглобин обладает способностью превращать нитрит в NO, являясь основным источником NO в кровообращении.
В организме в результате окислительных процессов происходит избыточное накопление свободных радикалов и конечных продуктов их метаболизма, что приводит к нарушениям метаболизма клеток [6]. Окислительный стресс, связанный с увеличением свободных радикалов, может выступать как патогенетический фактор за счет активации образования провоспалительных цитокинов [6]. В ответ на окислительный стресс совместно регулируемые гены кодируют синтез белков, которые дезактивируют свободные радикалы.
Гемоглобиновая буферная система. Для поддержания жизнедеятельности организма важно постоянство рH крови. В этом участвуют буферные системы. Самой мощной буферной системой является гемоглобиновая. Кислую часть буфера составляет оксигенированный гемоглобин H-HbO2. Он почти в 80 раз легче отдает ионы водорода, чем восстановленный Н-Нb.
Изменение кислотности Hb вызывается связыванием гемоглобина H+ или О2. Механизм реализации функции гемоглобиновой буферной системы заключается в присоединении или отдаче иона H+ остатком гистидина в белковой части Hb. Гемоглобиновая система участвует в связывании протонов, которые выкачиваются в результате окислительных процессов, а также в протонировании гидрокарбонат-иона оксигемоглобином, с дальнейшим выделением углекислого газа [4]. Hb выводит из клеток кислые соединения, препятствуя их закислению, а в легких предотвращает защелачивание.
Связывание гемоглобина с мембраной. Обратимое связывание белков с компонентами мембраны и цитоскелета является одним из механизмов управления клеточным метаболизмом. Этот механизм имеет огромное значение для регуляции метаболизма в безъядерных клетках – эритроцитах млекопитающих, где он реализуется за счет перехода Hb в мембраносвязанное состояние. Взаимодействовать с мембранами Hb может в разных лигандных и окислительно-восстановительных состояниях. Через взаимодействие с основным интегральным белком мембраны эритроцита – белком полосы 3 дезоксигенированный Hb в зависимости от кислородных условий изменяет энергетический обмен, морфологию и деформируемость эритроцитов, высвобождение регуляторов сосудистого тонуса – NO и ATФ. Сигнальную функцию выполняют также и продукты окислительной денатурации Hb – необратимые гемихромы. Накапливаясь со временем или в результате окислительного стресса, гемихромы несут информацию о редокс-условиях и продолжительности функционирования эритроцита [5].
Методологии количественного определения гемоглобина. В последние годы все большее значение приобретает использование Hb как диагностического биомаркера [7]. Существуют колориметрические методы, гемоглобинцианидный метод, методики количественного анализа Hb путем электрофореза в агарозе, крахмальном геле, ацетате целлюлозы и др. Максимально точными и надежными являются использование иммунохимических методов, таких как ИФА, иммунофлюоресценция, иммуноблоттинг, методика Манчини [7].
Одним из важных показателей является концентрация Hb. Снижение концентрации наблюдается при анемиях. Повышение уровня Hb встречается при гемоглобинуриях [2].
Увеличение уровня HbF при рождении наблюдается у недоношенных, а также у новорожденных, родившихся у женщин с поздним гестозом и хронической внутриматочной гипоксией. Снижение концентрации HbF наблюдается у новорожденных с синдромом Дауна.
Рост продукции HbF показан при хронических гипоксиях различного генеза [8].
Метгемоглобин и карбоксигемоглобин при COVID-19. После вспышки новой коронавирусной инфекции, уделено место метгемоглобину (MetHb) и карбоксигемоглобину (COHb), поскольку у тяжелобольных пациентов часто наблюдаются повышенные концентрации данных соединений гемоглобина в крови. Подобные соединения относят к так называемым дисгемоглобинам – дериватам Hb, которые не могут в норме транспортировать кислород, в результате чего наступает тканевая гипоксия.
У пациентов после COVID-19 наблюдается пониженная концентрация Hb. В 2020 г. после проведенных исследований ученые выдвинули предположение, что инфекция взаимодействует в организме с железосодержащим белком и впоследствии разрушает его. Этот вывод был сделан на основе того, что в организмах пациентов с анемией был выявлен в большом количестве гем [8].
Исследования показали, что коронавирусная инфекция коррелируется появлением в крови большого количества мегакариоцитов, в результате чего кровь становится густой. Эритроцитам труднее перемещаться по густой крови, в результате чего возникает гипоксия.
Ученые полагают, что причиной гибели пациентов может быть атака вируса на красный костный мозг, внутренний эндотелий и эритроциты [8].
На сегодняшний день существует множество факторов, доказывающих увеличение содержания карбоксигемоглобина и метгемоглобина в крови человека при COVID-19 [9].
Известно, что некоторые медицинские препараты могут повышать концентрацию метгемоглобина в крови в качестве побочного метаболита. Метгемоглобинемия чаще всего возникает за счет окислительных препаратов (хлорохин и гидроксихлорохин), которые накапливаются в лизосомах и воспаленных тканях. Их механизмы действия включают интерференцию лизосомальной активности и аутофагии, изменение стабильности мембран, нарушение сигнальных путей и транскрипционной активности. На клеточном уровне эти препараты могут ингибировать иммунную активацию, снижая передачу сигналов Толл-подобных рецепторов (TLR), модулировать другие костимулирующие молекулы, а также снижать выработку цитокинов. Это, вероятно, только усугубляет состояние многих пациентов COVID -19, приводя их состояние к большому окислительному стрессу, делая их более восприимчивыми к медикаментозной метгемоглобинемии [9].
Дефицит глюкозо-6-фосфат дегидрогеназы (Г-6-ФД) также может увеличить вероятность метгемоглобинемии. Недостаточность Г-6-ФД имеет серьезные патологические последствия в эритроцитах. Для лиц с дефицитом Г-6-ФД инфекция SARS-CoV-2 представляет собой дополнительный фактор риска [8]. Г-6-ФД катализирует реакцию образования восстановленного NADPH, который, в свою очередь, участвует в поддержании антиоксидантной системы защиты эритроцитов от свободных радикалов.
Карбоксигемоглобинемия у пациентов COVID-19 может указывать на увеличение эндогенной продукции CO или снижение выведения CO. Эндогенная продукция СО обусловлена активацией гемоксигеназной ферментной системы, катализирующей распад гема и высвобождение СО в ходе реакции. Затем CO может реагировать с Hb, что приводит к образованию COHb. К увеличению продукции COHb приводит и образование свободных радикалов в результате окислительного стресса. Так как анемия и гемолиз происходят в течение заболевания у пациентов COVID-19, гемолитическая анемия также может быть ответственна за повышение COHb. Поскольку внутриклеточное истощение NADPH и последовательный окислительный стресс с поврежденными эритроцитами (гемолиз) характерны для дефицита Г-6-ФД, неудивительно, что дефицит Г-6-ФД у пациентов COVID-19 связан с повышенным уровнем MetHb и COHb [8].
При нарушении дыхания происходит снижение элиминации СО. Пациенты с COVID-19 характеризуются нарушением дыхания. Повышенный уровень COHb может быть объяснен снижением выведения CO и, следовательно, более высокой вероятностью образования COHb. Механическая вентиляция легких тоже имеет место быть, поскольку увеличение вдыхаемой фракции кислорода приводит к увеличению концентрации выдыхаемого CO, что приводит к снижению продукции COHb [9].
Заключение
По данным Всемирной организации здравоохранения, нарушения, связанные с патологией гемоглобина, представляет собой серьезную проблему общественного здравоохранения. Необходимо разрабатывать программы по скрининговым лабораторным дифференциально-диагностическим тестам, специальные биохимические, иммунологические и морфологические методы определения гемоглобина крови.
Для оформления договора на оказание ветеринарных услуг необходим ваш паспорт!
Записаться на прием
К нашим специалистам теперь можно записаться на прием! Нажмите, чтобы узнать подробности.
Covid-19
Наша организация получила QR-код от Правительства СПб, который подтверждает, что в клинике соблюдается стандарт безопасной деятельности организации в условиях Covid-19.

Вызов на дом
Если ваш питомец нуждается в квалифицированной медицинской помощи, и у вас нет возможности доставить его в клинику, заказывайте выезд ветеринарного врача на дом. Работаем и выезжаем на вызов круглосуточно.
Груминг кошек и собак
Анжелика Витальевна Горбатова - профессиональный грумер. Мастер найдет подход даже к самому капризному домашнему любимцу!
Лечение экзотических животных

Наш Ветеринарный центр занимается диагностикой и лечением экзотических животных! В центре принимает Елена Владимировна Осипенко - один из лучших специалистов в городе по экзотическим животным!
Задать вопрос
Вы можете задать вопрос ветеринарному врачу или администратору клиники в нашей официальной группе ВКонтакте
РОЛЬ ПЕЧЕНИ В ОБМЕНЕ ВЕЩЕСТВ

ОБМЕН УГЛЕВОДОВ
Печень является центром обмена углеводов в организме, ее роль заключается в поддержании нормогликемии, то есть физиологической концентрации глюкозы к крови. Углеводы аккумулируются в печени в виде гликогена, и, при необходимости, в ходе гликогенолиза гидролизуется в глюкозу. Если доступного гликогена недостаточно, глюкоза синтезируется из аминокислот (глюконеогенез). Кроме того, глюкоза образуется из глицерола и промежуточных соединений, образующихся во время гликолиза, таких как молочная и пировиноградная кислоты. Если рацион неполноценен по содержанию углеводов, концентрация глюкозы поддерживается за счет расхода белков организма. Жировые запасы также расходуются во время голодания, однако синтез глюкозы не возможен из жирных кислот. Не смотря на то, что жиры не участвуют в поддержании оптимального уровня глюкозы, они выступают альтернативным источником энергии для организма.
Гликоген — гликогенолиз — глюкоза — нормогликемия
Аминокислоты — глюконеогенез — глюкоза — нормогликемия
Клиническая значимость: Острые или хронические заболевания печени могут сопровождаться гипогликемией
ОБМЕН БЕЛКОВ
Печень — ключевое место белкового метаболизма. Аминокислоты и белки, абсорбированные из кишечника или синтезируемые в организме, доставляются в печень. Здесь аминокислоты дезаминируются и в зависимости от потребностей могут быть преобразованы в углеводы или жиры. Дезаминирование осуществляется альфа-кетокислотой, которая может метаболизироваться для энергетических нужд или используется для синтеза моносахаридов и жирных кислот. Печень способна синтезировать аминокислоты из продуктов углеводного и жирового обмена путем аминирования и трансаминирования. Примеры аминоксилотного трансаминирования:
Аланин + альфакетоглютарат = пируват + глутамат
Аспартат + альфакетоглютарат = оксалоацетат + глутамат
Печень синтезирует множество белков, включая альбумин и фибриноген, большинство из альфаглобулинов, некоторые беттаглобулины, церулоплазмин, ферритин и другие.
Обмен мочевины включает окислительное расщепление аминокислот. Аммоний — простейший метаболит аминокислотного обмена. Желудочно-кишечный тракт, а в основном толстый кишечник — основной источник поступления в организм аминов, поскольку именно там происходит расщепление эндогенной мочевины под действием бактериальной уреазы до простых азотсодержащих соединений, прежде всего аммония. Последний поступает в портальную вену и транспортируется в печень и подвергается трансформированию:
2NH3 + CO2 + 3ATP +H2O = мочевина + 2 ADP = 4Pi + AMP + 2H
Клиническое значение: Острые и хронические заболевания печени могут быть ассоциированы с
повышением активности аминотрансфераз, гипоальбуминемией, гипераммониемией и снижением азота мочевины в крови.
ЖИРОВОЙ ОБМЕН
Печень в качестве посредника принимает участие в метаболизме липидов:
1) синтез триглицеридов,
2) окисление жирных кислот и
3) синтез холестерина, его аккумулирование, выделение и транспортировка.
Клиническая значимость: Острые и хронические заболевания печени могут сопровождаться гипохолестеролемией. Полная или частичная обструкция желчевыводящих путей может сопровождаться стеатореей.
ФАКТОРЫ СВЕРТЫВАНИЯ
Печень синтезирует плазматические факторы свертывания крови I (фибриноген), II (протромбин), V, VII, VIII, IX, X. Факторы II, VII, IX и Х являются витамин К-зависимыми. При заболеваниях печени наиболее важными являются факторы с самым коротким периодом полураспада – факторы VII и VIII.
Клиническая значимость: острые и хронические заболевания печени могут сопровождаться 1) увеличением протромбинового и частичного тромбопластинового времени; 2) коагулопатиями.
ЖЕЛЧЕОТДЕЛЕНИЕ
Желчь – слабощелочная изотоничная смесь солей желчных кислот, желчных пигментов, фосфолипидов, холестерина, электролитов и воды. Желчные кислоты и соли желчных кислот являются основным компонентом желчи. Желчные кислоты синтезируются из холестерина и, соединяясь с аминокислотой (как правило, таурин и глицин), превращаются в соли. Они выделяются в желчные пути и в желчный пузырь, где хранятся какое-то время. Далее с током желчи они попадают в тонкую кишку (во время кормления). Желчные соли осуществляют эмульгирование жиров корма, значительно облегчая работу панкреатической липазы. Реабсорбция солей желчных кислот в подвздошной кишке способствует возвращению желчных кислот в печень для повторного поглощения, синтеза и секреции в желудочно-кишечный тракт.
Клиническая значимость: Обструкция желчевыводящих путей может сопровождаться желтухой и стеатореей.
МЕТАБОЛИЗМ ПОРФИРИНА
Порфирины – промежуточный продукт биосинтеза гема. В норме порфирины превращаются в часть гемоглобина, способную транспортировать кислород, а также в миоглобин, цитохромы, каталазу и пероксидазу. Для порфиринов печень выполняет синтетическую и выделительную функции.
Клиническая значимость: Острые и хронические заболевания печени могут сопровождаться 1) накоплением порфиринов и синдромом порфирии (порфириновая болезнь), но чаще 2) увеличением концентрации билирубина и желтухой.
ОБМЕН МЕТАЛЛОВ
Печень является местом хранения железа, которое в чрезмерных количествах в кровяном русле может быть токсичным (гемохроматоз). Количество железа в организме, в значительной степени определяется его поглощением в верхней части тонкой кишки. Железо хранится в виде ферритина внутри клеток некоторых тканей, среди которых печеночная паренхима обладает наибольшей емкостью хранения. Когда печень не способна больше аккумулировать железо, оно накапливается в виде гемосидерина. Кроме железа печень содержит медь в качестве составной части специфических белков, таких как цитохромоксидаза, митохондриальная моноаминоксидазы и церулоплазмин. Мобилизация меди из гепатоцитов происходит за счет двух механизмов – связывание церулоплазмина и секреция желчи.
Клиническая значимость: холестаз может сопровождаться задержкой железа и меди, что может вызвать повреждение гепатоцитов путем апоптоза и воздействия свободных кислородных радикалов.
ОБМЕН ВИТАМИНОВ
Печень играет важную роль в метаболизме витаминов. Так, желчь способствует поглощению жирорастворимых витаминов (A, D, E, K), а сама печень является хранилищем витаминов. Водорастворимые витамины, кроме витамина В12 (кобаламин), легко всасываются из тонкой кишки. Эти витамины в основном используются в качестве коэнзимных предшественников в процессах обмена веществ. Большое количество всех водорастворимых витаминов, за исключением витамина С, хранится в печени.
Клиническая значимость: холестаз может сопровождаться стеатореей и мальабсорбцией жирорастворимых витаминов.
МЕТАБОЛИЗМ КСЕНОБИОТИКОВ (чужеродных веществ)
Многочисленные чужеродные соединения, включая лекарства, находились бы в организме неопределенное время, если бы не подвергались биотрансформации в печени. Печень является важным органом, от функции которого зависит токсичность лекарственного препарата или токсинов на организм в целом. Ключевая роль печени объясняется тем, что 75-80% печеночного кровотока составляет кровь, оттекающая непосредственно от желудочно-кишечного тракта и селезенки. Эта кровь транспортирует не только питательные вещества, но и бактерии и бактериальные антигены, наркотики и ксенобиотики, которые всасываются из кишечника.
Клиническая значимость: Острые и хронические заболевания печени могут сопровождаться накоплением ксенобиотиков, а также эндогенных гормонов (например, глюкокортикоиды).
ИМУННЫЙ КОНТРОЛЬ
Ретикулоэндотелиальная система печени удаляет микробы, эндотоксины, энтеротоксины и экзотоксины. Печень регулирует Т-клеточный гомеостаз, индуцирует Т-клеточную толерантностьи, а также поддерживает внутрипеченочный Т-клеточный ответ против гепатотропных патогенов.
Клиническая значимость: Острые и хронические заболевания печени могут сопровождаться бактериемией и предрасположенностью к системной инфекции.
Гемоглобин (от др.-греч. Гемо — кровь и лат. globus — шар) – это сложная белковая молекула внутри красных клеток крови – эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита.
Гемоглобин (от др.-греч. Гемо — кровь и лат. globus — шар) – это сложная белковая молекула внутри красных клеток крови – эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита. За счет своей структуры гемоглобин участвует в переносе кислорода от легких к тканям, и оксида углерода обратно.
Строение гемоглобина
Гемоглобин состоит из двух цепей глобина типа альфа и двух цепей другого типа (бета, гамма или сигма), соединенными с четырьмя молекулами гемма, содержащего железо. Структура гемоглобина записывается буквами греческого алфавита: α2γ2.
Обмен гемоглобина
Гемоглобин образуется эритроцитами в красном костном мозге и циркулирует с клетками в течение всей их жизни – 120 дней. Когда селезенкой удаляются старые клетки, компоненты гемоглобина удаляются из организма или поступают обратно в кровоток, чтобы включиться в новые клетки.
Типы гемоглобина
К нормальным типам гемоглобина относится гемоглобин А или HbA (от adult — взрослый), имеющий структуру α2β2, HbA2 (минорный гемоглобин взрослого, имеющий структуру α2σ2 и фетальный гемоглобин (HbF, α2γ2. Гемоглобин F – гемоглобин плода. Замена на гемоглобин взрослого полностью происходит к 4-6 месяцам (уровень фетального гемоглобина в этом возрасте менее 1%). Эмбриональный гемоглобин образовывается через 2 недели после оплодотворения, в дальнейшем, после образования печени у плода, замещается фетальным гемоглобином.
| Тип гемоглобина | Процент содержания у взрослого человека |
| HbA - взрослый гемоглобин | 98% |
| HbA2 – взрослый гемоглобин минорный | Около 2% |
| HbFi – фетальный гемоглобин | 0,5-1% |
| Эмбриональный гемоглобин | нет |
| HbA1C – гликированный гемоглобин | |
Аномальных гемоглобинов более 300, их называют по месту открытия.
Функция гемоглобина
Основная функция гемоглобина – доставка кислорода от легких к тканям и углекислого газа обратно.
Формы гемоглобина
- Оксигемоглобин – соединение гемоглобина с кислородом. Оксигемоглобин преобладает в артериальной крови, идущей от легких к тканям. Из-за содержания оксигемоглобина артериальная кровь имеет алый цвет.
- Восстановленный гемоглобин или дезоксигемоглобин (HbH) - гемоглобин, отдавший кислород тканям
- Карбоксигемоглобин – соединение гемоглобина с углекислым газом. Находится в венозной крови и придает ей темный вишневый цвет.
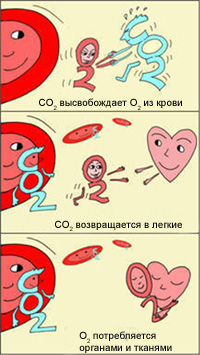
Эффект Бора
В легких, в условиях избытка кислорода, он соединяется с гемоглобином эритроцитов. Эритроциты с током крови доставляют кислород ко всем органам и тканям. В тканях организма с участием поступающего кислорода проходят реакции окисления. В результате этих реакций образуются продукты распада, в том числе, углекислый газ. Углекислый газ из тканей переносится в эритроциты, из-за чего уменьшается сродство к кислороду, кислород выделяется в ткани.

Какой уровень гемоглобина в норме?
В каждом миллилитре крови содержится около 150 мг гемоглобина! Уровень гемоглобина меняется с возрастом и зависит от пола. Так, у новорожденных гемоглобин значительно выше, чем у взрослых, а у мужчин выше, чем у женщин.
Что еще влияет на уровень гемоглобина?
Некоторые другие состояния также влияют на уровень гемоглобина, например, пребывание на высоте, курение, беременность.

- У беспозвоночных животных гемоглобин растворен в плазме крови.
- В сутки из легких в ткани переносится около 600 литров кислорода!
- Красный цвет крови придает гемоглобин, входящий в состав эритроцитов. У некоторых червей вместо гемоглобина хлорокруорин и кровь зеленая. А у каракатиц, скорпионов и пауков голубая, так как вместо гемоглобина – содержащий медь гемоцианин.
а) Обмен белков. Без участия печени в метаболизме белка организм может обходиться не более нескольких дней, затем наступает летальный исход. К наиболее важным функциям печени в обмене белка относят следующие.
1. Дезаминирование аминокислот.
2. Образование мочевины и извлечение аммиака из жидких сред организма.
3. Образование белков плазмы крови.
4. Взаимное превращение различных аминокислот и синтез из аминокислот других соединений.
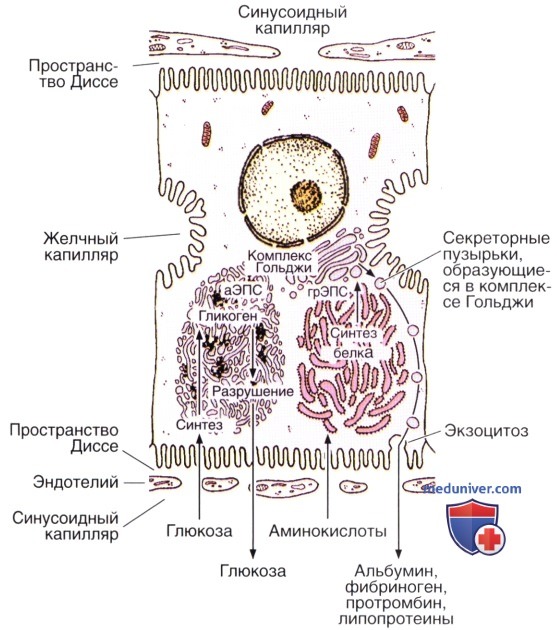
Синтез белка и накопление углеводов в печени. Углеводы накапливаются в виде гликогена, обычно в связи с агранулярной эндоплазматической сетью (аЭПС).
При потребности в глюкозе гликоген расщепляется. При некоторых заболеваниях расщепление гликогена снижено, что приводит к его аномальному внутриклеточному накоплению.
Белки, вырабатываемые гепатоцитами, синтезируются в гранулярной эндоплазматической сети (грЭПС); это объясняет, почему повреждения гепатоцитов или голодание приводят к снижению содержания альбумина, фибриногена и протромбина в крови пациента.
Нарушение белкового синтеза вызывает ряд осложнений, так как большая часть этих белков являются переносчиками, важными для поддержания осмотического давления крови и ее свертывания.
Предварительное дезаминирование аминокислот необходимо для их использования при получении энергии и преобразования в углеводы и жиры. В небольших количествах дезаминирование осуществляется и в других тканях организма, особенно в почках, но по значимости эти процессы несопоставимы с дезаминированием аминокислот в печени.
Образование мочевины в печени помогает извлечению аммиака из жидких сред организма. Большое количество аммиака образуется в процессе дезаминирования аминокислот, дополнительное его количество постоянно образуется бактериями в кишечнике и абсорбируется в кровь. В связи с этим если в печени мочевина не образуется, то концентрация аммиака в плазме крови начинает быстро нарастать, что приводит к печеночной коме и смерти. Даже в случае резкого снижения кровотока через печень, что иногда происходит вследствие формирования шунта между воротной и полой венами, содержание аммиака в крови резко повышается с созданием условий для токсикоза.
Все основные белки плазмы крови, за исключением некоторых гамма-глобулинов, образуются клетками печени. Их количество составляет приблизительно 90% всех белков плазмы. Остальные гамма-глобулины представляют собой антитела, образуемые главным образом плазматическими клетками лимфоидной ткани. Максимальная скорость образования белков печенью составляет 15-50 г/сут, поэтому если организм теряет около половины белков плазмы, их количество может быть восстановлено в течение 1-2 нед.
Следует учитывать, что истощение белков плазмы крови является причиной быстрого наступления митотических делений гепатоцитов и увеличения размеров печени. Этот эффект сочетается с выбросом белков плазмы крови печенью, который продолжается до тех пор, пока концентрация белков в крови не вернется к нормальным значениям. При хронических заболеваниях печени (в том числе и циррозе) уровень белков в крови, особенно альбуминов, может падать до очень низких значений, что является причиной появления генерализованных отеков и асцита.
К числу наиболее важных функций печени относится ее способность синтезировать некоторые аминокислоты наряду с химическими соединениями, в состав которых включены аминокислоты. Например, в печени синтезируются так называемые заменимые аминокислоты. В процессе такого синтеза принимают участие кетокислоты, имеющие сходную химическую структуру с аминокислотами (исключая кислород в кето-положении). Аминорадикалы проходят несколько стадий трансаминирования, перемещаясь от имеющихся в надичии аминокислот в кетокислоты на место кислорода в кето-положении.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:


