Риск шеринг в лекарственных закупках экономический аспект реферат
Обновлено: 02.07.2024
В течение 2020 года весь мир следил за новостями, связанными с распространением коронавирусной инфекции: численность заболевших, методы лечения, ограничительные меры и их влияние на экономику, вторая-третья волна, разработка вакцины, количество вакцинированных и т. д. Так или иначе важность этой темы обусловлена масштабами распространения заболевания по всему миру, а также высокой смертностью. Без сомнения, пандемия COVID-19 – главный фактор, оказавший влияние на развитие фармацевтического рынка в 2020 году.
По мнению экспертов, на конечные итоги по фармрынку в 2020 году влияли потребитель и его реакция на COVID-19. В результате российский фармацевтический рынок показал рост даже выше, чем прогнозировалось в начале года. Динамика рынка в денежном выражении составила 9, 8% вместо прогнозируемых ранее 5-6%. И его объем достиг 2 040 млрд руб. против 1 858 млрд долл. годом ранее (Рис. 1).
Объем продаж лекарственных препаратов в 2020 году
Конечно, тенденция исчезновения лекарств не нова. Но до прошлого года этот процесс был обусловлен, в основном, экономическими факторами (ценообразованием на препараты из списка ЖНВЛП и невозможностью индексаций цен; вытеснением позиций из госзакупок, что делало уже экономически не выгодным реализации лекарств только в аптечном сегменте).
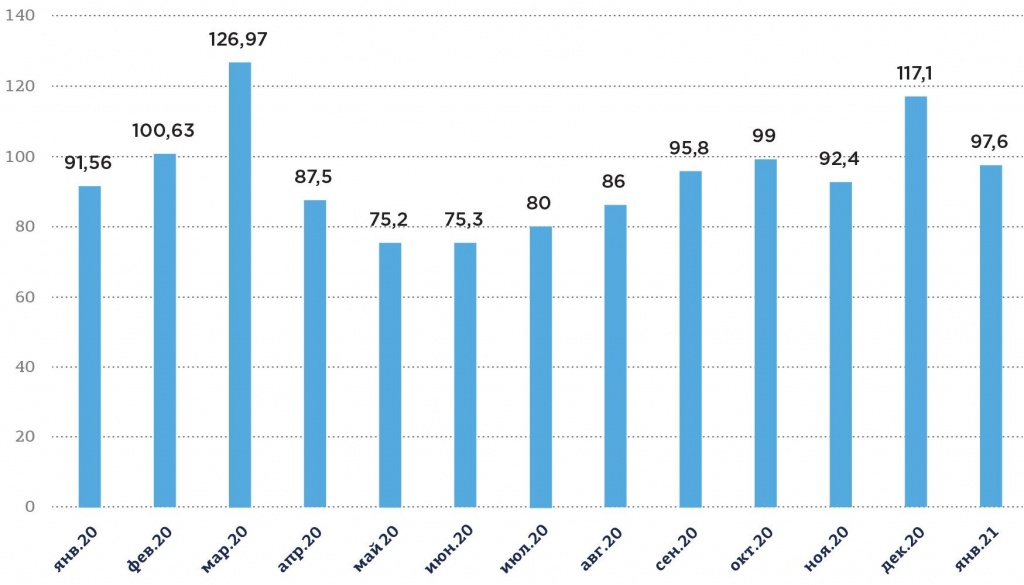
Рис. 2. Коммерческий рынок лекарственных препаратов в России, январь 2020 года – январь 2021 года, млрд руб.
Источник: zdrav.expert
Средняя взвешенная цена упаковки ЛП в России с января 2020 года по январь 2021 года увеличилась на 14,1%, составив 248,4 руб. (Рис. 3).
На отечественном фармацевтическом рынке в коммерческом сегменте в конце января 2021 года, как и год назад, преобладали отечественные лекарственные препараты, объем которых в натуральном выражении увеличился на 1,1% (Рис. 4).
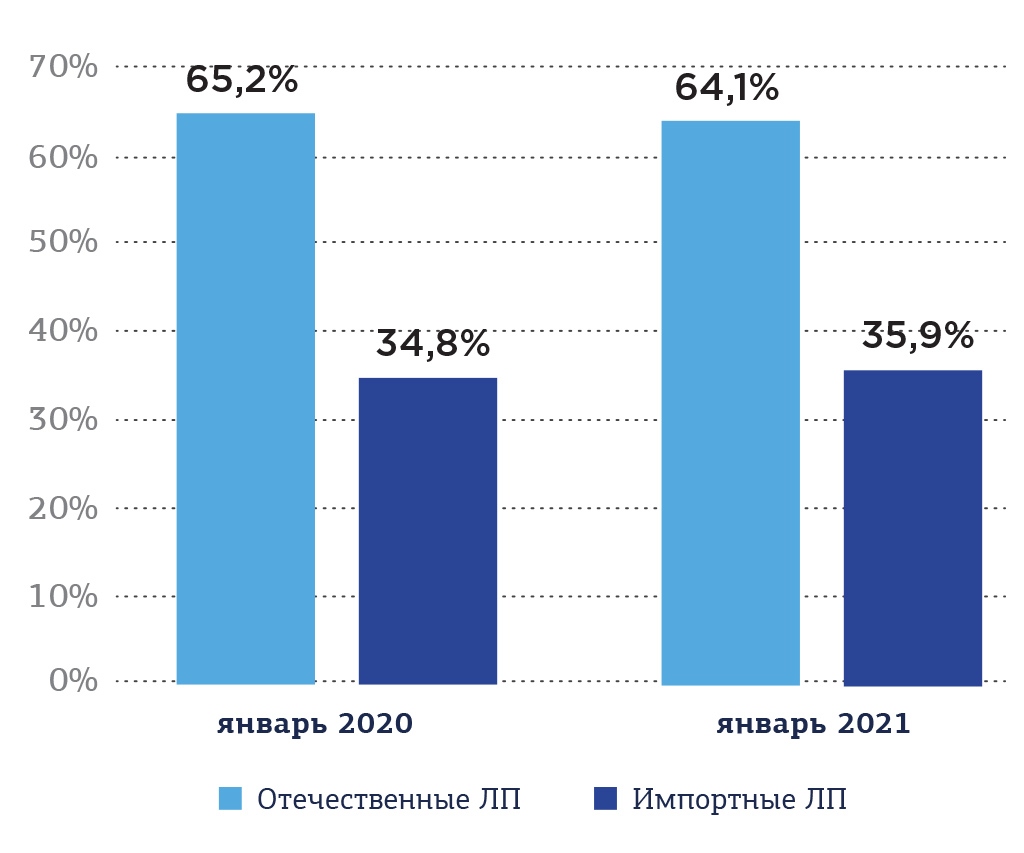
Рис. 4. Соотношение объемов продаж импортных и отечественных препаратов в натуральном выражении на коммерческом сегменте фармации России в январе 2020 и январе 2021 года, %
Источник: Финам
Однако в денежном выражении превалируют по объему продаж лекарственные препараты импортного производства. Так, на конец января 2021 года объем продаж импортных препаратов составил порядка 57,9%, что на 3,6% выше годом ранее (Рис. 5).
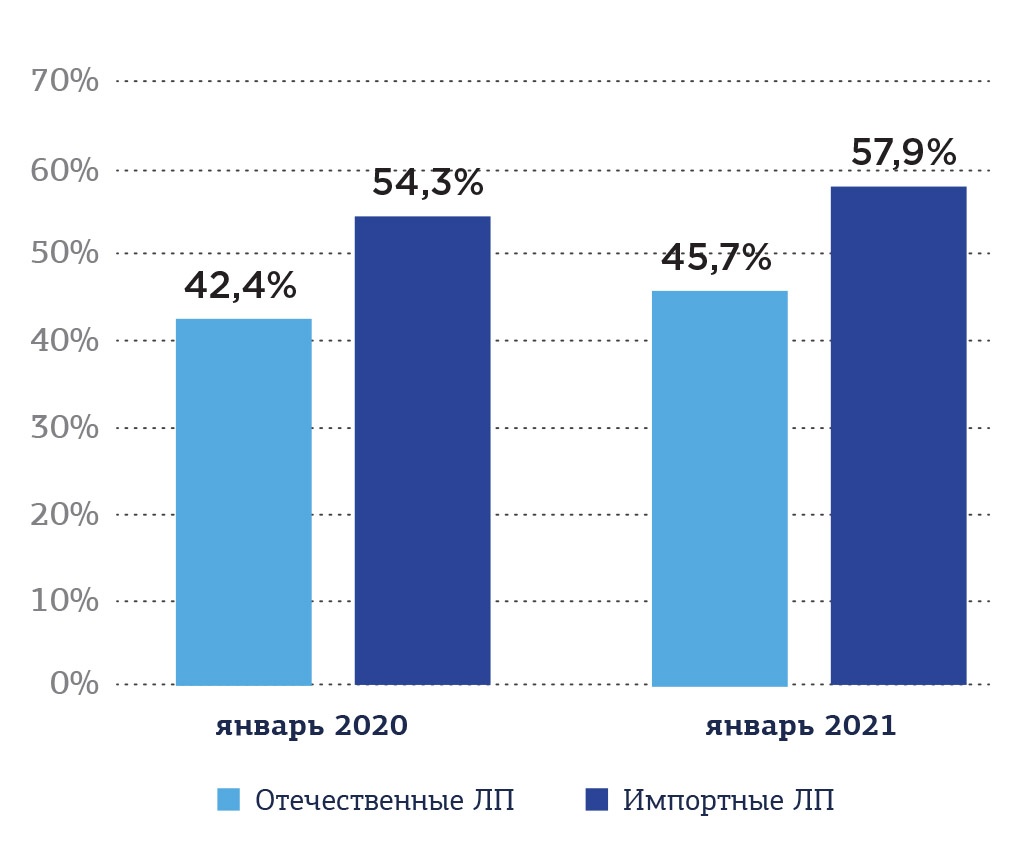
Рис. 5. Соотношение объемов продаж импортных и отечественных лекарственных препаратов в денежном выражении на коммерческом сегменте фармации России в январе 2021 года, %
Источник: zdrav.expert
Доли производства и продаж различных групп отечественных лекарств
Тем не менее, конец 2020 года ознаменовался увеличением производства отечественных лекарственных препаратов также на 3,6%.
Соотношение аптечных продаж лекарственных средств по АТС-группам I уровня в России в январе 2020- 2021 годов представлено в Таблице 1.
Табл. 1. Соотношение долей АТС-групп I уровня в объеме аптечных продаж лекарственных препаратов в России в январе 2020-2021 годов
Власти запустят эксперимент по возврату денег за неэффективное лечение. Речь идет о риск-шеринге (risk sharing, или соглашение о разделении рисков). Это модель, при которой государство закупает препараты у фармкомпаний на определенных условиях: если лечение оказывается неэффективным, то фирмы возвращают деньги властям. Существует и второй вариант риск-шеринга, когда оплата производится только по факту успешного лечения.
Вот что думают о риск-шеринге в сфере лекарственного обеспечения эксперты:
«Модель Risk-sharing с успехом применяется за рубежом, она хорошо себя зарекомендовала, например, в Великобритании. В России она также могла бы приносить выгоду пациентам, поскольку регионы, которым компании возмещали бы объем лекарственного препарата, не оказавшего заявленного эффекта в силу, например, индивидуальных особенностей организма пациента, могли бы использовать возмещенный лекарственный препарат для лечения других пациентов.
Безусловно, для реализации проекта по внедрению Risk-sharing потребовалось бы внести изменения в профильное законодательство, поскольку сейчас в законе нет ни определения Risk-sharing, ни условий, ни ответственности.
Само понятие Risk-sharing предполагает разделение ответственности (рисков) между производителем лекарственных средств и государством. Сложно обсуждать предложения Минздрава, которых пока никто не видел на бумаге. Однако, если министерство сведет Risk-sharing к перекладыванию ответственности на производителей, интерес бизнеса к этой инициативе будет невысоким.
Ситуация усугубляется тем, что приверженность пациентов к терапии — очень сложный вопрос, который вызывает споры среди экспертов много лет.
Юрий Мочалин, директор по корпоративным связям компании Санофи
«Мы приветствуем данную инициативу. Лекарственное обеспечение – довольно дорогостоящая статья бюджета, и мы понимаем тяжесть бремени, которое ложится на государство. В непростых экономических условиях такие обязательства выполнять становится еще труднее. Компания Санофи готова оказать всестороннюю поддержку государству для решения ключевой задачи – обеспечения доступа к инновационным препаратам как можно большему числу пациентов в России.
«В мире этот инструмент применяется достаточно избирательно — в отдельных нозологиях и в отдельных случаях. Российское законодательство эксперименты по Risk-sharing не предусматривает. Этот инструмент может быть полезен и имеет право на жизнь, но он не имеет ничего общего с тем, к чему нужно стремиться: к лекарственному возмещению. Не стоит подменять одно другим. В России принципиально важно реализовать именно механизм лекарственного возмещения. Отклоняться от этой генеральной линии не стоит. Определенная логика в том, что государство будет возмещать стоимость лекарств только в том случае, если они подействуют, — присутствует. Но тут важно заметить, что лечит не лекарство — лечит врач. Многое зависит и от того, как пациент принимает лекарство. Контролировать это производитель лекарства не может.
Статьи по теме

На наши вопросы отвечает профессор кафедры нервных болезней, Института Профессионального Образования ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России - Ольга Владимировна Воробьёва.

Сегодня компания Teva является одним из ведущих мировых производителей воспроизведенных лекарственных препаратов.


Сегодня мы поговорим с врачом редкой специализации - терапевтом–гемостазиологом сети клиник репродукции и генетики Нова Клиник Лидией Олеговной Бузян.

В Москве состоялось заседание Cовета экспертов по обмену научным опытом применения антиагрегантов, включая ацетилсалициловую кислоту (АСК), в качестве профилактики артериальных сосудистых осложнений COVID-19 в разные периоды заболевания*.

До конца финансового года остается несколько месяцев, и бизнес начинает активно подводить промежуточные итоги.
Ежегодно 29 сентября более чем в 100 странах мира, в том числе и России, отмечается Всемирный день сердца.
Интервью

На наши вопросы отвечает профессор кафедры нервных болезней, Института Профессионального Образования ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России - Ольга Владимировна Воробьёва.

Сегодня компания Teva является одним из ведущих мировых производителей воспроизведенных лекарственных препаратов.


Сегодня мы поговорим с врачом редкой специализации - терапевтом–гемостазиологом сети клиник репродукции и генетики Нова Клиник Лидией Олеговной Бузян.
Во многих странах мира система risk–sharing, т.е. разделение рисков между государством и бизнесом, работает уже не один год, в т.ч. и в фармацевтике. Теперь — слово за Россией.
Основной момент концепции разделения рисков заключается в том, что государство полностью выплачивает стоимость лекарственных препаратов, если лечение с их помощью оказалось эффективным. Если результаты лечения конкретного пациента не демонстрируют положительного эффекта, он переводится на другую схему лечения. И поставщик в этом случае возмещает объем затраченных средств на оплату препарата. "За рубежом используют различные термины для определения соглашения лиц, но в России остановились пока на понятии определения договоров. Таким образом, соглашение о разделении рисков для нас — это соглашение между субъектами. Заключается оно в форме договора, в котором стороны соглашаются взять на себя определенную часть риска, связанного с эффективностью лечения пациентов с определенной нозологией, определенным препаратом и на определенных соглашением условиях", — сообщила заместитель начальника отдела методологического обеспечения проведения комплексной ОТЗ ФГБУ "ЦЭККМП" МЗ РФ, к.м.н. Ксения Владимировна Герасимова. При этом соглашения на разделение рисков (схемы соглашений между плательщиком и производителем (поставщиком) технологий и лекарственных препаратов) делятся согласно классификации споров на два объединенных класса.
Первый — представляет собой схемы, основанные на достижении финансовых показателей, второй — основывается на достижении результата лечения.
В мире подобные схемы являются эффективными в плане расширения доступа пациентам к инновационным лекарственным препаратам. Однако в России речь больше идет о том, чтобы снизить нагрузку на бюджет плательщиков.
Необходимость разработки новых схем была определена распоряжением Министерства здравоохранения РФ №136–р от 30.01.15, в котором для модернизации системы лекарственного обеспечения различных категорий граждан было поручено разработать форму соглашения между Минздравом России и правительствами субъектов России. Форма соглашения, порядок и сроки отражены в приказе Министерства здравоохранения РФ от 19.02.16 №121н "Об утверждении формы соглашения между Министерством здравоохранения Российской Федерации и высшим исполнительным органом государственной власти субъекта Российской Федерации о реализации пилотного проекта, направленного на модернизацию системы лекарственного обеспечения отдельных категорий граждан, внедрение рациональных моделей ценообразования. В том числе на основе референтных цен на лекарственные препараты для медицинского применения, на территории субъекта Российской Федерации, а также формы отчета о ходе реализации указанного пилотного проекта, порядка и сроков его представления". Да, пока речь идет только о формате пилотного проекта по внедрению в субъектах РФ механизмов закупок лекарственных препаратов по инновационным моделям договоров. Такая "пилотная" закупка препаратов будет осуществляться в Москве, Московской и Калужской обл.
После информирования подготовки к реализации компаниями были подготовлены и поданы в Минздрав России заявки об участии в пилотном проекте. Подано 25 предложений от 11 фармацевтических компаний по 16 показаниям. В перечень предлагаемых нозологий вошли: печеночно–клеточный рак, фенилкетонурия, ревматоидный артрит, хронический гепатит С, рак молочной железы, рассеянный склероз, рак предстательной железы, анкилозирующий спондилит, болезнь Крона, язвенный колит, миелофиброз (истинная полицитемия), хронический миелоидный лейкоз, ювенильный идиопатический полиартрит, неклапанная фибрилляция предсердий, тромбопрофилактика после эндопротезирования.
Использования инновационных методов лекарственного обеспечения (ИМЛО): как это у них и зачем это нам?
В западных странах этот подход обеспечивает:
- Ускорение доступа к инновациям.
- Внедрение технологий, не прошедших ОТЗ, — использование соглашений при отсутствии научно обоснованных данных по их эффективности/безопасности.
- Снижение уровня неопределенности при лечении с применением новых технологий.
- Низкий уровень администрирования проектов.
В России ИМЛО актуально:
- только для лекарственных препаратов;
- скорее для лекарственных препаратов, включенных в перечень ЖНВЛП;
- скорее на региональном уровне;
- основная мотивация — повышение закупок ЛП, уже включенных в перечни.
Однако уже сейчас заметна низкая заинтересованность плательщиков.
- Допустимо ли использования инновационных методов лекарственного обеспечения (ИМЛО) для нового препарата?
- С чем связана необходимость использования ИМЛО в конкретной ситуации?
- Какая цель применения ИМЛО в конкретной ситуации?
- Чей опыт и какая наиболее приемлемая схема ИМЛО для запуска проекта?
- Можно ли использовать опыт ИМЛО в других странах для препаратов РФ?
- Федеральный или региональный уровень?
- Кто плательщик и кто переговорщик?
- Какие исходы терапии при проведении ИМЛО (в т.ч. клинические и финансовые) должны оцениваться?
- Какова цена внедрения и экономические результаты проекта ИМЛО?
- Каковы риски для внедрения ИМЛО в конкретной ситуации могут возникнуть: для государства, для индустрии?
- Как и кем внедрение ИМЛО будет мониторироваться?
КОМПЛЕКСНАЯ ОЦЕНКА — ОСНОВА ОСНОВ
Пока подготовка к реализации проекта проходит на федеральном уровне. В нее вошли: проведение экспертизы заявок на региональном уровне, формирование рабочих комиссий, подбор пациентов, методика, закупка препаратов. Результат оценки препарата является решающим при его включении в пилотный проект. Разработаны и методические рекомендации по проведению комплексной оценки. Они соответствуют мировому опыту по анализу информации сравнительной клинической эффективности препарата, его безопасности и экономических последствий применения.
СХЕМА СХЕМЕ РОЗНЬ…
Существуют различные схемы соглашений между плательщиком и производителем (поставщиком) технологий и лекарственных средств.
1. Схема, основанная на достижении финансовых показателей, в которой учитываются:
- ограничение верхнего предела расходов бюджета;
- скидки и уступки поставщика лекарственных средств;
- соглашение "цена — объем", при которой капитализация закупки отражается на стоимости партий лекарственных средств.
2. Схема, основанная на достижении результата лечения, в которой учитываются:
- возмещение в зависимости от результата лечения (PLR);
- условия продолжения лечения (CTC);
- возмещение при условии получения доказательных данных в рамках дополнительных исследований (CED).
Реализуется пилотный проект применения ИМЛО поэтапно. Алгоритм таков. Сначала осуществляется разработка и согласование проекта на федеральном и региональном уровнях, а затем на уровне медицинской организации.
На региональном уровне проделывается работа по формированию единой методологии представления информации о лекарственном препарате и проведение комплексной оценки ЛП для принятия решений о возможности его включения в пилотный проект по внедрению в субъектах РФ механизмов закупок лекарственных препаратов по инновационным моделям договоров.
Очень важны этапы проведения комплексной оценки ЛП в рамках реализации пилотного проекта. Проводится она следующим образом. Заявитель предоставляет анализ общих сведений о ЛП в рамках рассматриваемого показания. Потом проводится анализ данных о клинической эффективности ЛП. Затем — анализ клинико–экономической модели в случае закупки ЛП по инновационным моделям договоров. В итоге — подготовка заключения о возможности внедрения предлагаемой заявителем схемы.
По результатам проведения экспертизы Центром экспертизы и контроля качества медицинских препаратов рекомендовано 16 предложений от 10 фармацевтических компаний по 11 нозологиям. Итак, в пилотном проекте примут участие следующие фармацевтические компании: Байер (Bayer), Биомарин (BioMarin), Бристол–Майерс Сквибб (Bristol–Myers Squibb), Джонсон и Джонсон/Янсен (Johnson&Johnson/Janssen), МСД (MSD/Merck&Co), Санофи Джензайм (Sanofi Genzyme), Такеда (Takeda), Ф.Хоффманн–Ля Рош (Roche), Новартис (Novartis).
Также было принято решение субъектов РФ о включении в пилотный проект следующих нозологий:
- в Москве: хронический гепатит С, рассеянный склероз, болезнь Крона, язвенный колит, хронический миелоидный лейкоз;
- в Московской обл.: хронический гепатит С, рассеянный склероз, болезнь Крона, язвенный колит;
- в Калужской обл.: печеночно–клеточный рак.
Центр экспертизы и контроля качества медицинской помощи будет внимательно отслеживать проведение пилотного проекта. А пока фармацевтические компании, не участвующие в нем, могут, взвесив все "за" и "против", уже начать подготовку к следующему витку системы risk–sharing.
В современных условиях высокой рыночной конкуренции и постоянно меняющихся покупательских предпочтений трудно представить себе успешно развивающуюся компанию, в которой не налажен процесс управления рисками.
Управление рисками прежде всего необходимо для принятия управленческих решений в условиях, требующих выбора одного из нескольких вариантов при отсутствии определенности и однозначности преимуществ какого-либо решения.
Многие руководители считают, что они и без специальных технологий управления прекрасно видят возможные риски для компании и смогут вовремя их устранить, основываясь на собственном опыте и интуиции. Они ошибаются, и мы видим огромное количество примеров, когда крупные корпорации испытывают большие трудности в бизнесе или приходят к банкротству именно из-за ошибочных действий руководства.
Даже суперпрофессиональный руководитель не может контролировать качество всех бизнес-процессов и технологических операций компании без выделения управления рисками в отдельный процесс и вовлечения в него всех ключевых менеджеров компании. А если говорить о небольшом бизнесе, то по статистике в течение первого года работы закрываются около 90 % вновь созданных предприятий, и большинство из них — именно по причине некачественного управления предпринимательскими рисками.
ЦЕЛИ И НАЗНАЧЕНИЕ ПРОЦЕССА УПРАВЛЕНИЯ РИСКАМИ НА ПРЕДПРИЯТИИ
По общепринятой в менеджменте рисков классификации под риском подразумевается событие или стечение обстоятельств, которое в случае его реализации может существенным образом повлиять на достижение стратегических целей и текущих задач компании. Влияние риска может оказаться как негативным, т. е. несущим угрозы бизнесу, так и позитивным, предоставляющим возможности для его развития. Именно поэтому процесс управления рисками можно назвать искусством различать, что представляет собой выявленный риск — опасность для деятельности компании или наоборот, шанс ее улучшить.
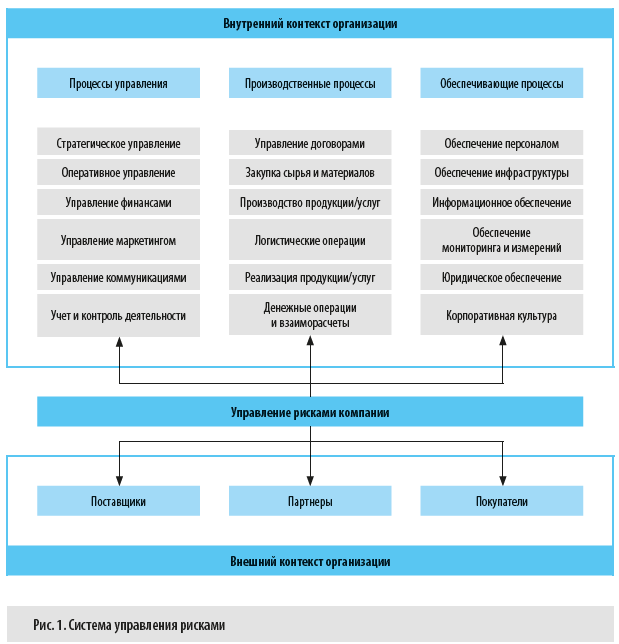
Система управления рисками — это процесс, осуществляемый как руководством компании, так и ее сотрудниками. Цель этого процесса — выявить потенциальные события, которые могут повлиять на результаты деятельности компании — как положительно, так и отрицательно, и обеспечить приемлемые для компании уровень угроз или степень реализации возможностей.
Специфическая особенность данного процесса состоит в том, что он охватывает все без исключения бизнес-процессы компании и реализуется в рамках как внешнего, так и внутреннего контекстов бизнеса (рис. 1).
Основные принципы управления рисками:
1. Управление рисками — неотъемлемая часть ежедневного процесса управления, которая предполагает, что каждый сотрудник обязан выявлять и оценивать риски для наиболее эффективного принятия управленческих решений.
2. Все риски, которые возникают по внешним или внутренним причинам и могут значительно повлиять на достижение целей предприятия, должны идентифицироваться, оцениваться и документироваться, а на основе этой информации — разрабатываться мероприятия по рискам.
3. Процесс управления рисками подразумевает применение единого и стандартизированного подхода к выявлению, оценке и работе с рисками.
4. Руководители всех уровней несут ответственность за своевременное выявление рисков, их оценку, разработку мероприятий по управлению рисками и информирование всех заинтересованных сторон, в том числе работников, о рисках, влияющих на достижение поставленных перед ними целей, а также за накопление знаний о рисках и анализ реализовавшихся рисков.
5. В процессе управления рисками необходим разумный баланс издержек на управление риском и величины возможного ущерба или выгоды от наступления рискового события: если уровень риска приемлемый, а затраты на управление риском превышают возможный эффект, дополнительные мероприятия по работе с этим риском не нужны.
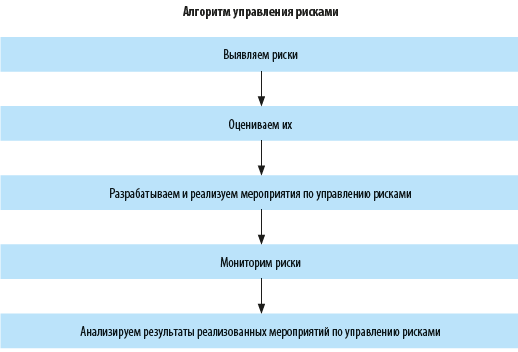
Методы управления рисками (рис. 2):
1. Снижение риска подразумевает воздействие на риск путем снижения вероятности реализации риска или уменьшения негативных/усиления позитивных последствий в случае реализации риска в будущем.
2. Перенос риска предполагает передачу риска (в том числе частичную) другой стороне (например, заключаются договоры страхования, хеджирования, аутсорсинга и др.) — это позволяет уменьшить негативное или усилить позитивное влияние риска на достижение целей компании.
3. Принятие риска допускает возможное наступление последствий риска с определением конкретных источников покрытия ущерба от негативных последствий.
4. Уклонение от риска означает отказ от совершения действий/мероприятий/целей, характеризующихся высокой степенью риска.
Теперь поговорим о том, как управлять рисками.
МЕТОДИКА ОПРЕДЕЛЕНИЯ УГРОЗ И ВОЗМОЖНОСТЕЙ ДЛЯ ЦЕЛЕЙ ПРЕДПРИЯТИЯ
Алгоритм процесса управления рисками представляет собой последовательную цепочку процедур, которые помогают руководству компании эффективно минимизировать угрозы и использовать возможности для достижения целей предприятия (см. схему).
Рассмотрим эти этапы подробнее.
1. Выявляем риски.
На этом этапе определяем внутренние или внешние события, реализация которых может негативно или позитивно отразиться на достижении целей компании.
Как выявлять риски?
В первую очередь риски выявляют:
• в рамках ежегодного цикла планирования;
• в ходе анализа деятельности компании и пересмотра ее целей и бюджета;
• в текущем режиме анализа эффективности процессов компании;
• в ходе производственных совещаний и индивидуальных бесед с сотрудниками компании.
По итогам процедуры выявления рисков формируется классификатор рисков компании и назначаются ответственные по каждому из рисков.
2. Оцениваем риски.
Главная цель оценки рисков — определить уровень рисков и выделить наиболее значимые (критические) риски, которые могут негативно или позитивно влиять на деятельность компании и достижение ее стратегических целей.
Читайте также: