Реферат строение атомного ядра ядерные силы
Обновлено: 07.07.2024
Функция "чтения" служит для ознакомления с работой. Разметка, таблицы и картинки документа могут отображаться неверно или не в полном объёме!
Реферат по физикена тему:“Атомное ядро”
Москва 1996
Оглавление 1 История открытий в области строения атомного ядра
Изучение атомного ядра вынуждает заниматься элементарными частицами. Причина этого ясна: в ядрах атомов частиц так мало, что свойства каждой из них в отдельности не усредняются, а, напротив, играют определяющую роль.
1.1 Модели атома до Бора
Развитие исследований радиоактивного излучения, с одной стороны, и квантовой теории - с другой, привели к созданию квантовой модели атома Резерфорда - Бора. Но созданию этой модели предшествовали попытки построить модель атома на основе представлений классической электродинамики и механики. В 1904 году появились публикации о строении атома, одни из которых принадлежали японскому физику Хантаро Нагаока, другие - английскому физику Д.Д. Томсону.
Нагаока представил строение атома аналогичным строению солнечной системы: роль Солнца играет положительно заряженная центральная часть атома, вокруг которой по установленным кольцеобразным орбитам движутся “планеты” - электроны. При незначительных смещениях электроны возбуждают электромагнитные волны.
В атоме Томсона положительное электричество “распределено” по сфере, в которую вкраплены электроны. В простейшем атоме водорода электрон находится в центре положительно заряженной сферы. В многоэлектронных атомах электроны располагаются по устойчивым конфигурациям, рассчитанным Томсоном. Томсон считал каждую такую конфигурацию определяющей химические свойства атомов. Он предпринял попытку теоретически объяснить периодическую систему элементов Д.И. Менделеева. Позднее Бор указал, что со времени этой попытки идея о разделении электронов в атоме на группы сделалась исходным пунктом.
Но вскоре оказалось, что новые опытные факты опровергают модель Томсона и, наоборот, свидетельствуют в пользу планетарной модели. Эти факты были открыты Резерфордом. В первую очередь следует отметить открытие ядерного строения атома.
1.2 Открытие атомного ядра
Уподобление атома планетной системе делалось еще в начале XX века. Но эту модель было трудно совместить с моделями электродинамики, и она была оставлена, уступив место модели Томсона. Однако в 1904 году начались исследования, приведшие к утверждению планетарной модели.
При изучении a-частиц Резерфорд, исходя из модели Томсона, подсчитал, что рассеивание a-частиц не может давать больших углов отклонений даже при многих столкновениях с частицей. И здесь Резерфорд обратился к планетарной модели.
7 марта 1911 года Резерфорд сделал в философском обществе в Манчестере доклад “Рассеяние a и b-лучей и строение атома”. В докладе он, в частности, говорил: “Рассеяние заряженных частиц может быть объяснено, если предположить такой атом, который состоит из центрального электрического заряда, сосредоточенного в точке и окруженного однородным сферическим распределением противоположного электричества равной величины. При таком устройстве a и b-частицы, когда они проходят на близком расстоянии от центра атома, испытывают большие отклонения, хотя вероятность такого отклонения мала”.
Важным следствием теории Резерфорда было указание на заряд атомного центра, который Резерфорд положил равным ±Ne. Заряд оказался

Элементарные частицы в ядре удерживаются особыми силами, называемыми ядерными. Кратко рассмотрим особенности этих сил.
Строение атомного ядра
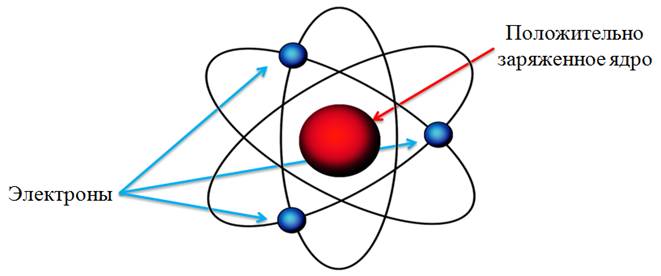
В опытах Э. Резерфорда в начале XXв было установлено, что весь положительный заряд атома сконцентрирован в весьма малой части атома – в ядре.

Рис. 1. Планетарная модель атома.

Рис. 2. Протоны и нейтроны в ядре.
Ядро самого легкого и распространенного элемента в Вселенной – водорода – состоит лишь из одного протона. Но, большинство ядер содержит большее количество протонов, оно равно атомному номеру элемента в таблице Менделеева. Самый тяжелый из стабильных элементов, не подверженных радиоактивному распаду – свинец-208, содержащий 82 протона и 126 нейтронов.
Все протоны заряжены одинаково, и такое большое число протонов, находящихся рядом, должно подвергаться действию больших сил отталкивания. Ядра должны очень быстро распадаться. Однако, в реальности этого не наблюдается. Следовательно, существуют силы, удерживающие протоны внутри ядра. Что это за силы ?
Ядерные силы
Силы электромагнитной природы выталкивают протоны из ядра, и не могут удерживать протоны вместе. Протоны обладают массой, а значит, должны испытывать гравитационное притяжение. Однако, подсчет показывает, что электрическое отталкивание между протонами в .25\times10^$ раз превышает силы гравитации.

Рис. 3. Сильное (ядерное) взаимоедйствие.
Важнейшая характеристика ядерных сил – малый радиус их действия, около $10^ – 10^м$. На больших расстояниях интенсивность ядерного взаимодействия резко убывает. Именно эта особенность и определяет размеры атомных ядер.
Электромагнитное взаимодействие имеет бесконечный радиус действия потому, что его переносчики (фотоны) сами в нем не участвуют, имеют нулевую массу покоя и могут свободно переноситься от одной заряженной частицы к другой. Переносчики же Сильного взаимодействия (глюоны и составленные из них пионы) имеют массу и сами участвуют во взаимодействии, притягиваясь к испустившему их нуклону. В результате они не могут удалиться от нуклона на большие расстояния.
Что мы узнали?
Нуклоны внутри ядер удерживаются ядерными силами, которые в 100 раз сильнее кулоновских. Это взаимодействие особой природы, самое сильное из известных, поэтому оно называется Сильным. Его особенность – малый радиус действия, не превышающий размера атомного ядра.

Мы уже познакомились с планетарной моделью атома, согласно которой, в ядре сосредоточена почти вся масса атома. Встает логичный вопрос о составе атомного ядра. В ходе данного урока мы попытаемся ответить на этот вопрос, а также познакомимся с соответствующими опытами.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Строение атомного ядра. Ядерные силы"
«Другого ничего в природе нет….
Ни здесь, ни там – в космических глубинах.
Все: от песчинок малых до планет
Степан Щипачёв
Ранее изучалось строение атома. С помощью опытов Резерфорда, было установлено, что почти вся масса и весь положительный заряд атома сосредоточены в атомном ядре, вокруг которого вращаются отрицательно заряженные электроны. После этого открытия возникал резонный вопрос: а из чего состоит ядро? Ещё в 1913 году, Резерфорд предположил, что в состав любого атомного ядра входит ядро атома водорода. Это предположение было обусловлено тем, что масса ядра любого химического элемента была в целое число раз больше массы ядра атома водорода. Это дало основание рассматривать ядро атома водорода как элементарную частицу. Такая частица была названа протоном.
В 1919 году Резерфорд провел следующий опыт: он обстреливал ядро атома азота a-частицами. При попадании a-частицы в ядро азота, образовались два совершенно новых ядра: по предварительным оценкам, это были ядра атомов кислорода и водорода.

Однако полной уверенности в этом не было до тех пор, пока эксперимент не был повторен в камере Вильсона. На фотографии видны расходящиеся прямые линии – это следы a-частиц, которые не испытали соударений с ядрами атомов азота.

Тем не менее, на фотографии ясно видно, что след одной a-частицы раздваивается. Это говорит о том, что именно эта a-частица столкнулась с ядром атома азота. По характеру искривления треков было установлено (на этот раз точно), что образовавшиеся ядра действительно являются ядрами атомов кислорода и водорода. Таким образом, Резерфордом фактически была получена первая искусственная ядерная реакция.

В уравнении, описывающем данную реакцию, символом , обозначено ядро атома водорода, масса которого составляет приблизительно одну атомную единицу массы (1 а.е.м.), а заряд равен модулю элементарного заряда. Ядро атома водорода также обозначается символом (то есть символом протона, поскольку это одно и то же). Впоследствии были проведены подобные эксперименты и с другими элементами, такими как натрий, алюминий, магний и многими другими. Из всех этих ядер a-частицы выбивали протоны, что подтверждало гипотезу Резерфорда.

Тем не менее, очень скоро стало ясно, что ядра не состоят только из протонов. Дело в том, что это противоречило опытным данным. Для примера возьмем ядро бериллия, заряд которого равен четырем элементарным зарядам . Это говорит нам о том, что в ядре бериллия находится 4 протона. Если бы ядро состояло только из протонов, то масса ядра бериллия была бы равна 4 а.е.м. В действительности же, масса ядра бериллия составляет 9 а.е.м. Следовательно, в ядро входят еще какие-то частицы, причем не обладающие электрическим зарядом. Именно на основании этого, в 1929 году Резерфорд высказал предположение о существовании электрически нейтральной частицы, масса которой приблизительно равна массе протона.
В 1930 году Вальтер Боте и его студент Герберт Беккер обнаружили следующее: при бомбардировке a-частицами ядра атома бериллия, из ядра исходит какое-то неизвестное излучение. Сначала было выдвинуто предположение о том, что это гамма-лучи, поскольку они имели высокую проникающую способность и никак не отклонялись в магнитном поле. Однако, от этой идеи пришлось отказаться, поскольку данное излучение обладало слишком большой энергией для гамма-лучей. В 1932 году изучением нового излучения занялся ученик Резерфорда - Джеймс Чедвик.


Он доказал, что неизвестное излучение – это на самом деле поток нейтральных частиц, масса которых приблизительно равна массе протона. Эту массу удалось определить по характеру взаимодействия с другими частицами. То, что частица электрически нейтральна, следовало из того, что она не отклонялась ни в электрическом, ни в магнитном поле. Такую частицу назвали нейтроном. Итак, нейтрон обозначается символом (поскольку не имеет заряда и обладает массой приблизительно равной 1 а.е.м.). Впоследствии точные измерения показали, что масса нейтрона чуть больше массы протона.
Практически сразу после открытия нейтрона физиками Дмитрием Иваненко и Вернером Гейзенбергом была предложена протонно-нейтронная модель строения ядра.

Работая независимо друг от друга, они пришли к выводу, что ядра атомов всех элементов состоят из двух видов частиц: протонов и нейтронов. Эти частицы стали называть нуклонами. Общее число нуклонов в ядре называется массовым числом (поскольку это число определяет массу ядра). Массовое число обозначается буквой А. Число протонов в ядре называется зарядовым числом (поскольку это число определяет заряд ядра). Зарядовое число обозначается буквой Z. Нетрудно догадаться, что число нейтронов в ядре равно разности общего числа нуклонов и числа протонов. То есть, чтобы найти число нейтронов, нужно из массового числа вычесть зарядовое число. Это число обозначается буквой N.
Итак, в общем случае, ядро любого химического элемента обозначается следующим образом:

где Х – это символ элемента, Z – зарядовое число и А – массовое число. Еще раз уточним, что массовое число равно массе, выраженной в атомных единицах и округленной до целых. Зарядовое число равно заряду, выраженному в единицах элементарного электрического заряда. Для примера рассмотрим ядро натрия.

В таблице Менделеева, натрий имеет порядковый номер 11 – это и есть зарядовое число. Значит, в ядре натрия содержится 11 протонов. Поскольку атом в целом электрически нейтрален, можно заключить, что в атоме содержится 11 электронов. В таблице Менделеева также указана масса натрия – 23. Значит, в ядре натрия содержится 12 нейтронов. Итак, чтобы определить количество протонов, нейтронов и электронов в атоме, нужно сделать следующее:
– Посмотреть в таблице Менделеева порядковый номер интересующего вас элемента. Таким образом, определяетс зарядовое число – то есть число протонов и число электронов.
– Посмотреть массу этого элемента в таблице Менделеева и округлить её до целых (она почти всегда очень близка к целому числу). Таким образом, определяется массовое число, то есть общее число нуклонов. Для нахождения числа нейтронов, нужно из массового числа вычесть зарядовое число.
Необходимо отметить, что существуют атомы, которые ничем не отличаются друг от друга по своим химическим свойствам, но обладают различным массовым числом. Впервые, на существование таких атомов обратил внимание Фредерик Содди, который работал вместе с Резерфордом. Содди предложил называть такие атомы изотопами. С помощью опытов было установлено, что изотопы одинаково вступают в химические реакции и образуют одинаковые соединения. Это говорило о том, что число электронов в электронных оболочках (а, значит, и заряд ядра) у изотопов одинаковы. Стало быть, в ядрах изотопов содержалось различное число нейтронов.
На сегодняшний день найдены изотопы всех химических элементов. Например, водород имеет три изотопа: протий, дейтерий и тритий.
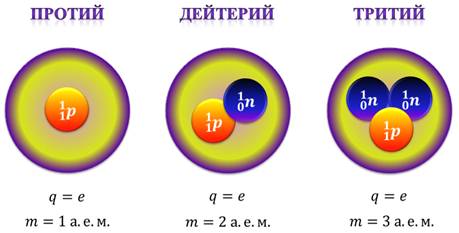
Ядро протия состоит только из одного протона (это самый распространенный изотоп водорода). То есть, заряд ядра протия равен элементарному заряду, а масса равна одной атомной единице. Ядро дейтерия включает в себя один протон и один нейтрон. Таким образом, заряд ядра дейтерия тоже равен элементарному, но масса уже равна двум атомным единицам. Наконец, ядро трития содержит один протон и два нейтрона. Заряд ядра трития опять-таки равен элементарному заряду, а вот масса равна трем массовым единицам.
Другие химические элементы могут иметь значительно больше изотопов: например у урана их насчитывается 26. Наиболее распространенные изотопы урана – это уран 235 и уран 238 (поскольку зарядовое число изотопов одинаковое, имеет смысл упоминать только массовое число, чтобы понять, о каком изотопе идет речь).

Надо сказать, что некоторые изотопы могут являться радиоактивными. В связи с этим, изотопы делятся на стабильные и нестабильные. Стабильные изотопы сохраняются неизменными сколь угодно долго, а нестабильные изотопы со временем превращаются в другие химические элементы в результате радиоактивного распада.
Именно из-за существования изотопов, для большинства элементов в таблице Менделеева указана дробная масса. Дело в том, что эта масса вычисляется как средняя масса всех изотопов с учетом степени распространения каждого изотопа. Например, как мы уже убедились, водород имеет три изотопа с массовыми числами один, два и три. Но протий распространен гораздо больше: его содержание в природе составляет почти 99,99%. Поэтому в таблице Менделеева масса водорода практически равна единице.
Возникает важнейший вопрос: как же ядра многих изотопов остаются стабильными? Что удерживает нуклоны в ядре? Ведь между положительно заряженными протонами должны возникать силы электростатического отталкивания. Силы, удерживающие протоны и нейтроны в ядре называются ядерными силами. Нетрудно догадаться, что раз протоны не разлетаются в разные стороны, значит, ядерные силы значительно мощнее, чем электростатические силы. Но ядерные силы действуют на очень малом расстоянии, то есть в пределах атомного ядра. Эти силы фундаментально отличаются от гравитационного или электромагнитного взаимодействия и относятся к сильному взаимодействию, о котором упоминалось в девятом и десятом классах. Также к свойствам ядерных сил можно отнести то, что они не являются центральными (то есть не действуют вдоль прямой, соединяющей частицы). Кроме того, ядерные силы не зависят от величины заряда частиц (поскольку они действуют и на незаряженные частицы – нейтроны).
Основные выводы:
– После открытия протона и нейтрона была предложена протонно-нейтронная модель ядра.
– Согласно этой модели все ядра атомов состоят из протонов и нейтронов. Частицы, входящие в состав ядра назвали нуклонами.
– Общее число нуклонов в ядре называется массовым числом, а число протонов в ядре называется зарядовым числом.
– Массовое число А численно равно массе ядра данного химического элемента, выраженной в атомных единицах массы и округленной до целого.
– Зарядовое число Z численно равно заряду ядра, выраженному в единицах элементарного электрического заряда.
– Число нейтронов в ядре определяется как разность массового и зарядового чисел.

– В результате исследований было открыто существование разновидностей каких-либо химических элементов, которые обладали одинаковыми химическими свойствами, но имели различную массу. Такие разновидности назвали изотопами.
– Ядерные силы – это силы, удерживающие нуклоны в ядре в течение длительного времени. Тем не менее, ядерные силы не распространяются за пределы атомных ядер.

ГОСТ
Атомная физика как одно из основных направлений в науке появилась на рубеже 19-20 вв. базе экспериментов в области оптических спектров. Данное научное течение занималась тщательным изучением строения самого атома и исследованием его свойств. Была создана количественная гипотеза атома. Последующие опыты, которые были направлены на определение ключевых свойств электронов, завершились формированием квантовой механики — физической теории, определяющей законы микромира.
Квантовая механика выполняет роль теоретического фундамент физика атомного ядра, поэтому выступает неким опытным полигоном в этом вопросе. Атомным учением были установлены важные оптические спектры строения атомов и разнообразие их химических элементов, закономерность связи интенсивности их движения с системой энергетических показателей. Это течение в науке подтвердила то, что внутренняя энергия атома всегда квантуется и параллельно изменяется.
В результате изучения аспекта радиоактивности возникло особое направление ядерной физики, которая изучает трансформацию простых веществ — физика элементарных частиц.
Атомное ядро — это основная центральная часть атома, которая состоит из нейтронов и протонов и нейтронов в виде нуклонов.
Атомная физика в процессе своего становления смогла добиться огромных успехов в исследовании явлений, происходящих в ядрах и взаимодополняющих элементарных частиц. Но данная дисциплина направлена на изучение, в первую очередь, изменений с самим ядром и с электронной оболочкой.
Эта сфера тщательно демонстрирует следствия превращения атомных ядер, которые происходят при распадах различных ядерных и радиоактивных процессах.
Достижения атомной физики невозможны без применения инновационных технологий в виде ускорителей положительно заряженных частиц. Именно разработка уникальных установок частиц помогли ученым изучить многие проблемы строения атомных ядер и их трансформаций. Центральной частью ядерной физики считается нейтронное направление, занимающееся ядерными реакциями, которые происходят под влиянием нейтронов. Современная ядерная наука условно распадается на две взаимодополняющие ветви — экспериментальную и теоретическую атомную физику.
Готовые работы на аналогичную тему
Посредством указанного течения возможно исследовать:
- первичный постоянный нуклеосинтез;
- термоядерные опасные реакции в звёздах;
- строение ядерной энергетики.
Физика атомного ядра имеет принципиально важное значение для многих разделов науки, в числе которое астрофизика.
Структура атомных ядер
Характер взаимосвязанной концепции микрообъекта, как и любой другой системы, непосредственно зависит от состава и строения ее элементов, а также от их трансформации. Именно такие критерии определяет целостную связанность всех принципов работы этих явлений.
С уровнем получаемых знаний кардинально менялось и представления о самой структуре элементарного вещества. В качестве принципов взаимодействия микрообъектов сначала рассматривались только молекулы как самые маленькие единицы частиц. Согласно протонно-нейтронной модели ядра состоят из простых элементов двух видов — нейтронов и протонов. Так как в целом атом электрически нейтрален, а интенсивность протона равна модулю заряда электрона, то количество этих частиц в ядре пропорционально числу электронов в атомной оболочке.
Следующим важным шагом в данном направлении было исследование того, какую роль в создании молекул из атомов играет коэффициент напряженности и силы, с которой они постоянно связываются друг с другом. Из всего этого стоит уяснить основное: структура этих процессов представляет собой систематическую и упорядоченную связь, а взаимодействие между элементами концепции возникает с помощью новых целостных свойств. В такой химической формуле именно специфический характер трансформации определяет важные особенности строения молекулы.
Атомное ядро как комплексная система существует только при наличии притяжения, объединяющего протоны и нейтроны в атомном ядре. Эти процессы определяют сильное взаимодействие всех частиц, поэтому их необходимо рассматривать как одно целое вещество — нуклон.
Радиоактивные мощные излучения включают в себя три типа лучей:
- бета-лучи состоят только из отрицательных электронов;
- альфа-лучи реализуют положительно заряженные частиц;
- гамма-лучи действуют по принципу работы лучей Рентгена (не имеют заряда), только их излучение значительно более жесткое.
Атомного ядро в физике состоит из элементов, которые имеют положительный заряд, равный абсолютной величине заряда электрона и спин, а также электро-нейтральных частица c таким же как у протона строением.
Ядерные силы
Состав ядра достаточно устойчиво, поэтому все частицы удерживаться внутри него определенными силами, причем очень большими. Устойчивость данного элемента невозможно объяснить простыми силами электромагнитов, так как между одинаково заряженными частицами всегда действует электрическое отталкивание.
Нейтроны в ядре не имеют электрического заряда, следовательно, между атомными частицами-нуклонами будут фиксироваться особые силы, называемые ядерными частицами.
Указанные элементы приблизительно в 100 раз превышают электрические кулоновские силы, и являются самым мощным потенциалом в этой сфере.
Полноценное взаимосвязь ядерных частиц зачастую называют сильными взаимодействиями, который в основном проявляются в большинстве элементарных частиц путем поглощения электромагнитных составляющих.
Еще одна ключевая особенность атомных сил — их кратковременность действия. Электрические магнитные силы значительно ослабевают с увеличением общего расстояния. Ядерная интенсивность проявляется только на равных интервалах ядра (10-12 — 10-13 см). Окончательно количественная теория ядерных сил еще не разработана, так как значительные успехи в ее изучении были достигнуты только 15 лет назад.
Закон радиоактивного распада
Вероятность распада радиоактивных ядер одинакова, если в самой системе имеется большое количество одинаковых элементов. Радиоактивный распад определенного ядра считается случайным явлением, поэтому точный момент его расщепления предсказать невозможно. Однако для значительного количества частиц, находящихся в образце вещества, действует статистический закон радиоактивного тления.
Закон радиоактивного распада:
- число оставшихся атомных ядер при обычном радиоактивном распаде автоматически уменьшается с течением времени;
- период полураспада может варьироваться в зависимости от количества элементов;
- в начальный момент времени число атомных имеет одинаковые показатели.
Благодаря ядерным силам ядра обладают огромной потенциальной связью, поэтому превращение легких частиц в более тяжелые предоставляет еще особый энергетический выигрыш в расчете на один нуклон.
Большинство процессов в окружающем мире можно отнести к явлениям, действующих в открытых динамических концепциях, в противоположность учениям классического естествознания о важной роли изолированных или замкнутых систем. Это понимание крайне важно в области самоорганизации в живой и неживой Природе, а также в полноценной взаимосвязи двух компонент культуры – гуманитарной и естественнонаучной. Развитие представлений и знаний о самой сути строения мира шло и продолжает идти от открытия одного класса структурных элементов к другому, более сложному для восприятия на конкретном историческом этапе.
Читайте также:

