Реферат пиридин и его производные
Обновлено: 06.07.2024
Гетероциклическими называют соединения, молекулы
которых содержат циклы, включающие наряду с атомами углерода один или несколько
гетероатомов. Гетероциклы – самый многочисленный класс органических соединений,
включающий около 2/3 всех известных природных и синтетических органических
веществ. К гетероциклам относятся многие алкалоиды, витамины, природные
пигменты. Они являются структурными фрагментами молекул нуклеиновых кислот и
белков. Более 60% наиболее известных и широко употребляемых лекарственных
препаратов являются гетероциклическими соединениями.
1. Классификация
Гетероциклы классифицируют по следующим основным признакам:
- по природе и числу гетероатомов;
- по размеру цикла;
- по степени ненасыщенности.
- Пиролиз. При нагревании кристаллических веществ, производных пиридина с карбонатом натрия, образуется пиридин, обнаруживаемый по характерному неприятному запаху.
- Цветная реакция с лимонной кислотой и уксусным ангидридом. При нагревании препарата с кристаллической лимонной кислотой и уксусным ангидридом возникает вишневое окрашивание.
- Образование полиметиновых красителей производных глутаконового альдегида (реакция Цинке).
Наибольшее распространение в
природе имеют пяти- и шестичленные гетероциклы, содержащие в качестве
гетероатомов азот, а также кислород и серу.
По степени ненасыщенности различают насыщенные, ненасыщенные и ароматические
гетероциклы. Гетероциклы неароматического характера по своим свойствам сходны с
соответствующими ациклическими соединениями (аминами, амидами, простыми и
сложными эфирами и т.д.). 5- и 6-членные гетероциклы, замкнутая сопряженная
система которых включает (4n + 2) электрона, обладают ароматическим характером
(см. лек. №2). Такие соединения по свойствам родственны бензолу и относятся к
ароматическим гетероциклическим соединениям. Для них, как и для бензоидных
систем, наиболее характерны реакции замещения. При этом гетероатом выполняет
роль “внутренней” функции, определяющей скорость и направление реакций
замещения.
Именно ароматические гетероциклические соединения широко распространены в
природе. Далее будут рассмотрены азотсодержащие ароматические гетероциклы.
2. Пятичленные азотсодержащие гетероциклы с одним
гетероатомом
Пиррол
Пиррол – 5-членный ароматический гетероцикл с одним атомом азота.
Ароматическая система пиррола включает 6 p -электронов:
четыре p -электрона от двойных связей и два – от гетероатома.
Атом азота с неподеленной парой электронов
действует как донор, повышая электронную плотность на атомах углерода цикла.
Поэтому пиррол относят к p -избыточным гетероциклам.
Химические свойства
Химические свойства пиррола определяются наличием ароматической системы и
полярной связи N-H.
Кислотно-основные свойства
Неподеленная пара электронов азота является частью ароматического секстета
электронов, поэтому пиррол практически лишен основных свойств (). Сила пиррола как основания не может
быть точно определена, так как он является ацидофобным соединением и
полимеризуется под действием кислот.
В то же время, наличие полярной связи N-H
обуславливает слабые кислотные свойства пиррола (pK a=16,5).
Реакции электрофильного
замещения
Пиррол, как p -избыточный гетероцикл, легко вступает в реакции электрофильного замещения.
Активность пиррола по отношению к электрофилам выше, чем у бензола, и близка к
активности анилина и фенола. Электрофильное замещение направляется
преимущественно в положение 2. Из-за ацидофобности пиррола
S E -реакции проводятся в
отсутствии кислот.
Биологически активные производные
пиррола.
Тетрапиррольные соединения содержат ароматический макроцикл порфин, включающий четыре пиррольных кольца.
Замещенные порфины называют порфиринами. В виде комплексов с
металлами порфирины и частично гидрированные порфирины входят в состав важных
природных соединений – гема (простетической группы гемоглобина –
содержащегося в эритроцитах основного белка дыхательного цикла, переносчика
кислорода от органов дыхания к тканям), зеленого пигмента растений хлорофилла, витамина В12.
Индол
Индол – ароматическое гетероциклическое соединение, содержащее
конденсированные бензольный и пиррольный циклы.
Химические свойства
Химические свойства индола аналогичны свойствам пиррола. Он практически не
обладает основными свойствами, ацидофобен, является слабой NH-кислотой.
Активно вступает в реакции электрофильного замещения, при этом заместитель
вступает в положение 3 пиррольного кольца.
Биологически активные производные
индола.
Триптофан – незаменимая (не
синтезируется в организме человека) аминокислота, входящая в состав животных и
растительных белков.
Серотонин – биогенный амин,
продукт метаболизма триптофана. Обладает высокой биологической активностью,
является нейромедиатором головного мозга.
Триптамин – токсичный биогенный
амин, продукт декарбоксилирования триптофана.
Индольные алкалоиды. Алкалоиды –
гетероциклические азотсодержащие основания растительного происхождения,
обладающие ярко выраженным физиологическим действием. Индольное кольцо входит
в состав многих алкалоидов – резерпина (содержится в растениях рода
раувольфия; используется как успокаивающее и понижающее кровяное давление
средство), стрихнина (содержится в семенах растения чилибухи; используется как
тонизирующее средство), лизергиновой кислоты (алкалоид спорыньи; диэтиламид
лизергиновой кислоты — ЛСД — сильное галлюциногенное средство).
3. Шестичленные азотсодержащие гетероциклы с одним
гетероатомами.
Пиридин
Пиридин – 6-членный ароматический гетероцикл с одним атомом азота.
Ароматическая система пиридина включает 6 p -электронов и
подобна ароматической системе бензола: каждый атом цикла подает в ароматический
секстет один р-электрон. Неподеленная пара электронов азота в силу своей
пространственной ориентации в сопряжении не участвует
Атом азота действует как акцептор, понижая
электронную плотность на атомах углерода цикла. Поэтому пиридин относят к p -дефицитным гетероциклам.
Химические свойства
Химические свойства пиридина определяются наличием ароматической системы и
основного атома азота.
Основные и нуклеофильные свойства.
Пиридин проявляет слабые основные свойства (=5,23) за счет неподеленной пары электронов
азота и с кислотами образует соли пиридиния.
Атом азота пиридина проявляет также
нуклеофильные свойства и алкилируется алкилгалогенидами с образованием солей
алкилпиридиния.
Соли алкилпиридиния легко взаимодействуют с
нуклеофильными реагентами, в том числе с комплексными гидридами металлов
(NaBH 4 ), с образованием продуктов
присоединения. Подобные процессы лежат в основе механизма действия кофермента
НАД + (см. лек. № 19).
Реакции электрофильного замещения
Реакции электрофильного замещения для пиридина
идут с большим трудом, что обусловлено p -дефицитностью ядра и способностью атома азота
образовывать соли с протонными кислотами и комплексы с кислотами Льюиса, что еще
больше уменьшает нуклеофильность ядра. По способности к электрофильному
замещению пиридин напоминает нитробензол. Атака электрофилами идет по положению
3.
Реакции нуклеофильного замещения
Наиболее характерными для пиридина являются реакции нуклеофильного замещения,
которые идут по положениям 2 и 4. Примерами таких реакций является
взаимодействие пиридина с амидом натрия (реакция Чичибабаина) и со щелочами.
Окисление и восстановление
Цикл пиридина устойчив к действию окислителей. Алкилпиридины окисляются с
образованием пиридинкарбоновых кислот.
Пиридин гидрируется в жестких условиях с
образованием насыщенного гетероцикла – пиперидина.
Соли алкилпиридиния легко восстанавливаются
комплесными гидридами металлов (см. выше).
Биологически активные производные
пиридина.
Никотиновая кислота (см. выше) и
ее амид — никотинамид — две формы витамина РР. Никотинамид является
составной частью ферментативных систем, ответственных за
окислительно-восстановительные процессы в организме. Диэтиламид никотиновой
кислоты – кордиамин – эффективный стимулятор центральной нервной
системы.
Пиридоксин и пиридоксаль – различные
формы витамина В 6 ,
предшественники кофермента пиридоксальфосфата, участвующего в процессах
синтеза аминокислот из кетокислот путем трансаминирования (см. лек. №16).
Никотинамиадениндинуклеотид – кофермент, участвующий в процессах окисления и восстановления, связанных с
переносом гидрид-аниона (см. лек. №19).
Пиридиновые алкалоиды. Ядро пиридина и пиперидина входит в состав
многих алкалоидов – никотина и анабазина (алкалоиды, содержащиеся в листьях
табака; чрезвычайно токсичны, используются как инсектициды), атропина
(содержится в растениях семейства пасленовых; высокотоксичен; применяется в
медицине как средство, вызывающие расширение зрачка), кокаина (содержится в
листьях коки; стимулирует и возбуждает нервную систему, известен как одно из
первых местноанестезирующих и наркотических средств).
Хинолин и
изохинолин
Хинолин и изохинолин – ароматические гетероциклические соединения, содержащие
конденсированные бензольный и пиридиниевый циклы.
Химические свойства
Химические свойства хинолина и изохинолина аналогичны свойствам пиридина. Они
обладают основными и нуклеофильными свойствами и образуют соли при
протонировании сильными кислотами и при алкилировании алкилгалогенидами. Реакции
электрофильного замещения протекают по наименее электронодефицитному бензольному
кольцу и направляются в хинолине в положения 6 и 8. Нуклеофильные реагенты
атакуют пиридиниевый цикл хинолина в положение 2.
При каталитическом гидрировании хинолина в
первую очередь затрагивается пиридиниевый цикл. При окислении разрушается
бензольный цикл и образуется 2,3- пиридиндикарбоновая кислота.
Биологически активные производные хинолина
и изохинолина.
Действие этих препаратов основано на образование
прочных хелатных комплексов с ионами металлов. Таким образом происходит
связывание микроэлементов, необходимых для жизнедеятельности бактерий.
Хинин — алкалоид коры хинного
дерева, эффективное противомалярийное средство.
Алкалоиды опия: морфин — сильнейшее болеутоляющее средство,
наркотик; папаверин — спазмолитическе и сосудорасширяющее средство.
4. Пяти- и шестичленные гетероциклы с
двумя атомами азота.
Имидазол.
Пиразол.
Имидазол и пиразол – 5-членные ароматические гетероциклы, содержащие два
атома азота.
Ароматические системы имидазола и пиразола
включают по 6 p -электронов. При этом один из атомов азота цикла подает в ароматическую
систему один р-электрон (пиридиниевый атом азота), другой атом азота –
неподеленную пару электронов (пиррольный атом азота).
Имидазол и пиразол содержат в молекуле
кислотный центр (связь N-H) и основный центр (пиридиниевый атом азота) и
являются амфотерными соединениями. При этом основные свойства преобладают над
кислотными.
В результате присутствия в молекуле
одновременно кислотного и основного центров имидазол и пиразол ассоциированы
за счет образования межмолекулярных водородных связей.
Следствием такой ассоциации являются высокие
температуры кипения и быстрый водородный межмолекулярный обмен между
пиррольным и пиридиниевым атомами азота, который в случае замещенных
гетероциклов приводит к существованию таутомеров.
Таутомерные формы быстро превращаются друг в
друга и не могут быть выделены в индивидуальном состоянии.
Особый вид таутомерии характерен для
5-гидроксипиразолов (пиразолонов-5). В растворе они существуют в виде
равновесной смеси гидроки-(I) и оксо-(II,III) таутомерных форм.
В кристаллическом состоянии наиболее устойчива
форма II.
Биологически активные производные
имидазола и пиразола.
Гистидин — a -аминокислота, входящая в
состав многих белков, в том числе гемоглобина; в составе ферментов
осуществляет кислотный и основной катализ за счет амфотерных свойств
имидазольного цикла.
Гистамин – биогенный амин,
продукт декарбоксилирования гистидина; обеспечивает аллергические реакции
организма.
Производные пиразолона-5 — антипирин,
амидопирин, анальгин – ненаркотические анальгетики, жаропонижающие и
противовоспалительные средства.
Пиримидин
Пиримидин – 6-членный ароматический гетероцикл с двумя атомами азота.
Ароматическая система пиримидина включает 6 p -электронов и
подобна ароматической системе пиридина: каждый атом цикла, в том числе и оба
атома азота, подают в ароматический секстет один р-электрон.
Химические свойства пиримидина подобны
свойствам пиридина. Пиримидин является более слабым основанием, чем пиридин,
за счет электроноакцепторного влияния второго атома азота (=1,3). Снижение, по сравнению с
пиридином, электронной плотности на атомах углерода кольца приводит к
инертности пиримидина по отношению к электрофильным реагентам и окислителям.
Реакции нуклеофильного замещении и восстановления в ядре пиримидина, напротив,
протекают легче, чем в пиридине.
Биологически активные производные
пиримидина.
Важную биологическую роль играют гидрокси- и
аминопроизводные пиримидина.
Урацил, тимин и цитозин – нуклеиновые основания; входят в состав нуклеозидов, нуклеотидов,
нуклеиновых кислот. Существуют в таутомерных оксо- и гидроксиформах, переходы
между которыми осуществляются за счет миграции протона между кислородом и
азотом кольца.
Наиболее стабильными являются оксо-форма для
цитозина и диоксо-формы для урацила и тимина.
Оксо-формы нуклеиновых оснований образуют
прочные межмолекулярные водородные связи.
Ассоциация такого типа играет важную роль в
формировании структуры ДНК.
Барбитуровая кислота и ее производные – барбитураты (веронал, люминал) – снотворные и противосудорожные
средства.
Тиамин (витамин
В1 ) содержит два гетероцикла –
пиримидин и тиазол.
Тиамин является предшественником кофермента
кокарбоксилазы, принимающего участие в декарбоксилировании a -кетокислот и синтезе
кофермента А.
Пурин
Пурин – ароматическое гетероциклическое соединение,
содержащее конденсированные пиримидиновый и имидазольный циклы.
Пурин, подобно имидазолу, существует в виде двух
таутомерных форм. Более стабильной является форма с атомом водорода в положении
7 .
Пурин является амфотерным соединением и образует
соли с сильными кислотами (по атому азота имидазольного цикла) и щелочными
металлами (по NH-группе). При действии алкилирующих реагентов (метилиодид,
диметилсульфат) дает 9-N-алкилпроизводные. Реакции замещения у атомов углерода
ароматического кольца характерны только для замещенных пуринов.
Биологически активные производные
пурина.
Важную биологическую роль играют гидрокси- и
аминопроизводные пурина.
Аденин и гуанин — нуклеиновые основания;
входят в состав нуклеозидов, нуклеотидов, в том числе нуклеотидных коферментов,
нуклеиновых кислот.
Для аденина известны две таутомерные формы,
являющиеся результатом миграции протона между атомами азота имидазольного цикла.
У гуанина, кроме того, существуют таутомерные гидрокси- и оксоформы.
Стабильными таутомерными формами гуанина
являются оксо-формы.
Гидроксипурины – гипоксантин, ксантин,
мочевая кислота – продукты метаболизма пуриновых оснований.
Для них, как и для гуанина, характерны
таутомерные превращения между гидрокси- и оксо-формами. Наиболее стабильными
являются оксо-формы.
Мочевая кислота – конечный продукт метаболизма
пуриновых соединений в организме. Она выделяется с мочой. Соли мочевой кислоты – ураты – откладываются в суставах при подагре, а также в виде почечных
камней.
In vitro аденин и гуанин могут быть превращены
соответственно в гипоксантин и ксантин дезаминированием под действием азотистой
кислоты.
Такие превращения пуриновых оснований в составе
нуклеиновых кислот приводят к мутациям.
Пуриновые алкалоиды – кофеин, теофиллин,
теобромин – метилированные по азоту производные ксантина; содержатся в чае,
кофе, какао-бобах.
Кофеин – эффективное средство, возбуждающее
центральную нервную систему и стимулирующее работу сердца. Теофиллин и теобромин
менее эффективны, однако обладают сильными мочегонными свойствами.
Пиридин С5Н5N – простейший шестичленный ароматический гетероцикл с одним атомом азота. Его можно рассматривать как аналог бензола, в котором одна группа СН заменена на атом азота.
Электронное строение молекулы пиридина
Электронное строение молекулы пиридина сходно со строением бензола. Атомы углерода и азота находятся в состоянии sp 2 -гибридизации. Все s-связи C–C, C–H и C–N образованы гибридными орбиталями, углы между ними составляют примерно 120°. Поэтому цикл имеет плоское строение. Шесть электронов, находящихся на негибридных р-орбиталях, образуют p-электронную ароматическую систему.
Из трех гибридных орбиталей атома азота две образуют s-связи С–N, а третья содержит неподеленную пару электронов, которая не участвует в образовании p-электронной системы.
Физические свойства
Пиридин – бесцветная жидкость с характерным неприятным запахом, Ткип= 115 0 С. Хорошо растворяется в воде и органических жидкостях. Ядовит! Вдыхание его паров может привести к тяжелому поражению нервной системы.
Химические свойства
Химические свойства пиридина определяются наличием ароматической системы и атома азота с неподеленной электронной парой.
Основные свойства
Неподеленная электронная пара атома азота в молекуле не участвует в образовании единой π-электронной системы, поэтому пиридин подобно аминам, проявляет свойства основания. Пиридин – более слабое основание, чем алифатические амины.
1. Взаимодействие с водой
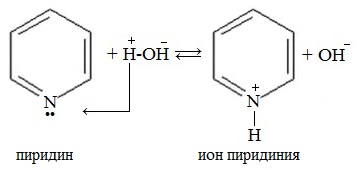
Водный раствор пиридина окрашивает лакмус в синий цвет.
2. Взаимодействие с кислотами
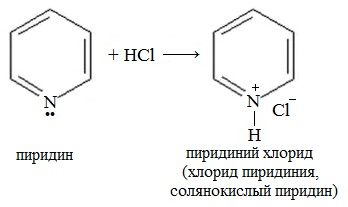
При взаимодействии пиридина с сильными кислотами образуются соли пиридиния.
Ароматические свойства
1. Реакции электрофильного замещения
Наряду с основными свойствами пиридин проявляет свойства ароматического соединения.
Нитрование
Подобно бензолу, пиридин вступает в реакции электрофильного замещения, однако его активность в этих реакциях ниже, чем у бензола, из-за большой электроотрицательности атома азота. Азот как более электроотрицательный элемент оттягивает электроны на себя и понижает плотность электронного облака в кольце, в особенности в положениях 2, 4 и 6 (орто- и пара- положения), создавая частичный отрицательный заряд в мета-положении.
Атом азота в реакциях электрофильного замещения ведет себя как заместитель II рода, электрофильное замещение идет в положение 3 (мета-положение).
Поэтому реакция нитрования пиридина проходит в более жестких условиях, чем у бензола ( при 300 0 С) и с низким выходом.
2. Реакции присоединения (гидрирование)
Как и бензол, пиридин может присоединять водород в присутствии катализатора с образованием насыщенного соединения пиперидина.
Пиперидин представляет собой циклический вторичный амин и является гораздо более сильным основанием, чем пиридин.
3. Реакции нуклеофильного замещения
Аминирование
В отличие от бензола, пиридин способен вступать в реакции нуклеофильного замещения, поскольку атом азота оттягивает на себя электронную плотность из ароматической системы, и орто-пара-положения по отношению к атому азота обеднены электронами. Так, пиридин может реагировать с амидом натрия, образуя смесь орто- и пара- аминопиридинов (реакция Чичибабина).
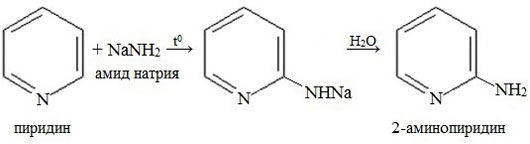
4. Гомологи пиридина по свойствам похожи на гомологи бензола. Так, при окислении боковых цепей образуются соответствующие карбоновые кислоты.
Пиридин, как и бензол, устойчив по отношению к окислителям: он не обесцвечивает раствор перманганата калия даже при нагревании.
Получение
1. Выделение из каменноугольной смолы
Пиридин выделяют из каменноугольной смолы, в которой его содержание составляет 0,08%.
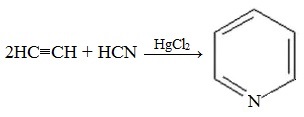
2. Синтез из ацетилена и циановодорода
В лабораторных условиях пиридин можно синтезировать из синильной кислоты (циановодород) и ацетилена:
Биологическая роль
Гомолог пиридина – 3-метилпиридин (β-пиколин) – при окислении образует никотиновую кислоту:
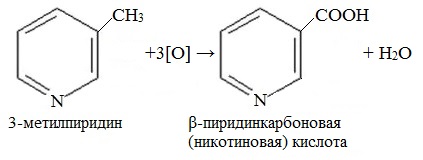
Никотиновая кислота и ее амид – никотинамид
представляют собой две формы витамина РР, который применяется для лечения пеллагры (кожное заболевание).
Многие производные пиридина играют важную роль в природе и жизни человека: они являются витаминами, биологически активными веществами, лекарственными препаратами, красителями и т.п.
Проявляя основные свойства, пиридин и его гомологи известны под общим названием пиридиновые основания.

Рубрики: Гетероциклические соединения
К этой группе относятся ЛС как природного, так и синтетического происхождения, обладающие различным фармакологическим эффектом. По химическому строению их можно разделить на 4 подгруппы:
производные пиридин-4-карбоновой (изоникотиновой) кислоты (табл. 50);
производные пиридин-З-карбоновой (никотиновой) кислоты (табл, 51);
производные пиридинметанола и оксипиридина (табл. 52);
производные дигидропиридина (табл. 53).






Химические свойства и анализ качества
Общие реакции на незамещенный цикл пиридина
Данная реакция характерна для производных пиридина, имеющих свободные 2-е и 6-е положения относительно гетероатома азота. Суть реакции заключается в расщеплении пиридинового цикла при действии 2,4-динитро- хлорбензола в щелочной среде с образованием производного глутаконового альдегида. Сначала происходит образование соли пиридиния (I), которая под действием гидроксида натрия после размыкания пиридинового цикла превращается в производное глутаконового альдегида (II), окрашенное в бурый или красный цвет, Производные глутаконового альдегида – малоустойчивые соединения, в результате гидролиза превращающиеся в глутаконовый альдегид (III), существующий в 2 таутомерных формах. Натриевая соль енольной формы глутаконового альдегида имеет желтую окраску:

В качестве расщепляющего агента вместо 2.4-динитрохлорбензола можно использовать другие соединения, например хлорродан (получаемый из роданида аммония и хлорамина Б) или бромродан. При этом также образуется глугаконовый альдегид, который далее конденсируют с анилином для получения окрашенного соединения:

Реакции кислотно-основного типа
ЛС группы пиридина в основном имеют амфотерный характер, обусловленный соответствующими структурными элементами их молекул.
Как азотсодержащие органические основания препараты этой группы образуют комплексные соединения с общеалкалоидными осади тельными реактивами (реактивами Люголя, Драгендорфа, Майера, растворами фосфорно-молибденовой, кремневольфрамовой кислот, танином и др.).
Лекарственные вещества данной группы, содержащие функциональные группы кислотного характера (карбоксильную, амидную, фенольную и др.), вступают во взаимодействие с солями тяжелых металлов с образованием солей (чаще комплексных), имеющих характерный внешний вид.
Анализ качества индивидуальных лекарственных веществ
Кислотно-основные свойства. Препарат является амфолитом. Основные свойства связаны с наличием пиридинового атома азота и аминогруппы в гидразиновом фрагменте, кислотные — с наличием амидной группы.
Восстановительные свойства. Восстановительные свойства изониазида обусловлены присутствием остатка гидразина. ГФ для идентификации препарата предлагает реакции окисления изониазида аммиачным раствором серебра нитрата и меди сульфата:

Если реакцию проводить в нейтральной среде, сначала происходит образование комплексной соли, а затем (при нагревании) процесс переходит в окислительно-восстановительный с выделением металлического серебра:

Реакция с меди сульфатом также проходит в 2 стадии. За счет кислотных свойств изониазида сначала образуется комплексная соль голубого цвета. При последующем нагревании происходит окисление препарата (как гидразида) с получением желто-зеленого, а затем грязно-желтого окрашивания с одновременным выделением пузырьков газа:

Методики количественного определения, ГФ регламентирует методику обратной йодометрии в присутствии небольшого количества щелочи и натрия гидрокапроната (для нейтрализации образующейся кислоты йодоводородной).
Суммарное уравнение реакции:

Избыток стандартного раствора йода оттитровывают раствором натрия тиосульфата:

Постадийно процесс можно выразить следующим образом:

В МФ приведен броматометрический метод количественного определения изониазида.
Как вещество основного характера изониазид можно количественно определять и методом кислотно-основного титрования в неводной среде. В среде кислоты уксусной ледяной при добавлении кислоты хлорной образуется диперхлорат изониазида:

Но поскольку ледяная уксусная кислота содержит некоторое количество уксусного ангидрида, изониазид частично ацетилируется по аминогруппе гидразинового фрагмента. Поэтому в колбу для титрования вместе с ледяной уксусной кислотой добавляют 20— 25% уксусного ангидрида и образовавшийся ацетилизониазид титруют как однокислотное основание хлорной кислотой:

Фтивазид
Кислотно-основные свойства. Препарат является амфолитом, и эго свойство ГФ использует при испытании подлинности. При добавлении к спиртовому раствору фтивазида нескольких капель раствора щелочи светло-желтое окрашивание переходит в ярко-желтое (образование фенолята). Последующее постепенное прибавление раствора соляной кислоты приводит сначала к ослаблению окрашивания (молекулярная форма), затем — вновь к усилению до ярко-желтого (солевая форма но основному центру).
Как гидразон фтивазид подвергается гидролитическому расщеплению по амидной и азометиновой группам с образованием изоникотиновой кислоты, гидразина и ванилина (обнаруживается по характерному запаху). Эта реакция также принята ГФ в качестве испытания подлинности:

Восстановительные свойства фтивазида проявляются после гидролиза.
Фтивазид может также вступать в различные реакции, характерные для присутствующих в его молекуле фрагментов и функциональных групп (например, в реакцию Пинке по пиридиновому фрагменту; окислению гидразина после гидролиза реактивом Фелинга, реакциям на фенольный гидроксил и др,).
Количественное определение фтивазида проводят методом кислотно-основного титрования в среде ледяной уксусной кислоты (титрант – 0,1 н, раствор хлорной кислоты) или с помошью окислительно-восстановительных методов, например йодатометрии. Препарат сначала подвергают кислотному гидролизу кипячением с раствором соляной кислоты. По окончании гидролиза добавляют хлороформ и титруют образовавшийся свободный гидразин 0,1 н. раствором КIO3 до обесцвечивания хлороформного слоя:

Ниаламид
Подлинность препарата определяют по наличию пиридинового фрагмента нагреванием с уксусным ангидридом и лимонной кислотой (появляется вишневое окрашивание), а также взаимодействием с реактивом Фелинга на остаток гидразина (сначала появляются пузырьки газа, затем выпадает красный осадок Сu2О).
Количественно ниаламид определяют нитритометрически. Методика основана на образовании нитрозопроизводного при титровании раствора препарата в присутствии кислоты хлороводородной 0,1 М стандартным раствором натрия нитрита:

В качестве внутреннего индикатора используют тропеолин 00 в смеси с метиленовым синим. Возможно применение внешнего индикатора (йод-крахмальная бумага).
Кислота никотиновая
Наличие в молекуле пиридинового атома азота (центр основности) и карбоксильной группы (центр кислотности) обусловливает амфотерный характер препарата. В качестве испытания подлинности предусмотрено применение ИК- и УФ-спектроскопии, а также реакции на пиридиновый цикл (нагревание порошка препарата с безводным карбонатом натрия, при этом появляется характерный неприятный запах пиридина), и на карбоксильную группу (образование нерастворимой, окрашенной в синий цвет комплексной соли с ацетатом меди).
Поскольку препарат проявляет достаточно выраженные кислотные свойства и хорошо растворяется в воде, его количественное определение проводят методом кислотно-основного титрования в водной среде (титрант — 0,1 М раствор едкого натра).
Лекарственная форма кислоты никотиновой (1% раствор для инъекций) содержит, кроме действующего вещества, гидрокарбонат натрия. Поэтому применение кислотно-основного титрования невозможно.
Данную лекарственную форму количественно определяют куприметрически. При этом к раствору препарата добавляют раствор сульфата меди, выпавший осадок отфильтровывают и в фильтрате определяют избыток реактива:

Так как меди сульфат в данной методике не является титрованным раствором, обязательно проведение контрольного опыта.
Никотинамид
Свойства никотинамида и никотиновой кислоты во многом схожи, Испытание подлинности препарата, отличающее его от кислоты никотиновой, заключается в образовании аммиака при щелочном гидролизе никотинамида.
Эта же реакция лежит в основе неофининального количественного определения препарата модифицированным методом Кьель- даля. Навеску препарата кипятят в растворе щелочи в аппарате Кьельдаля и выделяющийся аммиак перегоняют с водяным паром в раствор борной кислоты:

Борная кислота в водном растворе частично существует в виде гидратной формы, которая улавливает аммиак.

Образовавшийся борат аммония титруют 0,1 М раствором кислоты хлороводородной:

Параллельно проводят контрольный опыт.
Количественное определение никотинамида по ГФ X проводят методом кислотно-основного титрования в среде ледяной уксусной кислоты (титрант – 0,1 М раствор хлорной кислоты).
Диэтиламид кислоты никотиновой
Препарат отличается от предыдущих агрегатным состоянием (маслянистая жидкость).
Подлинность препарата определяют физико-химическими методами (ИК- и УФ-спектроскопия), а также реакциями щелочного гидролиза (выделяется диэтиламин с характерным запахом) и комплексообразования (образование синего комплекса с сульфатом меди, а при последующем добавлении раствора роданида аммония – двойного нерастворимого комплексного соединения ярко-зеленого цвета).
Количественное определение – метод кислотно-основного титрования в среде уксусного ангидрида (титрант – 0,1 М раствор хлорной кислоты). Лекарственную форму препарата (25% водный раствор) количественно определяют рефрактометрически.
Пикамилон
Испытания подлинности включают регистрацию УФ-спектра поглощения, а также проведение реакции на пиридиновый цикл и аминокислотный фрагмент препарата. Наличие цикла пиридина подтверждают реакцией с уксусным ангидридом и лимонной кислотой при нагревании (появляется интенсивное фиолетово-красное окрашивание). Нингидриновую пробу аминокислотной части выполняют после предварительного гидролиза амидной группы.
Количественное определение проводят методом кислотно-основного титрования в неводной среде (смесь ледяной уксусной кислоты и уксусного ангидрида; титрант – 0,1 М раствор хлорной кислоты).
Пиридоксина гидрохлорид, пиридоксальфосфат и пиридитол
Указанные лекарственные вещества являются амфотерными соединениями, при этом характер спектров их поглощения в УФ- области зависит от значения pH среды:

Реакции на характерные функциональные группы. Фенольный гидроксил открывают взаимодействием с раствором хлорида железа (III), образованием ауринового красителя с реактивом Марки, азокрасителей и индофенолов. Индофенольная реакция с 2,6-дихлорхинонхлоримидом является одной из реакций подлинности на пиридоксин гидрохлорид, принятых ГФ.

Получившийся индофеноловый краситель извлекают в слой бутанола, который окрашивается в голубой цвет.
Наличие альдегидной группы в пиридоксальфосфате обнаруживают реакцией образования основания Шиффа с фенилгидразином (выпадает желтый хлопьевидный осадок).
Дисульфидную группу в пиридитоле идентифицируют после нагревания препарата с цинковой пылью на водяной бане. Получившийся в результате реакции сульфид цинка взаимодействует с фосфорно-молибденовой кислотой в присутствии концентрированного раствора аммиака с образованием продукта синего цвета.
Количественное определение индивидуальных пиридоксина гидрохлорида, пиридоксальфосфата и пиридигола проводят методом кислотно-основного титрования в неводной среде (ледяная уксусная кислота и титрант – 0,1 М раствор хлорной кислоты). Пиридоксина гидрохлорид можно количественно определять алкалиметрически.
Пармидин
Испытание подлинности пармидина связано в первую очередь с тем, что по химическому строению препарат является уретаном. Наличие уретановых фрагментов подтверждают щелочным гидролитическим расщеплением при нагревании:

Пиридиновый цикл определяют реакцией препарата с лимонной кислотой и уксусным ангидридом при назревании (появляется желтое окрашивание, переходящее в красное).
Количествен ное определение — метод кислотно-основного титрования в среде ледяной уксусной кислоты (титрант – 0,1 М раствор хлорной кислоты).
Нифедипин
Подлинность препарата подтверждают физико-химическими методами (ИК- и УФ-спектроскопия).
Наличие нитро-группы, обладающей электроноакцепторными свойствами, обусловливает более интенсивное окрашивание при взаимодействии нифедипина в среде диметилформамида с 0,1 М спиртовым раствором гидроксида калия.
Как сложный эфир препарат вступает в реакции гидролитического расщепления и гидроксамовую пробу.
Количественное определение проводят с помощью УФ-спектрофотометрии с применением стандартного образца лекарственного вещества.
К производным пиридина относятся ЛС природного и синтетического происхождения с разным фармакологическим действием. В основе химической структуры ЛС рассматриваемой группы находится пиридин — шестичленный гетероцикл с одним атомом азота, который участвует в образовании единой замкнутой системы из 6 я-электронов.
Из-за отрицательного индукционного эффекта атома азота электронная плотность у атомов углерода, особенно в положениях 2, 4 и 6, понижена (я-дефицитный гетероцикл). Атом азота с таким электронным строением образует основный центр (рКа = 5,20) и называется пиридиновым. По сравнению с алифатическими аминами основные свойства пиридина выражены значительно слабее.
Основные свойства пиридина и его производных проявляются при взаимодействии с соединениями, способными принимать свободную пару электронов пиридинового азота на свою незаполненную орбиталь. Так, при взаимодействии с протоном в водных растворах кислот они образуют пиридиниевый катион КС5Н4>Ш+. С кислотами Льюиса образуются координационные соединения, с алкилгалогенидами — алкилпиридиниевые соли.
По химическому строению ЛВ рассматриваемой группы можно разделить на следующие группы (табл. 11.4):
1) производные пиридин-3-карбоновой (никотиновой) кислоты. К ним относятся кислота никотиновая, никотинамид, кордиамин, пикамилон;
2) производные пиридин-4-карбоновой (изоникотиновой) кислоты. В эту группу входят изониазид, фтивазид, ниаламид;
3) производные пиридинметанола. К ним относятся пиридоксина гидрохлорид (В6), пиридоксаль фосфат, пиридитол, пармидин, эмоксипин;
4) производные дигидропиридина. К ним относится нифедипин (коринфар).
Рассмотрим структурные элементы ЛС, производных пиридина:
Некоторые производные пиридина являются природными веществами. Например, никотинамид, входит в состав НАДФ, а пиридоксин представляет собой витамин В6. Исходным сырьем для получения ЛС, производных пиридина, является каменноугольная смола, содержащая метилпири-
Гидразид 4-пиридинкарбоновой кислоты
Применяют для лечения всех форм и локализаций активного туберкулеза у взрослых и детей.
Таблетки по 0,1; 0,2 или 0,3 г; порошок; 10 % раствор в ампулах по 5 мл.
4-Пиридинкарбоновой кислоты [(4-гид- рокси-3-метоксифенил)метилен]гидразид
Применяют для лечения всех форм и локализаций активного туберкулеза у взрослых и детей.
Порошок; таблетки по 0,1; 0,3 или 0,5 г в упаковке по 100 штук.
| * ЛС в учебной программе отсутствует. |
2-[3-оксо-3-[(фенилметил)амино]пропил] гидразид 4-пиридинкарбоновой кислоты >°
Применяют в психиатрической практике при депрессивных состояниях различных нозологических форм, сочетающихся с вялостью, заторможенностью, безынициативностью.
Таблетки (драже) по 0,025 (25 мг).
Применяют для восполнения дефицита витамина РР, как вазодилатирующее, гиполипидемическое, гиперхолесте- ринемическое действие.
Для предупреждения и лечения пеллагры (авитаминоз РР). Используют при спазмах сосудов конечностей, головного мозга, при вяло заживающих ранах, язвах, невритах лицевого нерва, инфекционных заболеваниях, гастритах с пониженной кислотностью, хронических колитах, гепатитах, циррозе печени.
Порошок; таблетки по 0,05 г (в лечебных целях); 0,1 % раствор в ампулах по 1 мл; рН раствора для инъекций 5,0-7,0.
Порошок; таблетки по 0,015 г (в профилактических целях); и по 0,005 и 0,025 г (в лечебных целях); 1 % раствор в ампулах по 1 мл и 2 мл.
(Кордиамин — СогсИаттит) Ы,М-Диэтил-3-пиридинкарбоксамид
Применяют при острых и хронических расстройствах кровообращения, при понижении сосудистого тонуса и ослаблении дыхания у больных с инфекционными заболеваниями и у выздоравливающих при остром коллапсе и асфиксии, при шоковых состояниях, возникающих во время хирургических вмешательств и в послеоперационном периоде.
В ампулах по 1 и 2 мл для инъекций; в шприц-тюбиках по 1 мл; для приема внутрь — во флаконах.
Читайте также:

