Реферат органические и неорганические материалы
Обновлено: 05.07.2024
Неорганические. Решающее значение имеют изделия и материалы на основе минерального сырья – горных пород, шлаков, стекла и асбеста.
1) Минеральная вата – теплоизоляционный материал, получаемый из расплава горных пород или металлургических шлаков и состоящих из стекловидных волокон и различных неволокнистых включений в виде капель силикатного расплава и микроскопических обломков волокон. Длина волокон мин. ваты в зависимости от способа производства бывает от 2 до 60мм. Теплопроводность – 0,042-0,046 Вт/(м* о С), температуроустойчивость – не менее 600 о С. В зависимости от плотности мин. вату выпускают трех марок – 75,100,125. Обладает высокой морозостойкостью, малой гигроскопичностью. Теплоизоляционные маты – на основе минерального волокна предназначены для тепловой изоляции строительных конструкций, промышленного оборудования и трубопроводов тепловых сетей. Теплоизоляционные полужесткие плиты на основе мин. волокна применяют в качестве эффективного теплоизоляционного материала в строительных конструкциях, трубопроводов и холодильных установок. Теплоизоляционные жесткие плиты и изделия на основе минерального волокна. Жесткие мин. изделия изготовляют в виде плит, скорлуп и полуцилиндров.
2) Стеклянная вата – это волокнистый теплоизоляционный материал, получаемый из расплавленной стекломассы. Стеклянная вата имеет повышенную химическую стойкость, теплопроводность при 25 о С – 0,05 Вт/(м* о С), она не горит и не тлеет, плотность в рыхлом состоянии не должна быть более 130 кг/м 3 . Структура прядей должна быть рыхлой. Стеклянную вату применяют для изготовления теплоизоляционных материалов и изделий и теплоизоляции при температуре изолируемых поверхностей от -200 до +450 о С. Изделия из стекловолокна: 6 видов плит и маты. Вата из супертонкого волокна, а также изделия на ее основе как хороший звукоизоляционный материал в последние года находит всё большее применение в строительстве. Базальтовое супертонкое стекловолокно явл. высококачественным материалом для тепловой изоляции, фильтрации, а также для изготовления теплостойких бумаг, картонов и матов. Пеностекло явл. хорошим теплоизоляционным высокопористым материалом ячеистого строения. Плиты из пеностекла применяют для теплоизоляции ограждающих конструкций здания, декоративной отделки интерьеров, изоляции поверхностей с температурой эксплуатации до 180 о С.
3) Вспученный перлит – это пористый сыпучий материал, получающийся вспучиванием природного перлита во вращающихся или шахтных печах при температуре 900-1200 о С. Вспученный перлит в виде песка представляет собой зерна белого или
серого цвета с воздушными замкнутыми порами. Перлитовый песок применяют в растворах и бетонах, идущих для приготовления теплоизоляционных изделий, огнезащитных штукатурок, а также для теплоизоляционных засыпок.
4) Вспученный вермикулит – получают ускоренным обжигом до вспучивания горной породы вермикулита из группы гидрослюд. Вермикулит при нагревании до 1000-1100 о С выделяет кристаллизационную воду и быстро вспучивается.
Органические – производят из различного растительного сырья: отходов древесины, торфа, очесов льна, конопли, из шерсти животных, а также на основе полимера. Многие орг. теплоизоляционные материалы подвержены быстрому загниванию, порче различными насекомыми и способны к возгоранию, поэтому их предварительно подвергают обработке. 1) Древесноволокнистые плиты (ДВП) – применяют для тепло- и звукоизоляции ограждающих конструкций. Изготовляют их из распушенной древесины или иных растительных волокон - неделовой древесины, отходов лесоперерабатывающей промышленности, костры, соломы, камыша, хлопчатника. 2) Камышитовые плиты, или просто камыш, применяют для теплоизоляции ограждающих конструкций зданий III класса, при строительстве малоэтажных жилых домов, небольших производственных помещений в сельскохозяйственном строительстве. Это теплоизоляционный материал в виде плит, спрессованных из стеблей камыша, которые затем скрепляются стальной оцинкованной проволокой. 3) Торфяные теплоизоляционные изделия – изготовляют в виде плит, скорлуп и сегментов и используют для теплоизоляции ограждающих конструкций зданий III класса и поверхностей промышленного оборудования и трубопроводов от -60 до +100 о С. Сырьем для них служит для их производства служит малоразложившийся верховой торф, имеющий волокнистую структуру, что благоприятствует получению из него качественных изделий путем прессования 4) Цементно-фибролитовые плиты – теплоизоляционный материал, полученный из затвердевшей смеси портландцемента, воды и древесной шерсти. древесная шерсть выполняет роль армирующего каркаса. 5) Фибролитовые плиты на ПЦ применяют в качестве теплоизоляционного, теплоизоляционно-конструктивного и акустического материала для стен, перегородок, перекрытий и покрытий зданий. Фибролитовые плиты получают также формованием и тепловой обработкой орг. коротковолнистого сырья. 6) Пробковые теплоизоляционные материалы (плиты, скорлупы, сегменты) применяют для теплоизоляции ограждающих зданий, холодильников и поверхностей холодильного оборудования. Изготовляют их путем прессования измельченной пробковой крошки, которую получают как отход при производстве закупорочных пробок из коры пробкового дуба. 7) Теплоизоляционные пенопласты в виде газонаполненных пластмасс, а так же минераловатных и стекловатных изделий изготовляют на полимерном связующем. 8) Древесностружечные плиты ДСП –получают горячим прессованием массы состава 90%, древесной шерсти 7-9%,синтетические смолы + антисептик + антипирены. 9) Войлочные материалы изготовляют из грубой конской или коровьей шерсти с примесью льняной пакли. Войлок используют при утеплении стен и потолков, помещая его под штукатурку. Войлок не гниет и не горит, но он может тлеть, имеет большое водопоглощение, служит средой для размножения моли.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Институт физики и химии
Кафедра физической химии
Реферат по дисциплине Химия строительных материалов,
Выполнил студент 4-го курса,
специальности ХФиММ: Кутюшев Д. Р.
Проверил преподаватель: Арасланкин С. В.
Вяжущие вещества – вещества, затвердевающие в следствии действия различных физико-химических процессов, иными словами, они работают в качестве цементирующего элемента. Переходя из вязкой пастообразной фазы в камневидную фазу, вяжущие вещества соединяют друг с другом частицы какого-нибудь заполнителя (песка, каменной крошки, щебня и прочих). Данная функциональная черта вяжущих веществ, нашла довольно обширное применение в строительной промышленности, их используют в рецептурах растворов – кладочных, штукатурных и специализированных, а кроме того бетонов, силикатного кирпича, асбестоцементных и других необожженных строительных материалов искусственного происхождения[2].
Вяжущие вещества классифицируются на органические и неорганические (минеральные) вещества. К органическому классу вяжущих веществ, принадлежат битумы, дегти, животные клеи, различные высокомолекулярные соединения. Они все переходят в эксплуатационную фазу в следствии воздействия повышенных температур, расплавления, либо растворения в разных органических растворителях. К неорганическому классу вяжущих веществ, принадлежат строительный гипс, известь, различные виды цементов, растворимое стекло и прочие. Неорганические вяжущие вещества, как правило, затворяются водой, а иногда и водными растворами различных солей. Их классифицируют на воздушные, кислотостойкие, гидравлические и вяжущие вещества автоклавного твердения. Также вяжущие вещества подразделяются на множество разных марок. Марка вяжущего вещества говорит о его прочностных показателях при сжатии, в стандартных условиях эксперимента. Еще их классифицируют по быстроте затвердевания. Самую большую скорость затвердевания имеют вяжущие вещества на основе гипса (до нескольких часов). Самую маленькую скорость затвердевания имеет воздушная известь (не один месяц)[5].
О примитивных вяжущих веществах знали уже за несколько тысячелетий до нашей эры, их прародителем была необожженная глина. Уже в древнем династическом Египте, в эпоху властвования фараонов, при строительстве пирамид активно употребляли вяжущие вещества, которые получали из гипса. Наглядным примером является известная египетская пирамида Хеопса, построенная приблизительно 4000 лет назад, которая возведена именно на гипсовом растворе. Тогда вяжущие вещества получали в следствии обжига гипсового камня и известняковых пород. Римляне для повышения стойкости к воде, к ним добавляли различные сильно измельченные минеральные порошки, например вулканический пепел, туф или пемзу. В древней Руси вяжущие вещества на основе гипса начали применять приблизительно в XI веке, при строительстве Софийского храма в Киеве[1]. В растворы, обладающие хорошими гидравлическими показателями, наши предки также добавляли бычью кровь, творожную массу, яйца и прочие похожие материалы. В 1584 году в Москве был издан Каменный приказ, который наряду с заготовкой строительного камня и выпуском кирпича ведал также изготовлением извести.
Большой вклад в развитие производства вяжущих веществ внесли англичане. В 1796 году Джеймс Паркер получил патент на производство романцемента. А в 1824 году Джозефом Аспдином был заявлен патент на производство портландцемента[1].
В нашей стране первые рецептуры по приготовлению вяжущих веществ были разработаны в XVIII веке. Данные рецептуры были обобщенным плодом многолетних исследований многих русских ученых.
Так, Василий Михайлович Севергин говорил о целесообразности применения известняковых пород с примесями глин и мергелистых пород для приготовления вяжущих веществ, обладающих хорошими гидравлическими свойствами[2].
Совершенно новым стали правила технологии получения гидравлических вяжущих, представленные в научной работе русского военного техника Егора Герасимовича Челиева, изданной в XIX веке. В своих исследованиях он приводит описание изготовления гидравлического вяжущего, полученного из извести и глины (в отношении 1:1) смешанных в присутствии воды; изготовления кирпичей и обжига их в горне на сухих дровах (примерно при температуре 1100 – 1200 ° C ). Уже тогда Егор Челиев предложил применять гипс при затворении получаемого им цемента водой, как для повышения устойчивости к воздушной среде только что обожженного продукта, так и для повышения прочности лежавшего без употребления в течение долгого времени цемента[1].
В XIX – XX веках в усовершенствование базы по производству вяжущих большой вклад внесли исследования Дмитрия Ивановича Менделеева, а также работы таких великих ученых, как Алексей Романович Шуляченко, Иван Григорьевич Малюга, Николай Николаевич Лямин, Николай Аполонович Белелюбский[1].
1. Неорганические вяжущие
Неорганическими вяжущими называют порошкообразные вещества высокой степени перемола, которые переходят в следствии затворения водой в вязкотекучее сходное с тестом вещество, затвердевающее при конкретных условиях до камневидного состояния.
По своему составу, важным показателям и применению выделяют несколько разновидностей неорганических вяжущих: воздушные, кислотоустойчивые, гидравлические и вяжущие автоклавного затвердевания. Каждую из приведенных групп подразделяют еще на некоторое количество различных подгрупп[2].
Таблица 1. Классификация минеральных вяжущих
В контакте с воздухом, затворенные воздушные вяжущие схватываются, затвердевают и упрочняются. В конечном итоге выходит камневидный материал, долго сохраняющий свои прочностные показатели, но исключительно на воздухе. Эти материалы, в силу особенности своих свойств, не используются ни в каких сооружениях, кроме наземных, в коих исключено действие не воздушных сред. К этому классу принадлежат строительная воздушная известь, гипсовые и магнезиальные вяжущие[2].
Кислотостойкие вяжущие после затвердевания в воздухе некоторый период сохраняют свои прочностные характеристики под влиянием неорганических кислот. К данному классу вяжущих принадлежат кислотостойкий цемент и прочие[ 1 ].
Затворенные водой, гидравлические вяжущие обладают особенностью, увеличивать свои прочностные характеристики в воде. По клинкерному и вещественному составу бывают: цементы на базе портландцементного клинкера (портландцемент, портландцемент с неорганическими добавками) и цементы на базе глиноземистого клинкера (глиноземистый и гипсоглиноземистый).
Вяжущие автоклавного твердения превращаются в камень исключительно в автоклавных условиях, то есть при паровом давлении 0,9 – 1,3 МПа и температуре 440 – 470 K . К ним принадлежат, к примеру известково-кремнеземистые, известково-пуццолановые, известково-зольные вяжущие и прочие [2].
Важными показателями вяжущих являются плотность, насыпная плотность, показатель водопотребления, быстрота схватывания и твердения, прочностные показатели.
Плотность сильно зависит от класса неорганического вяжущего. Больше остальных у негашеной извести – 3,1 – 3,3 г/см 3 и портландцемента – 3 – 3,2 г/см 3 , меньше всего у гипсовых вяжущих – 2,6 – 2,7 г/см 3 .
Насыпная плотность вяжущих сильно зависит от основной плотности и степени перемола порошка. Насыпная плотность портландцемента – 900 – 1100 кг/м 3 .
Водопотребление – это объем воды, нужный для достижения вязкотекучего тестообразного состояния. Маленький показатель водопотребления дает лучшее качественные и прочностные характеристики. Самый маленький показатель у портландцемента – 24 – 28%, самый большой у вяжущих на базе гипса – 50 – 80 %.
Время схватывания – это время, за которое затворенное неорганическое вяжущее, поддерживает свои показатели пластичности. Очень скоро схватываются гипсовые вяжущие: начинают через 4 – 5 минут, заканчивают через 10 – 15 минут после затворения водой. Очень долго схватывается гидратная известь, аж через 3 – 5 суток.
Быстрота затвердевания зависит от взаимодействия компонентов неорганического вяжущего с водой. У гипсовых вяжущих скорость затвердевания около 1 – 2 часов. Гашеная известь затвердевает не один год. Цементы по быстроте твердения выделяют: обычные (с нормировкой прочностных показателей за срок 28 суток), быстротвердеющие (с нормировкой прочностных показателей за срок 1 – 28 суток), быстротвердеющие (с нормировкой прочностных показателей за 1 сутки и меньше).
Прочность показывает способность вяжущего сохранять свои свойства под действием различных внешних нагрузок. Прочностные показатели камневидной фазы являются зависимыми от нескольких условий: вида вяжущего, тонкости его перемола, показателя водопотребления, быстроты твердения. По прочностным характеристикам выделяют цементы: высокопрочные (550 – 600 и более), повышенной прочности (500), рядовые (300 – 400), низкомарочные (менее 300). Большие прочностные показатели имеют вяжущие автоклавного твердения. А вот, прочностные показатели воздушных вяжущих намного меньше (5 – 20 МПа)[ 5 ].
1.1 Воздушные вяжущие
Затворенные водой воздушные вяжущие затвердевают и сохраняют прочностные характеристики исключительно в воздухе. Под влиянием водной среды такие материалы достаточно быстро подвергаются разрушению. Из-за этого воздушные вяжущие используются только при возведении наземных сооружений. К таким материалам принадлежат гипсовые вяжущие, воздушная известь (негашеная комовая известь, гашеная молотая известь), магнезиальные вяжущие, кислотостойкий цемент, растворимое стекло и прочие[2].
Гипсовые вяжущие классифицируются на две группы – низко обжиговые и высоко обжиговые. Исходным сырьем для них служит гипсовый камень – двухводный гипс – CaSО 4 ·2H 2 О, и ангидрит, в его состав входит безводный гипс – CaSО 4 , а кроме того отходы химической индустрии, содержащее двухводный или безводный сернокислый кальций. Чистый двухводный гипс состоит из 32,56% СаО; 46,51% SО 3 и 20,93% воды, а ангидрит – из 41,19% СаО и 58,81% SО 3 . Растворимость двухводного гипса, равна 2,05 грамм в одном литре воды при 20 ° С. Растворимость ангидрита – один грамм на один литр воды[ 3 ].
Магнезит широко распространенный минерал, который назван от области Магнесия (Фессалия, Греция), где был впервые обнаружен. В природных условиях магнезит существует в двух разновидностях – кристаллическом и аморфном. Прочностные показатели и того и другого вида магнезита по шкале Мооса находится в интервале 3,5 – 4,5; плотность 2,9 – 3,1. Состав магнезита 47,82% оксида магния и 52,18% CO 3 . В природном магнезите имеют место разные примеси: глинистые породы, углекислый кальций и прочие. В зависимости от состава примесных компонентов различают белый, бурый, серый и желтый магнезит. В аморфном состоянии всегда есть наличие кремнезема, но отсутствуют соединения железа. В природных условиях магнезит более редкий минерал, чем известняк и доломит. Наиболее известны два магнезиальных вяжущих: каустический магнезит и доломит. Каустический магнезит получают в следствии обжига магнезита (MgCО 3 ) и перемолом его в порошок высокой степени тонкости. Отличие между каустическим доломитом и каустическим магнезитом в исходном сырье. Для каустического доломита им является не магнезит, а доломит (CaCО 3 ·MgCО 3 ). И то и другое вяжущие затворяют раствором хлористого магния, сернокислого магния или прочих солей.
Доломит – это минерал, который имеет состава CaCO 3 – MgCO 3 . Еще доломитом называют осадочную карбонатную горную породу, которая состоит из минерала доломита на 95 %. Доломит назвали в честь геолога из Франции Деода де Доломье, он первым описал характерные особенности доломитовых пород. Прочностные показатели доломита по шкале Мооса 3,5 – 4; плотность 2,85 – 2,95. Содержание в доломите СаСО 3 – 54,27%; MgCО 3 – 45,73% или в окислах: СаО – 30,41%; MgO – 21,87% и СО 2 – 47,72%. Доломит, который встречается в природе, как правило, имеет избыток углекислого кальция. Кроме него, в доломите имеются глинистые и прочие примеси. Доломит бывает белого, желтого и бурого цвета, в зависимости от примесного состава[4].
Воздушная известь одно из самых древних вяжущих, которое до сих пор применяется в строительстве. Известь получается в следствии обжигания кальциевых и кальциево-магниевых карбонатных пород до избавления от углекислого газа. В следствии обжигания получается белый материал, который имеет название негашеная комовая известь. Исходным сырьем для получения извести являются достаточно распространенные осадочные горные породы: известняки, доломиты, мел, доломитизированные известняки. В составе сырья имеет преимущество карбонат кальция СаСО 3 , а также содержатся карбонат магния и прочие примеси. Сырье, обжигают в шахтных или вращающихся печах при температуре 900 – 1200 ° C , по итогам обжигания комовую известь гасят водой. В контакте с водной средой комки извести активно с ней взаимодействуют, преобразуясь в порошок, а при излишнем количестве воды – в пластичное тестообразное вещество. Такой процесс, сопровождающийся очень большим выделением тепла и нагреванием воды до кипения, называют гашением извести. В зависимости от времени гашения различают быстро гасящуюся известь (время гашения до 8 минут) средне гасящуюся (до 25 минут) и медленно гасящуюся (более 25 минут)[3].
1.2 Гидравлические вяжущие
Гидравлические вяжущие являются порошками высокой степени перемола, состоящие из силикатов и алюминатов кальция, которые реагируют с водой, переходя в твердую камневидную фазу. Состав компонентов, из которых состоят гидравлические вяжущие, записывают в виде различных оксидов. Например, силикат кальция CaSiО 3 , трехкальциевый алюминат Са 3 А1 2 О 3 [3].
К гидравлическим вяжущим принадлежат гидравлическая известь, которая занимает среднее положение между воздушными и гидравлическими вяжущими, романцемент, портландцемент, разновидности портландцемента и специализированные виды цементов[2].
Цементы готовят из мергеля конкретного химического состава или из смеси известняковых горных пород и глин (известняк 75 %, глина 25 %). Эту смесь подвергают обжигу в печах при 1450 ° C . Результатом обжига является частичное оплавление, и получение гранул, которые называют клинкером. Типичный клинкер имеет примерный состав 67% СаО, 22% SiO 2 , 5% A l 2 O 3 , 3% Fe 2 O 3 и 3% других компонентов и обычно содержит четыре фазы: алит, белит, алюминатная и ферритная фаза. В клинкере также обычно присутствуют в небольших количествах и несколько других фаз, таких как щелочные сульфаты и оксид кальция. При едином перемоле клинкера с гипсом и прочими добавками получается порошок серого цвета – это и есть цемент. Гипс регулирует быстроту схватывания; его можно частично заменить другими формами сульфата кальция. Степень перемола цемента также оказывает влияние на быстроту его схватывания, а еще и на прочностные показатели после затвердевания. Цементы разделяют: по виду клинкера и вещественному составу; прочностным показателям; быстроте затвердевания; специальным свойствам. Портландцемент готовят путем совместного перемола портландцементного клинкера, доменного шлака и гипса. Шлаковый портландцемент схватывается и затвердевает намного дольше, чем обычный портландцемент[5].
Задумайтесь! Мы с вами состоит из миллиардов атомов. Все атомы находятся в круговороте, и все атомы, которыми мы обладаем, в ком-то и где-то находились те 4,5 млрд. лет, которые существует Земля. Они были частями животных, растений, грибов и бактерий - а сейчас принадлежат нам на короткое время.

С химической точки зрения ответ на вопрос "Жив ли изучаемый объект?" - не представляется возможным. Понятию "жизнь" дано колоссальное количество определений. Жизнь - это самовоспроизведение с изменением, способ существования белковых тел, постоянный обмен веществ с внешней средой.
Мы приступаем к изучению неорганических и органических веществ клетки. Начнем с неотъемлемого компонента клетки, благодаря которому жизнь на Земле в принципе стала возможна - вода.
Составляет 60-80% массы клетки. Молекула воды обладает уникальным свойством - полярностью, которое возникает из-за разницы в электроотрицательности (ЭО) между атомами кислорода и водорода (у кислорода ЭО больше).

Поскольку молекула воды полярна, ее называют диполь. Между молекулами воды возникают непрочные водородные связи: водородная связь начинается от отрицательно заряженного атома кислорода (2δ - ) одной молекулы воды и тянется до положительно заряженного атома водорода другой молекулы воды (δ + )
- Гидрофильные (греч. hydro - вода и philéo - люблю) - вещества, которые хорошо растворяются в воде. Гидрофильными веществами являются сахара, соли, альдегиды, спирты, аминокислоты.
- Гидрофобные (греч. hydro - вода и phobos — страх) - вещества, которые не растворяются в воде. Гидрофобными веществами являются жиры.
-
Вода - универсальный растворитель
Большинство реакций, которые протекают в клетке, идут в растворе (водной среде). Полярность молекулы воды позволяет ей быть отличным растворителем для других гидрофильных (полярных) веществ.
Вода может поглощать теплоту при минимальном изменении температуры. Это настоящее "спасение" для клеток: чуть только температура меняется, вода начинает поглощать избыток тепла, защищая клетку от перегревания. Выделяясь на поверхность кожи с потом, вода испаряется, поверхность кожи при этом охлаждается.
Она не только создает среду для реакций в клетке, но и сама активно участвует во многих из них. Расщепление питательных веществ, попавших в клетку, происходит за счет реакции гидролиза (греч. hydro - вода и lysis - расщепление).
Питательные вещества, газы перемещаются по организму с током крови. Вода составляет 90-92% плазмы крови, является ее основным компонентом. С помощью воды происходит не только доставка веществ к клеткам, но и удаление из организма побочных продуктов обмена веществ.

Вода придает тканям тургор (лат. turgor — наполнение) - внутреннее осмотическое давление в живой клетке, создающее напряжение оболочек клеток. Вода составляет от 60 до 95% цитоплазмы, придает клеткам форму. Изменение тургора клеток растений приводит к перемещениям их частей, раскрытию устьиц, цветков.
Осмотическое давление - избыточное гидростатическое давление на раствор, отделенный от чистого растворителя с помощью полупроницаемой мембраны.
Главное - понимать суть: если мы поместим живую клетку в гипертонический раствор, то вода (растворитель) устремится из клетки в раствор (в сторону большей концентрации соли) - это приведет к сморщиванию клеток.
Если же клетка окажется в гипотоническом растворе, то вода извне устремится внутрь клетки (опять-таки в сторону большей концентрации солей), приводя при этом к разбуханию (и возможному разрыву) клетки.

Элементы
Процентное содержание элемента не коррелирует с его важностью и биологической значимостью. Так, к примеру, микроэлемент I играет важную роль в синтезе гормонов щитовидной железы: тироксина, трийодтиронина. За нормальные рост и развитие организмов отвечают Zn, Mn, Cu.
Благоприятно влияют на сперматозоиды Zn, Ca, Mg, защищая их от оксидативного стресса (окисления). Невозможным становится нормальное образование эритроцитов без должного уровня Fe и Cu.

В водной среде клетки соли диссоциируют (распадаются) на положительно заряженные ионы - катионы (Na + , K + , Ca 2+ , Mg 2+ ) и отрицательно заряженные - анионы (Cl - , SO4 2- , HPO4 2- , H2PO4 - ).
Для процессов возбуждения клетки (нейрона, миоцита - мышечной клетки) внутри клетки должна поддерживаться низкая концентрация ионов Na + и высокая концентрация ионов K + . В окружающей клетку среде все наоборот: много Na и мало K. В мембране существует специальный натрий-калиевый насос, который поддерживает необходимое равновесие. Если это соотношение нарушится, то нейрон не сможет сгенерировать нервный импульс, а клетка мышцы - сократиться.
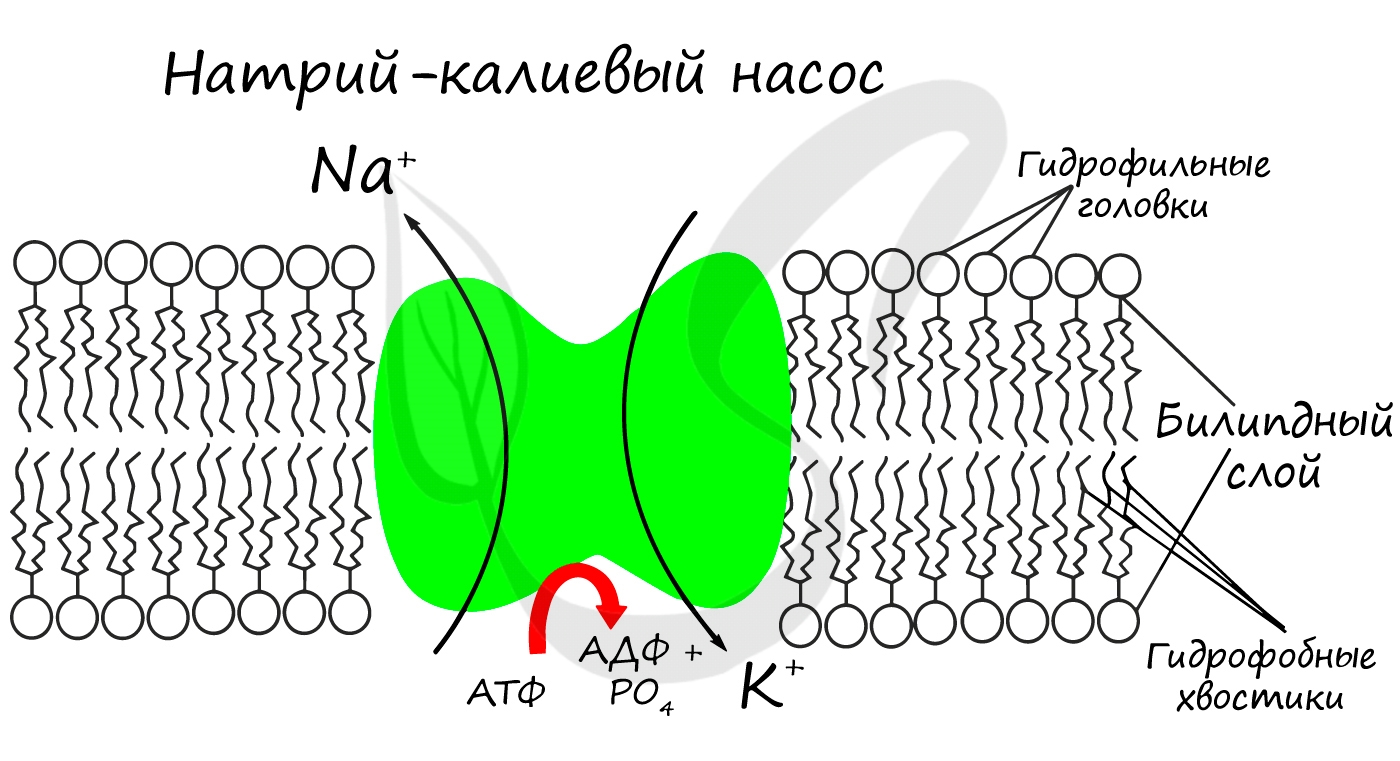
- Участвуют в активации ферментов
- Создают буферные системы (бикарбонтаную, фосфатную, белковую)
- Поддерживают кислотно-щелочное состояние (КЩС)
- Создают осмотическое давление клетки
- Создают мембранный потенциал клеток (натрий-калиевый насос)
- Являются основным минеральным составляющим скелета внутреннего и наружного (у моллюсков)

Мы переходим к органическим компонентам клетки, к которым относятся: жиры, углеводы, белки и нуклеиновые кислоты.
Белки, или пептиды (греч. πεπτος - питательный)
Белки - полимеры, мономерами которых являются аминокислоты. Белки представляют линейную структуру, образованную из длинной цепи аминокислот, между которыми возникают пептидные связи. Пептидная связь образуется между карбоксильной группой (COOH) одной аминокислоты и аминогруппой другой аминокислоты (NH2).
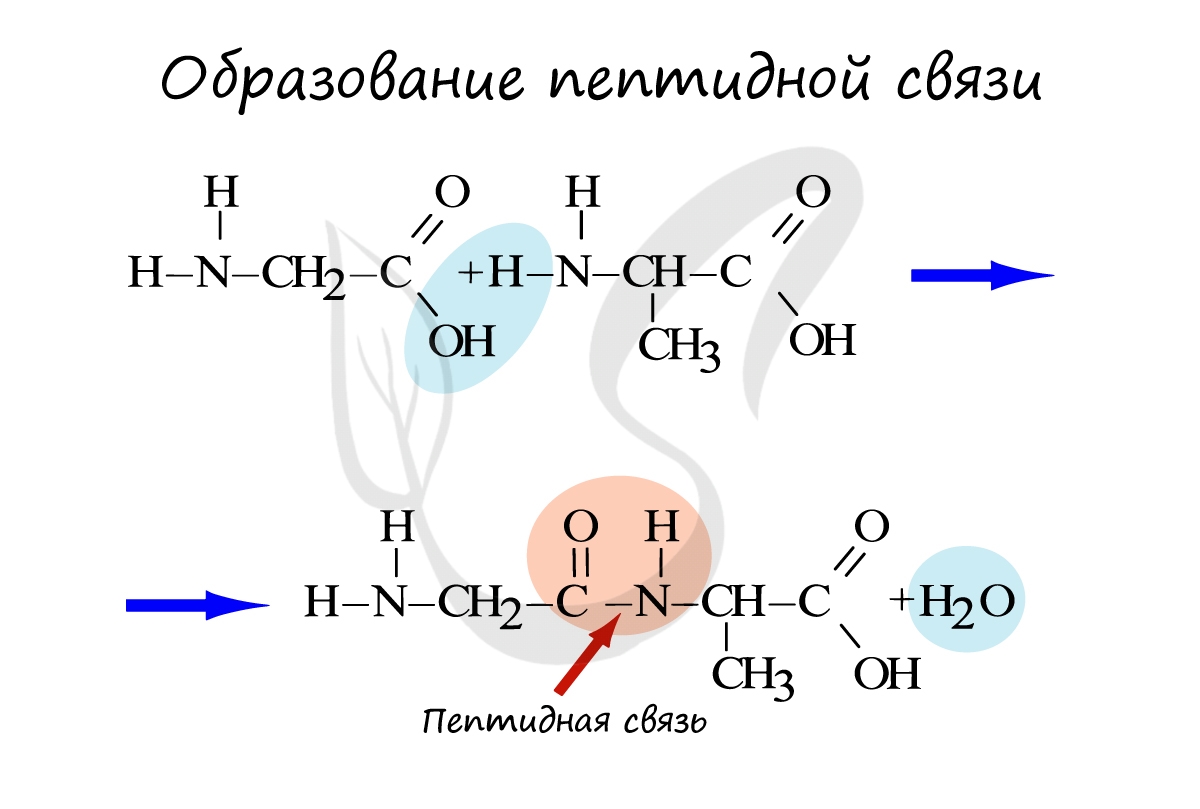
Между понятиями пептиды и белки существует определенная разница. Белки состоят из сотен тысяч аминокислот. Пептидами называют небольшие белки, содержащие до 10 аминокислот. Ими являются некоторые гормоны: окситоцин, вазопрессин, тиреолиберин - эти пептиды выполняют регуляторную функцию.
- Первичная - полипептидная цепь, в которой аминокислоты расположены линейно
- Вторичная - полипептидная цепь закручивается в спираль, формируется α или β структура
- Третичная - спирали скручиваются в глобулу (лат. globulus - шарик)
- Четвертичная - образуется у сложных белков путем соединения нескольких глобул

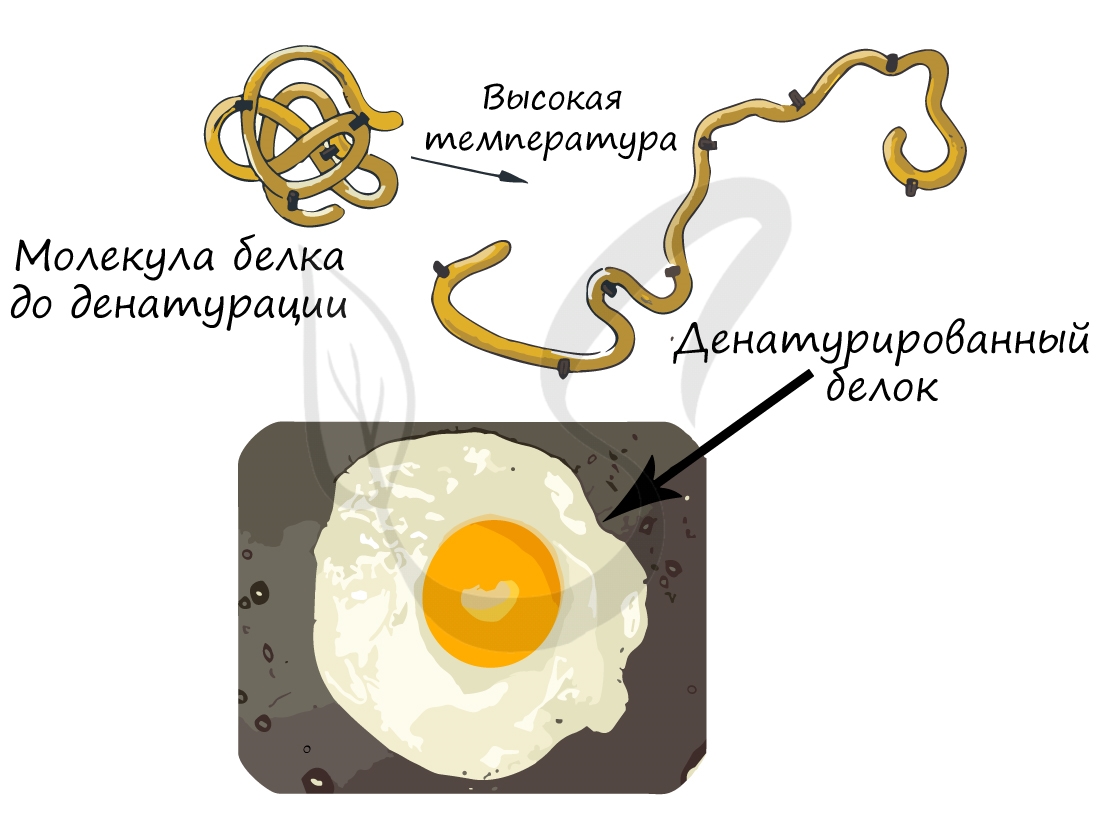
При резком изменении оптимальных для белка условий он подвергается денатурации: при этом происходит переход от высших структур организации к низшим, или "раскручивание белка". Важно заметить, что аминокислотная последовательность (первичная структура белка) при этом не меняется, однако свойства белка меняются кардинально (теряется его гидрофильность).
Осмелюсь сделать заявление: вы часто начинаете свой день с денатурации белка. Простейший способ провести такой эксперимент - пожарить яичницу. Заметьте, что изначально яичный белок прозрачный и текучий, но по итогу жарки эти свойства утрачиваются: он становится непрозрачным и вязким.
-
Каталитическая (греч. katalysis - разрушение)
Белки - природные катализаторы, ускоряющие реакции в организме в десятки и сотни тысяч раз. Эту роль главным образом выполняют белки-ферменты (энзимы).
Иногда в состав белков входят так называемые ко-факторы - небелковые соединения, которые необходимы ферменту для его биологической активности (в роли ко-факторов могут выступать Zn 2+ , Mg 2+ ).
Белки входят в состав клеточных мембран. Сложные белки: коллаген, эластин - входят в состав соединительных тканей организма, придавая им некоторую прочность и эластичность.
Некоторые гормоны, регулирующие обменные процессы в организме, имеют белковое происхождение: инсулин, глюкагон, адренокортикотропный гормон (АКТГ).
Говоря об этой функции, прежде всего, стоит вспомнить об антителах - иммуноглобулинах, которые синтезируют B-лимфоциты. Антитела нейтрализуют чужеродные организму антигены (разрушают бактерии).

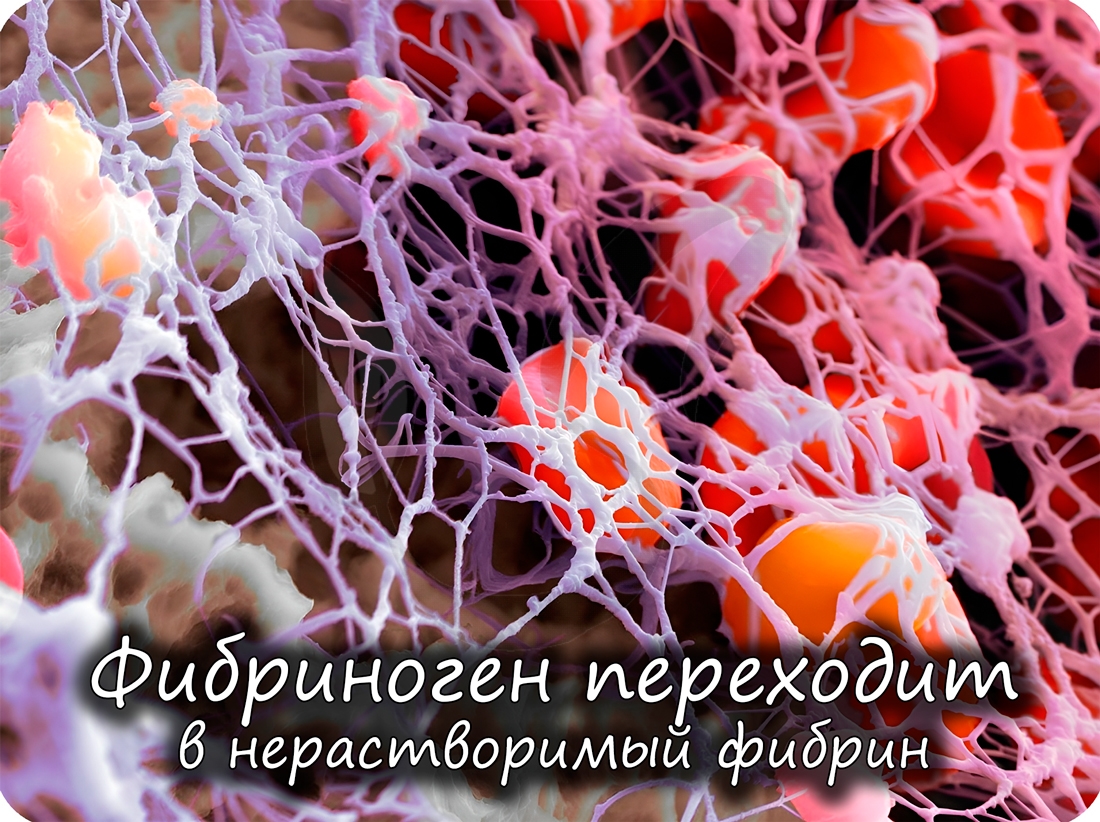
Помимо антител, защитную функцию выполняют также белки свертывающей системы крови (тромбин и фибриноген): они предохраняют организм от кровопотери.
При недостаточном питании в организме начинают окисляться молекулы белков. При расщеплении 1 г белков выделяется 17,6 кДж энергии.
Некоторые белки крови способны присоединять к себе и переносить различные молекулы. Альбумины участвуют в транспорте жирных кислот, глобулины - гормонов и некоторых ионов (Fe, Cu). Основной белок эритроцитов - гемоглобин - способен переносить кислород, углекислый и угарный газы (угарный конечно нежелательно ему переносить, будет отравление)
Двигательные белки, актин и миозин, на уровне саркомера обеспечивают сокращение мышц. При возбуждении мышечной ткани тонкие нити актина начинают тереться о толстые нити миозина, приводя к сокращению.
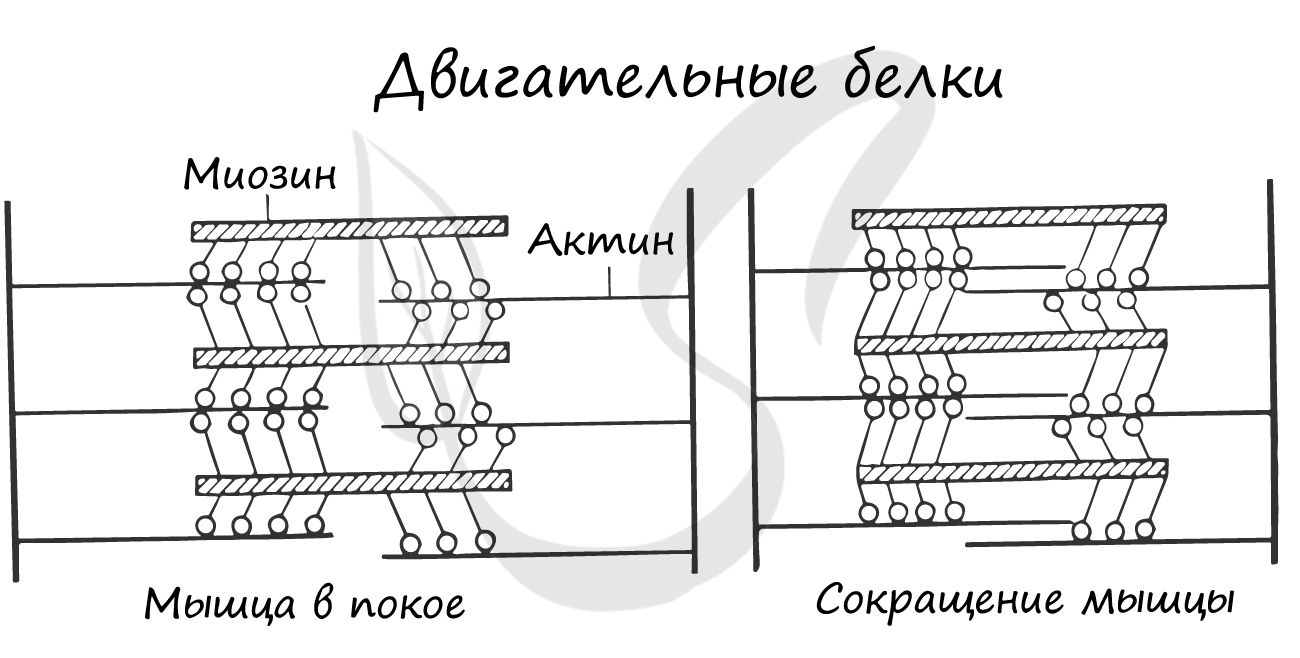
На поверхности мембраны белки образуют многочисленные рецепторы, которые, соединяясь с гормонами, приводят к изменению обмена веществ в клетке. Таким образом, гормоны реализуют воздействие на клетки органов-мишеней.
Жиры, или липиды (греч. lipos - жир)
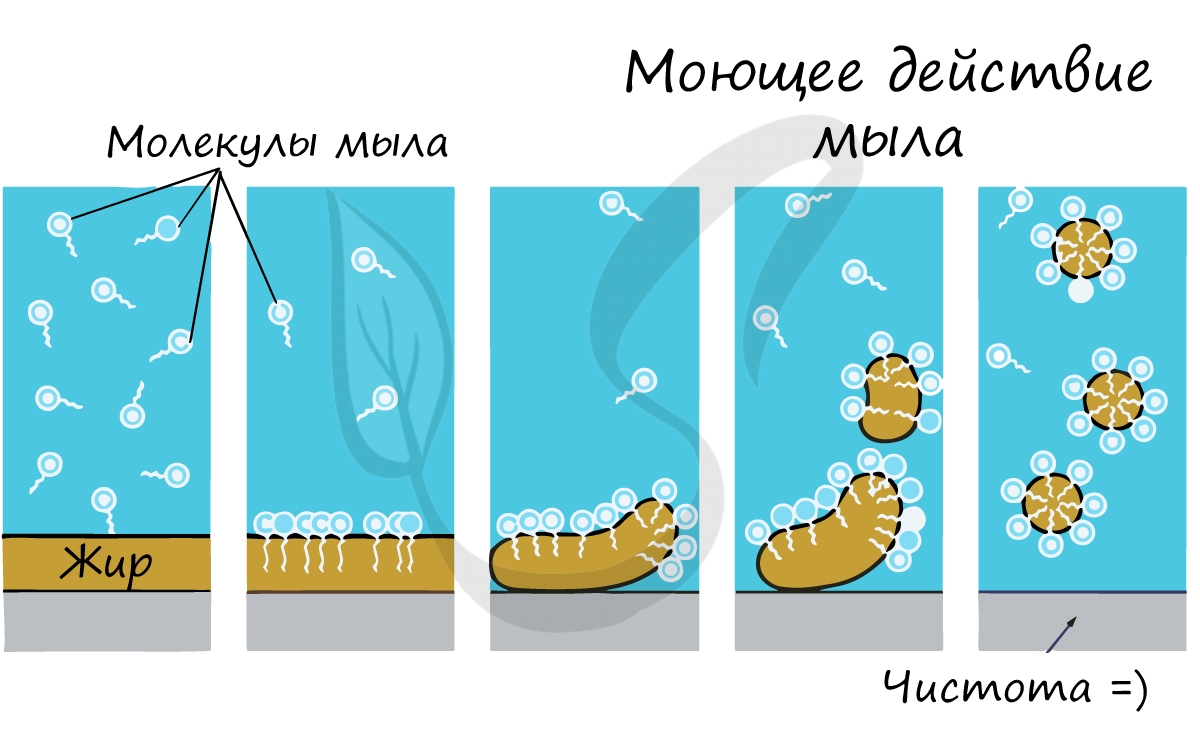
С химической точки зрения жиры являются сложными эфирами, образованными трехатомным спиртом глицерином и высшими карбоновыми кислотами (жирными кислотами). Среди их свойств надо выделить то, что они практически нерастворимы в воде. Вспомните, как тяжело смыть жир с рук водой.
Почему именно мыло смывает жир с рук? Дело в том, что молекула мыла повторяет свойства жира: одна часть ее гидрофобна, а другая гидрофильна. Мыло соединяется с молекулой жира гидрофобной частью, и вместе они легко смываются водой.
При окислении жиров выделяется много энергии: 1 г - 38,9 кДж. Это вдвое больше выделяющейся энергии при расщеплении 1г углеводов.
Жиры имеют способность накапливаться в клетках, расположенных в подкожно-жировой клетчатке, внутренних органах. Эти запасы являются резервом организма на случай голодания или при недостаточном питании.
В жирах также запасается вода: в 100 г жира содержится 107 мл воды. Многим пустынным животным (верблюдам) жировые запасы помогают длительное время обходиться без воды.
Жиры входят в состав биологических мембран клеток человека вместе с белками. Из фосфолипидов построены мембраны всех клеток органов и тканей!
Так, к примеру, холестерин - обязательный компонент мембраны, придает ей определенную жесткость и совершенно необходим для нормальной жизнедеятельности (заболевания возникают только при нарушении липидного обмена).

Жиры обладают плохой теплопроводностью. Располагаясь в подкожно-жировой клетчатке, они образуют термоизолирующий слой. Особенно хорошо он развит у ластоногих (моржи и тюлени), китов, защищает их от переохлаждения.
Некоторые гормоны по строению относятся к жирам: половые (андрогены - мужские и эстрогены - женские), гормон беременности (прогестерон), кортикостероиды.
Производное жира - витамин D - принимает важное участие в обмене кальция и фосфора в организме. Он образуется в коже под действием ультрафиолетового излучения (солнечного света). При недостатке витамина D возникает заболевание - рахит.

Углеводы
-
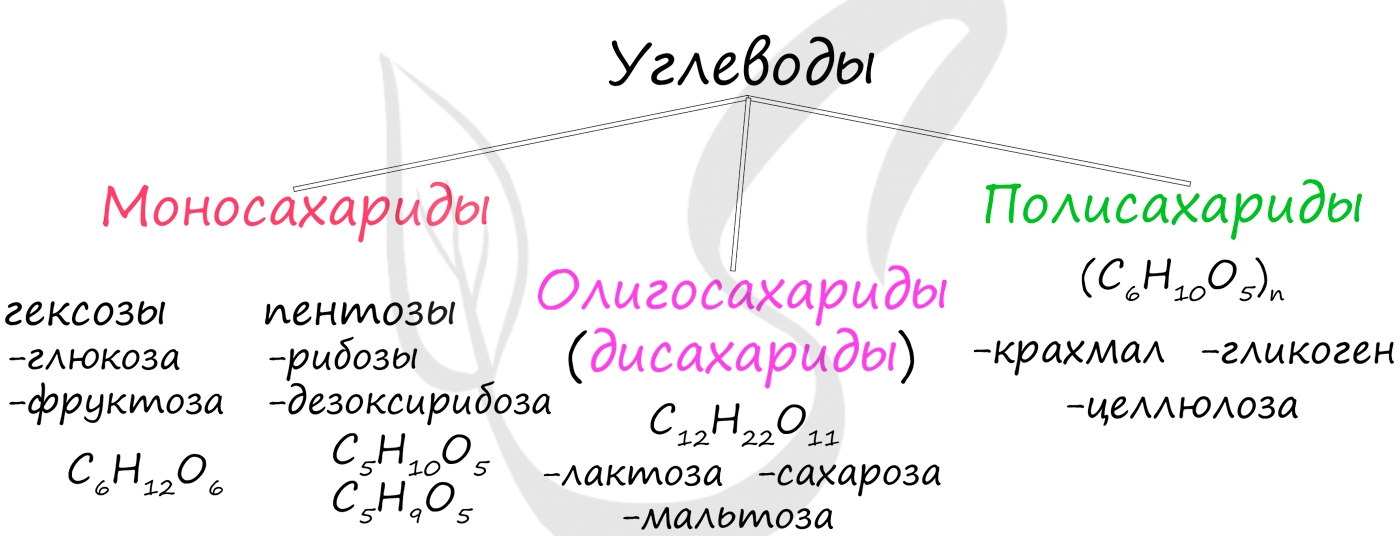
Моносахариды (греч. monos — единственный)
Простые сахара, легко растворяющиеся в воде и имеющие сладкий вкус. Моносахариды подразделяются на гексозы (имеют 6 атомов углерода) - глюкоза, фруктоза, и пентозы (имеют 5 атомов углерода) - рибоза и дезоксирибоза, входящие в состав нуклеиновых кислот.
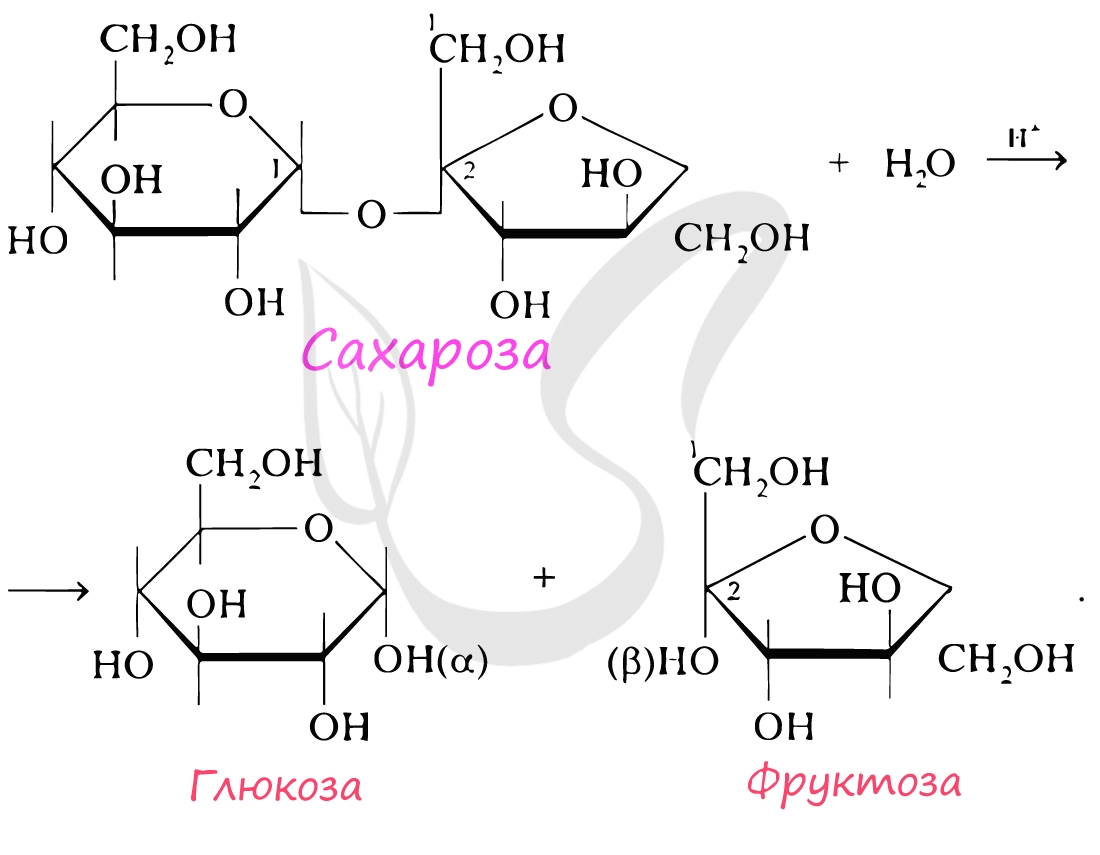
При гидролизе олигосахариды распадаются на моносахариды. В состав олигосахаридов может входить от 2 до 10 моносахаридных остатков. Если в состав олигосахарида входят 2 остатка моносахарида, то его называют дисахарид. К дисахаридам относятся сахароза, лактоза, мальтоза. При гидролизе сахароза распадается на глюкозу и фруктозу.
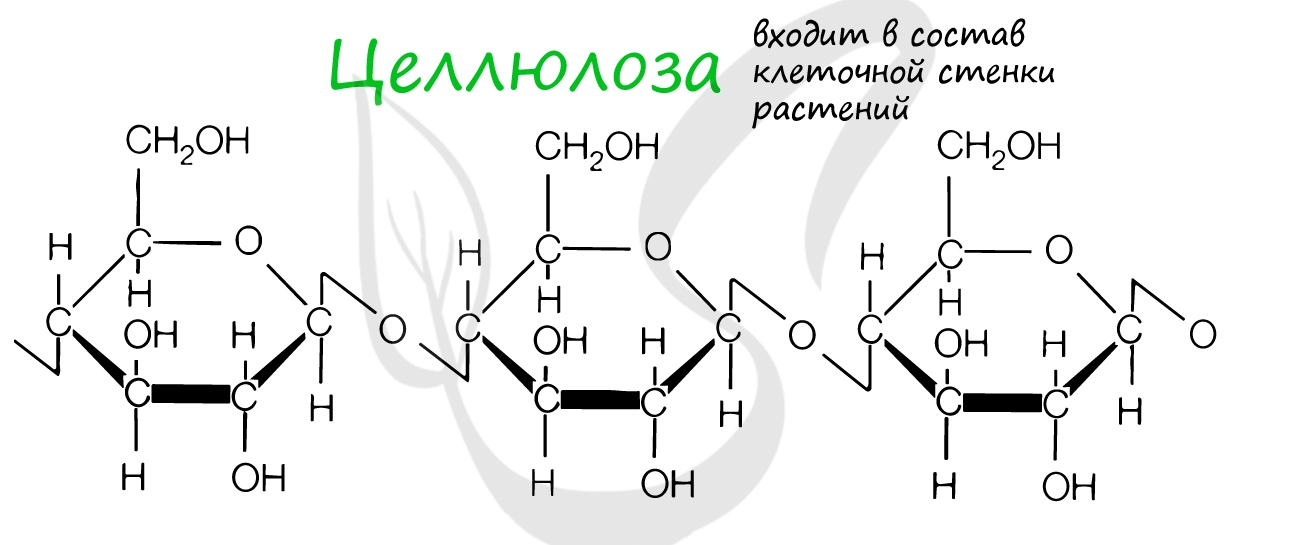
Это биополимеры, в состав которых входят сотни тысяч моносахаридов. Они обладают высокой молекулярной массой, нерастворимы в воде, на вкус несладкие.
Крахмал, целлюлоза, гликоген, хитин и муреин - все это биополимеры. Давайте вспомним, где они находятся.
Клеточная стенка образована: у растений - целлюлозой, у грибов - хитином, у бактерий - муреином. Запасным питательным веществом растений является крахмал, животных - гликоген.
В результате расщепления 1 г углеводов высвобождается 17,6 кДж энергии.
Запасным питательным веществом растений и животных соответственно являются крахмал и гликоген. Расщепление гликогена позволяет нам оставаться в сознании и быть активными между приемами пищи.
Гликоген представляет собой разветвленную молекулу, состоящую из остатков глюкозы. За счет больших размеров такая молекула хорошо удерживается в клетке, а ее разветвленность позволяет ферментам быстро отщеплять множество молекул глюкозы одновременно.
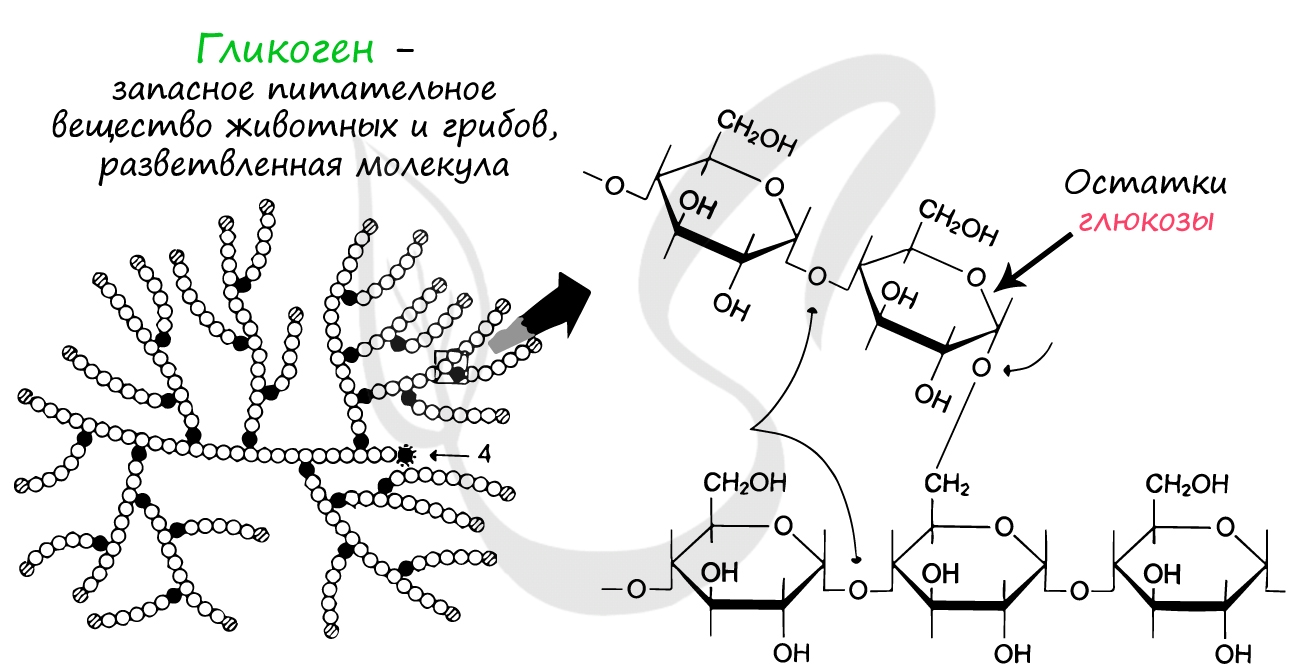
Существуют заболевания, при которых распад гликогена нарушается: в результате нейроны не получают глюкозы (источника энергии, соответственно не синтезируются и молекулы АТФ). Из-за этого становятся возможны частые потери сознания.
Целлюлоза входит в состав клеточных стенок растений, придавая им необходимую твердость. Хитин образует клеточную стенку грибов и наружный скелет членистоногих.
Нуклеиновые кислоты (от лат. nucleus — ядро)
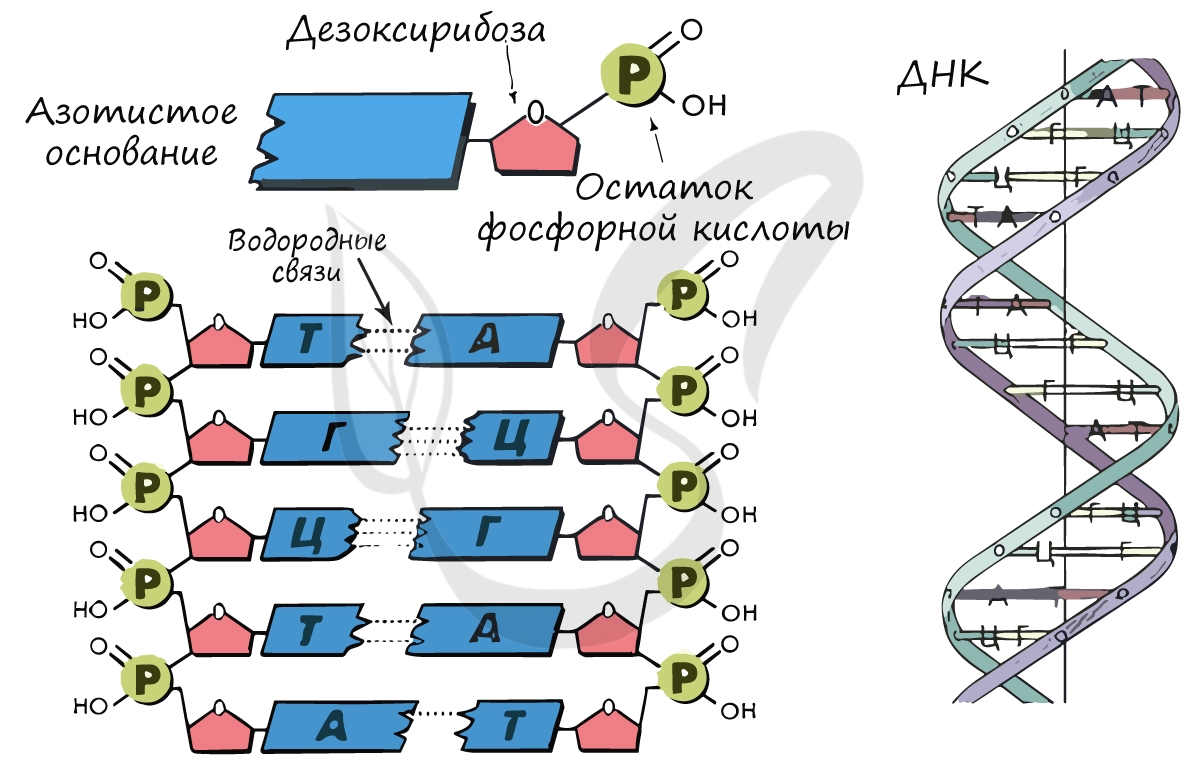
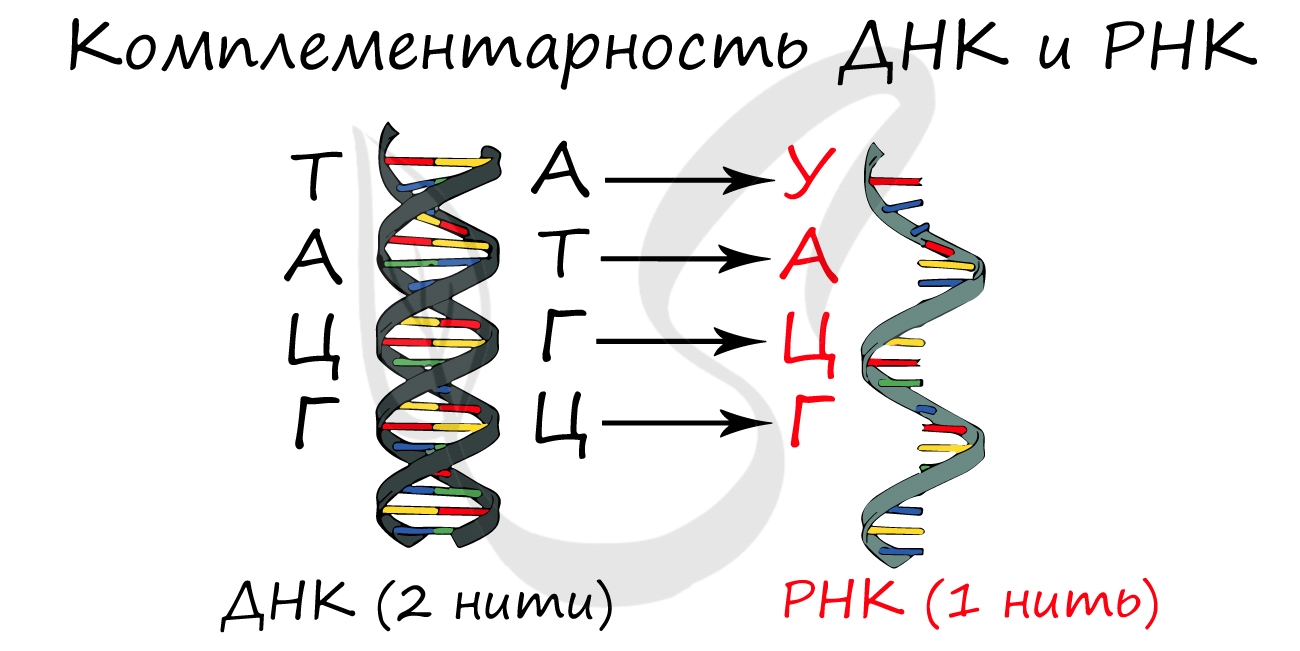
Для ДНК характерны следующие азотистые основания: аденин - тимин, гуанин - цитозин; для РНК: аденин - урацил, гуанин - цитозин. Исходя из принципа комплементарности, данные основания соответствуют друг другу, в результате чего между ними образуются связи.
Между аденином и тимином образуется 2 водородные связи, а между гуанином и цитозином - 3.
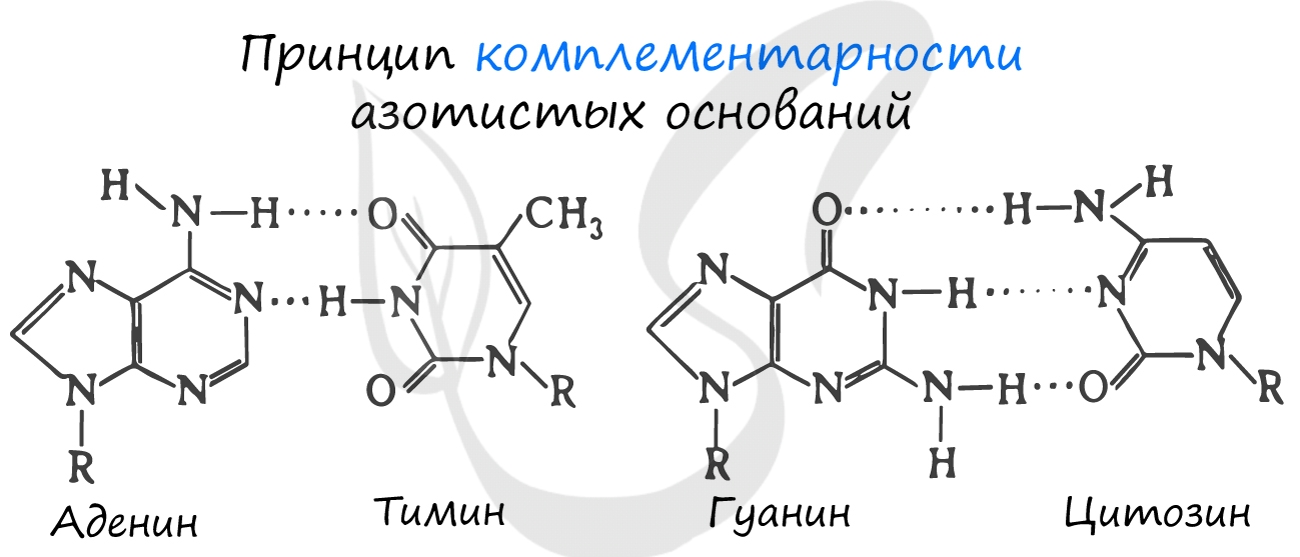
Именно по этой причине количество аденина в молекуле ДНК всегда совпадает с количеством тимина. К примеру, если в ДНК 20% аденина, то с уверенностью можно сказать, что в ней 20% тимина. Выходит на оставшиеся основания - цитозин и гуанин - остается 60%, значит, цитозин и гуанин составляют в ДНК 30% каждый. Таким нехитрым образом, зная процент содержания одного основания, можно подсчитать все остальные.
В ДНК остаток сахара - дезоксирибоза, в РНК - рибоза.
-
Рибосомальная РНК (рРНК)
Синтезируется в ядрышке. рРНК входит в состав малых и больших субъединиц рибосом. В процентном отношении рРНК составляет 80-90% всей РНК клетки.
Синтезируется в ядре в ходе процесса транскрипции (лат. transcriptio — переписывание). Фермент РНК-полимераза строит цепь иРНК по принципу комплементарности с ДНК. Исходя из данного принципа, гуанин (Г) в молекуле ДНК соединяется с цитозином (Ц) в РНК. Далее соответственно: цитозин (Ц) - гуанин (Г), аденин (А) - урацил (У), тимин (Т) - аденин (А).
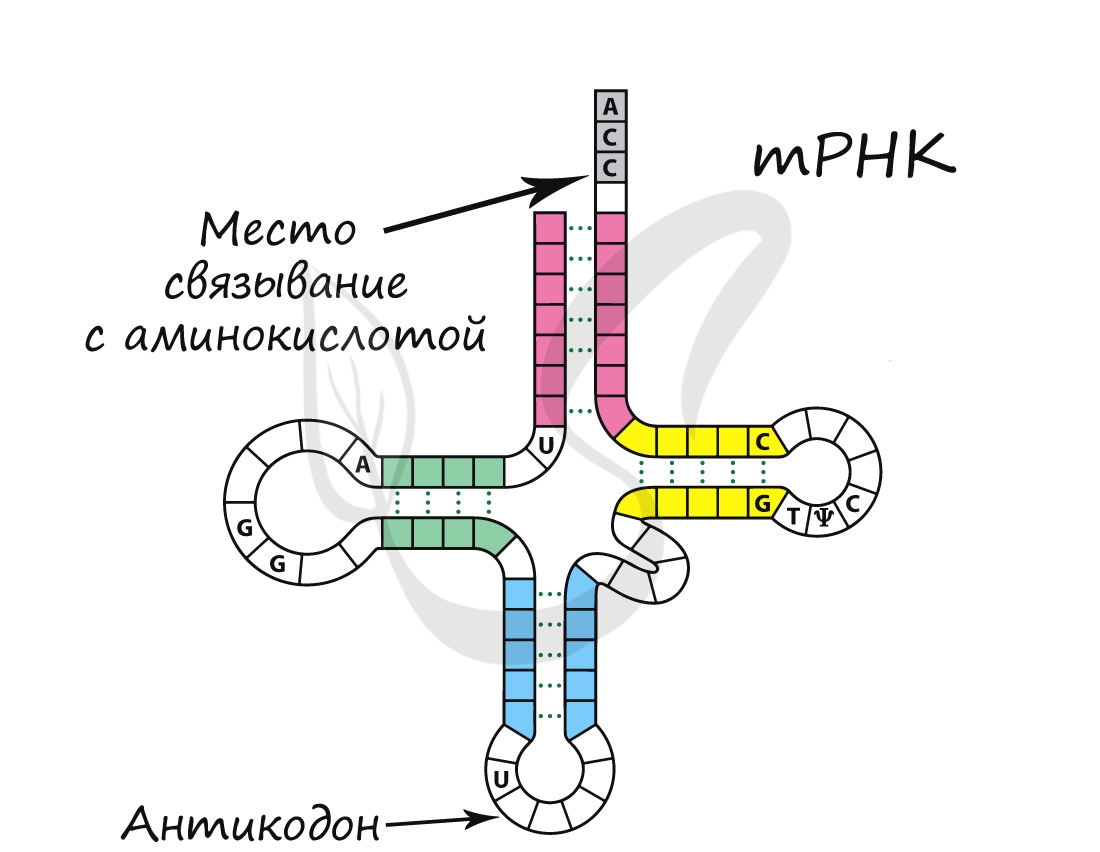
Обеспечивает транспорт аминокислоты к рибосоме во время синтеза белка. Благодаря этому становится возможным соединение аминокислот друг с другом, образуется белок. тРНК имеет характерную форму клеверного листа.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.

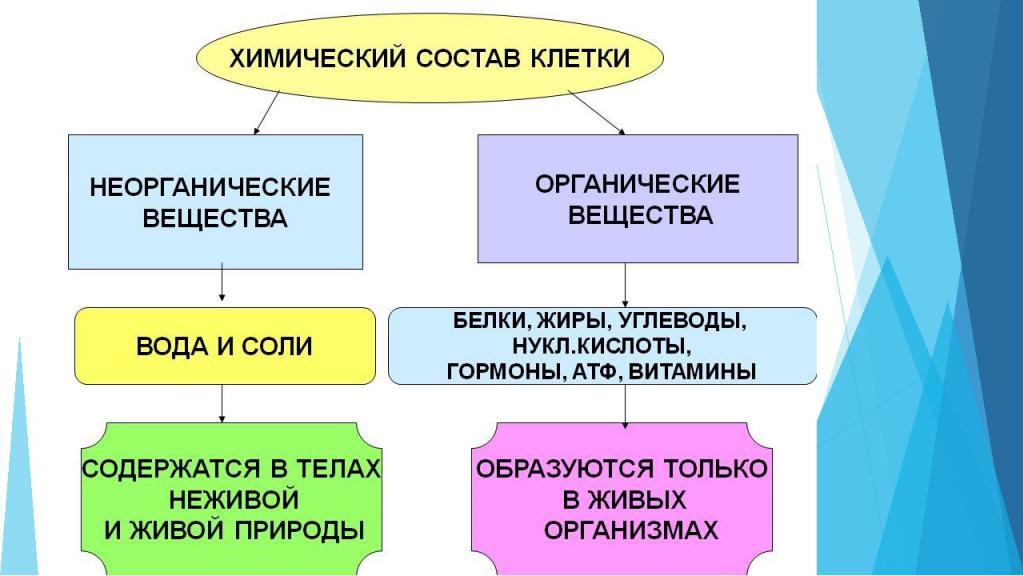
Ежедневно человек взаимодействует с большим количеством предметов. Они изготовлены из разных материалов, имеют свою структуру и состав. Все, что окружает человека можно разделить на органическое и неорганическое. В статье рассмотрим, что представляют собой такие вещества, приведем примеры. Также определим, какие встречаются неорганические вещества в биологии.
Описание
Неорганическими называются такие вещества, в составе которых нет углерода. Они противоположны органическим. Также к этой группе относят несколько углеродосодержащих соединений, например:
- цианиды;
- оксиды углерода;
- карбонаты;
- карбиды и другие.
Примеры неорганических веществ:
- вода;
- разные кислоты (соляная, азотная, серная);
- соль;
- аммиак;
- углекислый газ;
- металлы и неметаллы.
Неорганическая группа отличается отсутствием углеродного скелета, который характерен для органических веществ. Неорганические вещества по составу принято делить на простые и сложные. Простые вещества составляют немногочисленную группу. Всего их насчитывается примерно 400.

Простые неорганические соединения: металлы
Металлы – простые вещества, соединение атомов которых основывается на металлической связи. Эти элементы имеют характерные металлические свойства: теплопроводность, электропроводность, пластичность, блеск и другие. Всего в этой группе выделяют 96 элементов. К ним относятся:
- щелочные металлы: литий, натрий, калий;
- щелочноземельные металлы: магний, стронций, кальций; медь, серебро, золото;
- легкие металлы: алюминий, олово, свинец;
- полуметаллы: полоний, московий, нихоний;
- лантаноиды и лантан: скандий, иттрий;
- актиноиды и актиний: уран, нептуний, плутоний.
В основном в природе металлы встречаются в виде руды и соединений. Чтобы получить чистый металл без примесей, проводится его очистка. При необходимости возможно проведение легирования или другой обработки. Этим занимается специальная наука – металлургия. Она подразделяется на черную и цветную.

Простые неорганические соединения: неметаллы
Неметаллы – химические элементы, которые не обладают металлическими свойствами. Примеры неорганических веществ:
- вода;
- азот;
- сера;
- кислород и другие.
Неметаллы отличаются большим числом электронов на внешнем энергетическом уровне их атома. Это обуславливает некоторые свойства: повышается способность присоединять дополнительные электроны, проявляется более высокая окислительная активность.
В природе можно встретить неметаллы в свободном состоянии: кислород, хлор, фтор, водород. А также твердые формы: йод, фосфор, кремний, селен.
Некоторые неметаллы имеют отличительное свойство – аллотропию. То есть они могут существовать в различных модификациях и формах. Например:
- газообразный кислород имеет модификации: кислород и озон;
- твердый углерод может существовать в таких формах: алмаз, графит, стеклоуглерод и другие.

Сложные неорганические соединения
Эта группа веществ более многочисленна. Сложные соединения отличаются наличием в составе вещества нескольких химических элементов.
Рассмотрим подробнее сложные неорганические вещества. Примеры и классификация их представлены ниже в статье.
1. Оксиды – соединения, одним их элементов которых является кислород. В группу входят:
- несолеобразующие (например, монооксид углерода, оксид азота);
- солеобразующие оксиды (например, оксид натрия, оксид цинка).
2. Кислоты – вещества, в состав которых входят ионы водорода и кислотные остатки. Например, азотная кислота, серная кислота, сероводород.
3. Гидроксиды – соединения, в составе которых присутствует группа –ОН. Классификация:
- основания – растворимые и нерастворимые щелочи – гидроксид меди, гидроксид натрия;
- кислородосодержащие кислоты – диводород триоксокарбонат, водород триоксонитрат;
- амфотерные – гидроксид хрома, гидроксид меди.
4. Соли – вещества, в составе которых есть ионы металла и кислотные остатки. Классификация:
- средние: хлорид натрия, сульфид железа;
- кислые: гидрокарбонат натрия, гидросульфаты;
- основные: нитрат дигидроксохрома, нитрат гидроксохрома;
- комплексные: тетрагидроксоцинкат натрия, тетрахлороплатинат калия;
- двойные: алюмокалиевые квасцы;
- смешанные: сульфат алюминия калия, хлорид меди калия.
5. Бинарные соединения – вещества, состоящие из двух химических элементов:
- бескислородные кислоты;
- бескислородные соли и другие.

Неорганические соединения, содержащие углерод
Такие вещества традиционно относятся к группе неорганических. Примеры веществ:
- Карбонаты - эфиры и соли угольной кислоты – кальцит, доломит.
- Карбиды – соединения неметаллов и металлов с углеродом – карбид бериллия, карбид кальция.
- Цианиды – соли цианистоводородной кислоты – цианид натрия.
- Оксиды углерода – бинарное соединение углерода и кислорода – угарный и углекислый газы.
- Цианаты – являются производными от циановой кислоты – фульминовая кислота, изоциановая кислота.
- Карбонильные металлы – комплекс металла и монооксида углерода – карбонил никеля.

Свойства неорганических веществ
Все рассмотренные вещества отличаются индивидуальными химическими и физическими свойствами. В общем виде можно выделить отличительные черты каждого класса неорганических веществ:
1. Простые металлы:
- высокая тепло- и электропроводность;
- металлический блеск;
- отсутствие прозрачности;
- прочность и пластичность;
- при комнатной температуре сохраняют твердость и форму (кроме ртути).
2. Простые неметаллы:
- простые неметаллы могут быть в газообразном состоянии: водород, кислород, хлор;
- в жидком состоянии встречается бром;
- твердые неметаллы имеют немолекулярное состояние и могут образовывать кристаллы: алмаз, кремний, графит.
3. Сложные вещества:
- оксиды: вступают в реакцию с водой, кислотами и кислотными оксидами;
- кислоты: вступают в реакцию с водой, основными оксидами и щелочами;
- амфотерные оксиды: могут вступать в реакции с кислотными оксидами и основаниями;
- гидроксиды: растворяются в воде, имеют широкий диапазон температур плавления, могут менять цвет при взаимодействии с щелочами.
Органические и неорганические вещества клетки
Клетка любого живого организма состоит из множества компонентов. Некоторыми из них являются неорганические соединения:
- Вода. Например, количество воды в клетке составляет от 65 до 95%. Она необходима для осуществления химических реакций, перемещения компонентов, процесса терморегуляции. Также именно вода определяет объем клетки и степень ее упругости.
- Минеральные соли. Могут присутствовать в организме как в растворенном виде, так и в нерастворенном. Важную роль в процессах клетки играют катионы: калий, натрий, кальций, магний - и анионы: хлор, гидрокарбонаты, суперфосфат. Минералы необходимы для поддержания осмотического равновесия, регуляции биохимических и физических процессов, образования нервных импульсов, поддержания уровня свертываемости крови и многих других реакций.
Для поддержания жизнедеятельности важны не только неорганические вещества клетки. Органические компоненты занимают 20-30 % ее объема.
- простые органические вещества: глюкоза, аминокислоты, жирные кислоты;
- сложные органические вещества: белки, нуклеиновые кислоты, липиды, полисахариды.
Органические компоненты необходимы для выполнения защитной, энергетической функции клетки, они служат источником энергии для клеточной активности и запасают питательные вещества, проводят синтез белков, передают наследственную информацию.
В статье были рассмотрены сущность и примеры неорганических веществ, их роль в составе клетки. Можно сказать, что существование живых организмов было бы невозможным без групп органических и неорганических соединений. Они важны в каждой сфере человеческой жизни, а также в существовании каждого организма.
Читайте также:

