Реферат на тему протеомика
Обновлено: 17.05.2024
Геномика – это изучение функций генов. Геном человека полностью открыт в 2003 году. У человека он состоит из 3млрд пар оснований. закончено описание всех генов и их распределение по хромосомам. Выяснена роль всех генов. При этом стало ясно, что не все наследственные признаки записаны в ДНК, в геноме записана только информация о структуре белков. Протеомика – это изучение белков – как продуктов определенных генов и роли этих белков. белки – это самообучающиеся молекулы, т.е. в течение жизни они взаимодействуют между собой и это взаимодействие запускает метаболические цепи и процессы.
Прикрепленные файлы: 1 файл
Документ Microsoft Office Word (3).docx
Казахстанско-Российский Медицинский Университет
Факультет Общей медицины
По молекулярной биологии, на тему:
Геномика, протеомика и метаболономика
Выполнила студентка 109 А гр. Слесаренко Маргарита
Геномика и протеомика
Т.о., геномика и протеомика позволяют сделать следующие заключения: 1) все болезни наследственно обусловлены, за исключением острых инфекционных и травм. Поэтому можно выделить: а) классические наследственные болезни, например, фенилкетонурию, галактоземию, т.е. болезни, связанные с мутацией в одном гене; б) мультифакториально наследуемые болезни, когда мутации происходят во многих генах, например, атеросклероз, гипертоническая болезнь, ишемическая болезнь сердца и т.п. Поэтому современная запись диагноза включает указание какая хромосома и ген в ней поражены при данном заболевании.
2) наступил переломный период человечества, т.е. накоплен значительный мутационный груз, например, 200млн человек являются носителями гемоглобинопатий, 5% — носителями муковисцедоза, 3% — носителями врожденного гипотиреоза, 2-3% — носителями адреногенитального синдрома, 2-3% — носителями семейной гиперхолестеринемии.
Геномика – ветвь молекулярной биологии, основная задача которой заключается в секвенировании геномов, общем изучении нуклеотидных последовательностей РНК и ДНК. Современная геномика включает в себя множество подразделов. Попробую вкратце описать основные. Эволюционная геномика (или сравнительная геномика) – основана на сравнении организации и содержимого геномов различных живых организмов.
К примеру - огромное количество геномов различных микроорганизмов (большинство из которых – патогенные) уже расшифровано. Это позволяет находить в них гены-мишени лекарств и производить новые лекарственные препараты. Главную роль во всем этом играет современная наука – геномика.
Геномика – уже необходимая часть общей биологии. Она вносит свой немалый вклад в развитии сельского хозяйства, биотехнологии, здравоохранения.
Не менее чем биоинформатика и геномика, в современной науке популярно и такое направление как протеомика. Сейчас мы попробуем выяснить, что же это такое и с чем еe едят.
Протеомика (или по другому функциональная геномика) появилась совсем недавно и занимается такими интересными вещами, как изучение белков клетки в определенный момент времени, взаимосвязи структуры и функций клеточного протеома.
Так же как и геномика, протеомика делится на несколько направлений:
Клиническая протеомика – нахождение количества белков и их распознавание из образца(сыворотка крови, моча, спинномозговая жидкость, биопсия) и наблюдение за изменениями их концентрации.
Протеомика гемостаза – заключается в расшифровке механизмов гомеостаза. Например, протеомика тромбоцитов – была получена новая информация о белках коагуляции, найдены неизвестные ранее мишени для новых лекарств секретогранина III, циклофилина А
Структурная протеомика – получение информации не об одном, а о множестве белков одновременно. Уже разработан цикл специальных процедур и высокоточные приборы для проведения такого анализа.
Функции и свойства белков, взаимодействия белков между собой, взаимодействие структуры и функции изучает функциональная протеомика.Сегодня до 96% медикаментозных средств воздействуют именно на белки. Практическая протеомика системными методами позволит ускорить процесс создания лекарственных препаратов, так необходимых многим, и создать лекарства от неизлечимых ранее болезней.
ЧТО ЖЕ ТАКОЕ БИОИНФОРМАТИКА?
Основы протеомики и протеомного картирования
Описание: В настоящее время на уровне академических центров различных НИИ России стран СНГ Западной Европы США и Канады развиваются и внедряются в клинику результаты работы научных технологических платформ для биомедицинских и фармацевтических исследований. Если геномная карта человека одинакова по сути дела для всех клеток человека это 23 хромосомы с одним и тем же набором генов исключение составляют 14 половые клетки то в случае протеомной карты человека говорить об общности ее совершенно бессмысленно: каждая клетка каждая ткань каждая.
Дата добавления: 2015-09-04
Размер файла: 128.1 KB
Работу скачали: 42 чел.
Поделитесь работой в социальных сетях
Если эта работа Вам не подошла внизу страницы есть список похожих работ. Так же Вы можете воспользоваться кнопкой поиск
1 ПОНЯТИЯ, ПРИНЦИПЫ И НАПРАВЛЕНИЯ ПРОТЕОМИКИ..5
2 ПРОТЕОМНОЕ КАРТИРОВАНИЕ………………………………….7
3 МЕЖДИСЦИПЛИНАРНЫЙ ПОДХОД В ИСПОЛЬЗОВАНИИ ИНОВАЦИОННЫХ ПРОТЕОМНЫХ ИССЛЕДОВАНИЙ………………12
СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ……………………. 17
В настоящее время происходит революция в представлениях об этиологии, патогенезе и терапии болезней человека, что связано с достижениями в области молекулярной биологии и генетики, молекулярной медицины и фармакологии [1, 6].
Достигнуты серьезные успехи в понимании структуры и функции ДНК, РНК, белков, репликации и функционировании генома, обратной транскрипции, модификации, репарации и рекомбинации ДНК, транскрипции и трансляции мРНК в клетках про- и эукариот. Многочисленные исследования на основе новых биоаналитических методов прояснили основные пути регуляции экспрессии генов. Подробно изучены технологии рекомбинантных ДНК. Мощное развитие в настоящее время получило изучение физико-химических основ развития наследственных и социально-значимых болезней человека (атеросклероз, онкопатологии, сахарный диабет, внутриклеточные инфекции, нейродегенеративные болезни и т.д.).
В постгеномную эру остро встает вопрос о практической реализации фундаментальных разработок в области молекулярной биологии, медицины и фармакологии. При этом отражением функционирования генома являются постгеномные события, связанные с синтезом многочисленных белков, исследованию которых сейчас уделяется особое внимание в рамках отдельного научного направления протеомики. Развитие протеомных исследований невозможно без построения алгоритмов и методов анализа, создания базы данных, позволяющих выяснять механизм функционирования биологических текстов и разрабатывать целенаправленные фармакологические воздействия (биотрансформатика).
Связанные проблемы геномики и протеомики, фармакогеномики и биотрансформатики реализуются на основе уникальных методологических решений и технологических платформ.
В настоящее время на уровне академических центров, различных НИИ России, стран СНГ, Западной Европы, США и Канады развиваются и внедряются в клинику результаты работы научных технологических платформ для биомедицинских и фармацевтических исследований.
Цель практики изучить основы протеомики и протеомного картирования
Задача практики - закрепление и углубление теоретических знаний, полученных в процессе обучения; освоить методы работы со специальной литературой; собрать конкретные материалы в соответствии с рекомендованными вопросами; оформить результаты, полученные в ходе прохождение практики.
1 ПОНЯТИЯ, ПРИНЦИПЫ И НАПРАВЛЕНИЯ ПРОТЕОМИКИ
Конечно, геномика не исчезнет, она будет развиваться с той же самой, а может даже большей скоростью, но ясно, что центр постгеномных исследований будет перенесен в область инвентеризации и выяснения протеомной карты человека. На первый взгляд, задача кажется совершенно не решаемой. Если геномная карта человека одинакова, по сути дела, для всех клеток человека (это 23 хромосомы с одним и тем же набором генов исключение составляют 14 половые клетки), то в случае протеомной карты человека говорить об общности ее совершенно бессмысленно: каждая клетка, каждая ткань, каждая биологическая жидкость должна иметь собственную протеомную карту. Несмотря на то, что в каждой клетке может быть около 100 000 функционирующих генов, многочисленные реакции модификации могут увеличить число белков в клетке до 10 20 миллионов [2].
В этой связи в настоящее время существует два определения протеомики: узкое, которое можно назвать структурной протеомикой, и более широкое, которое включает и структурную, и функциональную части протеомики. В узком смысле этого слова протеомикой является наука, занимающаяся инвентаризацией белков с помощью комбинированного использования методов: двумерного электрофореза (2D-электрофорез), масс-спектрометрического (МС) анализа молекулярной массы и последовательности разделенных электрофорезом белков биологического материала с последующим анализом полученных результатов методами биоинформатики. По сути дела, структурная протеомика это комбинация 2D-электрофореза, масс-спектрометрии и биоинформатики. И если разрешающие возможности двумерного электрофореза известны давно, с первой работы OFarrell в 1975 г., то возможности МС анализа очень быстро определять молекулярную массу и последовательность полипептидных цепей стали ясны только в самое последнее время. Развивались они настолько быстро, что сейчас некоторыми фирмами созданы уже полностью автоматизированные системы для определения молекулярной массы и последовательности белков, работающие на фентомолярном и атомомолярном уровнях концентрации [7, 8, 10]. С помощью комбинации этих методов можно создать протеомную карту любого биологического материала, которая представляет собой фенотипическое проявление генома клетки, ткани или даже целого органа. В более широком смысле термины протеомный анализ, или протеомика могут быть использованы не только для инвентаризации белков биологического объекта, но и для контроля обратимой посттрансляционной модификации (ПТМ) белков специфическими ферментами, как-то: фосфорилирование, гликозилирование, ацилирование, френилирование, сцльфирование и т.д. [1].
В настоящее время уже более 300 различных типов посттрансляционной модификации охарактеризовано с помощью протеомики [9].
Интенсивное развитие МС-анализа способствовало появлению за последние 5 7 лет целой группы направлений протеомных исследований ( рис. 1), большая часть которых имеет биомедицинскую направленность, однако, фундаментальная основа на сегодняшний день, по-прежнему, сохраняется за структурной и функциональной протеомикой.
Рисунок 1 - Современные направления протеомного анализа.
2 ПРОТЕОМНОЕ КАРТИРОВАНИЕ
«В мире не существует двух индивидуумов с абсолютно одинаковым метаболизмом. Индивидуальные различия активности ферментов в печени могут быть причиной различий в ответной реакции пациентов на лекарство" А Гаррод.
Важность этих слов, принадлежащих, сложно переоценить в свете последних достижений молекулярной медицины. Прочтение геномов ряда организмов, и прежде всего человека, ознаменовало начало эры постгеномных технологий. Существенное влияние они оказали на медицину, позволив систематически анализировать молекулярные механизмы зарождения и развития заболевания. Знание этих механизмов позволяет подойти к качественно новому пониманию вопросов, связанных с профилактикой, диагностикой и лечением заболеваний. Пожалуй, впервые за всю свою историю медицина получила шанс приблизиться к статусу точной науки, миновав описательную практику анализа патологических процессов, бытовавшую в течение столетий.
Протеомная карта заболевания это понимание развития клинической картины заболевания в виде количественных и качественных нарушений на геномном, транскрипционном, трансляционном и посттрансялционном уровнях функционирования организма, т.е. на уровне нарушений в составе и взаимодействии генов в ДНК, РНК, белков, липидов, углеводов, а также на уровне образующихся в клетке и взаимодействующих между собой метаболитов.[3]
Важно подчеркнуть, что наличие подобных нарушений часто указывает лишь на вероятность развития патологии, следовательно можно, повлияв на факторы внешней среды, снизить вероятность развития заболевания, если провести соответствующие индивидуальные профилактические мероприятия.
Большинство заболеваний, таких как псориаз, шизофрения, диабет, обусловлены комбинацией малоэффективных генных вариантов, другими словами, обусловлены не единичным нарушениями, а их набором, локализованным в различных генах. При наличии четкой взаимосвязи между дефектом одного гена и развитием патологии можно говорить о ее наследственном характере. Однако на долю наследственных приходится лишь 2-5% всех заболеваний, остальные связаны с нарушением целого ансамбля генов, а значит, зависят от индивидуального профиля многих однонуклеотидных замен и/или нарушения экспрессии группы генов.
Протеомная диагностическая карта: включает SNP, ассоциированные с заболеваниями и SNP, ответственные за фармакокинетику и фармакодинамику лекарств, она формируется на основе знаний геномики, протеомики, липидомики, метаболомики, селломики, интерактомики и с применением современных методов полимеразной цепной реакции, хромато-масс-спектрометрии, современных видов микроскопии, микрофлюидных и нанотехнологических решений для аналитических работ.
Подобно тому, как сейчас гражданский паспорт служит документом, удостоверяющим личность, протеомная диагностическая карта, кроме идентификации личности, может предназначаться и для выбора индивидуумом соответствующего образа жизни. На его основе можно определять персонифицированное лечение, воплощая в жизнь золотой стандарт современной медицины: каждому больному - свое лекарство в нужное время и в нужной дозе.
Молекулярная (протеомная) диагностика является достоверным инструментом диагностики ранних стадий онкологических заболеваний и конкретно диагностики "молчащих раков", не проявляющих себя до тех пор, пока лечить его не станет поздно. Традиционные методики верификации рака подразумевают проведение биопсии, то есть забора микропорции ткани. Однако с точки зрения диагностики подход абсолютно неприемлем, поскольку трудно предположить человека, который в рамках плановой диспансеризации соглашается на манипуляции, по сложности и болезненности приближающиеся к хирургической операции. Значит, единственным наиболее доступным для диагностики биологическим образцом была и будет протеомное исследование крови.
Существует международный проект "Протеом человека" (аналог проекта "Геном человека") который планирует конструирование протеомной карты всех белков человека. Первоочередные задачи проекта "Протеом человека" - составление протеомных карт плазмы крови, печени и мозга, а также проведение антигенного картирования генома. Кроме того, специальный комитет в составе проекта рассматривает новые технологические инициативы. Российский центр проекта принимает участие в разработке протеомной карты плазмы крови и печени, активно развивает новые подходы в области нанотехнологий.
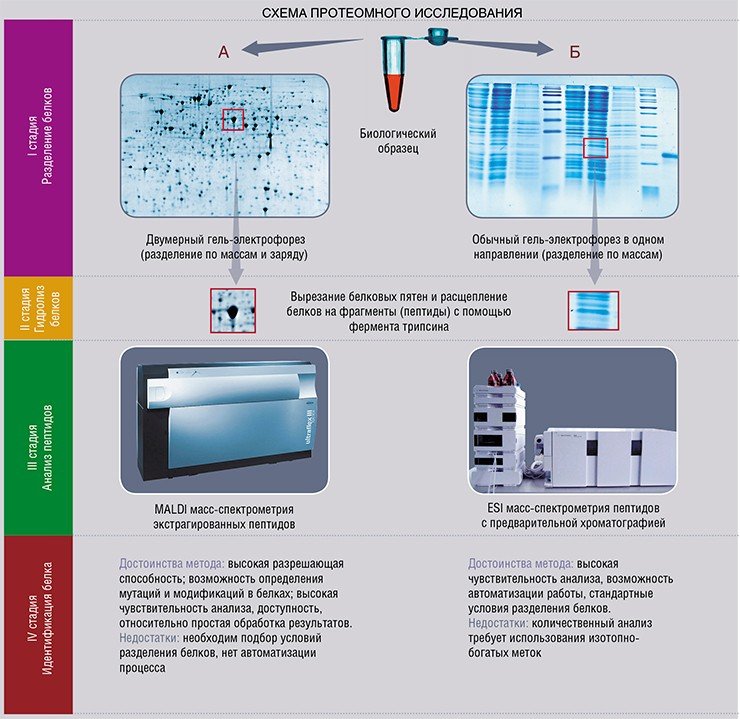
Схема проведения протеомного анализа проста и основана на достижениях современной масс-спектрометрии. Образец, например плазма крови, отбирается у пациента в количестве чуть более 1 мл.. Очевидно, что в плазме крови присутствует множество различных белков. Разделение белков проводится методом двумерного электрофореза, и на двумерной электрофоре-грамме каждый белок предстает в виде отдельного пятна. Его интенсивность соответствует уровню экспрессии белка, то есть его количеству. Анализ гелей позволяет выявить индивидуальные вариации протеома, оценить статистические параметры для каждого пятна. Затем, сравнивая электрофореграмму с эталонными, удается выявить различия, связанные с заболеваниями. Различия заключаются в повышении или понижении экспрессии белка, некоторые белки появляются в плазме больных, тогда как другие могут исчезнуть. Однако на этапе анализа двумерных электрофореграмм речь на самом деле еще не идет о конкретных белках, а только об интенсивности пятен. Для того чтобы определить (идентифицировать) белок, пятно вырезают из геля, подвергают расщеплению, и массы фрагментов (пептидов) детектируют с помощью масс-спектрометрии.
Протеомный анализ сопряжен с проведением ряда трудоемких рутинных процедур, связанных с тем, что число анализируемых белков велико, а для статистической значимости результата требуется обработать большое количество образцов в соответствии со стандартным протоколом. Снятые масс-спектры передаются в программу идентификации белков. Профиль масс, полученный на масс-спектрометре, соответствующий пептидным фрагментам белка, позволяет однозначно его идентифицировать, проведя поиск соответствия с теоретическими профилями, построенными по белкам человеческого генома через специализированные компьютерные базы данных в сети Интернет в онлайн-режиме.
Постгеномная эра открывает широкие перспективы перед российскими учеными - в исследованиях по данному направлению сейчас участвует около десяти научно-исследовательских институтов РАН, РАМН, Минздрава России, Минпромнауки России и МГУ, которые располагают мощной аппаратной базой с квалифицированным техническим персоналом и значит есть потенциал для дальнейшего развития.
Для врача молекулярная карта заболевания это ключ к точному диагнозу, прогнозу и целенаправленной терапии болезни.
Для исследователя молекулярная карта заболевания базис для новых открытий.

Рисунок 2 Молекулярная (протеомная) карта и терапия человека
3 МЕЖДИСЦИПЛИНАРНЫЙ ПОДХОД В ИСПОЛЬЗОВАНИИ ИНОВАЦИОННЫХ ПРОТЕОМНЫХ ИССЛЕДОВАНИЙ
Передовые методы медицинской диагностики, стоящие на стыке таких наук, как медицина, химия, физика и биология, требуют системного подхода к информационному обеспечению, которое в данном случае должно обеспечивать получение, хранение, обработку м анализ результатов исследований.
Междисциплинарная аналитическая лаборатория, имеющая уникальную базу высокотехнологичного медицинского диагностического оборудования, предполагает разработку новых подходов к еѐ информационному обеспечению.
Консультативно-диагностическая база междисциплинарной лаборатории (центра) включает 6 научных блоков:
- Протеомные и фармакопротеомные исследования биологических жидкостей и тканей организма человека;
- Исследование индивидуальной чувствительности к лекарственным средствам;
- Исследование биоэквивалентности лекарственных средств;
- Разработка и клинические испытания лекарственных средств (I фаза);
- Информационные стандарты лекарственных средств;
- Фармакоэпидемиологические исследования и регистрация ПЭ при применении лекарственных средств.
Консультативно-диагностическая база объединяет 6 подразделений лабораторных методов, оснащенных передовым, высокотехнологическим оборудованием:
- Подразделение новых электрофоретических методов исследования; Подразделение ПЦР;
- Подразделение спектрофотометрических методов исследования; Подразделение MALDI-TOF-MC;
- Подразделение иммунохимических методов исследования.
Результаты работы всех вышеперечисленных научных блоков и подразделений лаборатории внедряются на уровне консультативного подразделения по клинической фармакологии [4].
Информационную платформу для биомедицинской лаборатории можно представить в виде схемы, объединяющей три блока: эпидемиология и фармакоэпидемиология, молекулярные исследования и базы данных.
Получая большое количество клинической информации и данные эпидемиологических исследований в медицине с помощью высокотехнологичных методов исследования, анализа и обработки их результатов, идентификации полученной информации, формируются базы данных, которые затем посредством информационных технологий применяются во всех областях медицинской деятельности и способствуют решению следующих задач:
- развитию генодиагностики и генотерапии;
- формированию медико-генетических методов исследования на этапе первичной медицинской помощи;
- развитию фармакогеномных принципов диагностики и терапии при назначении лекарств;
- развитию исследований фармацевтической эквивалентности и биоэквивалентности лекарственных средств; созданию банка данных генетических полиморфизмов и протеомных паттернов заболеваний у здоровых лиц и пациентов.
В настоящее время прогресс в биомедицине обусловлен появлением новых электрофоретических методов исследования, методов ПЦР, ВЭЖХ и МС. Их эффективное применение связано с усовершенствованием способов первичной подготовки биологических образцов для исследования и развитием клеточных технологий. Соединение возможностей этих методов способствует созданию единых технологических платформ для реализации программ фундаментальных и прикладных исследований в области биомедицины, фармакологии и фармации.
Развитие новых технологических платформ для биомедицинских и фармацевтических исследований происходит на основе нанотехнологических решений.
Открытия в области расшифровки генома человека, геномов патогенных микроорганизмов, а также интересные результаты протеомных исследований биологических жидкостей и тканей организма человека способствуют появлению новых терапевтических агентов для лечения многих социально значимых заболеваний. Мощный потенциал открытий в области геномики, протеомики, метаболомики для разработки генотерапии и новых лекарственных препаратов можно реализовать в полной мере на основе новых технологических платформ и с учетом современных стандартов их проведения.
Важной задачей является создание полноценного биоинформационного ресурса, который станет мощной базой для планирования новых экспериментальных разработок, для интерпретации новых результатов геномных, протеомных исследований, а также для выполнения работ по предиктивной фармакологии. Будущее биоинформатики связано с развитием экспериментальной геномики для пациентов с разработкой типичного сценария развития организма человека, начиная с постнатального периода, что должно произвести революцию в медицине и здравоохранении.
Передовые методы биомедицинской диагностики, стоящие на стыке таких наук, как медицина, физика и биология, требуют системного подхода к информационному обеспечению, которое в данном случае должно способствовать получению, хранению, обработке, анализу и обмену результатами исследований в рамках выполнения многоцентровых программ.
СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ
1. Арчаков А.И. Биоинформатика, геномика и протеомика науки о жизни XXI столетия//Вопр. мед. химии. 2000. № 1. С. 13 18.
2. Арчаков А.И. Что за геномика? Протеомика//Вопр. мед. химии. 2000. № 1. С. 19 24.
3. Горбунова В.Н., Баранов В.С. Введение в молекулярную диагностику и генотерапию наследственных заболеваний. СПб.: Спец. лит, 1997. 287 с.
4. Горшкова Ю.В., Трегубов А.В. Информационные технологии в лаборатории прикладной фармакокинетики//Проблемы стандапртизации в здавоохранении. 2005. № 11. С. 129 132.
5. Ивахно С., Карнелюк А. Количественная протеомика и еѐ применение в системной биологии//Биохимия. 2006. Т. 71. № 10. С. 1312 1327.
6. Сарвилина И.В., Каркищенко В.Н., Горшкова Ю.В. Междисциплинарные исследования в медицине. М.: Техносфера, 2007. С. 15 56.
7. Blackstone N.B., Green D.R. The evolution of mechanism of cell suicid//Bioessays. 1999. Vol. 21. № 1. pp. 84 88.
8. Fiser A. Protein Structure modeling in proteomics era// Expert Rev. Proteomics. 204. Vol. 1. № 1. pp. 97 110.

ГОСТ
Задачи протеомики и ее значение для научных исследований
Протеомика – это раздел молекулярной биологии, занимающийся идентификацией и количественным анализом белков, или высокопроизводительным исследованием белков.
Объект изучения протеомики - это и есть протеом, то есть все белки, экспрессирующиеся в конкретной клетке, ткани или целом организме в определенный момент времени.
- Идентификация новых белков и их количественный анализ. Эта задача осложняется постоянным изменением совокупности всех белков организма, ткани или клетки в течение жизни/жизненного цикла. Даже разные типы клеток одного организма имеют различные протеомы. Кроме того, существуют и другие обстоятельства, усложняющие изучение протеома, например, явление посттрансляционных модификаций, которым подвержены многие белки. Для детального изучения посттрансляционных модификаций в протеомике даже выделяются отдельные разделы (гликопротеомика и фосфопротеомика).
- Формирование на основе полученных данных более глубокого и широкого понимания причин и механизмов развития различных заболеваний, к примеру, нейродегенеративных.
- Разработка новых методов лечения различных заболеваний.
- Поиск антигенов, которые могут использоваться в целях создания новых вакцин.
- Идентификация аномально экспрессирующихся белков при различных онкологических заболеваниях. Это позволяет своевременно диагностировать болезнь с помощью биомаркеров, а также выбрать рациональный метод лечения и спрогнозировать исход.
Открытие протеомики как науки позволило сделать огромный шаг в биологических и медицинских исследованиях различных направлений.
Значение протеомики для научных исследований:
- Благодаря последним достижениям протеомики стал возможным более глубокий анализ клеточных систем, подразумевающий изучение и описание их реагирования в ответ на различные воздействия (действия факторов внешней среды, изменения физиологии клетки в связи со сменой фаз клеточного цикла и многое другое) на уровне изменений белкового состава. Это позволяют намного глубже изучить суть множества биологических процессов, изучением которых занимается современная клиническая биохимия.
- Полученные биохимические данные позволяют сформировать и детализировать представления о различных болезнях на молекулярном уровне, что в свою очередь дает возможность расширить терапевтические и диагностические возможности различных заболеваний, включая онкологические.
- С помощью методов протеомики создаются протеомные карты для используемых в промышленности микроорганизмов, М. tuberculosis различных штаммов для разработки трансгенных растений, использующихся в медицинских целях, и новых лекарств.
- Протеомные исследования помогают находить мишени для действия лекарственных веществ при различных заболеваниях.
Готовые работы на аналогичную тему
В целях систематизации и хранения огромных объемов информации, полученной в ходе протеомных исследований, о разнообразных белках создаются информационные базы (или банки) данных, в которые заносятся все подтвержденные о них сведения.
Эти данные доступны в сети Интернете любому желающему и подразделяются на общие и специализированные. Общие базы содержат информацию о протеоме всего живого в глобальном смысле, то есть об известных белках всех живых организмов.
Примерами специализированных банков данных о протеоме являются банки данных трехмерных структур макромолекул (PDB), доменов белков (Prodom), лиганд-рецепторных комплексов белков (RELIBASE), лиганд-рецепторных комплексов и ионов металлов в активных белковых центрах (PROMISE), движения белковых субъединиц, доменов и петель (ProteinMotionDatabase), функционально значимых участков белков (PROSITE).
Методы исследования протеомики
Методы и технологии протеомики, делающие возможным комплексное изучение протеома, направлены на одновременное разделение с последующей идентификациюей и анализом всех белков, которые синтезируются в исследуемом объекте (клетке, органе, ткани, организме).

This paper focuses on the DNA insecticides as a novel preparation against gypsy moth (Lymantria dispar) based on DNA fragments of the anti-apoptotic gene of its nuclear polyhedrosis virus. It was found that the external application of a solution with two single-stranded DNA fragments from BIR and RING domains of LdMNPV (Lymantria dispar multicapsid nuclear polyhedrosis virus) IAP-3 (inhibitor of apoptosis) gene induces a significantly higher mortality of gypsy moth caterpillars in comparison with the application of the control solutions. This effect does not depend on the infection of caterpillars with LdMNPV. The results also show that DNA insecticides based on LdMNPV IAP-3 gene fragments can be selective in action, and at least are not harmful to tobacco hornworm (Manduca sexta) and black cutworm (Agrotis ipsilon). Part of the gypsy moth genome cloned with the fragments of BIR and RING domains of LdMNPV IAP-3 gene as primers, has an overlap with the corresponding part of the LdMNPV IAP-3 gene and Lymantria dispar IAP-1 mRNA for an inhibitor of apoptosis protein with the high cover by query, allows assuming that we cloned a part of gypsy moth anti-apoptosis gene. This finding gives the grounding that proposed here DNA insecticides might act through the blocking of the mechanisms involved in post transcriptional expression of insect anti-apoptosis genes. The results show the insecticidal potential of the viral genome fragments that can be used to create safe and relatively fast-acting DNA insecticides to control the quantity of gypsy moth populations, important task for forestry and agriculture.
Жимулёв И.Ф. Общая и молекулярная генетика / И. Жимулев. -Новосибирск: Сиб. унив. изд-во, 2007. -479 с.
Методические рекомендации к применению ПЦР-метода / В. Оберемок. -Симферополь: Таврический национальный университет им
Оберемок В.В. Методические рекомендации к применению ПЦР-метода / В. Оберемок. -Симферополь: Таврический национальный университет им. В.И. Вернадского, 2006. -35 с.
Recommendations
DNA insecticides
Baculovirus IAP (inhibitor of apoptosis) genes originated by capture of host genes. Antisense DNA oligonucleotides (oligoDNAs) from baculovirus IAP genes may down-regulate specific gene expression profiles in the baculovirus-free and baculovirus-infected insects. In this study, gypsy moth (Lymantria dispar) larvae infected with multicapsid nuclear polyhedrosis virus (LdMNPV) and LdMNPV-free larvae were treated with oligoDNA antisense to RING (really interesting new gene) domain of the LdMNPV IAP-3 gene. The results of insect mortality, biomass accumulation, histological studies, RT-PCR and analysis of DNA apoptotic fragmentation suggest that oligoRING induced apoptotic processes in both LdMNPV-free and LdMNPV-infected insect cells but they were more pronounced in the latter. These data open possibilities for new promising routes of insect pest control using antisense DNA oligonucleotides. . [more]
DIAP-2 gene expression analysis
The goal is to show the downward regulation of DIAP-2 gene by antisense ssDNA fragments from DIAP-2 gene.
Pioneer Evaluation of the Possible Side Effects of the Dna Insecticides on Wheat (Triticum Aestivum L.)
Роль макроэргических связей и слабых химических взаимодействий в жизни клетки

Белковое изобилие
В отличие от геномов, протеомы, т. е. полные наборы белков клетки, представлены активным набором молекул, которые постоянно модифицируются. При этом, если биохимия имеет дело с отдельными выделенными молекулами, то в случае с протеомом мы имеем дело с огромным молекулярным пулом (уместно провести аналогию с рыбой, пойманной на удочку, и рыбным изобилием принесенным неводом).
Функциональная, структурная и медицинская
Протеомика является классическим образцом междисциплинарной науки: она объединяет биологию, химию, компьютерное моделирование, сложную инструментальную технику
На официальной странице HUPO подробно изложены основные направления исследований, перечень которых может многое сказать даже неспециалисту: протеом человека, протеомика мозга, изучение антител, болезни, вызванные нарушениями метаболизма сахаров, протеомика сердечно-сосудистых заболеваний, протеомика стволовых клеток, определение биомаркеров заболеваний, изучение заболеваний человека на мышиных моделях и т. д.
Методологически в протеомике выделяют несколько направлений, главными среди которых являются функциональная, структурная и медицинская (клиническая) протеомика.
О целях функциональной протеомики уже упоминалось выше. Это получение информации о межбелковых взаимодействиях и их влиянии на экспрессию и модуляцию активности генов, а также пост-трансляционную модификацию белков в составе белковых комплексов.
Структурная протеомика, несмотря на то что является классическим направлением исследования белков, тем не менее, продолжает активно развиваться вследствие усовершенствования аналитических методов, таких как новые варианты ЯМР-спектроскопии, рентгеноструктурного анализа и масс-спектрометрии.
Современные достижения
Над поиском протеомных маркеров значимых заболеваний интенсивно работают исследователи всего мира – не только ученые из академических институтов, но и специалисты из исследовательских подразделений крупных и средних фармацевтических компаний.
Уже достигнуты определенные успехи в одной из самых проблемных областей медицины – ранней диагностике тяжелых заболеваний. В первую очередь это относится к раку предстательной железы (Downes et al., 2007; Larkin et al., 2010). Диагностика этого широко распространенного заболевания, проводящаяся по наличию в моче пациента белка простатспецифического антигена, – на сегодняшний день одна из самых ранних и точных.
К настоящему времени достигнуты неплохие результаты и в выявлении маркеров рака молочной железы (Mathelin et al., 2006; Gast et al., 2009). Из-за широкой клинической вариабельности этого заболевания в качестве маркеров предлагается использовать набор из 40 белков. Такой белковый профиль позволяет не только с высокой точностью диагностировать заболевание, но и прогнозировать эффективность лечения. Основные диагностические белки этого набора – гаптоглобин, трансферрин, аполипопротеины A-I и C-I – уже сегодня используются при диагностике рака молочной железы.

Ведутся исследования и по обнаружению маркеров нейродегенеративных заболеваний, таких как болезнь Альцгеймера, склерозов различной этиологии и т. д. (Cedazo-Minguez, Winblad, 2010). В этой области основными прогностическими маркерами являются ангиогенин (фермент, обеспечивающий рост кровеносных сосудов), креатининкиназа, фибриноген, аполипопротеин Е (Bowser, Lacomis, 2009)
В Сибири проблемами структурной и функциональной протеомики интенсивно занимаются в новосибирском Институте химической биологии и фундаментальной медицины СО РАН. В результате совместной работы с НИИ Психического здоровья ТНЦ СО РАМН проведена большая работа по поиску белков-маркеров шизофрении.
Этиология и патогенез этой тяжелейшей психической болезни неизвестны. Согласно одной из теорий возникновения шизофрении, в основе заболевания лежит нарушение белкового обмена. Сравнение протеомных профилей статистически достоверной выборки людей, страдающих шизофренией, и протеомных профилей здоровых добровольцев уже позволило исследователям выявить опредленный набор белков в качестве маркеров: аполипопротеин A-II, фосфомевалонат киназу и сериновую (треониновую) киназу. Дальнейшие усилия ученых будут направлены на уточнение роли этих белков в патогенезе болезни и внедрение этих маркеров в клиническую биохимию.
Cox J., Mann M. Is proteomics the new genomics? // Cell. 2007. V. 130(3). P. 395—398.
Capelo J.L., Carreira R., Diniz M. et al. Overview on modern approaches to speed up protein identification workflows relying on enzymatic cleavage and mass spectrometry-based techniques // Anal. Chim. Acta. 2009. V. 650. N 2. P. 151—159.
Читайте также:

