Реферат на тему платина по химии
Обновлено: 02.07.2024
Сегодня платина не только драгоценный металл, но – что значительно важнее – один из важных материалов технической революции. Один из организаторов советской платиновой промышленности, профессор Орест Евгеньевич Звягинцев, сравнивал значение платины со значением соли при приготовлении пищи – нужно немного, но без нее не приготовить обеда.
Содержимое работы - 1 файл
Платина.doc
Операция доводки – процесс трудный и тонкий. При недостатке восстановителя (кислота, сахар) осаждаемый хлороплатинат будет загрязняться иридием, при избытке же сама платина восстановится до хорошо растворимых соединений Pt 2+ , и выход благородного металла понизится.
Раствор хлористого аммония вводят на холоду. При этом основная часть платины в виде мелких ярко-желтых кристаллов (NH 4 ) 2 [PtCl 6 ] выпадает в осадок. Основная же масса спутников платины и неблагородных примесей остается в растворе. Осадок дополнительно очищают раствором нашатыря и сушат; фильтрат же отправляют в другой цех, чтобы выделить из него драгоценные примеси сырой платины – палладий, родий, иридий и рутений. Сухой осадок помещают в печь. После нескольких часов прокаливания при 800. 1000°C получают губчатую платину в виде спекшегося порошка серо-стального цвета.
Но это еще не та платина, которая нужна. Полученную губку измельчают и еще раз промывают соляной кислотой и водой. Затем ее плавят в кислородно-водородном пламени или в высокочастотной печи. Так получают платиновые слитки.
Когда платину добывают из сульфидных медно-никелевых руд, в которых содержание элемента №78 не превышает нескольких граммов на тонну руды, источником платины и ее аналогов служат шламы цехов электролиза меди и никеля. Шламы обогащают обжигом, вторичным электролизом и другими способами. В полученных концентратах содержание платины и ее извечных спутников – платиноидов – достигает 60%, и их можно извлекать из концентратов тем же путем, что и из сырой платины.
Методы получения платины и платиноидов из сульфидных руд разработаны в нашей стране группой ученых и инженеров. Многих из них уже нет в живых. Они сделали большое и очень важное для страны дело и потому заслуживают упоминания в рассказе об элементе №78. Это – И.И. Черняев, В.В. Лебединский, О.Е. Звягинцев, Н.К. Пшеницын, А.М. Рубинштейн, Н.С. Селиверстов, П.И. Рожков, Ю.Д. Лапин, Ю.Н. Голованов, Н.Д. Кужель, Е.А. Блинова, Н.К. Арсланова, И.Я. Башилов, И.С. Берсенев, Ф.Т. Киренко, В.А. Немилое, А.И. Степанов.
Химия платины
Как и положено элементу VIII группы, платина может проявлять несколько валентностей: 0, 2+, 3+, 4+, 5+, 6+ и 8+. Но, когда речь идет об элементе №78 и его аналогах, почти так же, как валентность, важна другая характеристика – координационное число. Оно означает, сколько атомов (или групп атомов), лигандов, может расположиться вокруг центрального атома в молекуле комплексного соединения. Наиболее характерная степень окисления платины в ее комплексных соединениях 2+ и 4+; координационное число в этих случаях равно соответственно четырем или шести.
Комплексы двухвалентной платины имеют плоскостное строение, а четырехвалентной – октаэдрическое.
На схемах комплексов с атомом платины посредине буквой А обозначены лиганды. Лигандами могут быть различные кислотные остатки (Cl – , Br – , I – , NO 2 – , NO 3 – , CN – , C 2 O 4 – , CNS – ), нейтральные молекулы простого и сложного строения (H 2 O, NH 3 , C 5 H 5 N, NH 2 OH, (CH 3 ) 2 S, C 2 H 5 SH) и многие другие неорганические и органические группы. Платина способна образовывать даже такие комплексы, в которых все шесть лигандов различны.
Химия комплексных соединений платины разнообразна и сложна. Не будем обременять читателя многозначительными частностями. Скажем только, что и в этой сложной области знаний советская наука неизменно шла и идет впереди. Характерно в этом смысле высказывание известного американского химика Чатта (1960 г.):
Потребность в платине
За последние 20. 25 лет спрос на платину увеличился в несколько раз и продолжает расти. До второй мировой войны более 50% платины использовалось в ювелирном деле. Из сплавов платины с золотом, палладием, серебром, медью делали оправы для бриллиантов, жемчуга, топазов. Мягкий белый цвет оправы из платины усиливает игру камня, он кажется крупнее и изящнее, чем в оправе из золота или серебра. Однако ценнейшие технические свойства платины сделали ее применение в ювелирном деле нерациональным.
Важнейшими областями применения платины стали химическая и нефтеперерабатывающая промышленность.
Платина – лучший катализатор реакции окисления аммиака до окиси азота NO в одном из главных процессов производства азотной кислоты. Катализатор здесь предстает в виде сетки из платиновой проволоки диаметром 0,05. 0,09 мм. В материал сеток введена добавка родия (5. 10%). Используют и тройной сплав – 93% Pt, 3% Rh и 4% Pd. Добавка родия к платине повышает механическую прочность и увеличивает срок службы сетки, а палладий немного удешевляет катализатор и немного (на 1. 2%) повышает его активность. Срок службы платиновых сеток – год-полтора. После этого старые сетки отправляют на аффинажный завод на регенерацию и устанавливают новые. Производство азотной кислоты потребляет значительные количества платины.
Платиновые катализаторы ускоряют многие другие практически важные реакции: гидрирование жиров, циклических и ароматических углеводородов, олефинов, альдегидов, ацетилена, кетонов, окисление SO 2 в SO 3 в сернокислотном производстве. Их используют также при синтезе витаминов и некоторых фармацевтических препаратов. Известно, что в 1974 г. на нужды химической промышленности в США было израсходовано около 7,5 т платины.
Не менее важны платиновые катализаторы в нефтеперерабатывающей промышленности. С их помощью на установках каталитического риформинга получают высокооктановый бензин, ароматические углеводороды и технический водород из бензиновых и лигроиновых фракций нефти. Здесь платину обычно используют в виде мелкодисперсного порошка, нанесенного па окись алюминия, керамику, глину, уголь. В этой отрасли работают и другие катализаторы (алюминий, молибден), но у платиновых – неоспоримые преимущества: большая активность и долговечность, высокая эффективность. Нефтеперерабатывающая промышленность США закупила в 1974 г. около 4 т платины.
Еще одним крупным потребителем платины стала автомобильная промышленность, которая, как это ни странно, тоже использует именно каталитические свойства этого металла – для дожигания и обезвреживания выхлопных газов. Для этих целей автомобильная промышленность США закупила в 1974 г. 11 т платины – почти столько же, сколько химическая и нефтеперерабатывающая отрасли, вместе взятые.
Четвертым и пятым по масштабам потребления покупателями платины в 1974 г. в США были электротехника и стекольное производство.
Из сплава платины с 5. 10% родия делают фильеры для производства стеклянного волокна. В платиновых тиглях плавят оптическое стекло, когда особенно важно ничуть не нарушить рецептуру.
В химическом машиностроении платина и ее сплавы служат превосходным коррозионностойким материалом. Аппаратура для получения многих особо чистых веществ и различных фторсодержащих соединений изнутри покрыта платиной, а иногда и целиком сделана из нее.
Очень незначительная часть платины идет в медицинскую промышленность. Из платины и ее сплавов изготавливают хирургические инструменты, которые, не окисляясь, стерилизуются в пламени спиртовой горелки; это преимущество особенно ценно при работе в полевых условиях. Сплавы платины с палладием, серебром, медью, цинком, никелем служат также отличным материалом для зубных протезов.
Спрос науки и техники на платину непрерывно растет и далеко не всегда бывает удовлетворенным. Дальнейшее изучение свойств платины еще больше расширит области применения и возможности этого ценнейшего металла.
Эталон килограмма
Из сплава платины с иридием в нашей стране изготовлен эталон килограмма, представляющий собой прямой цилиндр диаметром 39 мм и высотой тоже 39 мм. Он хранится в Ленинграде, во Всесоюзном научно-исследовательском институте метрологии им. Д.И. Менделеева. Раньше был эталоном и платино-иридиевый метр.
Минералы платины
Сырая платина – это смесь различных минералов платины. Минерал поликсен содержит 80. 88% Pt и 9. 10% Fe; купроплатина – 65. 73% Pt, 12. 17% Fe и 7,7. 14% Cu; в никелистую платину вместе с элементом №78 входят железо, медь и никель. Известны также природные сплавы платины только с палладием или только с иридием – прочих платиноидов следы. Есть еще и немногочисленные минералы – соединения платины с серой, мышьяком, сурьмой. К ним относятся сперрилит PtAs 2 , куперит PtS, брэггит (Pt, Pd, Ni)S.
Самые крупные
Самые крупные самородки платины, демонстрируемые на выставке Алмазного фонда СССР, весят 5918,4 и 7860,5 г.
Платиновая чернь
Платиновая чернь – мелкодисперсный порошок (размеры крупинок 25. 40 мкм) металлической платины, обладающий высокой каталитической активностью. Ее получают, действуя формальдегидом или другими восстановителями на раствор комплексной гексахлорплатиновой кислоты H 2 [PtCl 6 ].
Особенности платиновой посуды
Казалось бы, посуда из платины в лаборатории пригодна на все случаи жизни, но это не так. Как ни благороден этот тяжелый драгоценный металл, обращаясь с ним, следует помнить, что при высокой температуре платина становится чувствительной к многим веществам и воздействиям. Нельзя, например, нагревать платиновые тигли в восстановительном и тем более коптящем пламени: раскаленная платина растворяет углерод и от этого становится ломкой. В платиновой посуде не плавят металлы: возможно образование относительно легкоплавких сплавов и потери драгоценной платины. Нельзя также плавить в платиновой посуде перекиси металлов, едкие щелочи, сульфиды, сульфиты и тиосульфаты: сера для раскаленной платины представляет определенную опасность, так же, как фосфор, кремний, мышьяк, сурьма, элементарный бор. А вот соединения бора, наоборот, полезны для платиновой посуды. Если надо как следует вычистить ее, то в ней плавят смесь равных количеств KBF 4 и H 3 ВО 3 . Обычно же для очистки платиновую посуду кипятят с концентрированной соляной или азотной кислотой.

Платина — минерал, природная Pt из группы платины класса самородых элементов, Обычно содержит Pd, Ir, Fe, Ni. Чистая платина встречается весьма редко, большинство образцов представлены железистой разновидностью (поликсеном), а нередко и интерметаллидами: изоферроплатиной (Pt,Fe)3Fe и тетраферроплатиной (Pt,Fe)Fе. Платина, представленная поликсеном, является наиболее распространённым в земной коре из минералов платиновой подгруппы.
Смотрите так же:
СТРУКТУРА
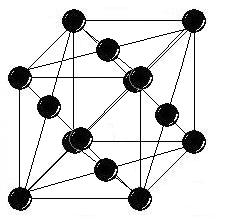
Кристаллическая решетка платины принадлежит к кубической системе. Молекула циклогексена имеет форму правильного шестиугольника. В рассматриваемой реакционной системе атомная структура катализатора и реагирующие молекулы обладают одним общим качеством – элементами симметрии третьего порядка. В кристалле платины такой порядок расположения атомов присущ только октаэдрической грани. В узлах расположены атомы платины. а = 0,392 нм, Z = 4, пространственная группа Fm3m
СВОЙСТВА

Цвет поликсена от серебряно-белого до стально-черного. Черта металлическая стально-серая. Блеск типичный металлический. Отражательная способность в полированных шлифах высокая – 65-70.
Твердость 4-4,5, у богатых иридием разностей – до 6-7. Обладает ковкостью. Излом крючковатый. Спайность обычно отсутствует. Уд. вес-15-19. Подмечена связь пониженного удельного веса с наличием пустот, занятых природными газами, а также включениями посторонних минералов. Обладает магнитностью, парамагнетик. Хорошо проводит электричество. Платина является одним из самых инертных металлов. Она нерастворима в кислотах и щелочах, за исключением царской водки. Платина также непосредственно реагирует с бромом, растворяясь в нём.
При нагревании платина становится более реакционноспособной. Она реагирует с пероксидами, а при контакте с кислородом воздуха — с щелочами. Тонкая платиновая проволока горит во фторе с выделением большого количества тепла. Реакции с другими неметаллами (хлором, серой, фосфором) происходят менее активно. При более сильном нагревании платина реагирует с углеродом и кремнием, образуя твёрдые растворы, аналогично металлам группы железа.
ЗАПАСЫ И ДОБЫЧА

Платина является одним из самых редких металлов: её среднее содержание в земной коре (кларк) составляет 5·10 −7 % по массе. Даже так называемая самородная платина является сплавом, содержащим от 75 до 92 процентов платины, до 20 процентов железа, а также иридий, палладий, родий, осмий, реже медь и никель.
Разведанные мировые запасы металлов платиновой группы составляют около 80 000 т и распределены, в основном, между ЮАР (87,5%), Россией (8,3%) и США (2,5%).
Самородную платину добывают на приисках, менее богаты рассыпные месторождения платины, которые разведываются, в основном, способом шлихового опробования.
Производство платины в виде порошка началось в 1805 году английским ученым У. Х. Волластоном из южноамериканской руды.
Сегодня платину получают из концентрата платиновых металлов. Концентрат растворяют в царской водке, после чего добавляют этанол и сахарный сироп для удаления избытка HNO3. При этом иридий и палладий восстанавливаются до Ir 3+ и Pd 2+ . Последующим добавлением хлорида аммония выделяют гексахлороплатинат(IV) аммония (NH4)2PtCl6. Высушенный осадок прокаливают при 800—1000 °C
Получаемую таким образом губчатую платину подвергают дальнейшей очистке повторным растворением в царской водке, осаждением (NH4)2PtCl6 и прокаливанием остатка. Затем очищенную губчатую платину переплавляют в слитки. При восстановлении растворов солей платины химическим или электрохимическим способом получают мелкодисперсную платину — платиновую чернь.
ПРОИСХОЖДЕНИЕ

Минералы платиновой группы в большинстве случаев встречаются в типичных магматических месторождениях, генетически связаннных с ультраосновными изверженными породами. Эти минералы в рудных телах выделяются в числе последних (после силикатов и окислов) в моменты, отвечающие гидротермальной стадии магматического процесса. Минералы платины, бедные палладием (поликсен, иридистая платина и др.), встречаются в месторождениях среди дунитов – оливиновых бесполевошпатовых пород, богатых магнезией и бедных кремнезёмом. При этом парагенетически они чрезвычайно тесно связаны с хромшпинелидами. Палладистая в никеле-палладистая платина преимущественно распространена в основных изверженных горных породах (норитах, габбро-норитах) и ассоциирует обычно с сульфидами: пирротином, халькопиритом и пентландитом.
В экзогенных условиях в процессе разрушения коренных месторождений и пород образуются платиноносные россыпи. Большинство минералов подгруппы платины в этих условиях химически устойчивы. Платина в россыпях встречается в виде самородков, чешуек, пластин, лепёшек, конкреций, а также скелетных форм и губчатых выделений размером от 0,05 до 5 мм., иногда до 12 мм. Уплощенные и пластинчатые зёрна платины указывают на значительное удаление от коренных источников и переотложение. Дальность переноса платины в россыпях обычно не превышает 8 км., в косовых россыпях она больше. Палладистая и медистая разновидности платины в зоне гипергенеза могут “облагораживаться”, теряя Pd, Cu, Ni. Содержание Cu и Ni, по А.Г. Бетехтину, в платине из россыпей может сокращаться более чем в 2 раза по сравнению с платиной коренного источника. В россыпях многих районов мира описаны новообразованная химически чистая платина и паладистая платина в виде натёчных форм радиально-лучистого строения.
ПРИМЕНЕНИЕ

Соединения платины (преимущественно, амминоплатинаты) применяются как цитостатики при терапии различных форм рака. Первым в клиническую практику был введен цисплатин (цис-дихлородиамминплатина(II)), однако в настоящее время применяются более эффективные карбоксилатные комплексы диамминплатины — карбоплатин и оксалиплатин.
Платина и её сплавы широко используются для производства ювелирных изделий.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Выберите документ из архива для просмотра:
Выбранный для просмотра документ Платиновые металлы.doc
Платиновые металлы, платиноиды, химические элементы второй и третьей триад VIII группы периодической системы Менделеева. К ним принадлежат: рутений (Ruthenium) Ru, родий (Rhodium) Rh, палладий (Palladium) Pd (легкие Платиновые металлы, плотность ~12 г/см3); осмий (Osmium) Os, иридий (Iridium) Ir, платина (Platinum) Pt (тяжелые Платиновые металлы, плотность ~22 г/см3). Серебристо-белые тугоплавкие металлы; благодаря красивому внешнему виду и высокой химические стойкости Платиновые металлы наряду с Ag и Au называют благородными металлами.
Имеются указания, что самородная платина в древности была известна в Египте, Эфиопии, Греции и Южной Америке. В 16 веке испанские конкистадоры обнаружили в Южной Америке вместе с самородным золотом очень тяжелый белый тусклый металл, который не удавалось расплавить. Испанцы назвали его платиной - уменьшительным от исп. plata - серебро. В 1744 испанский морской офицер Антонио де Ульоа привез образцы Pt в Лондон. Они вызвали живой интерес ученых Европы. Самостоятельным металлом Pt, которую первоначально считали белым золотом, была признана в середине 18 века.
В 1803 году английский ученый У. Х. Волластон обнаружил в самородной платине палладий, получивший это название от малой планеты Паллады (открытой в 1802), и родий, названный так по розовато-красному цвету его солей (от греч. rhodon - роза). В 1804 году английский химик Смитсон Теннант в остатке после растворения самородной Pt в царской водке открыл еще 2 металла. Один из них получил название иридий вследствие разнообразия окраски его солей (от греч. iris, род. падеж iridos -радуга), другой был назван осмием по резкому запаху его оксида (VIII) (от греч. osme - запах). В 1844 году К. К. Клаус при исследовании остатков от аффинажа (очистки) уральской самородной Pt в Петербургском монетном дворе открыл еще один Платиновый металл — рутений (от позднелат. Ruthenia— Россия).
Распространение в природе.
Платиновые металлы принадлежат к наиболее редким элементам, их среднее содержание в земной коре (кларки) точно не установлено. Самые редкие в земной коре — Rh и Ir (1·10-7% по массе), наиболее распространен Os (5·10-6%). Содержание Платиновых металлов повышено в ультраосновных и основных изверженных породах, происхождение которых связано с глубинными магматическими процессами. К этим породам приурочены месторождения Платиновых металлов. Еще выше среднее содержание Платиновых металлов в каменных метеоритах, которые считаются аналогами средней мантии Земли (кларки Платиновых металлов в каменных метеоритах составляют n·10-4—n·10-5% по массе). Для земной коры характерно самородное состояние Платиновых металлов, а у Rh, Pd, Os и Pt известны также немногочисленные соединения с серой, мышьяком и сурьмой. Установлено около 30 минералов Платиновых металлов, больше всего их у Pd (13) и Pt (9). Все минералы образовались на больших глубинах при высоких температурах и давлениях. Платина и другие Платиновые металлы встречаются в виде примеси во многих сульфидах и силикатах ультраосновных и основных пород. Геохимия Платиновых металлов в биосфере почти не изучена, их содержание в гидросфере и живом веществе не установлено. Некоторые осадочные марганцевые руды обогащены Pt (до 1·10-3%), в углях наблюдалась концентрация Pt и Pd (1·10-6%); повышенное содержание Платиновых металлов отмечалось в фосфоритах (вятских), в золе деревьев, растущих на месторождениях Pt.
Физические и химические свойства.
Физические и механические свойства Платиновых металлов сопоставлены в таблице. В дополнение необходимо указать, что Ru и Os очень тверды и хрупки (возможно вследствие присутствия примесей). Ph и Ir обладают меньшими твердостью и хрупкостью, а Pd и Pt ковки, поддаются прокатке, волочению, штамповке при комнатной температуре. Интересна способность некоторых Платиновых металлов (Ru, Pd, Pt) поглощать водород. Особенно это свойственно Pd, объем которого поглощает до 900 объемов Н2. При этом Pd сохраняет металлический вид, но растрескивается и становится хрупким. Все Платиновые металлы парамагнитны. Магнитная восприимчивость X·10-6 электромагнитных единиц при 18 °С равна 0,05 у Os; 0,50 у Ru; 5,4 у Pd; у Rh, Ir и Pt она несколько более 1,0.
Согласно давно установившейся традиции, Платиновые металлы принято помещать в VIII группу периодической системы элементов. В соответствии с этим; следовало ожидать, что все Платиновые металлы должны иметь высшую степень окисления +8. Однако это наблюдается только у Ru и Os, прочие же Платиновые металлы проявляют валентность не выше +6. Объясняется это тем, что у атомов Ru и Os остаются незаполненными соответственно внутренние подуровни 4f и- 5f. Поэтому для атомов Ru и Os возможно возбуждение не только с подуровней 5s и 6s на подуровни 5р и 6p, но и с подуровней 4d и 5d на подуровни 4f и 5f. Вследствие этого в атомах Ru и Os появляется по 8 непарных электронов и валентность +8. Электронные конфигурации атомов Rh, Ir, Pd, Pt такой возможности не допускают. Поэтому в некоторых вариантах таблицы Менделеева эти элементы (а также Со и Ni) выносят за пределы VIII группы. Все Платиновые металлы легко образуют комплексные соединения, в которых имеют различные степени окисления и различные координационные числа. Комплексные соединения Платиновых металлов, как правило, окрашены и очень прочны.
Химические свойства Платиновых металлов имеют много общего. Все они в компактном виде (кроме Os) малоактивны. Однако в виде так называемых черни (мелкодисперсного порошка) Платиновые металлы легко адсорбируют S, галогены и других неметаллы. (Чернь обычно получают восстановлением Платиновых металлов из водных растворов их соединений.) Компактные Ru, Rh, Os, Ir, будучи сплавлены с Pt, Zn, Pb, Bi, переходят в раствор при действии царской водки, хотя она не действует на эти Платиновые металлы, взятые отдельно.
Семейство Платиновых металлов можно разделить на 3 диады (двойки), образованные двумя стоящими один под другим легким и тяжелым Платиновыми металлами, а именно: Ru, Os; Rh, Ir; Pd, Pt.
При нагревании с О2 и сильными окислителями Ru и Os образуют легкоплавкие кристаллы-тетроксиды - оранжевый RuO4 и желтоватый OsO4. Оба соединения летучи, пары их имеют неприятный запах и весьма ядовиты. При действии восстановителей превращаются в низшие оксиды RuO2 и OsO2 или в металлы. Со щелочами RuO4 образует рутенаты, например, рутенат калия K2RuO по реакции:
RuO4+2KOH=K2RuO4 + ? О 2 + H2O.
При действии хлора K2RuO4 превращается в перрутенат калия:
Тетроксид OsO4 дает с КОН комплексное соединение K2[OsO4(OH)2]. С фтором и другими галогенами Ru и Os легко реагируют при нагревании, образуя соединения типа RuF3, RuF4, RuF5, RuF6. Осмий дает подобные же соединения, кроме OsF3. Весьма интересны комплексные соединения Ru с ксеноном Xe[RuF6] (канадский химик Н. Бартлетт, 1962), а также с молекулярным азотом - [(NO)(NH3)4 N2Ru(NH3)4NO]Cl (советский химик Н. М. Синицын, 1962) и [Ru(NH3)5N2]Cl2 (канадский химик А. Аллен, 1965).
На компактные Rh и Ir царская водка не действует. При прокаливании в О2 образуются оксиды Rh2O3 и Ir2О3, разлагающиеся при высоких температурах.
Pd легко растворяется при нагревании в HNO3 и концентрированной H2SO4 с образованием нитрата Pd(NO3)2 и сульфата PdSO4. На Pt эти кислоты не действуют. Царская водка растворяет Pd и Pt, причем образуются комплексные кислоты - тетрахлоропалладиевая кислота H2[PdCl4] и гексахлороплатиновая - коричнево-красные кристаллы состава H2[PtCl6]·6H2O. Из ее солей наибольшее значение для технологии Платиновых металлов имеет хлороплатинат аммония (NH4)2[PtCl6] - светло-желтые кристаллы, малорастворимые в воде и почти не растворимые в концентрированных растворах NH4Cl. При прокаливании они разлагаются по реакции:
(NH4)2[PtCl6] = Pt + Cl2 + 2NH4Cl
При этом Pt получается в мелкораздробленном виде (т. н. платиновая губка, или губчатая платина).
Разделение Платиновых металлов и получение их в чистом виде очень сложно вследствие большого сходства их химические свойств; это требует большой затраты труда, времени, дорогих реактивов. Для получения чистой Pt исходные материалы - самородную платину, платиновые шлихи (тяжелые остатки от промывки платиноносных песков), лом (негодные для употребления изделия из Pt и ее сплавов) обрабатывают царской водкой при подогреве. В раствор переходят: Pt, Pd, частично Rh, Ir в виде комплексных соединений H2[PtCl6], H2[PdCl4], H3[RhCl6] и Н2[IrCl6], а также Fe и Cu в виде FeCl3 и СuCl2. Нерастворимый в царской водке остаток состоит из осмистого иридия, хромистого железняка (FеСrO2), кварца и других минералов.
Из раствора осаждают Pt в виде (NH4)2[PtCl6] хлористым аммонием. Но чтобы в осадок вместе с Pt не выпал Ir в виде аналогичного нерастворимого соединения (NH4)2[IrCl6] (остальные Платиновые металлы NH4Cl не осаждает), предварительно восстанавливают Ir(+4) до Ir(+3) (например, прибавлением сахара C12Н22О11 по способу И. И. Черняева). Соединение (NН4)3[IrCl6] растворимо и не загрязняет осадка.
Хлороплатинат аммония отфильтровывают, промывают концентрированным раствором NH4Cl (в котором осадок практически не растворим), высушивают и прокаливают. Полученную губчатую платину спрессовывают, а затем оплавляют в кислородно-водородном пламени или в электрической печи высокой частоты. Из фильтрата, оставшегося после осаждения (NH4)2[PtCl6], и из осмистого иридия извлекают прочие Платиновые металлы путем сложных химические операций. В частности, для перевода в растворимое состояние нерастворимых в царской водке Платиновых металлов и осмистого иридия используют спекание с пероксидами ВаО2 или Na2O2. Применяют также хлорирование - нагревание смеси Pt-концентратов с NaCl и NaOH в струе хлора.
В результате аффинажа получают труднорастворимые комплексные соединения: гексахлорорутенат аммония (NH4)3[RuCl6], дихлорид тетрамминдиоксоосмия [OsO2(NH3)4]Cl2, хлорпентамминдихлорид родия [Rh(NH3)5Cl]Cl2, гексахлороиридат аммония (NH4)2[IrCl6] и дихлордиаммин палладия [Pd(NH3)2]Cl2. Прокаливанием перечисленных соединений в атмосфере Н2 получают Платиновые металлы в виде губки, например
[OsO2(NH3)4]Cl2 + 3H2 = Os +2H2O + 4N Н 3+2HCl
[Pd(NH3)2]Cl2 + H2 = Pd + 2NH3+2HCl.
Губчатые Платиновые металлы сплавляют в вакуумной электрической печи высокой частоты.
Применяют и других способы аффинажа, в частности основанные на использовании ионитов.
Основным источником получения Платиновых металлов служат сульфидные медно-никелевые руды, месторождения которых находятся в России (Норильск, Красноярский край), Канаде (округ Садбери, провинция Онтарио), ЮАР и других странах.
В результате сложной металлургич. переработки этих руд благородные металлы переходят в так называемых черновые металлы - нечистые никель и медь. Платиновые металлы собираются почти полностью в черновом Ni, a Ag и Аu - в черновой Сu. При последующем электролитич. рафинировании Ag, Au и Платиновые металлы осаждаются на дне электролитической ванны в виде шлама, который отправляют на аффинаж.
Из всех Платиновых металлов наибольшее применение имеет Pt. До 2-й мировой войны 1939-45 св. 50% Pt служило для изготовления ювелирных изделий. В последние 2-3 десятилетия ок. 90% Pt потребляется для науч. и промышленного целей. Из Pt делают лабораторные Приборы - тигли, чашки, термометры сопротивления и других,- применяемые в аналитич. и физико-хим. исследованиях. Ок. 50% потребляемой Pt (частично в виде сплавов с Rh, Pd, Ir, см. Платиновые сплавы) применяют как катализаторы в производстве азотной кислоты окислением МНз, в нефтехим. промышленности и мн. других Pt и ее сплавы используются для изготовления аппаратуры для некоторых химические производств. Ок. 25% Pt расходуется в электротехнике, радиотехнике, автоматике, телемеханике, медицине. Применяется Pt и как антикоррозионное покрытие (см. Платинирование).
Ir применяют главным образом в виде сплава Pt + 10% Ir. Из такого сплава сделаны междунар. эталоны метра и килограмма. Из него изготовляют тигли, в которых выращивают кристаллы для лазеров, контакты для особо ответственных узлов в технике слабых токов. Из сплава Ir с Os делают опоры для стрелок компасов и других приборов.
Способностью сорбировать Н2 и катализировать мн. химические реакции обладает Ru; он входит в состав некоторых сплавов, обладающих высокой твердостью и стойкостью против истирания и окисления.
Rh благодаря своей способности отражать ок. 80% лучей видимой части спектра, а также высокой стойкости против окисления является хорошим материалом для покрытия рефлекторов прожекторов и зеркал точных приборов. Но гл. область его применения - сплавы с Pt, из которых изготовляют лабораторную и заводскую аппаратуру, проволоку для термоэлектрич. пирометров и других
Pd в виде черни применяется преим. как катализатор во мн. химические производствах, в частности в процессах гидрогенизации. Из Pd изготовляют ювелирные изделия. Раствор H2[PdCl4] - чувствительный реактив на окись углерода. Полоска бумаги, пропитанная им, чернеет уже при содержании 0,02 мг/л СО в воздухе вследствие выделения Pd в виде черни по реакции:
Аффинаж Платиновых металлов сопровождается выделением ядовитых Cl2 и NOC1, что требует хорошей вентиляции и возможной герметизации аппаратуры. Пары легколетучих RuO4 и OsO4 вызывают общее отравление, а также тяжелые поражения дыхательных путей и глаз (вплоть до потери зрения). При попадании этих соединений на кожу она чернеет (вследствие восстановления их до RuO2, OsO2, Ru или Os) и воспаляется, причем могут образоваться трудно заживающие язвы. Меры предосторожности: хорошая вентиляция, резиновые перчатки, защитные очки, поглощение паров RuO4 и OsO4 растворами щелочей.
В организме Платиновые металлы представлены главным образом элементом рутением, а также искусств, радиоизотопами рутения и родия. Морские и пресноводные водоросли концентрируют радиоизотопы рутения в сотни и тысячи раз (по сравнению со средой), ракообразные - в десятки и сотни, моллюски - до десятков, рыбы и головастики лягушек - от единиц до сотен. 106Ru интенсивно мигрирует в почве, накопляясь в корнях наземных растений. У наземных млекопитающих радиоизотопы Ru всасываются через пищеварительный тракт, проникают в легкие, отлагаются в почках, печени, мышцах, скелете. Радиоизотопы Ru - составная часть радиоактивного загрязнения биосферы.
ПЛАТИНОВЫЕ МЕТАЛЛЫ И КАТАЛИЗ
Одним из наиболее удивительных свойств платиновых металлов является их способность ускорять (катализировать) различные химические процессы - гидрирования и дегидрирования, полимеризации и изомеризации, окисления и восстановления. Именно платине обязано своим появлением понятие "катализ", введенное Й.Я. Берцелиусом в 1835 году [5]. Каталитические свойства мелкодисперсного порошка платины - черни - еще раньше обнаружил Доберейнер, заметивший окисление спирта и образование уксусной кислоты под действием платины.
Нет ни одного платинового металла, который не сказал бы своего веского слова в катализе. С их участием организованы крупнотоннажные производства, например производство азотной кислоты, где на стадии окисления аммиака катализатором служит сетка из сплава платины и 5-10% родия, или производство уксусной кислоты взаимодействием метилового спирта с оксидом углерода (реакция карбонилирования) в присутствии карбонильного комплекса родия. Потенциального использования ждут сотни каталитически активных комплексов Ru, Os, Ir, Rh. Однако, пожалуй, самым ярким примером использования каталитических свойств металлов платиновой группы служит процесс очистки, или дожигания, выхлопных газов автомобилей. Проблему автомобильных катализаторов породила сама жизнь - с ростом числа автомобилей в мире резко ухудшилась экологическая ситуация.
Первоначально, в 70-е годы, в автомобильных катализаторах использовали только платину на металлических и неметаллических (g-Al2O3) носителях. Затем, принимая во внимание ее высокую стоимость, стали переходить на платино-палладиевые устройства, сокращая одновременно удельный расход платины с 3 до 1,6 г в расчете на один образец. Установка таких катализаторов позволила устранить только два токсичных компонента выхлопных газов: углеводороды и оксид углерода. Между тем при сжигании 1 т горючего наряду с 40-50 кг CO и 0,3-5 кг NH3 и углеводородов выделяется от 12 до 24 кг оксидов азота [6].
Химико-каталитические процессы, протекающие в системе очистки выхлопных газов, можно представить в виде группы уравнений.
Обстоятельное изучение платины провел шведский химик Хенрик Шеффер (1756 г.), который доказал, что она является не смесью уже известных металлов (например, золота и железа), как утверждали некоторые ученые, а новым химическим элементом.
В 1773-1774 годах М. де-Лиль получил ковкую форму платины. В 1783 году Шабано запатентовал процесс получения ковкой платины. Начиная со второй половины XVIII века платиной, ее свойствами, методами переработки и использования стали интересоваться многие химики-аналитики и технологи, в том числе и ученые Петербургской академии наук. Наиболее важные работы в этой области в первой половине XIX века - это создание методов получения ковкой платины.
Всемирную известность приобрели труды русского ученого и общественного деятеля А. А. Мусина-Пушкина (1760-1805). Еще в 1797 году он открыл новые способы получения амальгамы платины, а затем разработал совершенные методы ее ковки и очистки от железа. Работы Мусина-Пушкина были продолжены Архиповым, Варвинским, Любарским, Соболевским и др.
Исследование платины привело к открытию нескольких металлов, сопутствующих ей в природе и получивших общее название платиновых: в 1803 году были открыты палладий и родий, в 1804 году – осмий и иридий, а спустя сорок лет химикам стал известен и последний элемент этой группы – рутений.
Работам в этой области в немалой степени способствовал тот факт, что в 1819 году на Урале вблизи Екатеринбурга (ныне Свердловск) геологи обнаружили россыпные месторождения платины. Спустя пять лет в этих краях начал действовать первый в России платиновый рудник.
Важную страницу в биографию платины вписал известный русский инженер и ученый П.Г. Соболевский. Возглавив петербургскую Соединенную лабораторию Департамента горных и соляных дел, Горного кадетского корпуса и Главной горной аптеки, он вместе со своим сотрудником В.В. Любарским приступил к исследованию сырой платины и разработке технологии превращения ее в ковкий металл. Они растворяли самородную платину в царской водке, а из этого раствора, добавляя NH4Cl, осаждали хлороплатинат аммония (NH4)2[PtCl]. Этот осадок промывали, а затем прокаливали на воздухе. Получившейся губчатой платиной они заполнили специально изготовленные железные формы, спрессовали ее на винтовом прессе, нагрели до белого каления, затем вновь подвергли большому давлению. Таким образом, минуя плавление, губчатая платина превратилась в монолитные изделия, которые нельзя было отличить от литых, этот способ позволял делать из уральской платины изделия высокого качества. Так в 1826 году впервые в истории техники был создан и применен на практике оригинальных технологический процесс, сохранивший свое значение и по сей день. Он лежит в основе современных методов порошковой металлургии.
21 марта 1827 году в конференц-зале Петербургского горного кадетского корпуса на многолюдном торжественном собрании Ученого комитета по горной и соляной части были показаны изготовленные новым методом первые изделия из русской платины. Открытие П.Г. Соболевского и В.В. Любарского получило мировую известность. В 1828 году Соболевский описал свой способ получения ковкой платины в Петербургском “Горном журнале” под названием: “Об очищении и обработке сырой платины”.
Тогда же, благодаря предприимчивости министра финансов Е.Ф. Канкрина, Соболевскому было поручено приступить к чеканке 3-, 6-и 12-рублевых платиновых монет. Уже вскоре петербургский Монетный двор начал полным ходом выпускать такие деньги. За сравнительно короткий срок было выпущено почти полтора миллиона платиновых монет, на которые пошло около 15 тонн платины. Однако цена на этот металл росла, платиновые деньги становились все дороже и дороже, в результате чего их истинная стоимость значительно превысила нарицательную и уже вскоре они фактически вышли из обращения.
За несколько лет на Монетном дворе скопились значительные количества остатков платиновой руды. Министерство финансов поручило казанскому профессору Карлу Клаусу найти способ переработать их на платину. Через два года ему удалось опробовать новый метод извлечения платины из остатков руды.
В середине XIX столетия французские ученые А. Сент-Клер Девиль и Ж. Дебре предложили новый метод получения платины. Они изобрели специальную печь, облицованную изнутри пористым известняком, куда загружался губчатый металл. Плавили его с помощью газовых горелок, которые вставлялись через отверстия в верхней части печи. Этот процесс позволял извлекать более чистую и ковкую платину, так как примеси железа, меди и свинца образовывали легкоплавкие шлаки и поглощались стенками печи.
В 1913 году под руководством Н.Н. Барабошкина на базе исследовательских работ, проведенных в лаборатории Петербургского горного института, в г. Екатеринбурге начали строительство аффинажного завода для переработки добываемой шлиховой платины. В 1916 году начали выпускать лишь губчатую платину и только в 1923 году стали выделять спутники платины.
Основные свойства платины.
Положение в периодической системе элементов.
Платина - символ Pt (лат. Platinum), химический элемент 6-го переходного периода периодической системы. Для него характерно заполнение 5d-электронных орбиталей при наличии одного или двух s-электронов на более высоких 6s- электронных орбиталях.
Характеристика атомов платины.
5d 9 6s 1
Атомный объем, см 3
Будучи элементом переходного периода, платина характеризуется различными степенями окисления. В большинстве своих соединений платина проявляет степени окисления +2 и +4. С этими степенями окисления, благодаря высоким зарядам, небольшим ионным радиусам и наличию незаполненных d-орбиталей, она представляет собой типичный комплексообразователь. Так, в растворах все его соединения, включая простые (галогениды, сульфаты, нитраты), превращаются в комплексные, поскольку в комплексообразовании участвуют ионы соединений, присутствующих в растворе, а также вода. Поэтому гидрометаллургия платины основана на использовании ее комплексных соединений.
Начнем с самого неприятного – с токсичности соединений платины. Являясь биоксенным элементом, платина при введении в организм либо никак себя не проявляет, либо вызывает тяжелейшие поражения, в первую очередь почек, печени, нервной и иммунной систем.
Сама по себе металлическая платина токсического действия не оказывает, однако, примеси, содержащиеся в платиновой черни (в первую очередь, теллур), ядовиты, и при попадании порошка платины в желудочно-кишечный тракт возникают некрозы участков слизистой ЖКТ, зернистая дистрофия гепатоцитов, набухание эпителия извитых канальцев почки, а также “общая интоксикация”. Смертельные отравления металлической платиной не отмечены.
Соли платины дают общую интоксикацию организма с гибелью подопытных животных в период от трех часов до трех суток после введения препарата. При ингаляционном отравлении гексахлороплатинатом аммония смертельные концентрации не были достигнуты. Интоксикация сопровождается нарушением углеводного, белкового и холестеринового обмена. У человека – тошнота, диарея, понижение уровня гемоглобина в крови, разрушение почек. Гексахлороплатинат аммония способен впитываться в кожу, при этом платина обнаруживается в всех внутренних органах, крови и моче, накопление происходит в селезенке, надпочечниках, почках и половых органах, где платина обнаруживается даже через тридцать дней после введения.
Вдыхание комплексных соединений платины в виде пыли или тумана (5-70 мг/м 3 ) вызывают синюху, затруднение дыхания, кашель, при длительном воздействии бронхиальную астму. В ряде случаев отмечены аллергические реакции (покраснение и шелушение кожи, высыпания на открытых участках тела). Сходное действие оказывают платинохлористоводородная кислота и гексахлороплатинат аммония. У химиков при действии (NH4)2PtCl6 развивается светобоязнь, насморк, при длительном воздействии – астма. Любопытно отметить, что по индивидуальной чувствительности к соединениям платины у разных людей наблюдаются существенные отличия, сцепленные с некоторыми генетически обусловленными признаками.
К последствиям хронического отравления комплексами платины относится так называемый платиноз – совокупность вышеуказанных симптомов, носящая постоянный характер. У страдающих платинозом выявлен дисбаланс адренорецепторной регуляции. При длительной работе с платиной приобретенная аллергия возникает приблизительно в половине случаев.
В целом, хотя “благородная” платина уже более века служит химикам-неорганикам, исследующим координационные соединения, ее ядовитый характер требует серьезного и осторожного к себе отношения.
Платина очень тугоплавкий и труднолетучий металл, кристаллизуется в гранецентрированные кубические решетки. При воздействии на растворы солей восстановителями металл может быть получен в виде “черни”, обладающей высокой дисперсностью.
Платина в горячем состоянии хорошо прокатывается и сваривается. Характерным свойством является способность абсорбировать на поверхности некоторые газы, особенно водород и кислород. Склонность к абсорбции значительно возрастает у металла, находящегося в тонкодисперсном и коллоидном состоянии. Платина (особенно платиновая чернь) довольно сильно поглощает кислород: 100 объемов кислорода на один объем платиновой черни. Вследствии способности к абсорбции газов платину применяют в качестве катализаторов при реакциях гидрогенизации и окисления. Каталитическая активность увеличивается при использовании черни.
Физические свойства.
Плотность при 20 °С, г/дм 3
Платина как элемент VIII группы может проявлять несколько валентностей: 0, 2+, 3+, 4+, 5+, 6+ и 8+. Но, когда идет речь об элементе № 78 почти также, как валентность, важна другая характеристика - координационное число. Оно означает, сколько атомов (или групп атомов), лигандов, может расположиться вокруг центрального атома в молекуле комплексного соединения. Для степени окисления 2+ и 4+ координационное число равно соответственно четырем или шести.
Комплексы двухвалентной платины имеют плоскостное строение, а четырехвалентной - октаэдрическое.
Платина чрезвычайно устойчива против коррозии. При обычной температуре она не взаимодействует с минеральными и органическими кислотами. Серная кислота при нагреве медленно растворяет платину. Полностью платина растворяется в царской водке:
При растворении получается гексахлороплатиновая, или платинохлористоводородная, кислота H2[PtCl6], которая при выпаривании раствора выделяется в виде красно-бурых кристаллов состава H2[PtCl6]•H2O. При повышенных температурах платина взаимодействует с едкими щелочами, фосфором и углеродом.
С кислородом платина образует оксиды (II), (III) и (IV): PtO, Pt203 и PtO2. Оксид PtO получается при нагревании порошка платины до 430 °С в атмосфере кислорода при давлении 0.8 МПа. Оксид Pt2O3 можно получить при окислении порошка металлической платины расплавленным пероксидом натрия. Оксид PtO2 - порошок черного цвета - получается при кипячении гидроксида платины (II) со щелочью:
Гидроксид платины (IV) можно получить осторожным приливанием щелочи к раствору хлороплатината калия:
Сернистое соединение PtS - порошок коричневого цвета, не растворимый в кислотах и царской водке; PtS2 - черный осадок, получаемый из растворов действием сероводорода, растворимый в царской водке.
Платина при нагревании хорошо соединяется с фтором и хлором. При 360 °С воздействием хлора на платину можно получить тетрахлорид PtCl4, который при температуре выше 370 °С переходит в трихлорид PtCl3, а при 435 °С распадается на хлор и металлическую платину; PtCl2 растворяется в слабой соляной кислоте с образованием платинисто-хлористоводородной кислоты H2[PtCl4], при действии на которую солей металлов получаются хлороплатиниты Me2[PtCl4] (где Me - K, Na, NH4 и т.д.).
Тетрахлорид платины PtCl4 при воздействии соляной кислоты образует платинохлористоводородную кислоту H2[PtCl6]. Соли ее - хлороплатинаты Me2[PtCl6]. Практический интерес представляет хлороплатинат аммония (NH4)2[PtCl]6 - кристаллы желтого цвета, малорастворимые в воде, спирте и концентрированных растворах хлористого аммония. Поэтому при аффинаже платину отделяют от других платиновых металлов, осаждая в виде (NH4)2[PtCl6].
В водных растворах сульфаты легко гидролизуются, продукты гидролиза в значительном интервале pH находятся в коллоидном состоянии. В присутствии хлорид-ионов сульфаты платины переходят в хлороплатинаты.
Поведение платины в обогатительных операциях.
Формы нахождения платины в рудах.
Формы нахождения платины в рудах определяют ее поведение в последующих процессах обогащения. Поэтому их изучение имеет большое значение для выбора технологической схемы переработки платинусодержащих руд и концентратов.
Кларк и Вашингтон, а позднее И. И В. Ноддак подсчитали содержание платины в земной коре. Первые принимали в расчет только ту платину, которая находится в россыпях и коренных ультраосновных породах, а вторые учитывали также платину, находящуюся в рассеянном состоянии. Иногда пользуются данными по распространенности платины, приводимыми Гольдшмидтом. Обобщение ряда исследований на основе многочисленных определений дано А. П. Виноградовым.
Читайте также:

