Реферат на тему неорганические материалы
Обновлено: 02.07.2024
Все вещества делятся на простые и сложные. Простые вещества разделяют на металлы и неметаллы (металлоиды). Последние существуют в твердом (сера, кремний, йод и т д), жидком (бром), газообразном (хлор, кислород, водород) состояниях. Сложные неорганические вещества подразделяются на следующие классы: оксиды, основания, соли и кислоты. Оксиды - это соединения элементов с кислорода со степенью окисления (-2), причем атомы кислорода не связываются между собой, например: СО2-оксид углерода (И V). Если связь между двумя атомами кислорода существует, то это пероксиды, например: Н2О2 или Н-О-О-Н.
Файлы: 1 файл
Реферат.docx
Все вещества делятся на простые и сложные. Простые вещества разделяют на металлы и неметаллы (металлоиды). Последние существуют в твердом (сера, кремний, йод и т д), жидком (бром), газообразном (хлор, кислород, водород) состояниях. Сложные неорганические вещества подразделяются на следующие классы: оксиды, основания, соли и кислоты.
Оксиды - это соединения элементов с кислорода со степенью окисления (-2), причем атомы кислорода не связываются между собой, например: СО2-оксид углерода (И V).
Если связь между двумя атомами кислорода существует, то это пероксиды, например: Н2О2 или Н-О-О-Н.
В свою очередь, оксиды делятся на солетвирни и несолетвирни. Оксиды, которые не образуют солей, называют несолетвирнимы, в частности это: СО, КО, био, К2О - их мало. Солетвирних - много. Солетвирни делятся на: а) основные, б) кислотные, в) амфотерные.
а) основные оксиды - это такие соединения, которые с водой образуют основы. Связь ионный. Твердые вещества. В основном, к ним относятся оксиды щелочных и щелочно-земельных металлов I и II групп, соответственно: Ка2О, СаО и др.. Все они взаимодействуют с водой
К2О + Н2О ^ 2КаОН, СаО + Н2О ^ Са (ОН) 2.
С кислотами взаимодействуют с образованием солей и воды:
СаО + НС1 ^ СаС12 + Н2О.
Основные оксиды взаимодействуют с кислотными, образуя соли
СаО + БО3 ^ СаБО4, ВаО + С12Оу ^ Ва (С1О4) 2.
б) кислотные оксиды - это такие вещества, которые при взаимодействии с водой образуют кислоту. Их еще называют ангидридами кислот: БО2, БО3, Р2О3, СО2., СгО3, Мп2О7 и др..
Связь - ковалентная полярная. Агрегатное состояние - разное, например: (жидкость) БО3 + Н2О ^ Н2БО4 - сернистая кислота, (твердое тело) Р2О3 + 3Н2О ^ 2Н3РО3 - фосфорная кислота, газ) N02 + Н2О ^ HN02 + HN03 - Нитритная и нитратная кислоты, соответственно.
Кислотные оксиды взаимодействуют со щелочами, в результате чего образуются соль и вода: S02 + 2ШОН ^ Na2SO3 + Н2О.
Они взаимодействуют с основными и амфотерными оксидами с образованием солей, например: Р2О5 + СаО ^ Са (РО3) 2 - метафосфат кальция.
в) амфотерные оксиды - это такие оксиды, которые в зависимости от условий проявляют свойства или основных, или кислотных оксидов. К ним относятся оксиды некоторых металлов главных подгрупп (алюминия, бериллия) и побочных подгрупп, но в промежуточных степенях окисления (А12О3, ZnO, СИО, МпО2, Бе2О3). Связь ионно-ковалентная. Все они твердые. Амфотерные оксиды с водой непосредственно не взаимодействуют. С кислотами и щелочами дают различные соли
ZnO + 2НС1 ^ ZnC12 + Н2О, А12О3 + 6HNO3 ^ 2A1 (NO) 3 + 3Н2О,
ZnO + 2NaOH ^ NaZnO2 + Н2О, А12О3 + 2ШОН ^ 2NаА1O2 + Н2О, Бе2Оз +2 NаOH ^ 2NаFеO2 + Н2О.
Основные и кислотные оксиды имеют противоположные свойства. Оксиды получают или взаимодействием веществ с кислородом, или разложением сложных веществ.
Неорганические теплоизоляционные материалы и изделия изготовляют на основе минерального сырья (горных пород, шлака, стекла, асбеста). К этой группе относят: минеральную, стеклянную вату и изделия из них, некоторые виды легких бетонов на пористых заполнителях (вспученном перлите и вермикулите), ячеистые теплоизоляционные бетоны, пеностекло, асбестовые и асбестосодержащие материалы, керамические и др. Эти материалы малогигроскопичные, огнестойки, не подвергаются загниванию. Их используют как для утепления строительных конструкций, так и для изоляции горячих поверхностей промышленного оборудования и трубопроводов.
1. Минеральная вата и изделия из нее по объему производства занимает первое место среди всех теплоизоляционных материалов. Этому способствует наличие неограниченных сырьевых ресурсов для их получения в виде горных пород (доломита, известняка, мергелей и др.) и шлаков, простота технологического процесса и небольшие капиталовложения при организации производства.
Минеральная вата состоит из искусственных минеральных волокон.
Производство минеральной ваты включает две основные технологические операции — получение расплава и превращение его в тончайшие волокна. Для получения расплава применяют, как правило, шахтные плавильные печи — вагранки или ванные печи. Превращение расплава в минеральное волокно производят дутьевым или центробежным способами.
При дутьевом способе выходящий из печи расплав разбивается на мелкие капельки струей пара или воздуха, которые вдуваются в специальную камеру и в полете сильно вытягиваются, превращаясь в тонкие волокна диаметром от 2 до 20 мкм.
При центробежном способе струя жидкого расплава поступает на быстровращающийся диск центрифуги и под действием большой окружной скорости сбрасывается с него и вытягивается в волокна. Объемная масса минеральной ваты — 75—150 кг/м 3 , теплопроводность 0,042—0,046 Вт/ (м • К). Вата не горит, не гниет, ее не портят грызуны, она малогигроскопична, морозостойка и температуростойка. Минеральную вату применяют для теплоизоляции как холодных (до —200 °С), так и горячих (до +600 °С) поверхностей, чаще в виде изделий: войлока, матов, полужестких и жестких плит, скорлуп, сегментов. Иногда вату используют в качестве теплоизоляционной засыпки пустотелых стен и перекрытий, для чего ее гранулируют, т. е. превращают в рыхлые комочки во вращающемся дырчатом барабане.
Минеральный войлок выпускают в виде листов и рулонов из минеральной ваты, слегка пропитанной дисперсиями синтетических смол и спрессованной (рис. 1, а). Объемная масса войлока — 100—150 кг/м 3 , теплопроводность — 0,046—0,052 Вт/ (м- К). Листы и полотнища минерального войлока длиной 100—300 см, шириной 275_125 см, толщиной 3—6 см применяют для утепления стенперекрытий в кирпичных, бетонных и деревянных домах.
Минераловатные маты представляют собой минераловатный ковер, заключенный между битуминизированной бумагой, стеклотканью или металлической сеткой, прошитый прочными нитями ил и тонкой проволокой (рис. 1, г). Длина матов— от 60—120 но 500 см, ширина — от 30—100 до 150 см, толщина — от 3 до 10 см. Объемная масса матов— 100—200 кг/м 3 , теплопроводность — от 0,046 до 0,058 Вт/(м-К).
Маты применяют для теплоизоляции ограждающих конструкций жилых и общественных зданий, их используют также для утепления свежеуложенных бетонов и растворов при строительстве в холодное время года.
Минераловатные полужесткие плиты (рис. 1 б) изготовляют из минерального волокна путем нанесения на него распылением связующего (синтетических смол или битума) с последующим прессованием и термообработкой для сушки или полимеризации. Объемная масса плит в зависимости от вида связующего и уплотнения — 75—300 кг/м 3 , теплопроводность — 0,046—0,069 Вт/(м-К).
Полужесткие изделия применяют для теплоизоляции ограждающих конструкций зданий и горячих поверхностей оборудования при температуре до 200—300 °С, если изделия изготовлены на синтетическом связующем, и до 60 °С— на бутумном связующем.
Минераловатные жесткие изделия получают смешиванием минеральной ваты с битумной эмульсией или синтетическими смолами с последующим формованием, прессованием и прогреванием отформованных изделий для их сушки или полимеризации. Минераловатные жесткие плиты изготовляют длиной 1 м, шириной 0,5 и толщиной 4, 5, 6 см. Жесткие плиты делят на марки от 150 до 400 кг/м 3 . Теплопроводность плит находится в пределах 0,051—0,087 Вт/ (м-К).
Минераловатные жесткие плиты применяют для утепления стен, покрытий и перекрытий жилых и промышленных зданий и. холодильников. Жесткие плиты и фасонные изделия — сегменты, скорлупы (рис. 1, б) на синтетическом и бентонитоколлоидном связующих применяют для теплоизоляции горячих поверхностей.
Промышленность выпускает также Минераловатные плиты повышенной жесткости и твердые плиты на синтетических связующих, которые характеризуются более высокой прочностью и большими размерами, чем обычные жесткие плиты. Такие плиты размером 180x120 см, а при определенных параметрах уплотнения до 360 X 120 см экономически целесообразно применять для утепления стен, перекрытий и покрытий зданий. Например, 1 м 2 покрытия с использованием твердых минераловатных плит (рис. 2) в 5—7 раз легче и на 25—40 % дешевле по сравнению с железобетонным покрытием, утепленным пенобетоном (рис. 3).
2. Стеклянная вата и изделия из нее.
Стеклянная вата является разновидностью искусственного минерального волокна. Для изготовления ваты используют стеклянный бой или те же сырьевые материалы, что и для оконного стекла: кварцевый песок, известняк или мел, соду или сульфат натрия. Тонкое стеклянное волокно для текстильных материалов получают вытягиванием из расплавленной стекломассы (фильерный и штабиковый способы). Более грубое волокно, применяемое для тепловой изоляции, изготовляют дутьевым или центробежным способами. Такое волокно обычно называют стеклянной ватой.
Объемная масса стеклянной ваты обычно не превышает 125 кг/м 3 , i теплопроводность — 0,052 Вт/ (м-К). Промышленность выпускает также супертонкое стекловолокно с объемной массой до 25 кг/м 3 и теплопроводностью около 0,03 Вт/(м-К).
Стеклянная вата практически не дает усадки в конструкциях, волокна ее не разрушаются при длительных сотрясениях и вибрации. Она плохо проводит и хорошо поглощает звук, малогигроскопична, морозостойка. Слой стеклянной ваты толщиной 5 см соответствует по термическому сопротивлению кирпичной стене толщиной в 1 м.
Стекловатные маты длиной до 300 см, шириной до 100 см и толщиной 2—6 см и полужесткие и жесткие плиты размером 100 X (50—150) X (3—5 см), а также фасонные изделия на связующих из синтетических смол применяют в качестве теплоизоляционного и акустического материала при температуре не выше 200 о С, а прошивные маты и полосы — при температуре до 450 °С.
3. Пеностекло (ячеистое стекло) выпускают в виде блоков или плит размером 50 X 40 X (8—14) см путем спекания порошка стекольного боя или некоторых горных пород вулканического происхождения (трахиты, сиениты, нефелины, обсидианы и др.) с газообразователями, например с известняком или антрацитом. При температуре 800—900 °С частицы стекольного боя начинают сплавляться, а выделяющиеся из газообразователя газы образуют большое количество пор (пористость от 80 до 95 %). При этом в стекловидном материале межпоровых стенок содержатся мельчайшие микропоры. Двоякий характер пористости обеспечивает высокую теплоизоляционную способность пеностекла.
Теплопроводность у плит из пеностекла при объемной массе 150—300 кг/м 3 колеблется от 0,053 до 0,12 Вт/(м-К), а предел прочности при сжатии от 2,0 до 6,0 МПа, при этом они хорошо обрабатываются' (пилятся, сверлятся, шлифуются). Изделия из пеностекла обладают высокой водостойкостью, морозостойкостью и температуростойкостью. Для стекол обычного состава температуростойкость равна 300—400 °С, для бесщелочного стекла — до 1000 о С.
Пеностекло применяют как утеплитель стен, перекрытий, полов и кровель промышленных и гражданских зданий, в том числе железобетонных панелей в сборных крупнопанельных домах, в конструкциях холодильников, а также для изоляции тепловых установок и сетей.
4. Теплоизоляционные материалы из вспученных горных пород и изделия на их основе. Некоторые горные породы, содержащие в своем составе связанную воду, при нагреве теряют ее. Вода превращается в пар, вспучивает предварительно дробленую породу, в результате Чего образуются пористые зерна (вспученный перлит) или чешуйки (вспученный вермикулит).
Вспученный перлит получают путем измельчения и обжига перлита, обсидиана и других вулканических горных пород стекловидного строения, содержащих небольшое количество гидратной воды (3—5 %). При быстром нагреве до температуры 900—1200 о С вода переходит в пар и вспучивает размягченную породу; она распадается на отдельные шарообразные зерна с увеличением в объеме в 5—10 раз и более (пористость зерен 80—90 %). Объемная насыпная масса перлитового песка колеблется от 100 до 250 кг/м 3 , щебня до 500 кг/м 3 . Теплопроводность при 25 °С находится в пределах 0,046—0,071 Вт/(м-К).
Вспученные вермикулит и перлит используют в виде теплоизоляционных засыпок при температуре изолируемых поверхностей соответственно до 1100 и 800 °С. На их основе в смеси с вяжущим веществом получают растворные и бетонные смеси, из которых формуют теплоизоляционные изделия (плиты, скорлупы, сегменты, кирпич) или выполняют теплоизоляционные, звукопоглощающие и декоративные штукатурки, а на основе перлитового песка и щебня также конструктивно-теплоизоляционные конструкции. Например, цементный бетон на вспученном перлите при объемной массе 900— 1000 кг/м 3 имеет прочность при сжатии до 10 МПа, а теплопроводность — около 0,26 Вт/ (м • К).
Безобжиговые перлитовые и вермикулитовые теплоизоляционные изделия изготовляют на портландцементе, жидком стекле, синтетических смолах, битуме, различных клеях. Обжиговые изделия получают на связке из огнеупорной глины, диатомита. Свойства изделий зависят от вида вяжущего. Объемная масса колеблется от 200 до 500 кг/м 3 , а теплопроводность при 25 °С от 0,06 до 0,1 Вт/(м • К). Изделия на битумной связке применяют при температуре эксплуатации до 60 °С, на цементном связующем и жидком стекле — до 600 о С, а на керамической связке — до 900—1200 °С.
5. Асбестосодержащие теплоизоляционные материалы и изделия разделяют на асбестовые, состоящие только из асбестового волокна (асбестовая бумага, картон и изделия из них), и асбестосодержащие, изготовляемые из смеси асбестовых волокон с неорганическими вяжущими веществами (магнезиальные вяжущие, известь, цемент) или с трепелом (диатомитом). Порошкообразные смеси этих материалов перед применением затворяют водой и полученную пластическую массу наносят на изолируемую поверхность. В заводских условиях из таких же масс формуют изделия — плиты, сегменты и скорлупы.
Асбестовую бумагу изготовляют в виде листов и рулонов из асбестового волокна 5—6-го сортов с небольшим количеством (до 5 %) склеивающих веществ (крахмал, казеин). Толщина бумаги —
0,3—1,5 мм, объемная масса — 450—950 кг/м 3 , а теплопроводность при 100 °С— от 0,14 до 0,198 Вт/ (м-К); предельная температура применения 500 °С. Кроме гладкой выпускают гофрированную бумагу. Гладкую бумагу используют в качестве теплоизоляционной прокладки при изоляции трубопроводов, а гофрированную — для изготовления одной из разновидностей асбестового картона (ячеистый асбестовый картон).
Асбестовый картон изготовляют из асбеста 4—5-го сорта с наполнителем (каолин) и склеивающим веществом (крахмал) в виде листов толщиной от 2 до 10 мм. Объемная масса листов — 900— 1000 кг/м 3 , теплопроводность при 100 °С — 0,182 Вт/ (м-К). Асбестовый картон применяют для изоляции трубопроводов (до 500 °С), а также для покрытий деревянных конструкций и дверей, чтобы повысить их огнестойкость.
Асбестовый картон ячеистого строения изготовляют путем склеивания жидким стеклом или клеем чередующихся слоев гладкой и гофрированной асбестовой бумаги. Благодаря пористому строению такой картон легок и мало теплопроводен (теплопроводность при 50°С и объемной массе 200—600 кг/м 3 составляет 0,052—0,093 Вт/(м-К). В виде плит его применяют для теплоизоляции плоских поверхностей, в виде цилиндрических и полуцилиндрических покрышек — для изоляции трубопроводов.
Асбестодиатомовые (асбестотрепельные) теплоизоляционные материалы представляют собой порошки, состоящие из смеси асбеста (15 %) и молотого трепела или диатомита (асбозурит), иногда с добавками других веществ — слюдяных чешуек, отходов асбестоцементных заводов (асбослюда, асботермит). Порошки затворяют водой и в виде тестообразной массы наносят на изолируемую поверхность. Объемная масса изделий из асбозурита в сухом состоянии — 500—800 кг/м 3 , а теплопроводность при 100 °С — от 0,093 до 0,21 Вт/(м-К); температуростойкость — до 600 °С.
Из асбестоизвестковотрепельных теплоизоляционных изделий наибольшее применение нашли вулканитовые изделия. Их изготовляют из смеси диатомита (60 %), асбеста (20 %), извести (20 %) и воды. Изделия в виде плоских или лекальных плит небольших размеров после формования пропаривают в автоклаве, где происходит образование гидросиликатов кальция, обеспечивающих прочность вулканита.
Объемная масса вулканитовых плит — до 400 кг/м 3 , теплопроводность при 50 С С —не выше 0,091 Вт/(м-К), предел прочности при изгибе — не менее 0,3 МПа, максимальная температура применения — 600 °С.
Асбестомагнезиальные и асбестодоломитовые теплоизоляционные материалы и изделия изготовляют из смесей асбеста 5—6-го сорта с легкой водной углекислой солью магния (ньювель) или асбеста с водной углекислой солью магния и углекислого кальция (совелит), получаемых соответственно при переработке магнезита и доломита. Ньювель и совелит в виде порошков используют для засыпной или мастичной теплоизоляции, а также для изготовления плит, скорлуп и сегментов. Совелит дешевле и не менее эффективен, чем ньювель.
Объемная масса совелитовых изделий — не более 400 .кг/м 8 , теплопроводность при 100 °С— не выше 0,093 Вт/ (м-К), предельная температура применения — 500 °С.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Шилов Дмитрий Алексеевич
Учитель химии: Воронаев Иван
Основные классы неорганических веществ…………..3 стр.
Простые вещества………………………………………. 4 стр.
Бинарные соединения……………………………………12 стр.
Список литературы………………………………………14 стр.
Введение
Классификация неорганических веществ базируется на их химическом составе – наиболее простой и постоянной во времени характеристике. Химический состав вещества показывает, какие элементы присутствуют в нём и в каком числовом отношении для их атомов. Символы и названия химических элементов приведены в Периодической системе химических элементов Д. И. Менделеева.
Элементы условно делятся на элементы с металлическими и неметаллическими свойствами. Первые из них всегда входят в состав катионов многоэлементных веществ (металлические свойства), вторые – в состав анионов (неметаллические свойства). В соответствии с Периодическим законом вы периодах и группах между этими элементами находятся амфотерные элементы, проявляющие в той или иной мере металлические и неметаллические (амфотерные, двойственные) свойства. Элементы VIII А-группы продолжают рассматривать отдельно (благородные газы), хотя для Kr , Xe и Rn обнаружены явно неметаллические свойства (элементы He , Ne , Ar химически инертны).
Основные классы неорганических веществ . Соответственно делению элементов классифицируют простые вещества, одноэлементные по составу и представляющие собой формы нахождения элементов в свободном виде. Все двух- и многоэлементные вещества называют сложными веществами, а многоатомные простые вещества и все сложные вещества вместе – химическими соединениями (в них атомы одного или разных элементов соединены между собой химическими связями).
Классификация сложных веществ первых трёх классов по составу основана на обязательном наличии в них самого распространённого в природе элемента – кислорода, и на самом распространённом соединении кислорода – воде.
Первый класс сложных веществ – это оксиды, соединения катионов элементов (реальных или формальных) с кислородом (- II ); их общая формула Э х О у . К оксидам не относятся соединения кислорода с фтором (простейшее из них О - II F 2 - I ), а также пероксиды и надпероксиды ( Na 2 O 2 , KO 2 ), включающие анионы из химически связанных атомов кислорода О 2 2- и О 2 - .
Второй класс сложных веществ – гидроксиды, получающиеся при соединении оксидов с водой (чаще формально, реже реально). По химическим свойствам различают кислотные (Н х ЭО у ), основные и амфотерные [ M ( OH ) n ] гидроксиды, соответствующие кислотным, основным и амфотерным оксидам.
Третий класс сложных веществ – соли, продукты взаимодействия (реального и формального) гидроксидов. Разные типы гидроксидов реагируют между собой и образуют кислородсодержащие соли, имеющие общую формулу М х (ЭО у ) n и состоящих из катионов М n + и анионов (кислотных остатков) ЭО у х- . Такие соли называют средними солями, а если они содержат два химически разных катиона – двойными. При наличии водорода в составе кислотного остатка соли называются кислыми, а при наличии гидроксогрупп ОН – (иногда и ионов О 2– ) – основными солями.
Четвёртый класс сложных веществ – бинарные соединения, их существование и образование логически не вытекает из цепочки первых трёх классов (оксиды – гидроксиды – соли). Классификация бинарных соединений не связана с наличием в них кислорода (– II ) и не основана на соединении такого кислорода – воде. Фактически это обширный класс сложных неорганических веществ, не относящихся к оксидам, гидроксидам и солям и имеющих разнообразные химические свойства.
Неорганические вещества – соединения, образуемые всеми химичес-кими элементами (кроме большинства органических соединений углерода). Неорганические вещества делятся по химическому составу на простые и сложные.
Металлы – простые вещества элементов с металлическими свойствами (низкая электроотрицательность). Типичные металлы:
I А-группа Li , Na , K, Rb, Cs
IIA -группа Mg , Ca , Sr , Ba
При обычных условиях все металлы (за исключением ртути) – твёрдые вещества с характерным металлическим блеском. Большинство металлов имеют серебристо-белый цвет, хотя и есть исключения. Так медь – металл розово-красного цвета, золото – жёлтого. Многие физические свойства металлов изменяются в широких пределах. Например, осмий (самый тяжелый металл) имеет плотность в 42 раза большую, чем литий (самый лёгкий металл). В больших интервалах меняются температуры плавления металлов: наибольшая она у вольфрама (3420 о С), наименьшая – у ртути (–38,9 о С). Взаимодействуют с неметаллами с образованием бинарных соединений, то есть веществ, состоящих из двух элементов. Металлы обладают высокой восстановительной способностью по сравнению с типичными неметаллами. В электрохимическом ряду напряжений они стоят значительно левее водорода, вытесняют водород из воды (магний – при кипячении):
2М + 2Н 2 О = 2МОН + Н 2(г) (М = Li , Na , K, Rb, Cs)
М + 2Н 2 о = М(ОН) 2 + Н 2(г) (М = Mg , Ca , Sr , Ba )
Простые вещества элементов Cu , Ag , Ni также относят к неметаллам, так как у их оксидов CuO , Ag 2 O , NiO и гидроксидов Cu ( OH ) 2 , Ni ( OH ) 2 преобладают основные свойства.
Неметаллы. Простые вещества элементов с неметаллическими свойствами (высокая электроотрицательность). Типичные неметаллы:
VIIA - группа F 2 , Cl 2 , Br 2 , I 2
VIA - группа O 2 , S, Se
VA - группа N 2 , P , As
IVA - группа С, Si
При обычных условиях они могут быть газами (водород, кислород, гелий, хлор), жидкостями (бром), твёрдыми веществами (углерод, сера, фосфор). Неметаллы, находящиеся в твёрдом состоянии, как правило хрупкие. Характерными свойствами неметаллов являются низкие теплопроводность и электропроводность. Неметаллы образуют простые вещества, молекулы которых могут быть одноатомными (Не, Ne и другие благородные газы), двухатомными (Н 2 , О 2 , I 2 ), многоатомными ( O 3 , P 4 , S 8 ), полимерными ( S х , Р х ). Неметаллы обладают высокой окислительной способностью по сравнению с типичными металлами.
Амфигены. Амфотерные простые вещества, образованные элементами с амфотерными (двойственными) свойствами (электроотрицательность промежуточная между металлами и неметаллами). Типичные амфигены:
VII -группа Ве
VI Б-группа Cr
II Б-группа Zn
IIIA -группа Al , Ga
IVA -группа Ge , Sn , Pb
Амфигены обладают более низкой восстановительной способностью по сравнению с типичными металлами. В электрохимическом ряду напряжений они примыкают слева к водороду или стоят за ним справа.
Аэрогены. Благородные газы, одноатомные простые вещества элементов VIIIA -группы: He , Ne , Ar , Kr , Хе, Rn . Из них He , Ne и Ar химически пассивны (соединения с другими элементами не получены), а Kr , Хе и Rn проявляют некоторые свойства неметаллов с высокой электроотрицатель-ностью.
Сложные вещества . Образованы атомами разных элементов. Делятся по составу и химическим свойствам на: оксиды, гидроксиды, соли, бинарные соединения.
I . Оксиды . Оксид – это соединение какого-либо элемента с кислородом. Степень окисления кислорода в оксидах всегда равна (- II ). Оксиды делятся по составу и химическим свойствам на: солеобразующие (основные, кислотные, амфотерные, двойные) и несолеобразующие (пероксиды безразличные, солеобразные,).
Основные оксиды. Продукты полной дегидратации (реальной или условной) основных гидроксидов, сохраняющие химические свойства последних. Из типичных металлов только Li , Mg , Ca , Sr образуют оксиды Li 2 О, Mg О, Ca О, Sr О при сжигании на воздухе. Оксиды Na 2 O , K 2 O , Rb 2 О, Cs 2 О и Ва 2 О получают другими способами. К основным оксидам относят также CuO , Ag 2 O и NiO . Получение основных оксидов:
2 Mg + O 2 = 2 MgO
2 Cu + О 2 = 2 Cu О.
Этот метод практически неприменим для щелочных металлов, которые при окислении обычно дают пероксиды, поэтому оксиды Na 2 О, К 2 О крайне труднодоступны.
2С uS + 3 O 2 = 2 CuO + 2 SO 2
Метод неприменим для сульфидов активных металлов, окисляющихся до сульфатов.
Cu(OH) 2 = CuO + H 2 O ( при t o )
Этим методом нельзя получить оксиды щелочных металлов.
Разложение солей кислородсодержащих кислот
ВаСО 3 = ВаО + СО 2 (при t o )
Этот способ получения оксидов особенно легко осуществляется для нитратов и карбонатов, в том числе и для основных солей:
Основные оксиды при нагревании могут вступать в реакции с кислотными и амфотерными оксидами, с кислотами. Оксиды щелочных и щелочноземельных металлов непосредственно реагируют с водой:
Как и другие типы оксидов, основные оксиды могут вступать в окислительно-восстановительные реакции:
3CuO + 2NH 3 = 3Cu + N 2 + 3H 2 O ( при t o )
Кислотные оксиды. Продукты полной дегидратации (реальной или условной) кислотных гидроксидов, сохраняющие химические свойства последних. Представляют собой оксиды неметаллов или переходных металлов в высоких степенях окисления и могут быть получены методами, аналогичными методам получения основных оксидов, например:
2ZnS + 3O 2 = 2ZnO + 2SO 2 ( при t o )
Большинство кислотных оксидов непосредственно взаимодействуют с водой с образованием кислот:
Наряду с современной номенклатурой для кислотных оксидов до сих пор широко используется старинная система названий, как ангидридов кислот – продуктов отщепления воды от соответствующих кислот => СО 2 – ангидрид угольной кислоты, а SO 3 – ангидрид серной кислоты. Из типичных неметаллов только S , Se , P , As , С, Si образуют оксиды S О 2 , Se О 2 , Р 2 О 5 , As 2 О 3 , СО 2 , и Si О 2 при сжигании в воздухе. Остальные кислотные оксиды получают другими способами.
И с к л ю ч е н и е: у оксидов NO 2 и CIO 2 нет соответствующих кислотных гидроксидов, но их считают кислотными, так как NO 2 и CIO 2 реагируют со щелочами, образуя соли двух кислот, а CIO 2 и с водой, образуя две кислоты: а) 2 NO 2 + 2 N аОН = N а NO 2 + NaNO 3 + Н 2 О
б) 2 CIO 2 + 2 N аОН(хол.) = N а CIO 2 + N а CIO 3 + Н 2 О
Оксиды CrO 3 и Mn 2 O 7 (хром и марганец в высшей степени окисления) также являются кислотными.
Наиболее типичными для кислотных оксидов являются их реакции с основными и амфотерными оксидами, щелочами:
Кислотные оксиды могут вступать в многочисленные окислительно-восстановительные реакции:
Амфотерные оксиды. Продукты полной дегидратации (реальной или условной) амфотерных гидроксидов, сохраняющие химические свойства последних. Типичные амфигены (кроме G а) при сжигании на воздухе образуют оксиды ВеО, Cr 2 О 3 , Zn О, Al 2 О 3 , Ge О 2 , Sn О 2 , Pb О; амфотерные оксиды Ga 2 О 3 , Sn О, Pb О 2 получают другими способами. Обладают двойственной природой: они одновременно способны вступать в реакции, в которых выступают как основные, так и как кислотные оксиды, то есть реагируют как с кислотами, так и с щелочами:
Al 2 O 3 + 2 NaOH + 3Н 2 О = 2 Na [ Al ( OH ) 4 ]
К числу амфотерных оксидов относится оксид алюминия ( III ) Al 2 O 3 , оксид хрома ( III ) Cr 2 O 3 , оксид бериллия ВеО, оксид цинка ZnO , оксид железа ( III ) Fe 2 O 3 и ряд других. Идеально амфотерным оксидом является вода Н 2 О, которая диссоциирует с образованием одинаковых количеств ионов водорода (кислотные свойства) и гидроксид-иона (основные свойства).
Амфотерные свойства воды ярко проявляются при гидролизе растворённых в ней солей
Cu 2+ + Н 2 О = Cu ( OH ) + + H +
Двойные оксиды. Образованы либо атомами одного амфотерного элемента в разных степенях окисления, либо атомами двух разных (металлических, амфотерных) элементов, что и определяет их химические свойства. Примеры:
(Fe II Fe 2 III )O 4 , (Pb 2 II Pb IV )O 4 , (MgAl 2 )O 4 , (CaTi)O 3
Оксид железа образуется при сгорании железа на воздухе, оксид свинца – при слабом нагревании свинца в кислороде; оксиды двух разных металлов получают другими способами.
Несолеобразующие оксиды . Несолеобразующие оксиды – это оксиды неметаллов, не имеющие кислотных гидроксидов и не вступающие в реакции солеобразования (отличие от основных, кислотных и амфотерных оксидов). К таким оксидам относятся: СО, NO , N 2 O , SiO , S 2 О и др.
Рассмотрим несолеобразующие оксиды на примере оксида углерода ( II ) СО – угарного газа. Формальная степень окисления углерода 2+ не отражает строение молекулы СО. Оксид углерода является несолеобразующим и не взаимодействует в обычных условиях с водой, кислотами и щелочами. Пероксиды. Щелочные металлы образуют пероксидные соединения – соединения, в которых имеются химические связи кислород – кислород. Связь О – О не прочна, поэтому пероксиды неустойчивые соединения, легко разлагающиеся. Склонность к образованию таких соединений и их устойчивость возрастают от лития к цезию. Щелочные металлы образуют пероксиды состава Ме 2 О 2 и надпероксиды МеО 2 , где Ме – щелочной металл. Пероксиды щелочных металлов разлагаются водой с выделением кислорода:
Действием кислот на пероксиды щелочных металлов можно получить пероксид водорода:
II Гидроксиды . Гидроксиды металлов принято делить на две группы: растворимые в воде (образованные щелочными и щелочноземельными металлами) и нерастворимые в воде . Основное различие между ними заключается в том, что концентрация ионов ОН – в растворах щелочей достаточно высока, для нерастворимых же оснований она определяется растворимостью вещества и обычно очень мала. Тем не менее небольшие равновесные концентрации иона ОН – даже в растворах нерастворимых оснований определяют свойства этого класса соединений.
Гидроксиды – соединения элементов (кроме фтора и кислорода) с гидроксогруппами O - II H , могут содержать также кислород O - II . В гидроксидах
степень окисления элемента всегда положительная (от + I до + VIII ). Число гидроксогрупп от 1 до 6. Делятся по химическим свойствам на основные, кислотные и амфотерные.
Основные гидроксиды (основания) . Образованы элементами с металлическими свойствами. Получаются по реакциям соответствующих основных оксидов с водой:
Ме 2 О + Н 2 О = МеОН (Ме = Li , Na , K, Rb, Cs)
МеО + Н 2 О = Ме(ОН) 2 (Ме = Ca, Sr, Ba)
При нагревании реальная дегидратация (потеря воды) протекает для следующих гидроксидов:
Основные гидроксиды замещают свои гидроксогруппы на кислотные остатки по правилу валентности с образованием солей, металлические элементы сохраняют свою степень окисления в катионах солей.

Ежедневно человек взаимодействует с большим количеством предметов. Они изготовлены из разных материалов, имеют свою структуру и состав. Все, что окружает человека можно разделить на органическое и неорганическое. В статье рассмотрим, что представляют собой такие вещества, приведем примеры. Также определим, какие встречаются неорганические вещества в биологии.
Описание
Неорганическими называются такие вещества, в составе которых нет углерода. Они противоположны органическим. Также к этой группе относят несколько углеродосодержащих соединений, например:
- цианиды;
- оксиды углерода;
- карбонаты;
- карбиды и другие.
Примеры неорганических веществ:
- вода;
- разные кислоты (соляная, азотная, серная);
- соль;
- аммиак;
- углекислый газ;
- металлы и неметаллы.
Неорганическая группа отличается отсутствием углеродного скелета, который характерен для органических веществ. Неорганические вещества по составу принято делить на простые и сложные. Простые вещества составляют немногочисленную группу. Всего их насчитывается примерно 400.

Простые неорганические соединения: металлы
Металлы – простые вещества, соединение атомов которых основывается на металлической связи. Эти элементы имеют характерные металлические свойства: теплопроводность, электропроводность, пластичность, блеск и другие. Всего в этой группе выделяют 96 элементов. К ним относятся:
- щелочные металлы: литий, натрий, калий;
- щелочноземельные металлы: магний, стронций, кальций; медь, серебро, золото;
- легкие металлы: алюминий, олово, свинец;
- полуметаллы: полоний, московий, нихоний;
- лантаноиды и лантан: скандий, иттрий;
- актиноиды и актиний: уран, нептуний, плутоний.
В основном в природе металлы встречаются в виде руды и соединений. Чтобы получить чистый металл без примесей, проводится его очистка. При необходимости возможно проведение легирования или другой обработки. Этим занимается специальная наука – металлургия. Она подразделяется на черную и цветную.

Простые неорганические соединения: неметаллы
Неметаллы – химические элементы, которые не обладают металлическими свойствами. Примеры неорганических веществ:
- вода;
- азот;
- сера;
- кислород и другие.
Неметаллы отличаются большим числом электронов на внешнем энергетическом уровне их атома. Это обуславливает некоторые свойства: повышается способность присоединять дополнительные электроны, проявляется более высокая окислительная активность.
В природе можно встретить неметаллы в свободном состоянии: кислород, хлор, фтор, водород. А также твердые формы: йод, фосфор, кремний, селен.
Некоторые неметаллы имеют отличительное свойство – аллотропию. То есть они могут существовать в различных модификациях и формах. Например:
- газообразный кислород имеет модификации: кислород и озон;
- твердый углерод может существовать в таких формах: алмаз, графит, стеклоуглерод и другие.

Сложные неорганические соединения
Эта группа веществ более многочисленна. Сложные соединения отличаются наличием в составе вещества нескольких химических элементов.
Рассмотрим подробнее сложные неорганические вещества. Примеры и классификация их представлены ниже в статье.
1. Оксиды – соединения, одним их элементов которых является кислород. В группу входят:
- несолеобразующие (например, монооксид углерода, оксид азота);
- солеобразующие оксиды (например, оксид натрия, оксид цинка).
2. Кислоты – вещества, в состав которых входят ионы водорода и кислотные остатки. Например, азотная кислота, серная кислота, сероводород.
3. Гидроксиды – соединения, в составе которых присутствует группа –ОН. Классификация:
- основания – растворимые и нерастворимые щелочи – гидроксид меди, гидроксид натрия;
- кислородосодержащие кислоты – диводород триоксокарбонат, водород триоксонитрат;
- амфотерные – гидроксид хрома, гидроксид меди.
4. Соли – вещества, в составе которых есть ионы металла и кислотные остатки. Классификация:
- средние: хлорид натрия, сульфид железа;
- кислые: гидрокарбонат натрия, гидросульфаты;
- основные: нитрат дигидроксохрома, нитрат гидроксохрома;
- комплексные: тетрагидроксоцинкат натрия, тетрахлороплатинат калия;
- двойные: алюмокалиевые квасцы;
- смешанные: сульфат алюминия калия, хлорид меди калия.
5. Бинарные соединения – вещества, состоящие из двух химических элементов:
- бескислородные кислоты;
- бескислородные соли и другие.

Неорганические соединения, содержащие углерод
Такие вещества традиционно относятся к группе неорганических. Примеры веществ:
- Карбонаты - эфиры и соли угольной кислоты – кальцит, доломит.
- Карбиды – соединения неметаллов и металлов с углеродом – карбид бериллия, карбид кальция.
- Цианиды – соли цианистоводородной кислоты – цианид натрия.
- Оксиды углерода – бинарное соединение углерода и кислорода – угарный и углекислый газы.
- Цианаты – являются производными от циановой кислоты – фульминовая кислота, изоциановая кислота.
- Карбонильные металлы – комплекс металла и монооксида углерода – карбонил никеля.

Свойства неорганических веществ
Все рассмотренные вещества отличаются индивидуальными химическими и физическими свойствами. В общем виде можно выделить отличительные черты каждого класса неорганических веществ:
1. Простые металлы:
- высокая тепло- и электропроводность;
- металлический блеск;
- отсутствие прозрачности;
- прочность и пластичность;
- при комнатной температуре сохраняют твердость и форму (кроме ртути).
2. Простые неметаллы:
- простые неметаллы могут быть в газообразном состоянии: водород, кислород, хлор;
- в жидком состоянии встречается бром;
- твердые неметаллы имеют немолекулярное состояние и могут образовывать кристаллы: алмаз, кремний, графит.
3. Сложные вещества:
- оксиды: вступают в реакцию с водой, кислотами и кислотными оксидами;
- кислоты: вступают в реакцию с водой, основными оксидами и щелочами;
- амфотерные оксиды: могут вступать в реакции с кислотными оксидами и основаниями;
- гидроксиды: растворяются в воде, имеют широкий диапазон температур плавления, могут менять цвет при взаимодействии с щелочами.
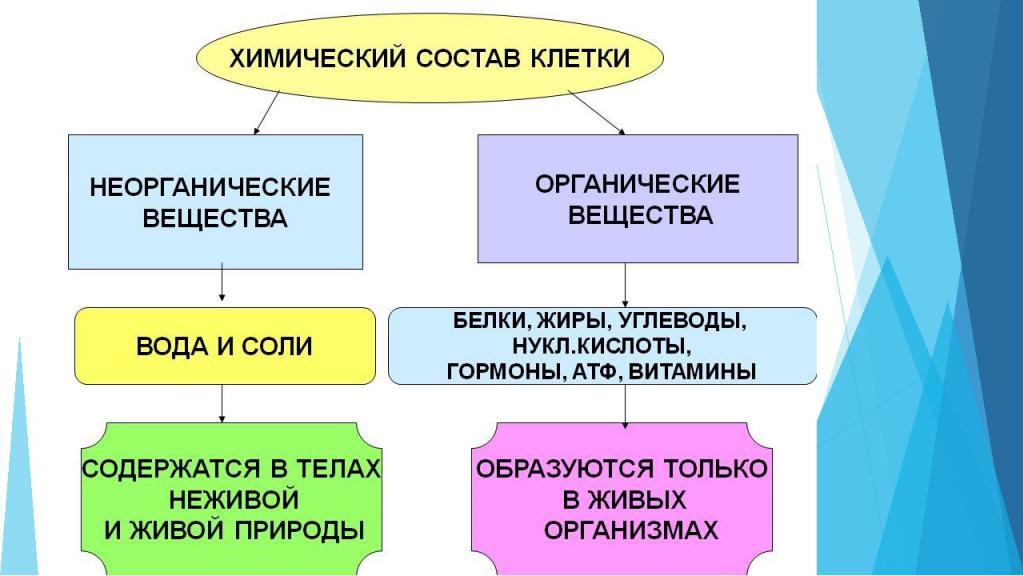
Органические и неорганические вещества клетки
Клетка любого живого организма состоит из множества компонентов. Некоторыми из них являются неорганические соединения:
- Вода. Например, количество воды в клетке составляет от 65 до 95%. Она необходима для осуществления химических реакций, перемещения компонентов, процесса терморегуляции. Также именно вода определяет объем клетки и степень ее упругости.
- Минеральные соли. Могут присутствовать в организме как в растворенном виде, так и в нерастворенном. Важную роль в процессах клетки играют катионы: калий, натрий, кальций, магний - и анионы: хлор, гидрокарбонаты, суперфосфат. Минералы необходимы для поддержания осмотического равновесия, регуляции биохимических и физических процессов, образования нервных импульсов, поддержания уровня свертываемости крови и многих других реакций.
Для поддержания жизнедеятельности важны не только неорганические вещества клетки. Органические компоненты занимают 20-30 % ее объема.
- простые органические вещества: глюкоза, аминокислоты, жирные кислоты;
- сложные органические вещества: белки, нуклеиновые кислоты, липиды, полисахариды.
Органические компоненты необходимы для выполнения защитной, энергетической функции клетки, они служат источником энергии для клеточной активности и запасают питательные вещества, проводят синтез белков, передают наследственную информацию.
В статье были рассмотрены сущность и примеры неорганических веществ, их роль в составе клетки. Можно сказать, что существование живых организмов было бы невозможным без групп органических и неорганических соединений. Они важны в каждой сфере человеческой жизни, а также в существовании каждого организма.
Читайте также:

