Реферат на тему иммуноферментный анализ
Обновлено: 05.07.2024
Функция "чтения" служит для ознакомления с работой. Разметка, таблицы и картинки документа могут отображаться неверно или не в полном объёме!
Принципы иммуноферментного анализа, основные виды ИФА, применение в диагностике
Российский государственный медицинский университет
Методы иммунного анализа широко вошли в медицинскую практику. Во всех областях современной медицины используется иммунный анализ, преимущественно, с диагностической и аналитической целями. Особенно важно, что они дают возможность идентифицировать биологические компоненты (гормоны, ферменты, нейропептиды, продукты иммунной системы, антигены и т.д.) в низких и очень низких концентрациях. Все продукты, против которых возможно получение антител, выявляются этими методами.
Иммунный анализ основывается на взаимодействии антигена (АГ) и антитела (АТ) с использованием различных вариантов мечения одного из компонентов (фермент, радионуклид, флуоресцентный краситель и другие). Оценка реакции проводится автоматически на специальной аппаратуре, что позволяет стандартизировать эти методы.
В зависимости от типа используемой метки и условий постановки теста иммунный анализ обозначается как иммуноферментный (ИФА), радиоиммунный (РИА), иммунофлуоресцентный и другие. При постановке реакций в один или несколько этапов они обозначаются как прямые или непрямые. Имеет значение среда, в которой проводится реакция. Если реакция проводится с реагентами, фиксированными на поверхности, то тест обозначается как твердофазный, например ELISA (enzyme linked immunosorbent assay).
В данной работе будет рассмотрен только иммуноферментный анализ – метод широко распространенный в биологии и медицине, как практической, так и фундаментальной.
Иммуноферментный анализ.
ИФА появился в середине 60-х годов и первоначально был разработан как метод для идентификации антигена в гистологическом препарате, а также для визуализации линий преципитации в тесте иммунодифузии и иммуноэлектрофореза, а затем стал использоваться для количественного определения антигенов и антител в биологических жидкостях. В разработке метода принимали участия Е. Энгвалл и Р. Пэлман, а также независимо от них В. Ван Вееман и Р. Шурс.
субстрат Рисунок 1. Основной принцып ИФА.
1) Для выявления антигенов. 2) Для выявления антител.
Метод основан на специфическом связывании антитела с антигеном, при этом один из компонентов конъюгирован с ферментом, в результатереакции с соответствующим хромогенным субстратом образовывается окрашенный продукт, количество которого можно определить спектрофотометрически (рис. 1).
Открытие возможности иммобилизации антигена и антитела на различных носителях с сохранением их связывающей активности позволило расширить использование ИФА в различных областях биологии и медицины.
Появление моноклональных антител послужило дальнейшему развитию ИФА, что позволило повысить его чувствительность, специфичность и воспроизводимость результатов.
Теоретически ИФА основывается на данных современной иммунохимии и химической энзимологии, знании физико-химических закономерностей реакции антиген-антитело, а также на главных принципах аналитической химии.

Иммуноферментный анализ (ИФА) — один из видов иммунохимического анализа. Он основан на высокоспецифической иммунологической реакции антигена (АГ) с соответствующим антителом (АТ) с образованием иммунного комплекса. При этом один из компонентов конъюгирован с ферментом. В результате реакции фермента с хромогенным субстратом образуется окрашенный продукт, количество которого можно определить спектрофотометрически.
Любой вариант ИФА содержит 3 обязательные стадии:
- Стадия узнавания исследуемого соединения специфическим антителом;
- Стадия формирования связи конъюгата с иммунным комплексом или со свободными местами связывания;
- Стадия превращения ферментной метки в регистрируемый сигнал.
В реакции участвуют:
- Твердая фаза;
- АГ и АТ;
- Конъюгат (антиген или антитело, меченые ферментом);
- Ферментный маркер;
- Субстрат;
- Стоп-реагент (чаще всего применяют серную кислоту).
Твердая фаза
В качестве твердой фазы для проведения ИФА можно применять различные материалы: полистирол, поливинилхлорид, полипропилен и другие. Твердой фазой могут служить стенки пробирки, 96-луночные и др. планшеты, шарики, бусины, а также нитроцеллюлозные и другие мембраны, активно сорбирующие белки.
Антигены и антитела
АГ и AT, используемые в ИФА, должны быть высокоочищенными и высокоактивными. АГ должны обладать высокой антигенностью, оптимальной плотностью расположения и количеством антигенных детерминант.
Чувствительность ИФА зависит от концентрации, активности и специфичности используемых антител. Используемые АТ могут быть поли- или моноклональными, различного класса (IgG или IgM) и подкласса (IgG1, IgG2).
Чувствительность и специфичность метода повышается при использовании моноклональных антител. В этом случае появляется возможность обнаруживать низкие концентрации АГ (AT) в образцах.
Ферментные маркеры: наибольшее применение нашли пероксидаза хрена (ПХ), щелочная фосфатаза (ЩФ) и β-D-галактозидаза.
Субстраты
- Для ПХ в качестве субстрата используют 3,3’,5,5’-тетраметилбензидин (ТМБ хромоген). Происходит цветная реакция, интенсивность которой зависит от количества связанного определяемого вещества;
- Для ЩФ субстратом является 4-нитрофенилфосфат;
- β-D-галактозидаза катализирует гидролиз лактозы с образованием глюкозы и галактозы.
Классификация ИФА
В основу классификации методов ИФА положено несколько подходов:
1 — по типу реагентов, присутствующих на первой стадии ИФА:
- В конкурентном ИФА на первой стадии в системе присутствуют одновременно анализируемое соединение и его аналог, меченный ферментом и конкурирующий за центры специфического связывания с ним;
- Для неконкурентных методов характерно присутствие на первой стадии только анализируемого соединения и специфичных к нему центров связывания.
2 — по принципу определения исследуемого вещества:
- Прямое определение концентрации вещества (АГ или АТ). Используют антитела к исследуемому веществу, соединенные со специфической меткой. В этом случае метка будет находиться в образовавшемся специфическом комплексе АГ-АТ. Концентрация определяемого вещества будет прямо пропорциональна регистрируемому сигналу;
- Непрямое определение концентрации вещества – по разности общего числа мест связывания и оставшихся свободными центров связывания. Концентрация определяемого вещества при этом будет возрастать, а регистрируемый сигнал снижаться, следовательно, в данном случае прослеживается обратная зависимость от величины регистрируемого сигнала.
3 — по типу результатов:
Конкурентный ИФА
- На твердой фазе иммобилизованы специфические моноклональные антитела;
- В лунки панелей вносят в известной концентрации антиген, меченный ферментом, и исследуемый образец. Параллельно в соседних лунках ставят положительный и отрицательный контроли. Для построения калибровки используют стандартный немеченый антиген в различных разведениях. Проводят инкубацию и отмывку;
- Добавляют субстрат, инкубируют, останавливают реакцию при развитии оптимального окрашивания в лунках с положительным контролем;
- Проводят учет результатов на ИФА-ридере. Концентрация определяемого вещества обратно пропорциональна оптической плотности.
Конкурентный ИФА для определения антител: искомые антитела и меченые ферментом антитела конкурируют друг с другом за антигены, сорбированные на твердой фазе.
Основным достоинством метода является высокая чувствительность, превосходящая возможности других схем ИФА.
- На твердой фазе иммобилизованы моноклональные антитела или аффинно-очищенные поликлональные антитела;
- В лунки панелей вносят исследуемый образец, параллельно ставят положительный контрольный образец и отрицательный контрольный образец в различных разведениях. Инкубируют и отмывают;
- В лунки вносят меченные ферментом моноклональные или поликлональные антитела —конъюгат. После инкубации проводят отмывку для удаления несвязавшихся антител;
- Вносят субстрат, инкубируют. Реакцию останавливают при достижении оптимального окрашивания в лунках с положительным контролем;
- Проводят учет результатов на ИФА-ридере. Концентрация определяемого вещества прямо пропорциональна оптической плотности.
Для полуколичественного варианта проведения методики рассчитывают отношение между средней оптической плотностью образца и оптической плотностью Cut-off.
Образцы рассматриваются как:
- положительные, если отношение более 1,1;
- сомнительные, если отношение 0,9–1,1;
- отрицательные, если отношение менее 0,9.
Сомнительные результаты анализа нельзя однозначно интерпретировать и для уточнения результата необходимо повторить обследование через 1–2 недели.

Иммуноферментный анализ (сокращённо ИФА, англ. enzyme-linked immunosorbent assay, ELISA) – лабораторный иммунологический метод качественного или количественного определения различных соединений, макромолекул, вирусов и пр., в основе которого лежит специфическая реакция антиген-антитело. Выявление образовавшегося комплекса проводят с использованием фермента в качестве метки для регистрации сигнала.
Твердофазный ИФА был предложен в 1971 году. Основные принципы твердофазного ИФА, независимо от модификации, заключаются в следующем:
1. На 1 этапе реакции адсорбируют антигены или антитела на твердой фазе. При этом не связавшиеся с твердой фазой реагенты легко удаляются отмыванием.
2. В сенсибилизированных лунках инкубируют исследуемый образец. В лунках с положительным контролем – стандартные реагенты. При этом на поверхности твердой фазы формируются иммунные комплексы. Несвязавшиеся компоненты удаляют отмыванием.
3. При добавлении конъюгата антитело-фермент или антиген-фермент и связывании его с иммобилизованным иммунным комплексом активный центр фермента остается доступным для последующего взаимодействия с субстратом. Инкубация субстрата в лунках с иммобилизованным конъюгатом приводит к развитию цветной реакции. Эту реакцию можно остановить на нужной стадии, выраженность окрашивания можно оценить визуально или по оптической плотности.
Из-за разнообразия объектов исследования – от низкомолекулярных соединений до вирусов и бактерий, и многообразия условий проведения ИФА существует большое количество вариантов этого метода.
Одним из принципов классификации методов ИФА является их разделение по типу проводимых на каждой из иммунохимических стадий реакций. В соответствии с эти все методы можно разделить на две группы –
гомогенные и гетерогенные. Если в ходе выполнения анализа все реакции, включая ферментативную стадию, протекают в растворе, то метод является гомогенным. Гетерогенный ИФА объединяет методы, в которых анализ проводится в двухфазной системе, при этом разделение на фазы может происходить на любой стадии определения [16].
В настоящее время EMIT (гомогенный ИФА) широко распространен во всем мире наряду с твердофазным ИФА (тИФА). EMIT по сравнению с тИФА является более экспрессным (до 2-х минут) и менее трудоемким, хотя менее чувствительный, и поэтому используется только в качественном анализе.
Возможна также классификация по типу иммунохимического взаимодействия на первой стадии анализа (в которой происходит связывание определяемого вещества). Если в системе присутствуют только анализируемое соединение и соответствующие ему центры связывания (антиген и специфические антитела), то метод является неконкурентным. Если же на первой стадии в системе одновременно присутствует анализируемое соединение и его аналог (меченное ферментом анализируемое соединение или анализируемое соединение, иммобилизованное на твердой фазе), конкурирующие за ограниченное количество центров специфического связывания, то метод является конкурентным.

Рис. 10. Конкурентный (а) и неконкурентный (б) ИФА
Другим типом классификации схем ИФА является разделение по типу определения концентрации анализуемого вещества:
1) прямое определение образовавшихся иммунокомплексов (аналитический сигнал прямо пропорционален концентрации определяемого вещества) – прямой ИФА;
2) определение концентрации оставшихся свободными, т.е. не вступившими в реакцию компексообразования антител – непрямой ИФА.
Так, среди конкурентных схем твердофазного ИФА существует два основных формата:
Прямой конкурентный формат ИФА использует в качестве меченного ферментом реагента одного из участников иммунохимической реакции (рис. 3) – определяемое соединение или специфический к нему диагностический реагент (антитела). В результате схема ИФА состоит из 3-х стадий:
– сорбции (иммобилизации) специфических антител, либо конъюгата антигена,
– аналитической стадии: конкурентной реакция Аг-Ат с участием меченого ферментом реагента (антигена или антител),
– фермент-субстратной реакции, в результате которой образуется окрашенный (или люминисцентный) продукт.
Например, на полистирольный планшет иммобилизуют специфические антитела (рис. 11 в) иммобилизованые на твердой фазе специфические антитела. На второй стадии к иммобилизованным антителам добавляют раствор, содержащий определяемое вещество и фиксированную концентрацию меченого антигена, инкубируют и после отмывки носителя от несвязавшихся компонентов регистрируют ферментативную активность образовавшихся на твердой фазе специфических иммунных комплексов. В этой схеме меченый ферментом и немеченый антиген конкурируют за связывание с иммобилизованными специфическими антителами.

Рис. 11. Виды конкурентного ИФА:
а – непрямой конкурентный ИФА с иммобилизацией конъюгата антигена с высокомолекулярным веществом и использованием меченых антивидовых антител; б – непрямой конкурентный ИФА с иммобилизацией конъюгата антигена с высокомолекулярным веществом и использованием меченых специфических антител; в – прямой конкурентный ИФА с иммобилизацией специфических антител и использованием меченого антигена (аналита)
Преимуществом прямой схемы является небольшое число стадий, что позволяет легко автоматизировать анализ. К недостаткам схемы относятся сложность методов синтеза ферментных конъюгатов, а также возможное влияние компонентов образца на активность фермента.
В непрямом конкурентном формате ИФА используются меченные ферментом антитела (специфические или вторичные) и иммобилизованный на твердой фазе конъюгат антиген-белок-носитель
(рис. 11 а, б). Непрямая схема с использованием меченых антивидовых антител является одной из наиболее распространенных схем ИФА (рис. 11 а). На поверхности носителя иммобилизуют конъюгат антиген-белок, к которому добавляют раствор, содержащий определяемый антиген и фиксированную концентрацию немеченых специфических антител, инкубируют и после удаления несвязавшихся компонентов добавляют фиксированную концентрацию меченых антивидовых антител. После инкубации и отмывки носителя детектируют ферментативную активность образовавшихся на твердой фазе специфических иммунных комплексов. Величина аналитического сигнала в этом случае находится в обратно-пропорциональной зависимости от концентрации определяемого антигена.
Применение универсального реагента – меченых антивидовых антител – даёт возможность выявлять антитела к разным антигенам. Кроме того, анализируемый образец и меченый реагент вводятся в систему на разных стадиях, что устраняет влияние различных эффекторов, содержащихся в образце, на каталитические свойства ферментной метки. Однако такая схема анализа усложняет его проведение из-за введения дополнительных стадий.
ИФА наркотических веществ и их метаболитов в биологических жидкостях и тканях широко используется в ХТЛ, бюро судмедэкспертизы, клинико-диагностических лабораториях, медицинских центрах. Чаще всего применяется полуколичественный вариант методики, т.к. в большинстве случаев необходимо дать заключение о том, превышает ли уровень метаболитов ПАВ в образце определенную пороговую концентрацию. Однако метод ИФА может использоваться (и используется в некоторых случаях) для количественного определения метаболитов ПАВ с высокой чувствительностью – до 10–9 г/л.
Отдельно следует выделить иммунохимический метод выявления фактов употребления наркотиков в отдаленные промежутки времени (до 4 месяцев после последнего употребления ПАВ), основанный на определении антител к наркотическим веществам в крови человека [4, 5]. Данный метод использует прямую неконкурентную схему ИФА.
Компоненты, используемые в ИФА
Ферментные метки обладают чрезвычайно мощным каталитическим действием, одна молекула фермента может реагировать с большим количеством молекул субстрата. Таким образом, фермент, присутствующий в ничтожных количествах, можно выявить и количественно определить по образованию продуктов катализируемой им реакции. Другое преимущество применения ферментов в качестве меток обусловлено наличием в молекуле многочисленных функциональных групп (сульфгидрильных, карбоксильных, остатков тирозина и др.), через которые можно ковалентно присоединить молекулы лиганда.
В ИФА может использоваться не менее 15 различных ферментов. Наибольшее применение, в соответствии с вышеназванными требованиями, нашли пероксидаза хрена (ПХ), щелочная фосфотаза (ЩФ) и β-D-галактозидаза. Все три стабильны и катализируют высокочувствительные реакции. Кроме того, продукты, получаемые в результате реакций, катализируемых этими ферментами, в зависимости от используемого субстрата, могут выявляться не только колориметрическими методами, но также флуоресцентными методами. Другие ферменты используются значительно реже. Это объясняется их более низкой в сравнении с ПХ и ЩФ удельной активностью.
Выбор субстрата в первую очередь определяется используемым в качестве метки ферментом, так как реакция фермент-субстрат высоко специфична.
Чаще используют хромогенные субстраты, которые, разрушаясь, образуют окрашенное вещество. Перспективным является использование высокоэнергетических субстратов – флуоресцентных, хемилюминесцентных.
3. Антигены и антитела.
Аг и Aт, используемые в ИФА, должны быть высокоочищенными и высокоактивными. Кроме того, Аг должны обладать высокой антигенностью, оптимальной плотностью расположения и количеством антигенных детерминант и гомогенностью. Многие синтетические и рекомбинантные Аг вирусов и бактерий хорошо себя зарекомендовали при использовании в ИФА. Это существенно повысило специфичность и воспроизводимость метода за счет сведения к минимуму перекрестных реакций.
Одним из наиболее важных реагентов в ИФА являются антитела. Чувствительность ИФА зависит от концентрации, активности и специфичности используемых антител. Используемые антитела могут быть поли- или моноклинальными, различного класса (IgG или IgM) и подкласса (IgGl, IgG2), антиаллотипическими или антиидиотипическими. При низкой аффинности Ат распад комплекса Аг-Ат приводит к удалению связанного Аг из системы. Чувствительность и специфичность метода повышается при использовании моноклональных антител. В этом случае появляется возможность обнаруживать низкие концентрации Аг (Aт) в испытуемых образцах.
4. Получение конъюгата.
При синтезе конъюгата с ферментом подбирают такой оптимальный метод введения ферментной метки, чтобы оба компонента конъюгата сохраняли свою биологическую активность: фермент – способность взаимодействовать с субстратом, а антиген или антитело – антигенность и антигенсвязывающую активность, соответственно. Наличие меченого, высокоочищенного антигена позволяет использовать конкурентные методы ИФА. Однако антигены разнообразны по своим физико-химическим свойствам и строению, а значит невозможно разработать универсальные методики для получения конъюгата с антигеном. В этом случае получение конъюгата антигена с ферментом представляет собой отдельную сложную задачу. Приготовление меченых антител для ИФА методически более доступно.
Конъюгирование фермента с иммунохимически активными белками производится различными методами: химическая сшивка, ковалентное связывание молекулы фермента с Аг или Aт и образование соединений через нековалентные связи, например, когда связь между ферментом и Аг или Aт осуществляется иммунологически, через взаимодействие антиген-антитело.
В качестве твердой фазы для проведения ИФА можно применять различные материалы: полистирол, поливинилхлорид, полипропилен и другие вещества. Твердой фазой могут служить стенки пробирки, 96-луночные и др. планшеты, шарики, бусины, а также нитроцеллюлозные и другие мембраны, активно сорбирующие белки.
Иммобилизация антигена или антител на твердой фазе возможна тремя путями:
– пассивная адсорбция, основанная на сильных гидрофобных взаимодействиях между белками и синтетической поверхностью;
– ковалентное прикрепление к твердой фазе;
– иммунохимическое и др. (нековалентное и неадсорбционное присоединение).
Пассивная адсорбция белков широко используется при проведении ИФА на платах для титрования, на нитроцеллюлозных мембранах. Пассивная адсорбция идет по принципу насыщения и коррелирует с молекулярной массой адсорбируемого вещества. В стандартных наборах ИФА используются 96-тилуночные прозрачные полистирольные планшеты.

Рис. 12. Набор для ИФА-определения наркотических еществ в биологических жидкостях: – планшет с нанесенным антигеном; 2 – положительный и отрицательный контрольный образец; 3 – реагент для выявления образовавшихся иммунных комплексов; 4 – растворы буфера для приготовления анализируемых образцов; 5 – раствор буфера для проведения фермент-субстратного окрашивания; – раствор для остановки реакции окрашивания субстрата; – инструкция по применению
Свободные сайты на поверхности твердой фазы, не связавшиеся с сорбируемым агентом, могут фиксировать в ходе теста другие молекулы, в том числе и конъюгаты, что приводит к повышению фонового сигнала. Для предотвращения неспецифического связывания после иммобилизации на твердую фазу основного материала проводят обработку нейтральными для теста веществами. Наиболее популярные блокирующие агенты – бычий сывороточный альбумин (БСА), казеин и др. Выбор блокирующего агента и условия проведения этого этапа зависят от типа твердой фазы, чувствительности системы.
Готовый набор для ИФА-определения наркотических веществ в биологических жидкостях выглядит следующим образом (рис. 12).
ИФА. Иммуноферментный анализ ( ифа ). Метод иммуноферментного анализа (ИФА). Схема, методика иммуноферментного анализа ( ифа ).
Метод иммуноферментного анализа (ИФА) во многом напоминает РИА, но включает использование коммерческих реагентов — Аг или AT, маркированных ферментами (например, пероксидазой или щелочной фосфатазой). После образования иммунного комплекса в систему вносят субстрат, расщепляемый ферментом, что приводит к окрашиванию среды в жёлто-коричневый (при использовании псроксидазы) или жёлто-зелёный цвет (при использовании фосфатазы).
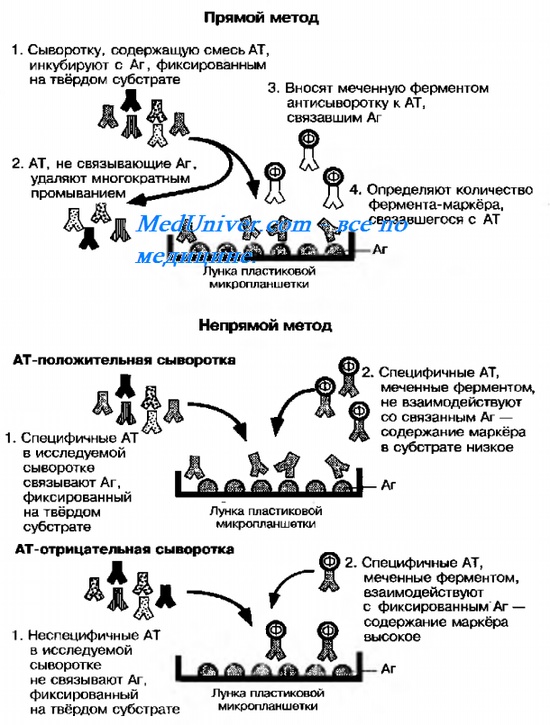
Рис. 10-19. Схема выявления Аг прямым и непрямым методами твердофазного ИФА.
По сравнению с классическими методами выявления Аг, иммуноферментный анализ ( ифа ) позволяет непосредственно регистрировать взаимодействие Аг с AT в специфической фазе, а не анализировать вторичные проявления взаимодействия — агглютинацию, преципитацию или гемолиз. Метод отличает высокая чувствительность — обычно достаточно присутствия Аг в концентрации I нг/мл. К настоящему времени созданы многочисленные модификации базовой методики.
Наибольшее распространение получил гетерогенный иммуноферментный анализ ( ифа ) на твёрдой фазе (твердофазный ИФА). Для этого коммерческие моноклональные AT или Аг фиксируют на лунках пластиковых панелей, куда затем вносят исследуемый материал (содержащий Аг или AT). Основные варианты твердофазного иммуноферментный анализ ( ифа ) представлены на рис. 10-19. На практике ИФА широко применяют для выявления Аг Chlamydia trachomatis в мазках из мочеиспускательного канала и влагалища, стрептококков группы А в мазках из зева и токсина Clostridium difficile в фекалиях. Метод позволяет не только выявлять AT, но и определять их принадлежность к различным классам lg, например выявлять IgM к Аг Mycoplasma pneumoniae.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

