Реферат на тему химическое равновесие 10 11 класс
Обновлено: 05.07.2024
Все химические реакции протекают в двух направлениях: в сторону образования продуктов реакции (вправо – прямая реакция) и в сторону превращения продуктов в исходные вещества (влево – обратная реакция). Вследствие обратимости химической реакции не доходят до конца.
Вложенные файлы: 1 файл
39_Khimicheskoe_ravnovesie_39.doc
1. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ
1.1. Общие понятия и представления
Все химические реакции протекают в двух направлениях: в сторону образования продуктов реакции (вправо – прямая реакция) и в сторону превращения продуктов в исходные вещества (влево – обратная реакция). Вследствие обратимости химической реакции не доходят до конца.
Так как скорость реакции прямо пропорциональна концентрации, то с течением времени скорость прямой будет уменьшаться, а скорость обратной расти. Когда обе скорости сравниваются, наступает состояние химического равновесия, когда число молекул, составляющих систему, перестает изменяться и остается постоянным во времени при неизменных внешних условиях. Таким образом, химическим равновесием называется такое состояние обратимой химической реакции, при котором с течением времени не происходит изменения концентраций реагирующих веществ в реакционной смеси. Химическое равновесие – это динамическое равновесие, характеризующееся постоянством равновесных концентраций (или парциальных давлений) всех участников реакции при постоянстве внешних условий и минимальным значением энергии Гиббса или энергии Гельмгольца.
выражение для скорости прямого и обратного процессов имеет вид:
где k1 и k2 - константы скорости соответственно прямой и обратной реакции.
Скорости процесса дает суждение лишь о разности этих двух скоростей Dv = v1 – v2. Для химического равновесия v1 = v2.
Константы скорости не зависят от концентрации и при постоянной температуре являются постоянными. Поэтому их отношение есть некая постоянная величина, называемая константой химического равновесия:
В общем виде, для реакции
где [A], [B], [E], [R] – равновесные концентрации участников реакции.
Это уравнение выражает закон действующих масс: отношение произведения равновесных активностей (концентраций) продуктов реакции, взятых в степенях, равных их стехиометрическим коэффициентам, к такому же произведению активностей (концентраций) исходных веществ при данной температуре есть величина постоянная, называемая константой химического равновесия.
Константа химического равновесия – это характеристика химического равновесия, отражающая взаимосвязь между равновесными концентрациями (или парциальными давлениями) веществ, участвующих в химической реакции.
Константы равновесия зависят от природы реагирующих веществ, температуры, и не зависят от концентрации, активности, давления и фугитивности.
Как было сказано выше, при наступлении химического равновесия число молекул веществ, составляющих химическую систему, перестает меняться и остается постоянным во времени при неизменных внешних условиях. При изменении внешних условий равновесие сдвигается в сторону исходных веществ (влево) или в сторону продуктов реакции (вправо) и возвращается к исходному состоянию, если внешние условия приобретают первоначальное значение. Бесконечно малое изменение внешних условий влечет за собой также бесконечно малое изменение состояния равновесия. Таким образом, химические реакции протекают как термодинамические равновесные процессы, т.е. к ним можно применять общие условия термодинамического равновесия. Химическая термодинамика позволяет предсказать концентрации реагентов в смеси и влияние на них изменения внешних условий и предвидеть максимальный выход полезного продукта, что имеет большое практическое значение.
Химическую реакцию можно рассматривать как добавление в систему продуктов реакции и удаление исходных веществ. Закрытую систему, в которой протекают химические превращения, в целом можно рассматривать как совокупность открытых систем, для которых фундаментальное уравнение термодинамики имеет следующий вид (в зависимости от того, какая функция выбрана в качестве термодинамического потенциала):
где mI – химический потенциал i-го компонента, выражаемый как
Величина представляет собой изменение термодинамического потенциала в результате изменения количества молей dn всех участников химической реакции.
Химический потенциал показывает вклад одного моля данного компонента в величину термодинамического потенциала системы. Так как большинство реакций протекает в изобарно-изотермических условиях, то наиболее часто используется выражение:
Соответственно, при постоянстве температуры и давления справедливо равенство:
где G – общая энергия Гиббса системы.
Общим условием химического равновесия является равенство химических потенциалов продуктов и исходных веществ:
1.2. Критерии достижения состояния химического равновесия
Критериями достижения истинного состояния химического равновесия могут служить следующие признаки:
- достижение равновесного состояния при подходе к нему с двух сторон, т.е. при использовании в одном случае в качестве исходных вещества, записанные в левой части химического уравнения, а в другом – в правой части;
- достижение равновесного состояния при различных исходных соотношениях концентраций реагирующих веществ;
- с изменением внешних условий равновесие сдвигается в сторону исходных веществ (влево) или в сторону продуктов реакции (вправо), но если внешние условия достигают первоначальных значений, равновесие возвращается к исходному состоянию;
- бесконечно малое изменение внешних условий влечет за собой также бесконечно малое изменение состояния равновесия.
1.3. Константа химического равновесия
Рассмотрим подробнее различные способы выражения константы химического равновесия. В разделе 1.1 было показано, что константа равновесия может быть выражена через равновесные концентрации веществ. Кроме этого, константа равновесия может быть выражена следующим образом:
через равновесные парциальные давления
через мольные доли
Константы равновесия KC (выражаемая через равновесные концентрации) и KP (выражаемая через равновесные парциальные давления) безразмерны только для реакций, идущих без изменения числа молей газообразных участников. В остальных случаях KP имеет размерность давления, а KC – размерность концентрации в степенях Dn, где Dn = r + e – a – b (изменение числа молей реагирующих газов в течение реакции).
В неидеальных (реальных) системах вместо концентраций компонентов используют активности, вместо парциальных давлений – фугитивности. Константы равновесия, выраженные через активности и фугитивности компонентов, имеют вид:
где аi – равновесные активности компонентов,
где – равновесные фугитивности компонентов.
где gi – коэффициент фугитивности.
Парциальное давление компонента системы можно выразить следующим образом:
где Р – общее давление, – общее число молей всех компонентов.
Связь между некоторыми константами имеет вид:
Константа равновесия KХ для реакции в газовой фазе, в отличие от констант KP и KC, зависит от общего давления; если реакция в газовой фазе протекает без изменения числа молей (то есть Dn = 0), то справедливо соотношение:
Кроме того, для растворов имеют место соотношения:
где Ci – молярная концентрация i-го компонента (растворенного вещества), M0 – молярная масса растворителя, r – плотность раствора (г/мл), Mi – молярная масса i-го компонента (растворенного вещества).
Связь между KX и Km имеет вид:
Следует помнить, что вид выражения для константы равновесия и ее числовое значение зависят от того, в каком направлении и для каких количеств веществ написано стехиометрическое уравнение реакции. Например, для реакции взаимодействия водорода и азота с образованием аммиака
константа равновесия имеет вид
а при изменении стехиометрических коэффициентов
константа равновесия приобретает вид:
1.4. Гетерогенные реакции
Гетерогенными реакциями называются реакции, в которых компоненты находятся в разных фазах.
Активность чистой твердой фазы принимают равной 1.
Так, например, для реакции
константа равновесия может быть записана в виде (учитывая, что FeO плохо растворим в жидком железе и считая активность железа равной единице)
где YFeO и XFeO – коэффициент активности и молярная доля оксида железа в жидком железе.
учитывая, что XMn = 1 – XFe и XMnO = 1 – XFeO (то есть пренебрегая растворимостью оксидов в жидких металлах и металлов в жидких оксидах) получаем:
Растворимостью оксидов в жидких металлах и металлов в жидких
оксидах пренебрегаем.
считая, что активности чистых твердых фаз СаСО3 и CaO при данной температуре постоянны, получаем:
1.5. Уравнение изотермы химической реакции
протекает самопроизвольно при постоянных Р и Т и участвующие в ней вещества являются идеальными газами, то изменение энергии Гиббса будет равно:
где Gi – мольные энергии Гиббса компонентов реакции. Поскольку компоненты реакции являются идеальными газами, то для каждого из них величина энергии Гиббса равна:
Полученное уравнение называется уравнением изотермы химической реакции (изотермой Вант Гоффа) при постоянных Р, Т. Уравнение изотермы химической реакции при V, T = const можно записать в виде:
При химическом равновесии DGP,T = 0 и из уравнения изотермы химической реакции следует:
Если известна константа равновесия химической реакции, легко оценить возможность самопроизвольного течения реакции при иных (неравновесных) парциальных давлениях веществ в системе, определив знак изменения энергии Гиббса. Из уравнения изотермы следует, что если K 0 > 0 и данная реакция не идет в стандартных условиях. Если DGT 0 >> 0, то можно сказать, что DGT > 0 и реакция невозможна при любых разумных составах смеси, изменяя которые можно было бы сделать отрицательным изменение энергии Гиббса данной реакции.
Если при данной температуре стандартное изменение энергии Гиббса имеет большое по абсолютной величине отрицательное значение DGT 0 0 , можно сделать вывод о термодинамической устойчивости вещества:
- если DGT 0 0 >> 0, равновесие сдвинуто в сторону распада соединения – соединение неустойчиво.
1.6. Влияние температуры на химическое равновесие
Химическое равновесие при повышении температуры должно сместиться в сторону эндотермической реакции (в том направлении, в котором протекает эндотермическая реакция), а при понижении температуры – в том направлении, в котором протекает экзотермическая реакция (в соответствии с качественным правилом – принципом Ле Шателье).
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Тема : Химическое равновесие.
Цель: Актуализировать знания о химическом равновесии и условиях при котором оно смещается.
1. Кинетическое и термодинамическое описание химического равновесия.
2. Смещение химического равновесия (принцип Ле - Шателье).
3. Равновесия в биологических средах.
1.Обратимыми химическими реакциями называются химические реакции и физико-химические процессы, самопроизвольно протекающие как в прямом, так и в обратном направлении. Уравнение гипотетической обратимой реакции может быть представлено схемой:
аА + bВ сС +dD
Ниже приведены примеры некоторых обратимых реакций:
N2 + 3 H2 2 NH3
NH4Cl + H2O NH4OH + HCl
Hb + O2 HbO2
Пределом протекания обратимых процессов является состояние химического равновесия. Химическое равновесие — это такое состояние обратимого процесса, в котором скорость прямой и обратной реакций равны между собой (рисунок 3).
Рисунок 3. Изменение скорости прямой и
обратной реакций в ходе обратимого процесса
Признаком химического равновесия является постоянство во времени концентрации всех веществ, участвующих в процессе (рисунок 4). Концентрации веществ в состоянии химического равновесия называются равновесными: [Ā], моль/л.
Рисунок 4 — Кинетические кривые
обратимой реакции аА bВ
Кинетическое описание химического равновесия основано на законе действующих масс: скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ (Гульдберг-Вааге,1884).
Согласно закону действующих масс, скорости прямой и обратной реакций равны:
где υпр — скорость прямой реакции,
υобр — скорость обратной реакции,
kпр — константа скорости прямой реакции,
kобр — константа скорости обратной реакции.
В состоянии равновесия υпр = υобр, следовательно можно записать, что
Отношение констант скорости является постоянной величиной, обозначаемой Kc:
где Kс – концентрационная константа равновесия.
Таким образом, закон действующих масс для обратимой реакции записывается так:
Например, для биохимической реакции окисления гемоглобина в оксигемоглобин
Hb + O2 HbO2
константа химического равновесия равна:
Если в химической реакции участвуют газообразные, жидкие и твердые вещества, то для расчета Кс используют только равновесные концентрации газов.
Например, синтез кристаллической мочевины из углекислого газа и аммиака описывается уравнением:
CO2 (г) + 2 NH3 (г) H2O (г) + CO(NH2)2 (к).
В равновесии участвуют как газообразные, так и твердые вещества, но концентрацию кристаллической мочевины при составлении уравнения для Kc не учитывают:
Если К >> 1, то равновесие смещено вправо, (υпр > υобр); если К
В основе термодинамического описания обратимого процесса лежит уравнение изотермы химической реакции:
где Δ G– это изменение свободной энергии Гиббса в ходе процесса, а Δ G o – стандартное изменение свободной энергии.
В состоянии химического равновесия Δ G = 0, а концентрации веществ А, В, С и D являются равновесными. Соответственно
Δ G o = - RT ln K.
Таким образом, K зависит только от температуры и природы реагирующих веществ.
2. Смещение химического равновесия (принцип Ле- Шателье)
Состояние химического равновесия является наиболее энергетически выгодным состоянием обратимого процесса, так как характеризуется минимальным запасом внутренней энергии системы (G min) (рисунок 5).
Рисунок 5 — Энергетическая диаграмма
обратимой реакции
Таким образом, любой обратимый процесс стремится к равновесию. В 1884 г. французский физико-химик и металлург Ле -Шателье сформулировал общий закон смещения химического равновесия.
Этот принцип позволяет предсказать качественные изменения в равновесной системе при изменении условий.
Частные случаи принципа Ле- Шателье:
1) Повышение температуры смещает равновесие в сторону эндотермической, а понижение температуры — в сторону экзотермической реакции.
Рассмотрим влияние температуры на равновесие обратимой биохимической реакции
Hb + O2 HbO2, ΔrН = – 10 кДж.
При повышении температуры равновесие смешается влево (кровь отдает кислород тканям), при понижении температуры равновесие смещается вправо (кровь обогащается кислородом).
2) При повышении давления равновесие смещается в сторону меньшего количества газообразных веществ, а при понижении давления — в сторону их большего количества. Изменение давления не влияет на смещение химического равновесия, если: (а) в реакции не участвуют газы; (б) реакция протекает без изменения количества газообразных веществ. Например,
N2 + O2 2NO.
Используя данный принцип, можно рассмотреть влияние давления на равновесие обратимой реакции окисления гемоглобина в оксигемоглобин.
Венозная кровь поступает в легкие, где испытывает повышенное давление кислорода О2. В результате равновесие смещается вправо (кровь насыщается кислородом). Артериальная кровь, поступающая в ткани, оказывается при пониженном давлении кислорода, в результате чего равновесие смещается влево (кровь отдает кислород тканям).
3) При увеличении концентрации вещества, участвующего в обратимом превращении, равновесие смещается в сторону той реакции, которая протекает с убылью этого вещества (и наоборот).
Например, при увеличении содержания гемоглобина в крови равновесие смещается вправо (ткани обогащаются кислородом). При недостатке гемоглобина (анемия) равновесие смещается влево (больной страдает от кислородной недостаточности).
3. Равновесие в биологических средах
Важнейшей биологической средой является вода. Описание процессов, протекающих в водных растворах, возможно с позиций теории химического равновесия. Многие процессы, играющие важную роль в метаболизме живых организмов, связаны с обратимым переносом протонов (протолитические равновесия).
К важнейшим протолитическим равновесиям относится диссоциация воды, протекающая по уравнению:
H2O H + + OH -
Вода – очень слабый электролит; при комнатной температуре из 5 млн. молекул воды только одна молекула диссоциирует на ионы. Поскольку молярная концентрация молекул воды значительно превышает молярную концентрацию ионов ([H2O]>> [H+]) , то можно считать, что концентрация молекул воды является величиной постоянной ([H2O] = const). Применив закон действующих масс, напишем выражение для концентрационной константы равновесия рассматриваемого процесса:
Умножив левую и правую части уравнения на [H2O], получим уравнение
Kw — ионное произведение воды; эта величина является константой равновесия, описывающей обратимую диссоциацию воды. При стандартной температуре (t = 25 o C) Кw = [H + ][OH - ] = 10 -14 .
Для воды и водных растворов:
Не менее важным является протолитическое равновесие, устанавливающееся при диссоциации слабых кислот и оснований.
Уксусная кислота является слабым электролитом. Ее диссоциация протекает обратимо по уравнению:
CH3COOH CH3COO - + H +
Константа равновесия, описывающая данный обратимый процесс обозначается Ka и называется константой кислотности:
Аммоний гидроксид является слабым электролитом. Его диссоциация протекает обратимо по уравнению:
NH4OH NH4 + + OH -
Константа равновесия, описывающая данный обратимый процесс обозначается Kb и называется константой основности:
Чем больше Ка и Kb, тем сильнее диссоциируют кислоты и основания в водных растворах.
К протолитическим равновесиям, играющим важную биологическую роль, относятся реакции гидролитического разложения веществ. Гидролиз солей — это реакция ионного обмена между составными частями соли и воды, протекающая с изменением кислотности раствора. Гидролизу подвергаются растворимые соли, в состав которых входят катионы слабых оснований или анионы слабых кислот.
Контрольные вопросы :
1.Какие химические реакции называют обратимыми?
2.Что произойдет, если на систему, находящуюся в равновесии оказать внешнее воздействие?
3.В какую сторону сместиться равновесие при повышении температуры и давления?
Изучение особенностей и закономерностей течения химических реакций, как продолжение формирования представлений о различных типах химических реакций по признаку обратимости.
Обобщение и конкретизация знаний о закономерностях химических реакций, формирование умений и навыков определять, объяснять особенности и, вытекающие из них условия, необходимые для протекания той или иной реакции.3) Расширить и углубить знания о многообразии химических процессов 4) Рассмотреть этот раздел химической науки как важнейший в прикладном аспекте и рассмотреть представления о химическом равновесии - как частном случае единого закона природного равновесия, стремления к компенсации, устойчивости равновесия в единстве с основной формой существования материи, движении, динамики.
Содержание
Введение…………………………………………………………. 1
Равновесие в химических реакция……………………………….2
Смещение химического равновесия. Принциа Ле-Шателье…. 5
Скорость реакции и равновесие………………………………….7
Список используемой литературы………………………………13
Работа состоит из 1 файл
Химия реферат.docx
ГБОУ ВПО ВГМУ Минздравсоцразвития России
Реферат на тему
Выполнила: студентка 101 группы стоматологического факультета Воронцова Дарья
Преподаватель: Ситникова А.А.
Зам кафедры: Иванова Н.С.
Равновесие в химических реакция……………………………….2
Смещение химического равновесия. Принциа Ле-Шателье…. 5
Скорость реакции и равновесие………………………………….7
Список используемой литературы………………………………13
Введение
- Изучение особенностей и закономерностей течения хими ческих реакций, как продолжение формирования представлений о различных типа х химических реакций по признаку обратимости.
- Обобщение и конкретизация знаний о закономерностях химических реакций, формирование умений и навыков определять, объяснять особенности и, вытекающие из них условия, необходимые для протекания той или иной реакции.3) Расширить и углубить знания о многообразии химических процессов 4) Рассмотреть этот раздел химической науки как важнейший в прикладн ом аспекте и рассмотреть представ ления о химическом равновесии - как частном случае единого закона природного равновесия, стремления к компенсации, устойчивости равновесия в единстве с основной формой существования материи, движении, динамики.
- Рассмотреть тему: “Обратимые и необратимые реакции" на конкретных примерах, используя предшествующие представления о скорости химических реакций.
- Продолжить изучение особенностей обратимых химических реакций и формирование представлений о химическом равновесии как динамичном состоянии реагирующей системы.
- Изучить принципы смещения химического равновесия и пронаблюдать условия смещения химического равновесия.
Равновесие в химических реакциях
Химические реакции - это явления, при которых одно (или одни) вещества превращаются в другие, доказательством этого являются видимые и невидимые изменения. Видимые: изменения цвета, запаха, вкуса, выпадение осадка, изменение окраски индикатора, поглощение и выделение тепла. Невидимые: изменение состава вещества, которое можно определить с помощью качественных и аналитических реакций. Все эти реакции можно подразделить на два типа: обратимые и необратимые реакции.
Химическое равновесие - состояние системы, в котором скорость прямой реакции (V1) равна скорости обратной реакции (V2). При химическом равновесии концентрации веществ остаются неизменными. Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются.
Состояние химического равновесия количественно характеризуется константой равновесия, представляющей собой отношение констант прямой (K1) и обратной (K2) реакций.
Для реакции mA + nB pC + dD константа равновесия равна
Константа равновесия зависит от температуры и природы реагирующих веществ. Чем больше константа равновесия, тем больше равновесие сдвинуто в сторону образования продуктов прямой реакции. В состоянии равновесия молекулы не перестают испытывать соударения, и между ними не прекращается взаимодействие, но концентрации веществ остаются постоянными. Эти концентрации называются равновесными.
Равновесная концентрация - концентрация вещества, участвующего в обратимой химической реакции, достигшей состояния равновесия.
Равновесная концентрация обозначается формулой вещества, взятой в квадратные скобки, например:
Как и любая другая концентрация, равновесная концентрация измеряется в молях на литр.
Если бы в рассмотренных нами примерах мы взяли другие концентрации исходных веществ, то после достижения равновесия получили бы другие значения равновесных концентраций. Эти новые значения (обозначим их звездочками) будут связаны со старыми следующим образом:
В общем случае для обратимой реакции aA + bB dD + fF в состоянии равновесия при постоянной температуре соблюдается соотношение
Это соотношение носит название закон действующих масс, который формулируется следующим образом:
при постоянной температуре отношение произведения равновесных концентраций продуктов реакции, взятых в степенях, равных их коэффициентам, к произведению равновесных концентраций исходных веществ, взятых в степенях, равных их коэффициентам, есть величина постоянная.
Постоянная величина (КС) называется константой равновесия данной реакции. Индекс " с" в обозначении этой величины показывает, что для расчета константы использовались концентрации.
Если константа равновесия велика, то равновесие сдвинуто в сторону продуктов прямой реакции, если мала, то - в сторону исходных веществ. Если константа равновесия очень велика, то говорят, что реакция " практически необратима", если константа равновесия очень мала, то реакция " практически не идет".Константа равновесия - для каждой обратимой реакции величина постоянная только при постоянной температуре. Для одной и той же реакции при разных температурах константа равновесия принимает разные значения.Приведенное выражение для закона действующих масс справедливо только для реакций, все участники которых представляют собой либо газы, либо растворенные вещества. В других случаях уравнение для константы равновесия несколько меняется.
Например, в протекающей при высокой температуре обратимой реакции
участвует твердый графит С (гр). Формально, пользуясь законом действующих масс, запишем выражение для константы равновесия этой реакции, обозначив ее К':
Твердый графит, лежащий на дне реактора, реагирует только с поверхности, и его " концентрация" не зависит от массы графита и постоянна при любом соотношении веществ в газовой смеси.
Умножим правую и левую части уравнения на эту постоянную величину:
Получившаяся величина и есть константа равновесия этой реакции:
Аналогичным образом, для равновесия другой обратимой реакции, протекающей также при высокой температуре, CaCO3 (кр) СаО (кр) + СО2 (г), получим константу равновесия КС = [CO2].
В этом случае она просто равна равновесной концентрации углекислого газа.
С метрологической точки зрения константа равновесия не является одной физической величиной. Это группа величин с различными единицами измерений, зависящими от конкретного выражения константы через равновесные концентрации. Например, для обратимой реакции графита с углекислым газом [Kc] = 1 моль/л, такая же единица измерений и у константы равновесия реакции термического разложения карбоната кальция, а константа равновесия реакции синтеза йодоводорода - величина безразмерная. В общем случае [Kc] = 1 (моль/л) n .
Смещение химического равновесия. Принцип Ле Шателье
Перевод равновесной химической системы из одного состояния равновесия в другое называется смещением (сдвигом) химического равновесия, которое осуществляется изменением термодинамических параметров системы - температуры, концентрации, давления При смещении равновесия в прямом направлении достигается увеличение выхода продуктов, а при смещении в обратном направлении - уменьшение степени превращения реагента. И то, и другое может оказаться полезным в химической технологии. Так как почти все реакции в той или иной степени обратимы, в промышленности и лабораторной практике возникают две проблемы: как получить продукт " полезной" реакции с максимальным выходом и как уменьшить выход продуктов " вредной" реакции. И в том, и в другом случае возникает необходимость сместить равновесие либо в сторону продуктов реакции, либо в сторону исходных веществ. Чтобы научиться это делать, надо знать, от чего зависит положение равновесия любой обратимой реакции.
Положение равновесия зависит:
- от значения константы равновесия (то есть от природы реагирующих веществ и температуры),
- от концентрации веществ, участвующих в реакции и 3) от давления (для газовых систем оно пропорционально концентрациям веществ).
- Состояние системы остается неизменным во времени при сохранении внешних условий.
- Равновесие является динамическим, то есть обусловлено протеканием прямой и обратной реакции с одинаковыми скоростями.
- Любое внешнее воздействие вызывает изменение в равновесии системы; если внешнее воздействие снимается, то система снова возвращается в исходное состояние.
- К состоянию равновесия можно подойти с двух сторон – как со стороны исходных веществ, так и со стороны продуктов реакции.
- В состоянии равновесия энергия Гиббса достигает своего минимального значения.
Для качественной оценки влияния на химическое равновесие всех этих очень разных факторов используют универсальный по своей сути принцип Ле Шателье (французский физикохимик и металловед Анри Луи Ле Шателье сформулировал его в 1884 году), который применим к любым равновесным системам, не только химическим.
Если на систему, находящуюся в равновесии, воздействовать извне, то равновесие в системе сместится в направлении, в котором происходит частичная компенсация этого воздействия.
В качестве примера влияния на положение равновесия концентраций веществ-участников реакции рассмотрим обратимую реакцию получения йодоводорода
По закону действующих масс в состоянии равновесия
Пусть в реакторе объемом 1 литр при некоторой постоянной температуре установилось равновесие, при котором концентрации всех участников реакции одинаковы и равны 1 моль/л ([H2] = 1 моль/л; [I2] = 1 моль/л; [HI] = 1 моль/л). Следовательно, при этой температуре КС = 1. Так как объем реактора 1 литр, n (H2) = 1 моль, n (I2) = 1 моль и n (HI) = 1 моль. В момент времени t 1 введем в реактор еще 1 моль HI, его концентрация станет равной 2 моль/л. Но, чтобы КС оставалась постоянной, должны увеличиться концентрации водорода и йода, а это возможно только за счет разложения части йодоводорода по уравнению
Пусть к моменту достижения нового состояния равновесия t 2 разложилось x моль HI и, следовательно, образовалось дополнительно по 0,5x моль H2 и I2. Новые равновесные концентрации участников реакции: [H2] = (1 + 0,5x) моль/л; [I2] = (1 + 0,5x) моль/л; [HI] = (2 - x) моль/л. Подставив числовые значения величин в выражение закона действующих масс, получим уравнение
Откуда x = 0,667. Следовательно, [H2] = 1,333 моль/л; [I2] = 1,333 моль/л; [HI] = 1,333 моль/л.
Скорость реакции и равновесие
Пусть есть обратимая реакция A + B C + D. Если предположить, что прямая и обратная реакция проходят в одну стадию, то скорости этих реакций будут прямо пропорциональны концентрациям реагентов: скорость прямой реакции v1 = k1 [A] [B], скорость обратной реакции v2 = k2 [C] [D] (квадратными скобками обозначены молярные концентрации реагентов). Видно, что по мере протекания прямой реакции концентрации исходных веществ А и В снижаются, соответственно, уменьшается и скорость прямой реакции. Скорость же обратной реакции, которая в начальный момент равна нулю (нет продуктов C и D), постепенно увеличивается. Рано или поздно наступит момент, когда скорости прямой и обратной реакций сравняются. После этого концентрации всех веществ - А, В, С и D не изменяются со временем. Это значит, что реакция достигла положения равновесия, а не изменяющиеся со временем концентрации веществ называются равновесными. Но, в отличие от механического равновесия, при котором всякое движение прекращается, при химическом равновесии обе реакции - и прямая, и обратная - продолжают идти, однако их скорости равны и поэтому кажется, что никаких изменений в системе не происходит. Доказать протекание прямой и обратной реакций после достижения равновесия можно множеством способов. Например, если в смесь водорода, азота и аммиака, находящуюся в положении равновесия, ввести немного изотопа водорода - дейтерия D2, то чувствительный анализ сразу обнаружит присутствие атомов дейтерия в молекулах аммиака. И наоборот, если ввести в систему немного дейтерированного аммиака NH2D, то дейтерий тут же появится в исходных веществах в виде молекул HD и D2. Другой эффектный опыт был проведен на химическом факультете МГУ. Серебряную пластинку поместили в раствор нитрата серебра, при этом никаких изменений не наблюдалось. Затем в раствор ввели ничтожное количество ионов радиоактивного серебра, после чего серебряная пластинка стала радиоактивной. Эту радиоактивность не могло "смыть" ни споласкивание пластинки водой, ни промывание ее соляной кислотой. Только травление азотной кислотой или механическая обработка поверхности мелкой наждачной бумагой сделало ее неактивной. Объяснить этот эксперимент можно единственным образом: между металлом и раствором непрерывно происходит обмен атомами серебра, т.е. в системе идет обратимая реакция Ag (тв) - е - = Ag + . Поэтому добавление радиоактивных ионов Ag + к раствору приводило к их "внедрению" в пластинку в виде электронейтральных, но по-прежнему радиоактивных атомов. Таким образом, равновесными бывают не только химические
реакции между газами или растворами, но и процессы растворения металлов, осадков. Например, твердое вещество быстрее всего растворяется, если его поместить в чистый растворитель, когда система далека от равновесия, в данном случае - от насыщенного раствора. Постепенно скорость растворения снижается, и одновременно увеличивается скорость обратного процесса - перехода вещества из раствора в кристаллический осадок. Когда раствор становится насыщенным, система достигает состояния равновесия, при этом скорости растворения и кристаллизации равны, а масса осадка со временем не меняется. Как система может "противодействовать" изменению внешних условий? Если, например, температуру равновесной смеси повышают нагреванием, сама система, конечно, не может "ослабить" внешний нагрев, однако равновесие в ней смещается таким образом, что для нагревания реакционной системы до определенной температуры требуется уже большее количество теплоты, чем в том случае, если бы равновесие не смещалось. При этом равновесие смещается так, чтобы теплота поглощалась, т.е. в сторону эндотермической реакции. Это и можно трактовать, как "стремление системы ослабить внешнее воздействие". С другой стороны, если в левой и правой частях уравнения имеется неодинаковое число газообразных молекул, то равновесие в такой системе можно сместить и путем изменения давления. При повышении давления равновесие смещается в ту сторону, где число газообразных молекул меньше (и таким способом как бы "противодействует" внешнему давлению). Если же число газообразных молекул в ходе реакции не меняется (H2 + Br2 (г) 2HBr, СО + Н2О (г) СО2 + Н2), то давление не влияет на положение равновесия. Следует отметить, что при изменении температуры изменяется и константа равновесия реакции, тогда как при изменении только давления она остается постоянной.
Несколько примеров использования принципа Ле Шателье для предсказания смещения химического равновесия. Реакция 2SO2 + O2 2SO3 (г) экзотермична. Если повысить температуру, преимущество получит эндотермическая реакция разложения SО3 и равновесие сместится влево. Если же понизить температуру, равновесие сместится вправо. Так, смесь SО2 и О2, взятых в стехиометрическом соотношении 2: 1 (, при температуре 400° С и атмосферном давлении превращается в SО3 с выходом около 95%, т.е. состояние равновесия в этих условиях почти полностью смещено в сторону SО3. При 600° С равновесная смесь содержит уже 76% SО3, а при 800° С - только 25%. Именно поэтому при сжигании серы на воздухе образуется в основном SО2 и лишь около 4% SО3.
Химическое равновесие - состояние химической системы, при котором скорость прямой реакции равна скорости обратной.
В большом количестве заданий, которые мне довелось увидеть, я ни один раз видел, как коверкают это определение. Например, в заданиях верно-неверно предлагают похожий вариант, однако говорят о "равенстве концентраций исходных веществ и продуктов" - это грубая ошибка. Химическое равновесие - равенство скоростей.

Принцип Ле Шателье
В 1884 году французским химиком Анри Ле Шателье был предложен принцип, согласно которому, если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию), то система будет стремиться компенсировать внешнее воздействие.

Это принцип обоснован термодинамически и доказан. Однако в такой абстрактной формулировке его сложно применить для решения конкретных задач по химическому равновесию. В этой статье я покажу конкретные примеры и обозначу алгоритм действия, чтобы вы могли успешно справляться с заданиями.
Влияние изменения концентрации на химическое равновесие
При увеличении концентрации какого-либо компонента химической реакции, система будет стремиться восстановить равновесие: равновесие будет смещаться в сторону расходования добавленного компонента.
Объясню проще: если вы увеличиваете концентрацию вещества, которое находится в левой части, равновесие сместится в правую сторону. Если добавляете вещество из левой части (продуктов реакции) - смещается в сторону исходных веществ. Посмотрите на пример ниже.
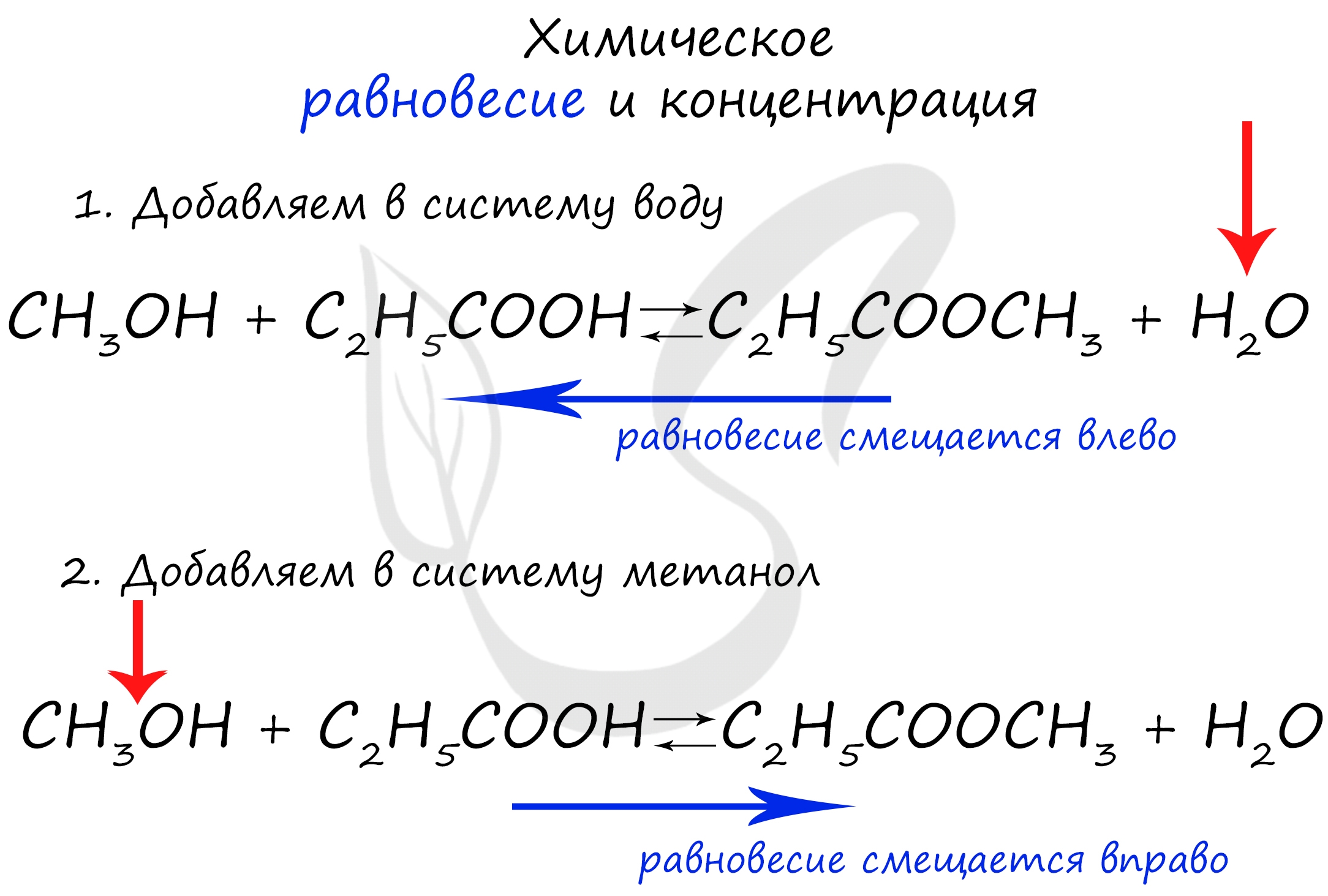
Если мы попытаемся удалить какое-либо вещество из системы (уменьшить его концентрацию), то система будет стремиться заполнить "пустое" место, которые мы создали. Наглядно демонстрирую на примере:
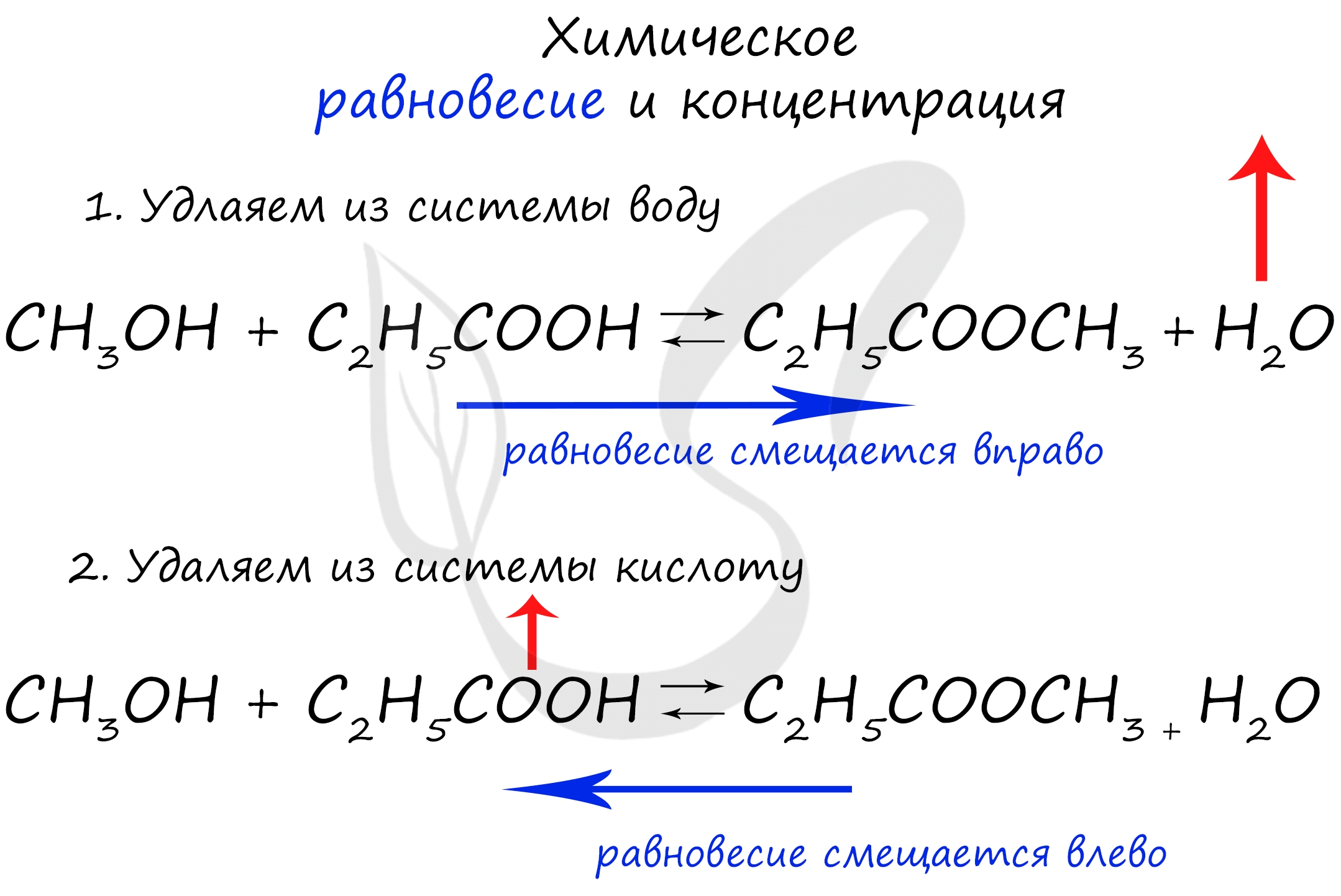
Можно подвести итог полученным знаниям таким образом: "Куда добавляем - оттуда смещается, откуда берем - туда смещается". Воспользуйтесь этой или придумайте свое правило для запоминания этой закономерности ;)
Изменения давления и химическое равновесие
Если речь в задании идет об изменении давления, то первое, что нужно сделать, это посчитать количество газов в уравнении слева и справа. Твердые вещества и жидкости считать не нужно. Например:
В приведенном уравнении количество молекул газа в левой части - 1, в правой - 2.
Запомните правило: "При увеличении давления равновесие смещается в сторону меньших газов, при уменьшении давления - в сторону больших газов". Для нашей системы правило действует таким образом:

В случае, если слева и справа количество молекул газа одинаково, например, в реакции:
Слева - 2 газа, и справа - 2. В такой реакции увеличение или уменьшение давления не повлияет на химическое равновесие.
Изменение температуры и химическое равновесие
Если в задании увеличивают или уменьшают температуру, то первое, что вы должны оценить: экзотермическая это реакция или эндотермическая.
Следуйте следующему правилу: "При увеличении температуры равновесие смещается в сторону эндотермической реакции, при уменьшении - в сторону экзотермической реакции". У любой обратимой реакции есть экзо- и эндотермические части:
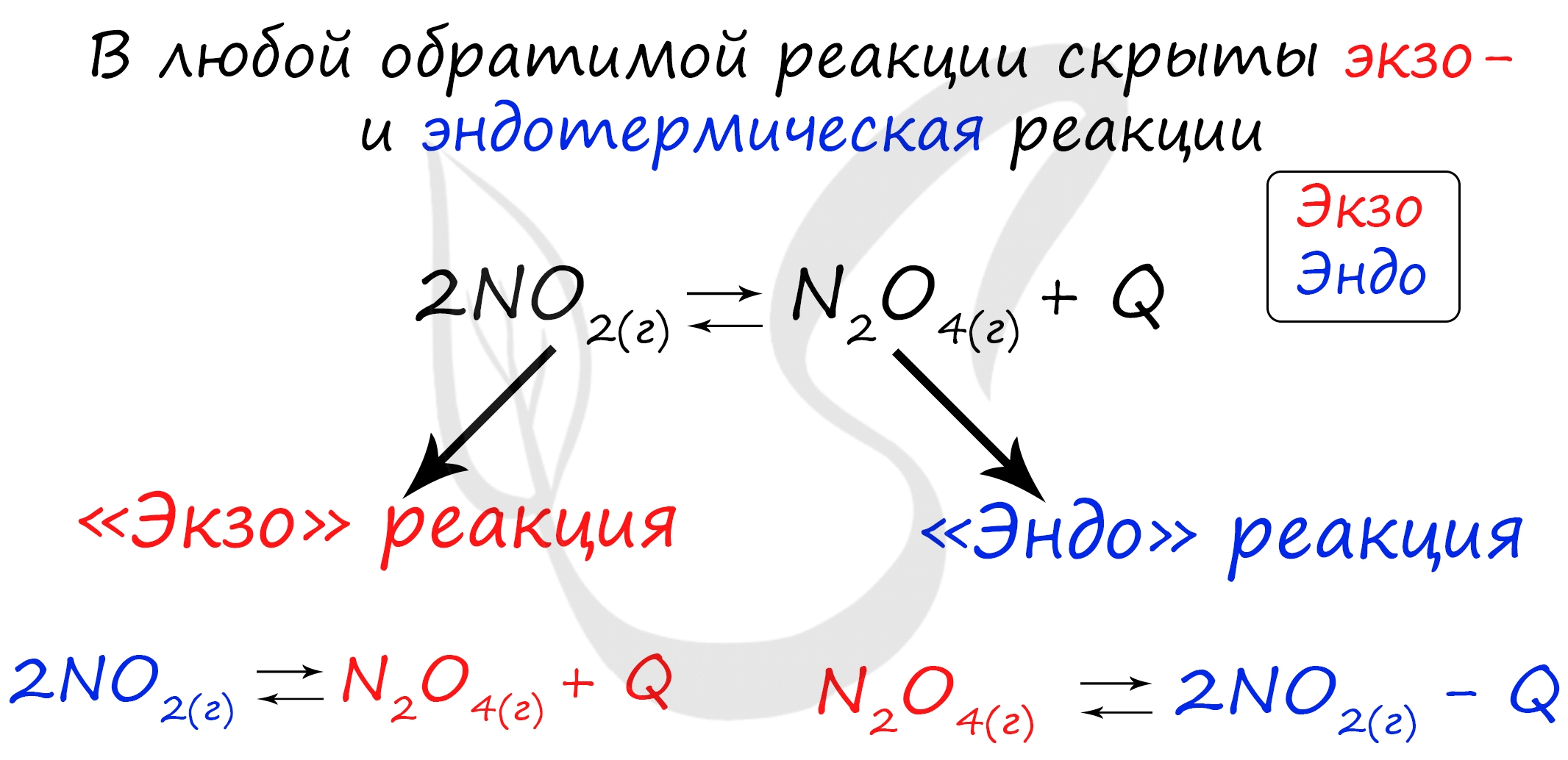
Поэтому данное правило универсально и применимо для всех реакций. Для примера разберем следующие задачи:

Чтобы не осталось белых пятен, возьмем экзотермическую реакцию и повторим с ней подобный эксперимент.

Катализатор и ингибитор
Действие катализатора и ингибитора соответственно касается только ускорения и замедления химической реакции. Они никоим образом не влияют на равновесие.
Константа равновесия
Константой равновесия называют отношения скоростей прямой и обратной реакции. Для реакции типа aA + bB = cC + dD константа равновесия будет записана следующим образом:

Решим задачу. Дана реакция: 2NO + Cl2 ⇄ 2NOCl . Вычислите константу равновесия, если равновесные концентрации веществ для данной реакции: c(NO) = 1.8 моль/л , c(Cl2) = 1.2 моль/л , c(NOCl) = 0.8 моль/л.

Константу равновесия для данной задачи можно представить в виде 1.64 * 10 -1 .
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Равновесным считается состояние системы, которое остается неизменным, причем это состояние не обусловлено действием каких-либо внешних сил. Состояние системы реагирующих веществ, при котором скорость прямой реакции становится равной скорости обратной реакции, называется химическим равновесием. Такое равновесие называется еще подвижным или динамическим равновесием.
Влияние изменения внешних условий на положение равновесия определяется принципом Ле Шателье (принципом подвижного равновесия):
Если на систему, находящуюся в состоянии равновесия, производить какое–либо внешнее воздействие, то в системе усилится то из направлений процесса, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении.
Принцип Ле Шателье применим не только к химическим процессам, но и к физическим, таким как кипение, кристаллизация, растворение и т. д.
Рассмотрим влияние различных факторов на химическое равновесие на примере реакции окисления NO:
При повышении температуры равновесие сдвигается в сторону эндотермической реакции, при понижении температуры – в сторону экзотермической реакции.
Степень смещения равновесия определяется абсолютной величиной теплового эффекта: чем больше по абсолютной величине энтальпия реакции ΔH, тем значительнее влияние температуры на состояние равновесия.
В рассматриваемой реакции синтеза оксида азота (IV) повышение температуры сместит равновесие в сторону исходных веществ.
Сжатие смещает равновесие в направлении процесса, который сопровождается уменьшением объема газообразных веществ, а понижение давления сдвигает равновесие в противоположную сторону.
В рассматриваемом примере в левой части уравнения находится три объема, а в правой – два. Так как увеличение давления благоприятствует процессу, протекающему с уменьшением объема, то при повышении давления равновесие сместится вправо, т.е. в сторону продукта реакции – NO2. Уменьшение давления сместит равновесие в обратную сторону. Следует обратить внимание на то, что, если в уравнении обратимой реакции число молекул газообразных веществ в правой и левой частях равны, то изменение давления не оказывает влияния на положение равновесия.
Для рассматриваемой реакции введение в равновесную систему дополнительных количеств NO или O2 вызывает смещение равновесия в том направлении, при котором концентрация этих веществ уменьшается, следовательно, происходит сдвиг равновесия в сторону образования NO2. Увеличение концентрации NO2 смещает равновесие в сторону исходных веществ.
Катализатор одинаково ускоряет как прямую, так и обратную реакции и поэтому не влияет на смещение химического равновесия.
При введении в равновесную систему (при Р = const) инертного газа концентрации реагентов (парциальные давления) уменьшаются. Поскольку рассматриваемый процесс окисления NO идет с уменьшением объема, то при добавлении инертного газа равновесие сместится в сторону исходных веществ.
Для химической реакции:
константа химической реакции Кс есть отношение:
В этом уравнении в квадратных скобках – концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, т.е. равновесные концентрации веществ.
Константа химического равновесия связана с изменением энергии Гиббса уравнением:
ΔGT о = – RTlnK (2)
Задача 1. При некоторой температуре равновесные концентрации в системе 2CO (г) + O2 (г)→2CO2 (г) составляли: [CO] = 0,2 моль/л, [O2] = 0,32 моль/л, [CO2] = 0,16 моль/л. Определите константу равновесия при этой температуре и исходные концентрации CO и O2, если исходная смесь не содержала СО2.
Решение.
Во второй строке под Спрореагир понимается концентрация прореагировавших исходных веществ и концентрация образующегося CO2, причем, Сисходн= Спрореагир + Сравн.
Задача 2. Используя справочные данные, рассчитайте константу равновесия процесса
Решение.
ΔG298 о = 2·(- 16,71) кДж = -33,42·10 3 Дж.
lnK = 33,42·10 3 /(8,314× 298) = 13,489. K = 7,21× 10 5 .
Задача 3. Определите равновесную концентрацию HI в системе
если при некоторой температуре константа равновесия равна 4, а исходные концентрации H2 , I2 и HI равны, соответственно, 1, 2 и 0 моль/л.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л H2.
| Вещество | H2 | I2 | HI |
| сисходн., моль/л | 1 | 2 | 0 |
| спрореагир., моль/л | x | x | 2x |
| cравн., моль/л | 1-x | 2-x | 2x |
Тогда, К = (2х) 2 /((1-х)(2-х))
Решая это уравнение, получаем x = 0,67.
Значит, равновесная концентрация HI равна 2× 0,67 = 1,34 моль/л.
Решение.
Если К = 1, то ΔG о T = — RTlnK = 0;
ΔН о 298 = -202 – (- 115,9) = -86,1 кДж = — 86,1× 10 3 Дж;
ΔS о 298 = 239,7 – 218,7 – 130,52 = -109,52 Дж/К;
0 = — 86100 — Т·(-109,52)
Задача 5. Для реакции SO2(Г) + Cl2(Г) →SO2Cl2(Г) при некоторой температуре константа равновесия равна 4. Определите равновесную концентрацию SO2Cl2, если исходные концентрации SO2, Cl2 и SO2Cl2 равны 2, 2 и 1 моль/л соответственно.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л SO2.
| Вещество | SO2 | Cl2 | SO2Cl2 |
| cисходн., моль/л | 2 | 2 | 1 |
| cпрореагир., моль/л | x | x | х |
| cравн., моль/л | 2-x | 2-x | x + 1 |
Решая это уравнение, находим: x1 = 3 и x2 = 1,25. Но x1 = 3 не удовлетворяет условию задачи.
Следовательно, [SO2Cl2] = 1,25 + 1 = 2,25 моль/л.
1. В какой из приведенных реакций повышение давления сместит равновесие вправо? Ответ обоснуйте.
Так как увеличение давления благоприятствует процессу, протекающему с уменьшением количества
газообразных веществ, то равновесие сместится вправо в реакции 3.
2. При некоторой температуре равновесные концентрации в системе:
составляли: [HBr] = 0,3 моль/л, [H2] = 0,6 моль/л, [Br2] = 0,6 моль/л. Определите константу равновесия и исходную концентрацию HBr.
К = 4; исходная концентрация HBr составляет 1,5 моль/л.
3. Для реакции H2(г) + S(г) →H2S(г) при некоторой температуре константа равновесия равна 2. Определите равновесные концентрации H2 и S, если исходные концентрации H2, S и H2S равны, соответственно, 2, 3 и 0 моль/л.
[H2] = 0,5 моль/л; [S] = 1,5 моль/л.
4. Используя справочные данные, вычислите температуру, при которой константа равновесия процесса
становится равной 1. Примите, что ΔН о Т≈ΔН о 298, а ΔS о T≈ΔS о 298
5. Используя справочные данные, рассчитайте константу равновесия процесса:
7. При температуре 500 К константа равновесия процесса:
равна 3,4·10 -5 . Вычислите Δ G о 500.
8. При температуре 800 К константа равновесия процесса н-С6Н14(г)+ 2С3Н6(г)+Н2(г) равна 8,71. Определите ΔG о f,800(С3Н6(г)), если ΔG о f,800(н-С6Н14(г)) = 305,77 кДж/моль.
9. Для реакции СО(г) + Cl2(г) →СO2Cl2(г) при некоторой температуре равновесная концентрация СO2Cl2(г) равна 1,2 моль/л. Определите константу равновесия данного процесса, если исходные концентрации СО(г) и Cl2(г) равны соответственно 2,0 и 1,8 моль/л.
10. При некоторой температуре равновесные концентрации в системе 2SО2(г) + О2(г) →2SO3(г) составляли: [SО2 ]=0,10 моль/л, [О2]=0,16 моль/л, [SО3]=0,08 моль/л. Вычислите константу равновесия и исходные концентрации SО2 и О2.
К=4,0; исходная концентрация SО2 составляет 0,18 моль/л;
исходная концентрация О2 составляет 0,20 моль/л.
Читайте также:

