Реферат на тему электролиты и неэлектролиты
Обновлено: 05.07.2024
Свойства растворов относятся к коллигативным свойствам, т.е. к таким свойствам, которые зависят от концентрации частиц в растворе. Изучение свойств растворов различных веществ показало, что для большинства растворов наблюдаются отклонения от закона Р. Рауля.
Например, при растворении 0,1 моля хлорида натрия в 1000 г воды понижение температуры замерзания раствора составило не 0,186 о , а 0,318 о , т.е. примерно в 2 раза больше теории.
Ван-Гофф ввел в уравнение Р.Рауля поправочный коэффициент, который назвал изотоническим коэффициентом – отношение наблюдаемого значения к расчетному значению.
Полученные экспериментальные данные привели к выводу, что при растворении вещества происходит распад (диссоциация) молекул (кристаллов) растворенного вещества в растворе на более мелкие частицы (ионы).
Растворы, в которых не происходит диссоциация растворенного вещества на ионы, называются растворами неэлектролитов. Система характеризуется отсутствием ионов в растворе и не обладает ионной проводимостью.
Растворы, в которых растворенное вещество распадается на ионы, называются растворами электролитов. Растворы электролитов являются ионными проводниками.
Описание процесса диссоциации изложено в теории электролитической диссоциации созданной С. Аррениусом.
Основные положения этой теории:
1.При растворении электролитов происходит диссоциация (распад) их молекул на заряженные частицы – ионы.
2.При диссоциации устанавливается термодинамическое равновесие между образовавшимися ионами и молекулами.
3.Величина заряда иона совпадает с валентностью атома элемента или кислотного остатка, а число положительных зарядов равно числу отрицательных зарядов.
Согласно современной теории растворов диссоциация происходит в результате взаимодействия структурных частиц растворённого вещества (молекул, ионов) с молекулами растворителя. Хорошо диссоциируют вещества с ионной и ковалентной полярной связью. Неполярные и малополярные вещества не диссоциируют или диссоциируют очень мало. На диссоциацию электролитов в значительной степени влияет полярность растворителя. Чем выше полярность растворителя, тем выше степень диссоциации электролита.
С точки зрения электролитической диссоциации, кислотами называются электролиты, образующие при диссоциации в водных растворах ионы водорода (Н + ).
Основаниями называются электролиты, которые при диссоциации в водном растворе образуют гидроксид-ионы (ОН - ).
Солями называются электролиты, которые при диссоциации в водном растворе образуют ионы металлических элементов /катионы/ (за исключением NH4 + ) и ионы кислотного остатка /анионы/.
Сильные и слабые электролиты
Изучение коллигативных свойств растворов электролитов показало, что в растворах присутствуют наряду с ионами и молекулы, так как диссоциация происходит не полностью, т.е.
Долю молекул, распавшихся на ионы, характеризуют степенью диссоциации (a). Степень диссоциации – отношение числа распавшихся на ионы молекул (n) к общему числу растворённых молекул N:
Например: a = 20 %. Это значит, что из 100 молекул электролита 20 молекул распалось на ионы. КА Û К + + А - и в растворе присутствует 40 ионов, а также 80 нераспавшихся молекул. Всего в растворе будет присутствовать 120 частиц. Изотонический коэффициент равен 1,2
Все электролиты по степени диссоциации делятся на две группы: сильные и слабые.
Электролиты, для которых при эквивалентной концентрации растворов Cн = 0,01-0,1мол/л, степень диссоциации (a) больше 50% относят к сильным. Принято, что сильные электролиты при растворении в воде полностью диссоциируют на ионы (в растворе присутствуют только в виде ионов).
Электролиты, для которых при эквивалентной концентрации растворов Cн = 0,01-0,1мол/л, степень диссоциации (a) меньше, 50 % относят к слабым. Принято, что слабые электролиты при растворении в воде лишь частично диссоциируют на ионы (в растворе присутствуют в основном в молекулярном виде).
К сильным электролитам относятся:
соли, растворимые в воде;
основания элементов I и II групп главных подгрупп Периодической системы элементов Д.И.Менделеева;
К слабым электролитам относятся:
соли, не растворимые в воде;
основания не растворимые в воде, за исключением NH4OH, а также элементов I и II групп главных подгрупп.
К СЛАБЫМ ЭЛЕКТРОЛИТАМ ОТНОСИТСЯ ВОДА ! ! !
Слабые электролиты имеют различную степень диссоциации, которая зависит от концентрации электролита и температуры раствора.
Чтобы исключить влияние концентрации электролита для характеристики диссоциации, используют константу диссоциации.
Так как диссоциация является обратимым процессом КА К + + А - то по закону действующих масс:
В состоянии равновесия
Константа равновесия в этом случае характеризует диссоциацию электролита и называется константой диссоциации / KД /. KД зависит от температуры и не зависит от концентрации раствора. По величине KД можно судить о силе электролита.
Например: Для одной и той же температуры KД (NH4OH) = 1,79∙10 -5 ;
Самым слабым электролитом является HСN, имеющая наименьшее значение константы диссоциации.
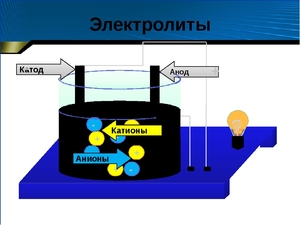
Хорошо известно, что одни вещества в растворенном или расплавленном состоянии проводят электрический ток, другие в тех же условиях ток не проводят. Это можно наблюдать с помощью простого прибора. Он состоит из угольных стержней (электродов), присоединенных проводами к электрической сети. В цепь включена электрическая лампочка, которая показывает присутствие или отсутствие тока в цепи. Если опустить электроды в раствор сахара, то лампочка не загорается. Но она ярко загорится, если их опустить в раствор хлорида натрия.
Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами.
Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами.
Неэлектролиты
Неэлектролиты находятся в растворе в виде неполярных или малополярных молекул.
К неэлектролитам относятся вещества с ковалентной неполярной (слабополярной) связью. В качестве примера веществ, не диссоциирующих в растворах и расплавах, можно привести простые вещества неметаллов (сера, фосфор, йод и др.), оксиды, органические кислоты (уксусная, молочная, муравьиная, лимонная и т. п.), органические спирты (этиловый спирт, глицерин и т. д.); также неэлектролитами являются такие вещества, как сахароза, ацетон, метан и другие.

Электролиты
Электролиты распадаются в растворе или расплаве на ионы, и именно наличие ионов способствует прохождению электрического тока. Процесс этот — распада на ионы — называют диссоциацией, а теория, описывающая данные процессы — теорией электролитической диссоциации. В растворе распад на ионы происходит по причине разрыва связей вещества, что является результатом взаимодействия с молекулами воды (то есть происходит гидратация электролита).
Ионы (атомы или их группы, обладающие отрицательным или положительным зарядом) под действием электрического тока начинают двигаться по направлению к одному из электродов, что и обуславливает электропроводимость.
Молекула электролита, способная диссоциировать на большее, чем два, количество ионов, будет диссоциировать постадийно. Примером может служить диссоциация многоосновной кислоты.
Подробнее познакомиться с теорией электролитической диссоциацией вы сможете, посмотрев это видео.
Степень диссоциации
Понятие, количественно характеризующее, насколько полно произошёл распад электролита на ионы, называют степенью диссоциации. Этот показатель рассчитывается как отношение количества продиссоциировавших молекул к общему числу молекул вещества в растворе и фактически показывает долю (процент) распавшихся на ионы молекул в общем количестве.

Следующие факторы могут влиять на степень электролитической диссоциации:
Температура
Зависимость от температуры достаточно сложна. Если распад на ионы экзотермический, то повышение температуры степень диссоциации будет уменьшать, а если эндотермический, повышение температуры приведёт к увеличению степени диссоциации. В целом же для каждого электролита есть определённые температурные условия, в которых он в максимальной степени будет распадаться на ионы.
Изменение показателя константы диссоциации (характеризует способность распадаться на ионы) для уксусной кислоты при изменении температуры можно привести в качестве примера:
| 0 °С | 25 °С | 50 °С |
| 1,65∙10 -5 | 1,75∙10 -5 | 1,62∙10 -5 |
максимальная ионизация раствора, как видно, наступает при 25 °C, а при температурах выше и ниже этого значения диссоциация происходит в меньшей степени.
Что такое степень диссоциации? Подробный ответ вы найдете в этом видео.
Природа растворителя и электролита
- Растворители с полярными молекулами, хорошей диэлектрической проницаемостью (этот показатель максимален у воды и равен 81, а, например, у этилового спирта — 25) обладают высокой ионизирующей способностью, то есть способны вызывать диссоциацию вещества.
- Вещества с сильно полярными ковалентными и ионными связями являются сильными электролитами.
- При увеличении концентрации степень диссоциации уменьшается и наоборот.
Стадия процесса диссоциации
Если молекула распадается на ионы постадийно, то каждая следующая стадия имеет примерно в 1000−10 000 раз меньший эффект, чем предыдущая.
Экспериментально определить степень диссоциации можно по электропроводности растворов, т. к. она прямо зависит от концентрации движущихся ионов. Истинное значение при этом получить нельзя, такое значение называют кажущимся. Оно меньше истинного, так как при движении к электродам ионы могут сталкиваться, что частично уменьшает их подвижность. При высокой концентрации может возникать притяжение между ионами, обусловленное электростатическими силами, они чаще сталкиваются, теряя свою подвижность, что влияет на показания электропроводности.
Например, в растворе соляной кислоты (1 моль/л) измерения покажут степень распада на ионы равной 0,78 (78%), но фактически раствор не будет содержать 22% недиссоциированных молекул, так как практически все молекулы диссоциированы.
Сильные и слабые проводники
По величине показателя степени диссоциации, выделяют электролиты сильные и слабые. К сильным условно относят вещества, значение степени диссоциации у которых больше 30%, если данный показатель ниже 5%, то к слабым, остальные считаются электролитами средней силы.
Сильные электролиты:
- соли;
- кислоты: хлорная, азотная, йодоводородная, хлорноватая, хлороводородная, серная, бромоводородная, марганцовая;
- основания: гидроксиды щелочных и щелочноземельных металлов.
- органические кислоты (все), как и кремниевая, сероводородная, угольная, синильная и некоторые другие.
- основания, например, гидроксид цинка II, гидроксид аммония, гидроксид меди II, гидроксид алюминия III, гидроксид магния II.
Видео
Из этого видео вы узнаете о свойствах электролитов.
Поставь лайк, это важно для наших авторов, подпишись на наш канал в Яндекс.Дзен и вступай в группу Вконтакте
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Электролиты и неэлектролиты
Взятые в отдельности, вода, соли, щелочи и кислоты тока не проводят. Но водные растворы кислот, щелочей и солей проводят электрический ток. На какие группы можно разделить все вещества по отношению к электрическому току?
Вещества проводящие электрический ток – электролиты ; вещества не проводящие электрический ток – неэлектролиты.
Свойства электролитов
Электролиты – проводники второго рода. В растворе или расплаве они распадаются на ионы, благодаря чему и проводят электрический ток.
Для объяснения этого свойства в 1887 г. Шведский ученый С.Арениус предложил теорию электролитической диссоциации.
Распад электролитов на ионы при растворении его в воде или расплавлении называют электролитической диссоциацией.
Основные положения теории электролитической диссоциации.
1) Электролиты при растворении в воде распадаются (диссоциируют) на ионы – положительные и отрицательные : NaCl ↔ Na + + Cl -
2) При действии электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные – к аноду. Поэтому первые называются катионами, а вторые – анионами. Направленное движение ионов происходит в результате притяжения их к противоположено заряженным электродам.
3) Диссоциация – обратимый процесс: параллельно с распадом молекул на ионы (диссоциацией) протекает процесс соединения ионов (ассоциация). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости.
С.Аррениус не мог указать, почему электролиты при растворении в воде распадаются на ионы, так как считал диссоциацию электролитов физическим процессом. Причину диссоциации выяснил русский ученый И.А.Каблуков, который, основываясь на теории Д.И.Менделеева о химической природе растворения, стал рассматривать электролитическую диссоциацию как химическое взаимодействие электролитов с водой. Основная причина диссоциации – гидратация ионов, идущая с выделением большого количества энергии, чем затрачивается на ионизацию растворяемого вещества.
Механизм электролитической диссоциации.
Диссоциация электролитов происходит в воде и не происходит, например, в керосине. Как это объяснить?
В молекуле воды связи между атомами водорода и атомами кислорода ковалентные полярные. Электронные пары, связывающие атомы. Смещены от атома водорода к атому кислорода. На атомах водорода поэтому сосредоточен положительный заряд, а на атоме кислорода – отрицательный.
Рассмотрим механизм диссоциации веществ с ионным видом связи на примере хлорида натрия. Он состоит из трёх этапов:
a) ориентация полярных молекул воды (диполей) вокруг кристалла и расшатывание кристаллической решётки под действием хаотичного движения молекул воды; (при погружении кристалла соли в воду молекулы воды притягиваются к ионам, находящимся на поверхности кристалла: к положительным ионам своими отрицательными полюсами (атомы кислорода), а к отрицательным ионам – положительными полюсами (атомы водорода).
b) гидратация – окружение молекулами воды ионов натрия и хлора (образование гидратированных ионов);
c) разрушение кристаллической решётки – диссоциация хлорида натрия.
(притянувшись к ионам растворяемой соли молекулы воды во много раз ослабляют притяжение ионов друг к другу. Связи между положительными и отрицательными ионами в кристаллической решетке разрываются. Происходит разъединение гидратированных ионов)
Молекулы воды, притянувшиеся к ионам при растворении кристалла, остаются связанными с ними и в растворе.
Механизм диссоциации веществ с ковалентной полярной связью включает в себя дополнительный этап:
ориентация полярных молекул воды вокруг полярной молекулы электролита;
изменение вида связи с ковалентной полярной на ионную;
4) Не все электролиты в равной мере диссоциируют на ионы. В растворах электролитов наряду с ионами могут присутствовать и молекулы. Степень диссоциации a – это отношение молекул, распавшихся на ионы, к общему числу молекул в растворе a = n/N,
где n – число диссоциированных молекул, N – общее число молекул в растворе.
Сильные электролиты при растворении в воде практически полностью диссоциируют на ионы. У них a стремится к единице. К сильным электролитам относятся: все растворимые соли, кислоты H2SO4, HNO3, HCl, все щелочи.
Слабые электролиты при растворении в воде почти не диссоциируют на ионы. У них a стремится к нулю. К слабым электролитам относятся: слабые кислоты – H 2 S, H 2 CO 3 , H 2 SO 3 , HNO 2 , NH 3 ·H 2 O, вода.
Диссоциация кислот, солей и оснований.
Диссоциация протекает в растворах и расплавах.
Растворимые кислоты - это электролиты, которые в водных растворах и расплавах диссоциируют на катион водорода и анион кислотного остатка.
Основания – это электролиты, которые в водных растворах и расплавах диссоциируют на катион металла и гидроксид-анион.
Растворимые основания – это гидроксиды, образованные ионами активных металлов: одновалентных: Li + , Nа + , К + , Rb + , Сs + , Fr + ; двухвалентных: Са 2+ , Sr 2+ , Ва 2+ .
Соли – это электролиты, которые в водных растворах и расплавах диссоциируют на катион металла и анион кислотного остатка.
Электролиты чрезвычайно важны в науке и технике. Все жидкие системы в живых организмах содержат электролит. Важный класс электролитов - полиэлектролиты.
Электролиты являются средой для проведения многих химических синтезов и процессов электрохимических производств. При этом всё большую роль играют неводные растворы электролитов. Благодаря им возможно создания новых химических источников тока и совершенствования технологических процессов разделения веществ - экстракции из растворов и ионного обмена.
Электролиты – вещества, подвергающиеся в растворах или расплавах электролитической диссоциации и проводящие электрический ток за счет движения электронов.
Сила электролита в значительной степени зависит от природы растворителя. Мерой воздействия растворителя является диэлектрическая проницаемость, значение которой для воды весьма высока и при 20 градусах равно 81. Именно для воды свойство ослаблять химические связи между ионами особенно сильно.
Деление электролитов на сильные и слабые в некоторой степени условно, т. к. оно отражает не свойства самих электролитов, а их состояние в растворе. Последнее зависит от концентрации, природы растворителя, температуры, давления и др.
Цель данного реферата дать определение понятию электролиты, выявить их свойства и различия, а также подробно рассмотреть диссоциации кислот, оснований и солей.
Электролитическая диссоциация.
Одним из важнейших факторов растворимости являются силы межмолекулярного взаимодействия возникающие между частицами растворенного вещества и молекулами растворителя. В ряде случаев действие этих сил приводит к тому, что дробление веществ на мельчайшие частицы в растворе идет дальше и растворение сопровождается диссоциацией молекул на ионы. Например:
Представьте, что газообразный хлористый водород попадает в воду и начинает взаимодействовать с молекулами растворителя. При этом молекулы HCl связываются с молекулами воды силами межмолекулярного взаимодействия. Обобщенно такой процесс называется гидратацией, а связанные с HCl молекулы воды – гидратной оболочкой.
В случае с раствором хлороводорода (соляная кислота) дальнейшая гидратация молекул HCl приводит к разрыву связи H–Cl и образованию в растворе гидратированных подвижных ионов H + (водн) и Cl – (водн). Ионы несут электрический заряд – положительный и отрицательный. Раствор, в котором теперь присутствуют подвижные ионы, становится электропроводным. Поэтому процесс распада вещества в растворе на ионы называется электролитической диссоциацией.
Электролитическая диссоциация – это полный или частичный распад растворенного вещества на ионы.
Теорию электролитической диссоциации в 80-х годах XIX века предложил выдающийся шведский химик Сванте Аррениус (1859-1927). Сегодня нам кажется вполне естественным, что растворенные вещества могут распадаться на ионы. Мы знаем, почему устойчивы именно такие, а не другие ионы – это знание опирается на современные представления о строении атомов. Например, элемент Na (электронная оболочка 1s 2 2s 2 2p 6 3s 1 ) может существовать в виде устойчивого катиона Na + , имеющего уже электронную оболочку чрезвычайно стабильной частицы – атома инертного газа неона (1s 2 2s 2 2p 6 ). В отличие от нейтрального атома неона, заряженная частица Na + хорошо взаимодействует с молекулами полярного растворителя – воды. Анион Cl – имеет электронную оболочку инертного газа аргона (…3s 2 3p 6 ). Таким образом, на процесс диссоциации влияет не только взаимодействие ионов с растворителем, но и фактор устойчивости самих ионов.
По признаку электрической проводимости все растворы можно разделить на две большие группы: растворы электролитов (проводят электрический ток) и растворы неэлектролитов (ток не проводят). Например, чистая вода, а также водные растворы сахара, глюкозы, спирта и ряда других веществ ток практически не проводят (в растворах отсутствуют ионы), поэтому эти вещества – неэлектролиты.
Напротив, раствор хлороводорода (соляная кислота) – это не просто электролит, а сильный электролит: более 99% молекул HCl в растворе распадаются на ионы H + и Cl – . Поэтому обратную стрелку в уравнении диссоциации HCl изображают короткой или вообще не пишут. Такие же свойства у растворов HBr (бромоводородная кислота) и HI (иодоводородная кислота).
Однако вполне похожее соединение – фтороводород HF – не проявляет свойств сильного электролита и в растворе ток проводит плохо. Здесь, наоборот, в уравнении диссоциации нужна более длинная обратная стрелка:
Константа и степень диссоциации.
В месте с процессом диссоциации на ионы, в растворах происходит и обратный процесс – ассоциация ионов в нейтральные молекулы. Таким образом, электролитическая диссоциация – это обратимая химическая реакция или динамическое равновесие, к которому применимы те же закономерности, что и к любому другому химическому равновесию. Например, для описания процесса диссоциации можно использовать константу равновесия Кр, которая в данном случае будет называться константой диссоциации Кд:
Итак, константа диссоциации Кд – это частный случай константы равновесия. Значения Кд для сильных электролитов часто бывают настолько велики, что их не удается измерить непосредственно. Эти значения получают косвенно, из термодинамических данных, и в разных справочниках они могут отличаться, хотя и остаются очень большими. Для нас здесь важно то обстоятельство, что ионов H + и Cl – в растворе очень много (их концентрация – в числителе дроби), а недиссоциированных молекул [HCl] чрезвычайно мало.
Напротив, Кд фтороводорода намного меньше единицы (ее значение уже можно определить более точно – см. следующий параграф). Следовательно, в растворе много недиссоциированных молекул HF и мало ионов H + и F – .
Оба раствора (HCl и HF) являются растворами электролитов, но HCl – сильный электролит, а HF – слабый. На примере этих двух веществ мы видим, что хорошую (или плохую) диссоциацию в растворе, как и хорошую (или плохую) растворимость трудно предсказать только по формуле вещества.
Помимо константы диссоциации, мерой силы электролита может служить степень диссоциации α. Это отношение числа распавшихся на ионы молекул (n1) к общему числу молекул (n0), изначально попавших в раствор:
сильные электролиты – α близка к 1 (или 100%);
слабые электролиты – α около 0,01 (1% и менее).
Поскольку вода – полноправный участник процесса диссоциации, ее иногда включают в химическое уравнение. Например, для уксусной кислоты процесс ее диссоциации в воде можно записать так:
Такие уравнения как бы подчеркивают, что ионы в водном растворе не изолированы, а связаны с молекулами растворителя. Для иона Н + это взаимодействие очень характерно: благодаря его связыванию с не поделенной электронной парой атома кислорода молекулы Н2О образуется достаточно прочный комплекс Н2О---Н + или, как его условно называют, ион гидроксония Н3О + . Конечно, молекулы воды взаимодействуют и с анионом CH3COO – (и любыми другими анионами), но это обстоятельство в уравнениях диссоциации обычно не отражают просто по традиции (и чтобы не загромождать уравнения).
Поскольку к процессу диссоциации применим принцип Ле Шателье, последнее уравнение указывает нам на еще одну важную закономерность: если разбавлять раствор уксусной кислоты, т.е. добавлять в него воду, то по принципу Ле Шателье должен активизироваться процесс, связанный с расходованием воды, т.е. прямая реакция (распад на ионы). В этом случае в растворе должен активизироваться процесс образования ионов из молекул. Иными словами, при разбавлении растворов слабых электролитов степень диссоциации возрастает.
Этот закон, установленный физико-химиком Вильгельмом Оствальдом в 1888 г., позволяет, в частности, с высокой точностью определять константы диссоциации многих веществ (за исключением очень сильных электролитов). Дело в том, что величину α удается опытным путем связать с электропроводностью раствора. Таким образом, зная концентрацию раствора, и выяснив в опыте степень диссоциации электролита, можно вычислить и величину Кд.
Полезность закона разбавления не исчерпывается определением констант диссоциации. Приведем простой пример его практического использования – вычислим более точно степень диссоциации в 0,1 М растворе уксусной кислоты, если ее константа диссоциации Кд = 1,8·10 –5 . Поскольку электролит слабый (это видно из константы диссоциации), можно воспользоваться законом разбавления для слабых электролитов: Кд = α 2 С. Отсюда:
Подставляя в эту формулу численные значения, получим:
Эта же формула поможет нам количественно определить, как изменитя степень диссоциации в таком растворе, если его разбавить в 10 раз. После разбавления концентрация уксусной кислоты составит 0,01 М. Отсюда:
Мы видим, что при разбавлении степень диссоциации уксусной кислоты заметно возросла.
Диссоциация кислот, оснований, солей.
При диссоциации кислот роль катионов играют ионы водорода (H + ), других катионов при диссоциации кислот не образуется:
Именно ионы водорода придают кислотам их характерные свойства: кислый вкус, окрашивание индикатора в красный цвет и проч.
Отрицательные ионы (анионы), отщепляемые от молекулы кислоты, составляет кислотный остаток.
одноосновные кислоты: HCl, HF, HNO3;
двухосновные кислоты: H2SO4, H2CO3;
трехосновные кислоты: H3PO4.
Ступенчатая диссоциация двухосновной кислоты:
Ступенчатая диссоциация трехосновной кислоты:
При диссоциации многоосновных кислот самая высокая степень диссоциации приходится на первую ступень. Например, при диссоциации фосфорной кислоты степень диссоциации первой ступени равняется 27%; второй - 0,15%; третьей - 0,005%.
При диссоциации оснований роль анионов играют гидроксид-ионы (ОH - ), других анионов при диссоциации оснований не образуется:
однокислотные основания - KOH, NaOH;
двухкислотные основания - Ca(OH)2;
трехкислотные основания - Al(OH)3.
ZnOH + ↔ Zn 2+ + OH -
Некоторые вещества, в зависимости от условий, могут выступать, как в роли кислот (диссоциировать с отщеплением катионов водорода), так и в роли оснований (диссоциировать с отщеплением гидроксид-ионов). Такие вещества называются амфотерными.
Диссоциация Zn(OH)2, как основания:
ZnOH + ↔ Zn 2+ + OH -
Диссоциация Zn(OH)2, как кислоты:
Соли диссоциируют в воде на анионы кислотных остатков и катионы металлов (или других соединений).
Нормальные (средние) соли получаются полным одновременным замещением всех атомов водорода в кислоте на атомы металла - это сильные электролиты, полностью диссоциируют в воде с образованием катоинов металла и однокислотного остатка: NaNO3, Fe2(SO4)3, K3PO4.
Кислые соли содержат в своем составе кроме атомов металла и кислотного остатка, еще один (несколько) атомов водорода - диссоциируют ступенчато с образованием катионов металла, анионов кислотного остатка и катиона водорода: NaHCO3, KH2PO4, NaH2PO4.
Основные соли содержат в своем составе кроме атомов металла и кислотного остатка, еще одну (несколько) гидроксильных групп - диссоциируют с образованием катионов металла, анионов кислотного остатка и гидроксид-иона: (CuOH)2CO3, Mg(OH)Cl.
Mg(OH)Cl ↔ Mg(OH) + + Cl -
Двойные соли получаются одновременным замещением атомов водорода в кислоте на атомы различных металлов: KAl(SO4)2.
Смешанные соли диссоциируют на катионы металла и анионы нескольких кислотных остатков: CaClBr.
CaClBr ↔ Ca 2+ + Cl - + Br -
Заключение.
Итак, подведем итоги: Электролитами называют вещества, растворы и сплавы которых с другими веществами электролитически проводят гальванический ток.
Признаком электролитической проводимости в отличии от металлической должно считать возможность наблюдать химическое разложение данного вещества при более или менее продолжительном прохождении тока. В химически чистом состоянии электролиты обыкновенно обладают ничтожно малой электропроводностью.
Слово электролит широко используется в науке и технике, в разных отраслях оно может иметь различающийся смысл.
Многокомпонентный раствор для электроосаждения металлов, а также травления и др. (технический термин, например электролит золочения)
Электролиты являются важной частью химических источников тока: гальванических элементов и аккумуляторов. Электролит участвует в химических реакциях окисления и восстановления с электродами, благодаря чему возникает ЭДС. В источниках тока электролит может находиться в жидком состоянии (обычно это водный раствор) или загущённым до состояния геля.
В электролитических конденсаторах в качестве одной из обкладок используется электролит. В качестве второй обкладки — металлическая фольга (алюминий) или пористый, спечённый из металлических порошков блок (тантал, ниобий). Диэлектриком в таких конденсаторах служит слой оксида самого металла, формируемый химическими методами на поверхности металлической обкладки.
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A - (анион)
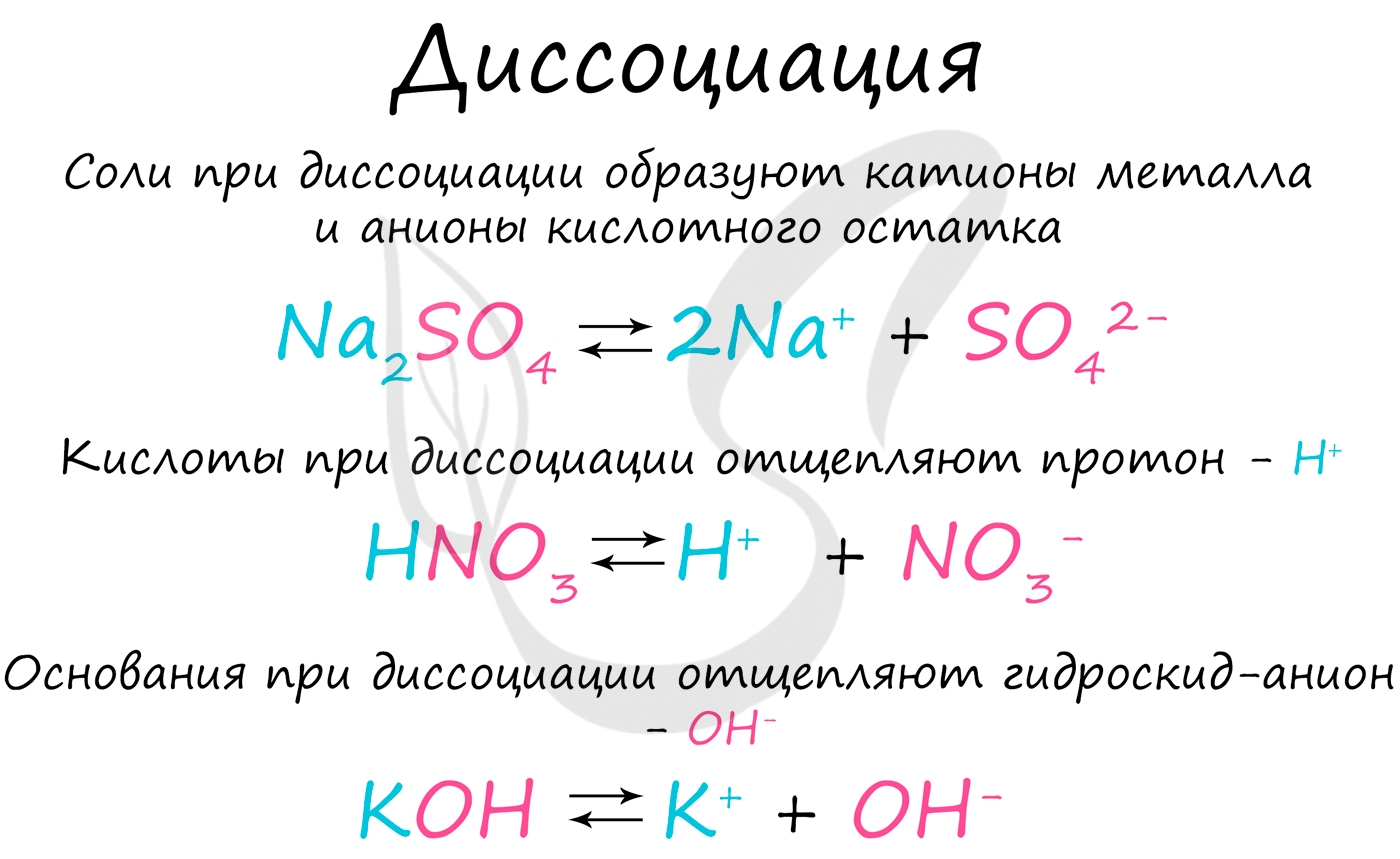
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
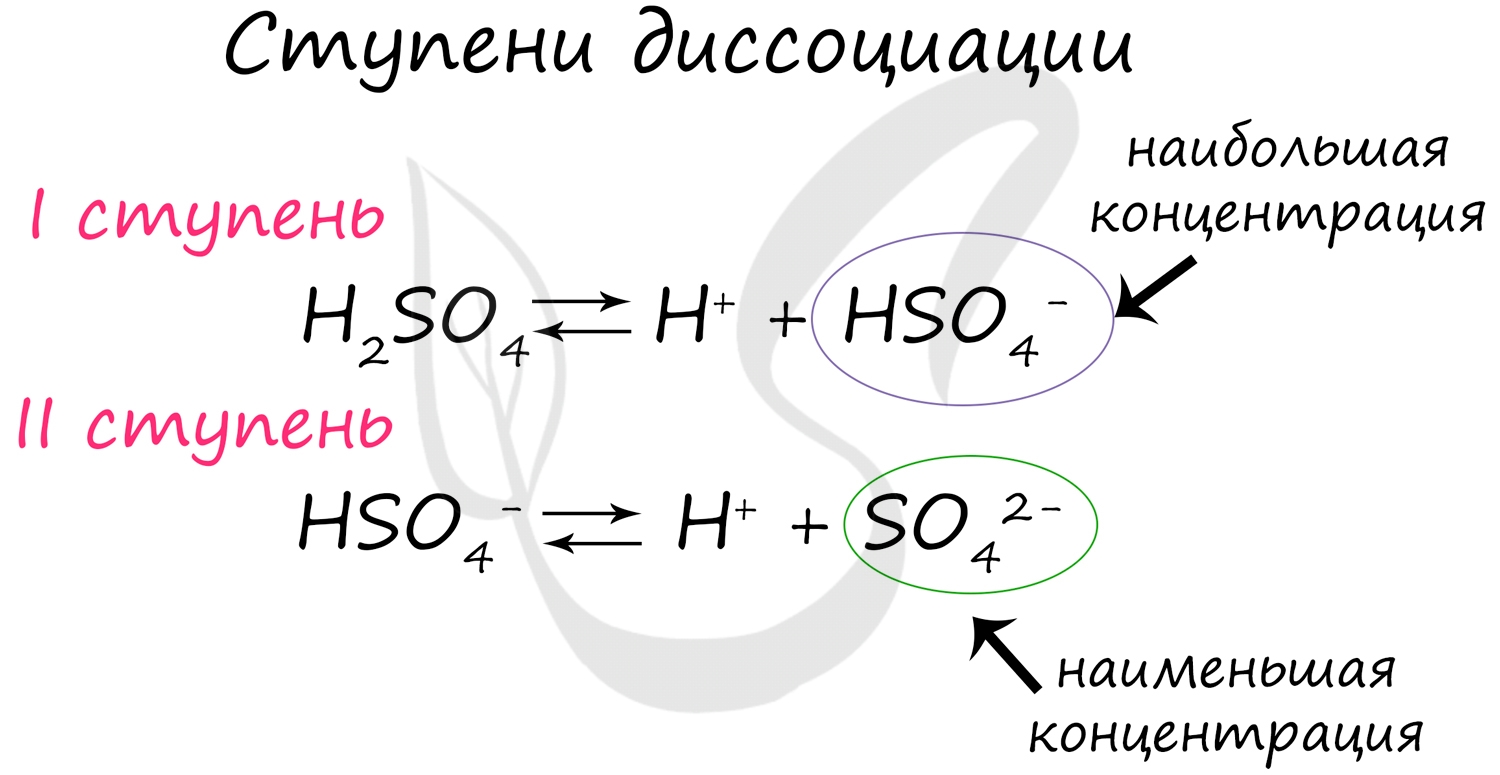
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
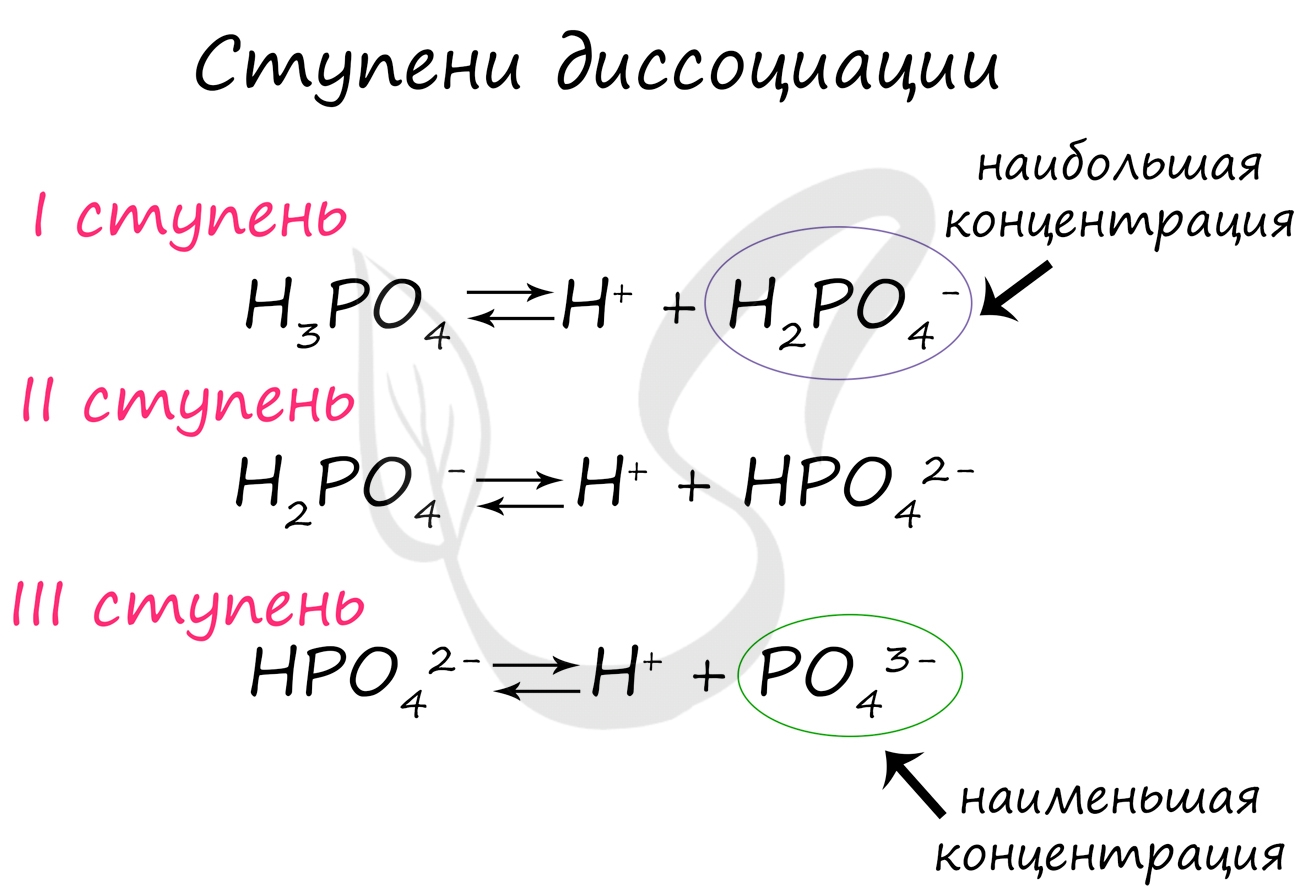
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.

Электролиты - жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
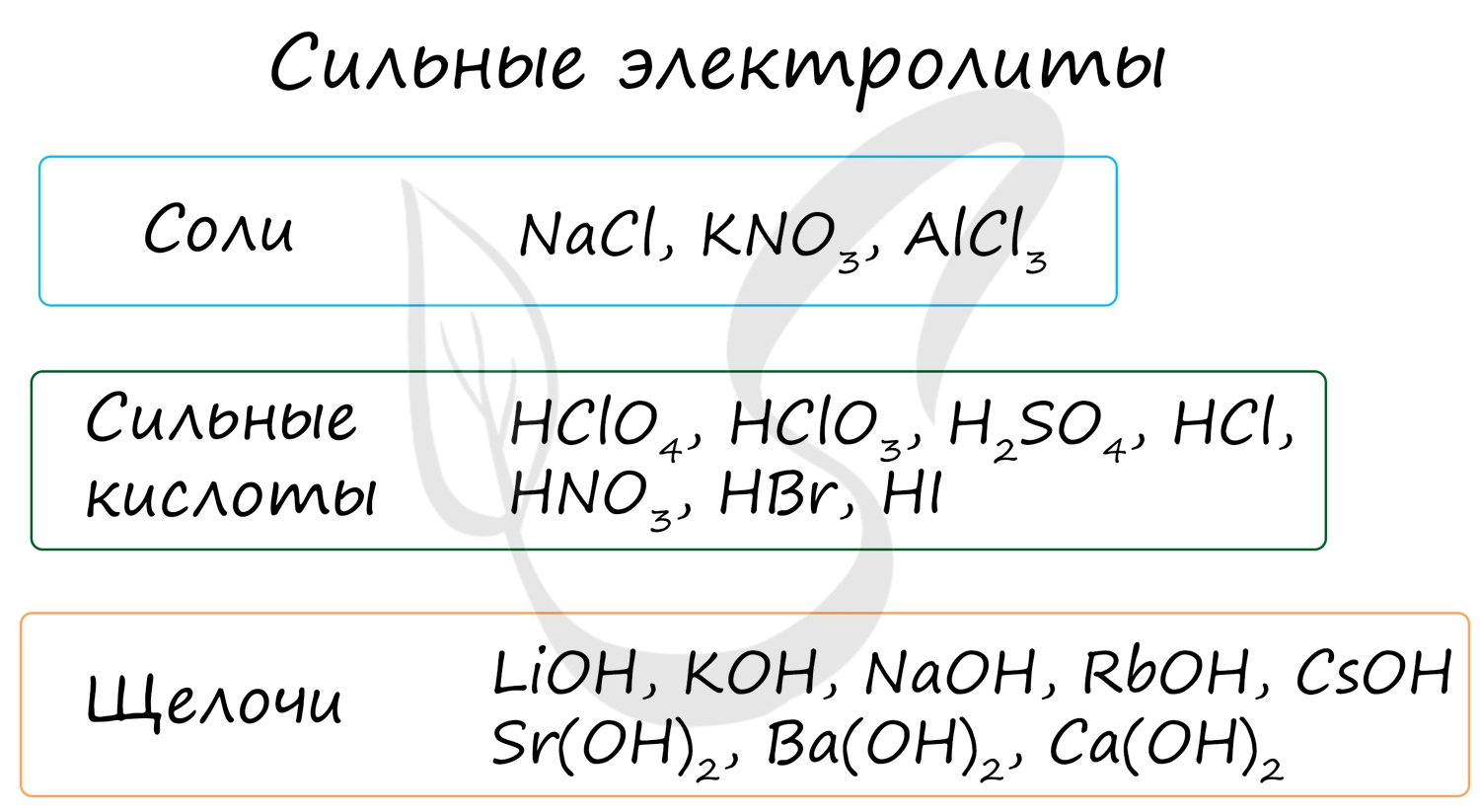
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
Неэлектролиты - вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
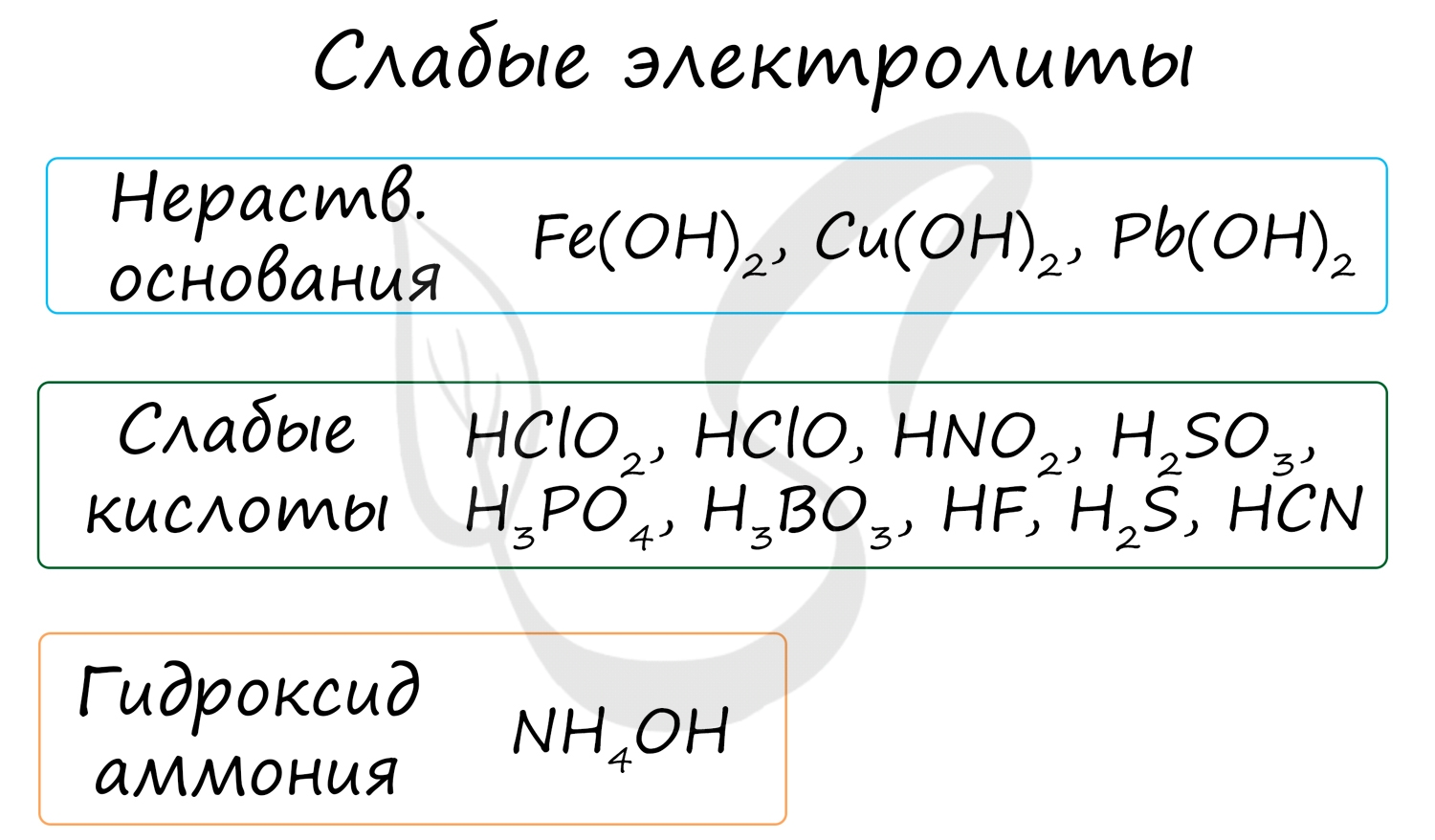
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
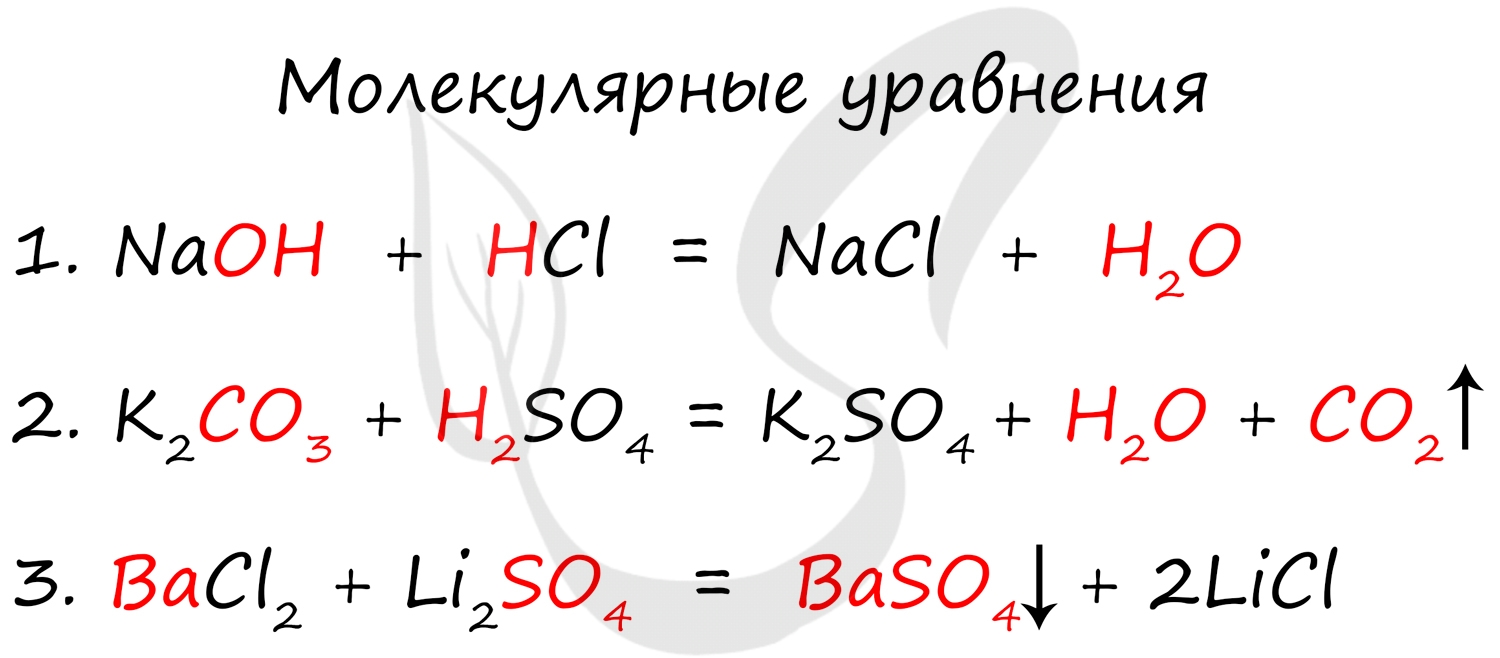
- Слабые электролиты (в их числе вода)
- Осадки
- Газы

Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике - остается только то, что сократить нельзя.
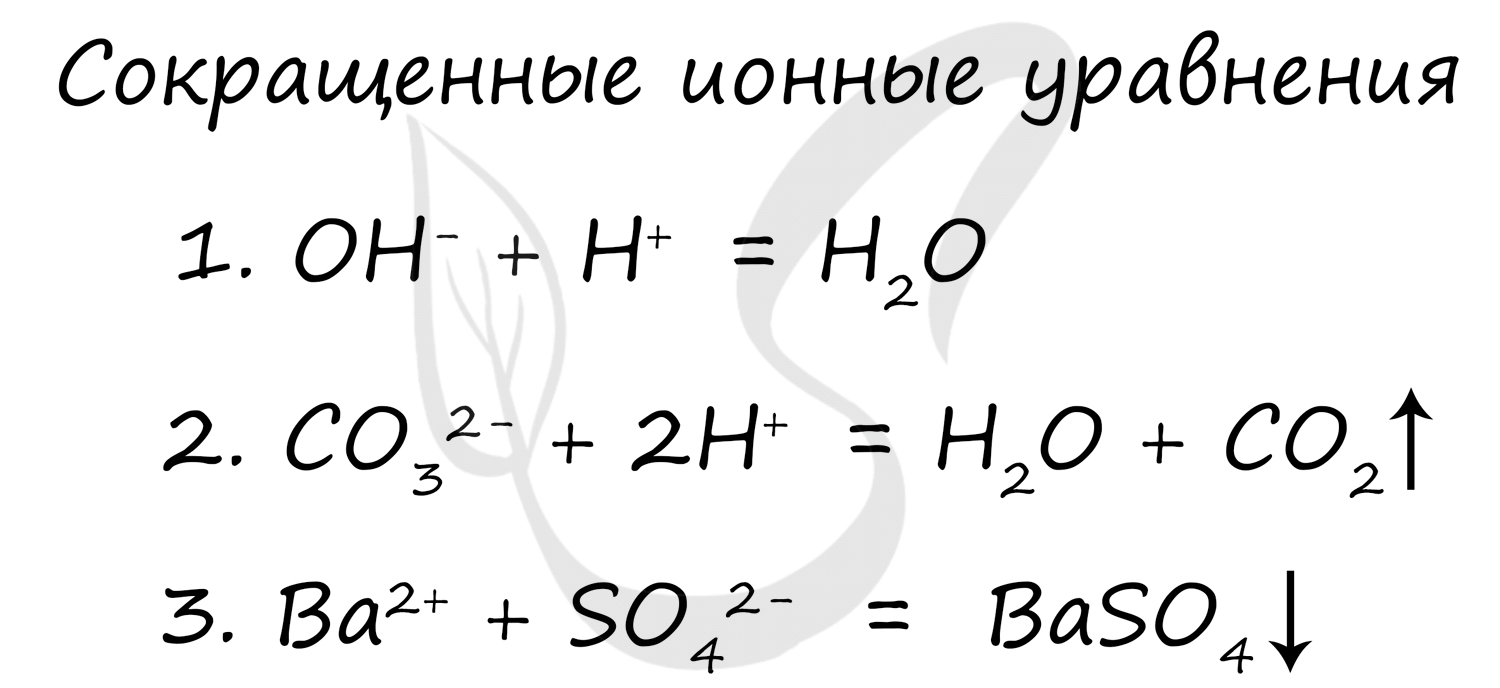
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:

