Реферат на тему болезнь паркинсона
Обновлено: 25.06.2024
Это синдром прогрессирующего поражения центральной нервной системы (экстрапирамидной системы), проявляющийся снижением общей двигательной активности, замедленностью движений (брадикинизией) , дрожанием , повышением мышечного тонуса, тремором , ригидностью и гипокинезией, акинезией , тремор покоя и постуральной неустойчивостью в различных сочетаниях, а также нарушениями походки и нарушениями позы . Обычно связан с поражением базальных ганглиев или их связей с моторными зонами коры . Паркинсонизм у пожилых встречается часто. Исследования показали, что в возрасте 65-74 лет паркинсонизм встречается у 15% лиц, а в возрасте старше 85 лет - более чем у 50%.
Гетерогенную группу болезней Паркинсона нозологически подразделяют на первичный (идиопатический, генуинный паркинсонизм, дрожательный паралич, paralysis agitans) и вторичный (симптоматический) паркинсонизм. К вторичному паркинсонизму относят заболевания головного мозга, при которых обнаруживается паркинсонический синдром: постэнцефалитический, атеросклеротический, лекарственный, токсический.
В последние годы в связи с развитием молекулярной генетики в медицинскую терминологию введены понятия спорадический, моногенный, семейный паркинсонизм.
Классическая триада основных симптомов болезней Паркинсона включает ригидность скелетной мускулатуры, гипокинезию и тремор "покоя" конечностей, головы и нижней челюсти. В современной неврологии в качестве четвертого характерного симптома фигурируют постуральные нарушения.
При идиопатической форме паркинсонизма патоморфологические нарушения обусловлены появлением в цитоплазме нейронов эозинофильных включений - телец Леви, диффузно распределенных в черной субстанции (substantia nigra) среднего мозга, гипоталамусе, гиппокампе, подкорковых ганглиях. Регистрируется повреждение нигральных дофаминергических нейронов, ведущее к резкому снижению концентрации дофамина в полосатом теле, следствием чего является изменение функционального состояния структуры стриопаллидарного комплекса. Принято считать, что присутствие телец Леви одновременно с гибелью нейронов черной субстанции является патоморфологической характеристикой, отличающей идиопатическую форму болезни Паркинсона от других нейродегенеративных заболеваний.
К настоящему времени выдвинуто несколько гипотез для объяснения причин болезней Паркинсона (митохондриальная теория; гипотеза, связанная с накоплением железа, свободных радикалов, нейротоксинов, агрессивным действием вирусных инфекций; теория генетической предрасположенности). Вероятнее всего несколько механизмов одновременно или поэтапно могут вести к формированию риска заболевания.
Основная часть случаев болезни Паркинсона, за исключением моногенных наследственных форм, относится к категории мультифакториальных нейро-дегенеративных заболеваний и является результатом взаимодействия генетических и средовых факторов.
Этиология паркинсонизма до настоящего времени остаётся не полностью выясненной.
Однако, по-видимому, в развитии болезни Паркинсона играет роль генетическая предрасположенность, а также воздействие различных нейротоксинов, образующихся в самих дофаминовых нейронах, в частности, МФТП (англ. MPTP) и свободных радикалов, приводящее к повреждению дофаминовых нейронов, истощению в них запасов дофамина, нарушению их трофики и в конечном итоге гибели нейронов.
Болезнь Паркинсона относят к дегенеративным заболеваниям головного мозга с наследственной предрасположенностью, основными проявлениями которого являются нарушение контроля за своими движениями, замедленность и скованность при ходьбе, дрожание рук, ног и подбородка. Болезнь Паркинсона – это одно из самых частых заболеваний среди пожилых людей. А отдельные признаки паркинсонизма всё чётче вырисовываются даже у здорового человека по мере его естественного старения. Болезнь Паркинсона возникает чаще всего в возрасте 50-65 лет и длительно неуклонно прогрессирует. Мужчины и женщины страдают с одинаковой частотой. Распространенность болезни Паркинсона среди населения в целом составляет 1-2 на 1000, а среди лиц старше 65 лет - 1:100.
Различают первичный и вторичный паркинсонизм. Первичный паркинсонизм – это собственно болезнь Паркинсона, вызванная наследственными факторами и составляющая 80% от всех проявлений паркинсонизма. Вторичный паркинсонизм (или синдром Паркинсона) проявляется не сам по себе, а на фоне различных заболеваний и патологических состояний.
В поздних стадиях болезни Паркинсона нередко присоединяется органический психоз с галлюцинаторно-параноидными проявлениями или хронический делирий (дезориентация во времени и месте, спутанность, галлюцинации, бред). Болезнь Паркинсона развивается в результате гибели клеток компактной части черной субстанции и голубоватого места. Кроме того, погибают нейроны бледного шара и скорлупы. В нейронах базальных ядер, ствола мозга, спинного мозга и симпатических ганглиев обнаруживают эозинофильные включения (тельца Леви). Они отсутствуют при других заболеваниях, сопровождающихся паркинсонизмом.
Медиальный бледный шар и сетчатая часть черной субстанции оказывают тормозящее действие на ядра таламуса, от которых идет возбуждающая импульсация к моторной коре; стриатум (хвостатое ядро и скорлупа) модулирует это тормозящее действие. Это осуществляется с помощью прямого моносинаптического тормозного пути от стриатума к медиальному бледному шару и сетчатой части черной субстанции, а также непрямого пути тормозного пути, идущего от стриатума к данным структурам через латеральный бледный шар и субталамическое ядро; этот непрямой путь в конечном счете растормаживает медиальный бледный шар и сетчатую часть черной субстанции. Таким образом, активация прямого пути ведет к возбуждению моторной коры, а непрямого - наоборот.
Отростки дофаминергических нейронов компактной части черной субстанции направляются к стриатуму, оказывая возбуждающее влияние на прямой путь (через D1-рецепторы) и тормозящее - на непрямой (через D2-peцепторы). При болезни Паркинсона дофаминергические нейроны черной субстанции погибают. В результате снижается активность прямого пути и повышается - непрямого. Следовательно, уменьшаются возбуждающие влияния таламуса на моторную кору.
При болезни Паркинсона уменьшается содержание и других медиаторов, в частности норадреналина. Клинические проявления этих изменений неизвестны. Предполагают, что их следствием бывает депрессия.
Болезнь обычно начинается с малых признаков двигательных нарушений: с мелкого тремора, напоминающего катание пилюль, гипертонуса мышц, брадикинезии (замедленные, затруднённые движения) и гипокинезии (уменьшение двигательной активности), появления гнусавости и смазанности речи, скованности и неловкости в движениях, изменения походки (шаркающая, мелкие шажки), изменения почерка (мелкий дрожащий почерк).
У многих больных, умерших от паркинсонизма, при вскрытии в черной субстанции обнаруживаются белковые скопления (они называются тельцами Леви по фамилии немецкого патологоанатома, открывшего их в 1912 г.). Аналогичные образования характерны также для болезни Альцгеймера и хореи Гентингтона. Являются ли эти кластеры причиной деструктивных изменений или, напротив, выполняют защитные функции, удерживая аномальные, токсичные для нейрона белки от распространения по всей клетке, - не совсем ясно. В любом случае большинство ученых сходятся на том, что выяснение причины кластеризации белков поможет раскрыть тайну болезни Паркинсона.
Центральное место во всей этой истории занимают два внутриклеточных процесса: пространственная упаковка белков и их элиминация. Белки синтезируются в клетке в виде полимерной цепочки из аминокислот, соединяющихся друг с другом в соответствии с инструкциями, записанными в генах. По завершении синтеза белковая молекула сворачивается в компактную трехмерную глобулу при участии особых молекул - шаперонов. Эти же молекулы вновь упаковывают белки, утратившие должную конфигурацию. Если по тем или иным причинам шаперонная система выходит из строя, то неправильным образом уложенные белки становятся мишенью для так называемой убиквитин-протеасомной системы. Сначала к белковой молекуле с аномальной конформацией присоединяется небольшой белок убиквитин (процесс называется убиквитинилированием). Вслед за первой убиквитиновой "бусиной" присоединяется вторая - и так до тех пор, пока на конце обреченной на гибель белковой молекулы не образуется цепочка (своеобразная "черная метка"). Она служит сигналом для протеасомы ("мусорщика" нервной клетки) к расщеплению аномального белка на составляющие его аминокислоты. В 2004 г. за исследование этой системы были удостоены Нобелевской премии по химии Авраам Гершко (Avram Hershko) и Аарон Цихановер (Aaron Ciechanover) из Института "Технион" в Израиле, а также американский биохимик Ирвин Роуз (Irwin Rose) из Калифорнийского университета.
В 1997 г. Михаэль Полимеропулос (Mihael H. Polymeropoulos) из Национальных институтов здоровья идентифицировал мутацию в гене, кодирующем белок под названием альфа-синуклеин, у членов итальянских и греческих семей, страдавших наследственной формой паркинсонизма.
Мутация наследовалась по аутосомно-доминантному типу, т.е. для возникновения болезни было достаточно одной мутантной копии гена (полученной от отца или матери). Мутация в гене альфа- синуклеина встречается крайне редко: доля несущих ее больных составляет лишь 1% от числа всех страдающих паркинсонизмом. Но сам факт обнаружения связи между наличием мутантного белка и болезнью Паркинсона вызвал большой интерес в научных кругах. Отчасти это было связано с тем, что в том же году выяснилось, что альфа-синуклеин (не важно, мутантный или нормальный) относится к категории белков, способных к образованию кластеров. Отсюда напрашивается вывод: разобравшись, каким образом мутация приводит к паркинсонизму, можно раскрыть тайну образования телец Леви в дофаминпродуцирующих клетках черной субстанции при болезни Паркинсона.
В 1998 г. японские ученые Есикуни Мицуно (Yoshikuni Mizuno) из Университета Джунтендо и Нобуёси Шимицу (Nobuyoshi Shimizu) из Университета Кейо идентифицировали еще один ген - он кодирует белок паркин, мутация в котором приводит к наследственному паркинсонизму, но другого типа. Такая мутация обычно встречается у людей, заболевших в возрасте до 40 лет, и чем моложе пациент, тем выше вероятность, что в основе заболевания лежит мутация в гене паркина. Те, кто получают мутантные копии гена и от отца, и от матери, обязательно заболевают, но к группе риска относятся и люди, несущие лишь одну копию мутантного гена. Мутации в гене паркина встречаются чаще, чем в гене альфа-синуклеина, однако точные цифры неизвестны.
В молекуле паркина имеются несколько доменов, характерных и для многих других белков. Особый интерес представляют так называемые RING-домены; содержащие их белки участвуют в расщеплении других белков. Имеющиеся на сегодня данные позволяют предположить, что гибель нейронов при данной форме паркинсонизма происходит, в частности, вследствие нарушения убиквитинилирования - составного компонента системы удаления аномальных белков. В норме паркин присоединяет убиквитин к неправильно упакованным белкам, без этого белок не получает "черную метку" и не разрушается. Недавно обнаружили, что белок под названием BAG5, присутствующий в тельцах Леви, может связываться с паркином и блокировать его работу, результатом чего служит гибель дофаминергических нейронов.
Интересно, что у некоторых больных, несущих мутацию в гене паркина, в нейронах черной субстанции отсутствуют тельца Леви. Это означает, что, пока происходит убиквитинилирование, белковые агрегаты не образуются. А отсюда, в свою очередь, следует, что, когда аномальные белки не держатся вместе, а распределяются по всей клетке, возникает хаос. Поскольку у людей с мутацией в гене паркина паркинсонизм развивается в молодом возрасте, можно предположить, что у них отсутствует защитный механизм, обеспечивающий кластеризацию токсичных белков.
Этиология и патогенез болезни Паркинсона, ее клиническая картина и диагностика. Развитие постуральной неустойчивости, проявление акинеза и пластической гипертонии. Изменения мышечного тонуса. Консервативное и хирургическое лечение болезни Паркинсона.
| Рубрика | Медицина |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 08.06.2016 |
| Размер файла | 23,6 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
1. Этиология болезни Паркинсона
2. Патогенез болезни Паркинсона
3. Клиническая картина болезни Паркинсона
4. Диагностика болезни Паркинсона
5. Течение и прогноз болезни Паркинсона
6. Консервативное лечение болезни Паркинсона
7. Хирургическое лечение болезни Паркинсона
8. Уход за больными людьми с болезнью Паркинсона
9. Специализированный уход и лечение
Введение
Заболевание впервые описано английским врачом Джеймсом Паркинсоном в 1817 году, который назвал его дрожательным параличом.
Болезнь Паркинсона относится к группе нейродегенеративных заболеваний, то есть при этом заболевании у человека гибнут нейроны головного мозга, которые вырабатывают дофамин в качестве нейромедиатора.
Удельный вес людей с болезнью Паркинсона в возрастной группе старше 60 лет составляет 1 %, а старше 85 лет - от 2,6 % до 4 %. Чаще всего первые симптомы заболевания появляются в 55-60 лет. Однако в ряде случаев болезнь может развиться и в возрасте до 40 (болезнь Паркинсона с ранним началом) или до 20 лет (ювенильная форма заболевания).
В России каждый год диагностируют болезнь Паркинсона почти у 10 тыс. человек. А во всем мире паркинсонизмом болеет больше 10 млн. человек, и в перспективе к 2050 году их число может увеличиться до 50 млн.
1. Этиология болезни Паркинсона
Болезнь Паркинсона в 20% случаев имеет генетические причины (наследственную предрасположенность и мутации), а в 80% случаев - факторы окружающей среды.
Клинические проявления дрожательного паралича и синдрома паркинсонизма возникают в результате перенесенных острых и хронических инфекций нервной системы (эпидемический энцефалит Экономо, клещевой, вирусный и другие виды энцефалитов).
Причинами болезни могут служить церебральный атеросклероз, сосудистые заболевания головного мозга, опухоли, травмы нервной системы, длительное использование препаратов фенотиазинового ряда (аминазин, трифтазин), производных раувольфии, метилдофа - лекарственный паркинсонизм.
Паркинсонизм может развиваться при острой или хронической интоксикации окисью углерода и марганца.
В возникновении акинетико-ригидного синдрома может иметь значение наследственно обусловленное нарушение обмена катехоламинов в мозге или неполноценность ферментных систем, контролирующих этот обмен.
Часто выявляется семейный характер заболевания при аутосомно-доминантном типе наследования. Различные экзо- и эндогенные факторы (атеросклероз, инфекции, интоксикации, травмы) способствуют проявлению генных дефектов в механизмах обмена катехоламинов в подкорковых ядрах и возникновению заболевания.
паркинсон гипертония постуральный мышечный
2. Патогенез болезни Паркинсона
Основным патогенетическим звеном дрожательного паралича и синдрома паркинсонизма является нарушение обмена катехоламинов (дофамина, норадреналина) в экстрапирамидной системе.
Дофамин выполняет самостоятельную медиаторную функцию в реализации двигательных актов. В норме концентрация дофамина в базальных узлах во много раз превышает его содержание в других структурах нервной системы. Ацетилхолин является медиатором возбуждения между полосатым телом, бледным шаром и черным веществом. Дофамин является его антагонистом, действуя тормозяще. При поражении черного вещества и бледного шара снижается уровень дофамина в хвостатом ядре и скорлупе, нарушается соотношение между дофамином и норадреналином, возникает расстройство функций экстрапирамидной системы. В норме импульсация модулируется в сторону подавления хвостатого ядра, скорлупы, черного вещества и стимулирования бледного шара. При выключении функции черного вещества возникает блокада импульсов, поступающих из экстрапирамидных зон коры большого мозга и полосатого тела к передним рогам спинного мозга. В то же время к клеткам передних рогов поступают патологические импульсы из бледного шара и черного вещества. В результате усиливается циркуляция импульсов в системе альфа- и гамма-мотонейронов спинного мозга с преобладанием альфа-активности, что приводит к возникновению паллидарно-нигральной ригидности мышечных волокон.
3. Клиническая картина болезни Паркинсона
Для болезни Паркинсона характерны 4 двигательных нарушения (тремор, гипокинезия, мышечная ригидность, постуральная неустойчивость), а также вегетативные и психические расстройства.
Для дрожательного паралича и паркинсонизма характерны гипо- и акинезия. Гипокинезия - снижение спонтанной двигательной активности. Появляется своеобразная сгибательная поза: голова и туловище наклонены вперед, руки полусогнуты в локтевых, лучезапястных и фаланговых суставах, нередко плотно приведены к боковым поверхностям грудной клетки, туловища, ноги полусогнуты в коленных суставах. Отмечается бедность мимики. Темп произвольных движений с развитием заболевания постепенно замедляется, иногда довольно рано может наступить полная обездвиженность. Походка характеризуется мелкими шаркающими шагами. Больной ходит мелкими шагами, ступни при этом располагаются параллельно друг другу - кукольная походка.
Постуральная неустойчивость развивается на поздних стадиях заболевания. У больного отмечаются затруднения преодоления как инерции покоя, так и инерции движения. Больному сложно начать движение, а начав его, трудно остановиться.
Акинез и пластическая гипертония особенно резко проявляются в мускулатуре лица, жевательных и затылочных мышцах, мышцах конечностей. При ходьбе отсутствуют содружественные движения рук (ахейрокинез). Речь тихая, монотонная, без модуляций, с наклонностью к затуханию в конце фразы.
В результате характерного для болезни Паркинсона уменьшения амплитуды движений почерк становится мелким - микрография.
Изменения мышечного тонуса ведут к нарушению тенденции конечности к возвращению в исходную позицию после совершённого движения. Например, после резкого пассивного тыльного сгибания стопы она некоторое время сохраняет приданную ей позицию - феномен Вестфаля.
Психические нарушения проявляются утратой инициативы, активности, сужением кругозора и интересов, резким понижением различных эмоциональных реакций и аффектов, а также некоторой поверхностью и медлительностью мышления (брадифрения). Наблюдаются брадипсихия - трудное активное переключение с одной мысли на другую, акайрия - прилипчивость, вязкость, эгоцентризм. Встречаются нарушения сна, дыхательные дискинезии с приступами зевоты, кашля, адипозогенитальные нарушения, вегетативные пароксизмы.
Посттравматический паркинсонизм достоверно можно диагностировать у больных молодого и среднего возраста. Заболевание развивается после тяжелой, иногда повторной черепно-мозговой травмы. Для посттравматического паркинсонизма нехарактерны антеретропульсии, судорога взора, расстройства жевания, глотания, дыхания, каталептоидные явления. В то же время часто встречаются вестибулярные расстройства, нарушение интеллекта и памяти, зрительные галлюцинации (вследствие поражения коры большого мозга). Нередко отмечаются регредиентное течение или стабилизация патологического процесса.
4. Диагностика болезни Паркинсона
Диагностика болезни Паркинсона в большинстве случаев не вызывает затруднений - достаточно наличия у пациента гипокинезии и одного из симптомов: тремора покоя, ригидности, постуральных нарушений в сочетании с положительным эффектом от приёма леводопы. На начальных этапах заболевания, когда проявления заболевания не выражены либо выражены слабо, правильной диагностике может способствовать выявление постуральных рефлексов (рефлексов положения).
5. Течение и прогноз болезни Паркинсона
Заболевание неуклонно прогрессирует. Исключение составляют некоторые формы, обусловленные лекарственными интоксикациями (при отмене препаратов может наступить улучшение состояния). Общепризнано, что лечение в начальной стадии позволяет уменьшить выраженность симптомов, замедлить прогрессирование заболевания. В поздних стадиях лечебные мероприятия менее эффективны. Заболевание приводит к инвалидизации в течение нескольких лет.
6. Консервативное лечение болезни Паркинсона
Лечение больных с дрожательным параличом должно быть комплексным, длительным и включать специфические антипаркинсонические препараты, седативные средства, физиотерапевтические процедуры, лечебную физкультуру, психотерапию с учетом этиологического фактора, возраста больных, клинической формы и стадии болезни, а также наличия сопутствующих заболеваний.
При легких формах вначале назначают амантадин (мидантан) и парасимпатолитики, так как они вызывают меньше побочных явлений. Применяют центральные парасимпатолитики (циклодол, наркопан), пиридоксин, амантадин, агонисты дофаминовых рецепторов (бромокриптин, лизурид).
При выраженных клинических проявлениях паркинсонизма в настоящее время базисным препаратом является леводопа, обычно в сочетании с ингибитором декарбоксилазы. Дозы увеличивают медленно, в течение нескольких недель, до по лучения клинического эффекта. Побочные действия препарата - дистонические нарушения и психозы. Леводопа, попадая в ЦНС, декарбоксилируется в допамин, необходимый для нормальной функции базальных ганглиев. Препарат влияет прежде всего на акинезию и в меньшей степени - на другие симптомы. При сочетании леводопы с ингибитором декарбоксилазы можно уменьшить дозу леводопы и тем самым уменьшить риск развития побочных явлений.
В арсенале симптоматических антипаркинсонических средств большое место занимают холинолитические препараты, которые, блокируя м- и н-холинорецепторы, способствуют расслаблению поперечнополосатой и гладкой мускулатуры, уменьшают насильственные движения и явления брадикинезии. Это естественные и синтетические атропиноподобные препараты: беллазон (ромпаркин), норакин, комбипарк. Применяют также препараты фенотиазинового ряда: динезин, депаркол, парсидол, дипразин. Основная причина многообразия медикаментозных препаратов, используемых для лечения паркинсонизма, в недостаточной их лечебной эффективности, наличии побочных явлений, индивидуальной непереносимости и быстром привыкании к ним.
7. Хирургическое лечение болезни Паркинсона
Несмотря на большие успехи, достигнутые в медикаментозном лечении паркинсонизма, возможности его в ряде случаев ограничены.
Наиболее широко применяемый препарат леводопа в большей степени способствует устранению таких симптомов болезни, как акинезия, общая скованность, в меньшей степени он влияет на ригидность мышц и тремор. Приблизительно у 25 % больных этот препарат практически неэффективен или плохо переносится.
В этих случаях возникают показания для стереотаксической операции на подкорковых узлах. Обычно производится локальное разрушение вентролатерального ядра зрительного бугра, субталамических структур или бледного шара.
С помощью операции удается в большинстве случаев добиться положительного эффекта - снижения мышечного тонуса, ослабления или прекращения тремора, уменьшения гипокинезии.
Операция обычно выполняется на стороне, противоположной той, на которой преобладают симптомы паркинсонизма. При показаниях производится двустороннее разрушение подкорковых структур.
Нейростимуляция является современным методом лечения, который представляет собой малоинвазивную нейрохирургическую операцию.
Суть метода: лечебный эффект достигается за счёт стимуляции точно рассчитанным небольшим по амплитуде электрическим током определённых структур головного мозга, ответственных за контроль над движениями тела. Для этого пациенту вводятся в головной мозг тонкие электроды, которые соединяются с нейростимулятором (похож на кардиостимулятор), имплантирующимся подкожно в области груди под ключицей.
Сама операция обычно проводится в два этапа. На первом этапе под местным обезболиванием с помощью магнитно-резонансной томографии и стереотаксической нейронавигации электроды вводятся в глубинные структуры головного мозга, ответственные за контроль над движениями, - в область субталамического ядра. Затем осуществляется тестовая стимуляция, в ходе которой пациент сообщает о соматосенсорных ощущениях, возникающих при различных параметрах стимуляции. При положительном результате проводится второй этап: пациенту имплантируются подкожные части системы - коннекторы и генератор импульсов (нейростимулятор). Обычно второй этап проводится под наркозом. В послеоперационном периоде производится программирование нейростимулятора и обучение пациента. Пациент имеет возможность сам корректировать настройки стимуляции (в пределах, заданных врачом) в зависимости от собственного самочувствия и особенностей выполняемой деятельности.
8. Уход за больными людьми с болезнью Паркинсона
Уход должен осуществляться людьми терпеливыми, в идеале - близкими родственниками пациента. Для этого придется запастись мужеством, преодолеть брезгливость и раздражение. Очень важно понимать, что пациент не в состоянии адекватно оценивать происходящее с ним, характер его бывает несносен.
Для поддержания больного могут понадобиться следующие действия и мероприятия:
1. Психологическая поддержка, терпеливое и мягкое обращение с больным.
2. Поддержание физической активности путем занятия лечебной физкультурой.
3. Обеспечение безопасности больного. С этой целью убирают все острые и твёрдые предметы из комнат, в которых находится пациент, чтобы он не смог травмироваться, если упадёт.
4. Дом, в котором находится пациент с болезнью Паркинсона, должен быть обустроен приспособлениями, облегчающими передвижение - поручнями в ванной и туалете, верёвкой или трапецией для поднятия с постели, стульями с подлокотниками.
5. Использование ортопедических средств - тростей, ходунков или специальных кресел.
6. Полноценное питание. Профилактика запоров: обильное питье и волокнистая пища (сырые фрукты и овощи).
7. Посильная двигательная активность.
8. Сохранение трудовой активности и социальных контактов.
9. Частый отдых, который предупреждает сильную усталость и ощущение бессилия.
10. Больного нельзя торопить и волновать. Тремор и другие симптомы болезни усиливаются, если человек волнуется или спешит выполнить какое-либо движение.
11. Для расслабления мышц больному показаны теплые ванны.
12. Контроль за регулярностью физиологических отправлений: стула и мочеиспусканий.
13. Рекомендуется утренний прием лекарств в постели до подъема больного.
14. Помощь утром при вставании с постели (скованность, разбитость). Лучше вставать в два этапа: сначала сесть на кровати и отдохнуть, затем - вставать на ноги.
15. Использование особых приспособлений для выполнения простых действий в повседневной жизни (особая расческа, бритва, столовые принадлежности и др.).
16. При ходьбе необходимо напоминать больному о том, чтобы он держался прямо, размахивал руками, поднимал ноги и опускал ноги на пол сначала на пятку, а потом переступал на носок. Пациенту с болезнью Паркинсона приходится делать осознанные усилия, чтобы сделать то, что у других происходит само собой.
17. Необходимо во время еды напоминать больному о продумывании процесса проглатывания. Например, можно сказать: "Постарайтесь держать губы и зубы сомкнутыми". Или: "Не поменять ли Вам сторону, на которой Вы жуете, чтобы одна сторона не слишком уставала?".
18. Предлагать частые приемы пищи небольшими порциями. Пищу необходимо резать на мелкие кусочки. Обычно люди с болезнью Паркинсона худеют потому, что устают прежде, чем заканчивают прием пищи. Кроме того, они могут смущаться из-за того, что насорили на столе или едят медленно, и могут потерять интерес к еде.
19. При сильном треморе рук можно использовать питье через соломинку или утяжеленный стакан, наполненный жидкостью наполовину.
20. Необходимо поддерживать больного эмоционально и быть особенно терпеливым с ним, когда он что-то делает сам.
21. Контроль за регулярным медикаментозным лечением (антипаркинсоническими препаратами).
9. Специализированный уход и лечение
В целях обеспечения максимально эффективного ухода за пациентом создаются пансионаты и санатории для больных паркинсонизмом, в которых больные находятся под круглосуточным наблюдением квалифицированного персонала. Это специально обученные медицинские сёстры, владеющие всеми необходимыми навыками. Более того, в пансионате для больных паркинсонизмом уход выполняется под постоянным контролем невролога.
Дополнительное преимущество нахождения в таких учреждениях - пациент постоянно окружен такими же людьми, как и он. А это даёт ему ощущение причастности к определённому сообществу. При лечении в санатории болезнь Паркинсона протекает легче, санаторный режим благотворно сказывается на физическом самочувствии и эмоциональном состоянии больного.
Современная медицина пока не может излечить болезнь Паркинсона, однако существующие методы консервативного и оперативного лечения позволяют значительно улучшить качество жизни больных и замедлить прогрессирование болезни.
Подобные документы
Болезнь Паркинсона (паркинсонизм) как хроническое нейродегенеративное заболевание, его формы и основные симптомы болезней. Этиология и распространенность данного заболевания, механизм развития. Генетические и биохимические аспекты болезни Паркинсона.
реферат [28,7 K], добавлен 19.03.2011
Понятие, этиология и патогенез болезни Паркинсона как прогрессирующего дегенеративного заболевания, избирательно поражающего дофаминергические нейроны черной субстанции. Принципы и методы организации лечения и ухода за больными, специфическая терапия.
презентация [588,8 K], добавлен 11.04.2016
Определение и распространенность болезни Паркинсона - прогрессирующего нейродегенеративного заболевания. Причины возникновения заболевания: старение, наследственность, некоторые токсины. Формы болезни: смешанная, акинетико-ригидная и дрожательная.
реферат [40,7 K], добавлен 06.04.2014
Структура и функциональная роль шаперонов в фолдинге белков. Характеристика заболеваний, связанных с нарушением фолдинга белков: болезнь Альцхаймера, Прионовые болезни, болезнь Паркинсона. Лекарственная терапия и подходы к лечению болезни Паркинсона.
курсовая работа [1,3 M], добавлен 11.05.2015
Причины развития и ведущие симптомы идиопатического синдрома паркинсонизма. Признаки наличия у человека болезни Паркинсона: мышечная ригидность, гипокинезия, тремор. Назначение физиотерапевтического, лекарственного и хирургического лечения заболевания.
презентация [705,5 K], добавлен 13.10.2014
Клинические проявления болезни Паркинсона. Стадии паркинсонизма по Хён и Яру. Риск развития заболевания. Основные препараты, устраняющие двигательные нарушения. Лечение с применением стволовых клеток, нейростимуляция. Сестринский уход за больным.
презентация [1,1 M], добавлен 27.03.2015
Акинетико-ригидный синдром в классической форме, дрожательный паралич. Патологический процесс при болезни Паркинсона является дегенеративным. Утрата меланин содержащих нейронов черного вещества. Поражение двустороннее. Этиология болезни наследственная.

БОЛЕЗНЬ ПАРКИНСОНА: ЭТИОЛОГИЯ, КЛИНИКА, СОВРЕМЕННЫЕ МЕТОДЫ ДИАГНОСТИКИ И ТЕРАПИИ
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке "Файлы работы" в формате PDF
Коркмазова Ф. А., Шевченко П.П.
Ставропольский государственный медицинский университет
Кафедра неврологии, нейрохирургии и медицинской генетики
Цель: проанализировать по литературным данным современные аспекты этиопатогенеза, клиники, диагностики и терапии болезни Паркинсона.
Диагноз болезни Паркинсона ставится на основе характерной клинической симптоматики заболевания, т. е. является клиническим [5, 11]. В частности, достаточно широко используют клинико-диагностические критерии Банка головного мозга общества БП Великобритании. В настоящее время придается огромное значение доклинической диагностике БП. Именно для доклинической стадии заболевания нейропротективные мероприятия наиболее эффективны, поэтому формирование целевой группы риска развития БП с помощью достоверных биомаркеров БП - первоочередная задача. На сегодняшний день потенциальными инструментальными методами, способными предоставлять биомаркеры БП, являются различные нейровизуализационные подходы, молекулярно-генетический анализ, исследование обоняния, когнитивных, вегетативных функций и т.д. Специфичный и стабильный биомаркер БП - гиперэхогенность черной субстанции, а наиболее доступный, высокоинформативный и неинвазивный метод доклинической диагностики БП - транскраниальная сонография. Данный метод открывает новые возможности для формирования группы риска БП и проведения ранних нейропротективных мероприятий [4,5,10]. С помощью позитронно-эмиссионной томографии (ПЭТ) проводился анализ скорости прогрессирования дегенеративного процесса, и, в частности, было показано, что при БП в среднем накопление снижается в хвостатом ядре на 3 %, а в скорлупе на 9 %, что позволило рассчитать продолжительность доклинической стадии при БП -6 ± 3 года. У части пациентов с клиническим диагнозом БП возможно обнаружение генетических мутаций [3, 4, 5]: на биохимическом уровне имеется дефект активности митохондриального комплекса I, оценка активности которого в тромбоцитах может применяться в качестве биохимического маркёра БП. Также предложено определять уровень тирозин-гидроксилазы, дофамина и рецепторов дофамина в лимфоцитах периферической крови, уровень которых в данных клетках крови, по данным ряда авторов, снижается уже при начальных проявлениях БП. Рядом авторов предлагается оценивать степень поражения чёрной субстанции по уровню железа с помощью транскраниальной ультрасонографии. При этом следует отметить, что обнаруженные нейробиохимические изменения непосредственно в дофаминергических нейронах чёрной субстанции, такие как дефицит глутатиона, накопление железа, дефицит цинка, не являются специфичными только для БП, а также распространены не у всех пациентов с БП. Определённую информацию можно получить, оценивая плотность дофаминовых рецепторов [13]. В частности, показано, что на начальных стадиях плотность постсинаптических Dl-рецепторов не меняется, но отмечается увеличение плотности D2-рецепторов, что отражает механизмы компенсации в условиях дефицита дофамина. На поздних стадиях в большей степени уменьшается плотность D1-рецепторов при относительной сохранности D2-рецепторов, плотность которых остаётся дольше неизменной.
Когда лекарственная терапия становится малоэффективной, должна быть рассмотрена возможность хирургического лечения. Хирургические методы лечения можно разделить на два типа: деструктивные операции и стимуляцию глубинных мозговых структур [1, 10, 11]. К деструктивным операциям применяемым при болезни Паркинсона относятся таломо- и паллидотомия. Глубокая стимуляция субталамических ядер широко используется для лечения осложненного течения болезни Паркинсона. Результатом нейрохирургического лечения являются уменьшение двигательных симптомов болезни Паркинсона (брадикинезия, тремор и др.), возможность существенного снижения дозировок допаминергических препаратов, уменьшение выраженности леводопа-индуцированной дискинезии и сокращение off-периодов.
Литература:
Артемьев, Д.В. Болезнь Паркинсона – возможности лечения / Д.В. Артемьев, М.Р. Нодель, И.Т. Хатиашвили // Неврол. журн. – 2000. – № 2. – С. 53–59.
Байрамукова А. М., Ажахметова А.К., Карпов С.М./ Эпидемиология болезни Паркинсона в различных странах мира/ Успехи современного естествознания. 2013г. N9. C. 20-21
Бурнусус Н.И., Карпов С.М./ Биохимические маркеры в диагностике ранних форм болезни Паркинсона/ Международный научно-исследовательский журнал/ 2013г. N 10-5 (17)/ c. 13-14
Голубев, В.Л. Болезнь Паркинсона и синдром паркинсонизма / В.Л. Голубев, Я.И. Левин, А.М. Вейн. –М.: МЕДпресс-информ, 2000. – 416 с.
Диагностика и медикаментозное лечение болезни Паркинсона (зарубежный опыт) / подгот.С. Костюченко // НЕЙРОNEWS. – 2011. – № 7 (34). –С. 54–61
Что такое болезнь Паркинсона? Причины возникновения, диагностику и методы лечения разберем в статье доктора Полякова Т. А., невролога со стажем в 13 лет.
Над статьей доктора Полякова Т. А. работали литературный редактор Елена Бережная , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Болезнь Паркинсона — это одно из самых распространенных нейродегенеративных заболеваний, поражающее преимущественно дофамин-продуцирующие (дофаминергические) нейроны в определенной области мозга, называемой чёрной субстанцией с накоплением в клетках белка альфа-синуклеина и особых внутриклеточных включений (телец Леви). Это заболевание — самая частая причина синдрома паркинсонизма (80% всех случаев). Распространенность болезни Паркинсона составляет около 140 (120-180) случаев на 100 000 населения. [1] Заболевание чаще всего проявляет себя после 50 лет, однако нередки случаи дебюта болезни и в более раннем возрасте (с 16 лет). Мужчины страдают немного чаще женщин.
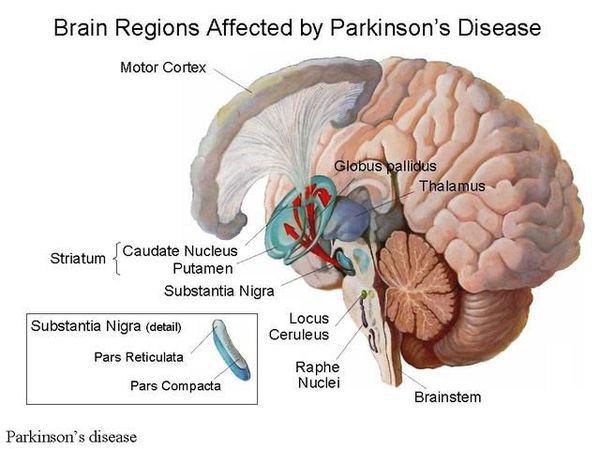
Причина остается в значительной степени неизвестной. Предполагается, что на возникновение заболевания влияют генетические факторы, внешняя среда (возможное воздействие различных токсинов), процессы старения. Генетические факторы имеют доминирующее значение при раннем развитии болезни Паркинсона. Молодые пациенты с этим заболеванием и с семейной историей болезни с большей вероятностью переносят гены, связанные с болезнью Паркинсона, такие, как SNCA, PARK2, PINK1 и LRRK2. В одном из последних исследований показано, что 65% людей с ранним началом болезни Паркинсона в возрасте до 20 лет и 32% людей с началом от 20 до 30 лет имели генетическую мутацию, которая, как полагают, увеличивает риск развития болезни Паркинсона. [2]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы болезни Паркинсона
- нарушение обоняния;
- расстройства сна;
- когнитивные симптомы (снижение памяти, легкомысленность);
- запор;
- расстройства мочеиспускания;
- повышенное потоотделение;
- сексуальную дисфункцию;
- усталость;
- боль (особенно в конечностях);
- покалывание;
- беспокойство и депрессию. [3]
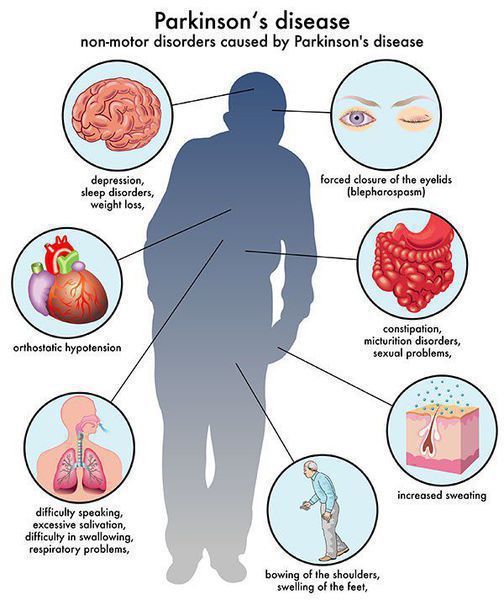
В начале заболевания нередко ставится неверный диагноз — плечелопаточный периартрит, проявляющийся болью и напряжением в мышцах руки и спины.
Синдром паркинсонизма является основным клиническим проявлением болезни Паркинсона, его симптомы: [1]
- замедленность всех движений;
- истощаемость быстрых повторяющихся движений в руках и ногах;
- скованность мышц (мышечная ригидность);
- дрожание рук и ног (но почти никогда — головы), наиболее выражено в покое;
- неустойчивость при ходьбе;
- укорочение длины шага и шарканье при ходьбе, топтание на месте, застывания при ходьбе, отсутствие cодружественных движений руками при ходьбе.
Вначале симптомы возникают только с одной стороны тела, но постепенно приобретают двусторонний характер. Симптомы остаются выраженными на той стороне, где возникли в начале заболевания. Симптомы на другой стороне тела часто не становятся такими же тяжелыми, как симптомы на начальной стороне. Движения становятся все более замедленными (основной симптом паркинсонизма). Симптомы заболевания колеблются в течения дня и зависят от многих факторов.
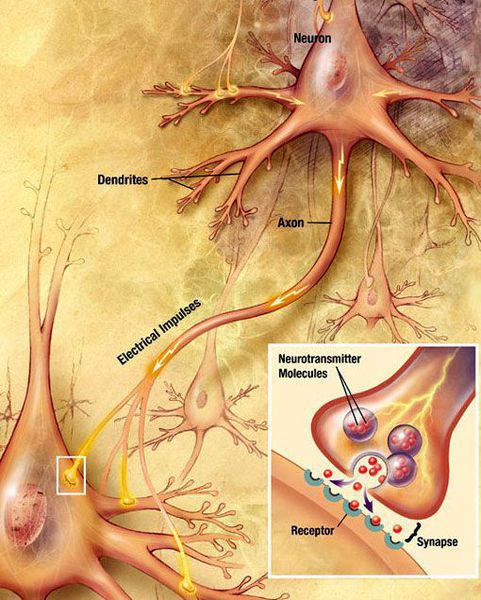
Патогенез болезни Паркинсона
Болезнь Паркинсона относится к группе синуклеинопатий, так как избыточное накопление в нейронах альфа-синуклеина приводит к их гибели. Повышенный уровень альфа-синуклеина может быть следствием нарушения внутриклеточной системы клиренса белков, осуществляемого лизосомамии и протеосомами. У пациентов обнаружено нарушение функционирования указанной системы, среди причин которого указывают старение, окислительный стресс, действие воспаления, токсины окружающей среды. Клетки гибнут предположительно из-за активации генетически запрограмированного механизма (апоптоза). [4]
Классификация и стадии развития болезни Паркинсона
Болезнь Паркинсона классифицируется по форме, стадии и темпу прогрессирования заболевания.
В зависимости от преобладания в клинической картине того или иного симптома выделяют следующие формы: [1]
1. Смешанная (акинетико-ригидная-дрожательная) форма характеризуется наличием всех трёх основных симптомов в разном соотношении.
2. Акинетико-ригидная форма характеризуется выраженными признаками гипокинезии и ригидности, к которым обычно рано присоединяются нарушения ходьбы и постуральная неустойчивость, при этом тремор покоя отсутствует или выражен минимально.
3. Дрожательная форма характеризуется доминированием в клинической картине тремора покоя, признаки гипокинезии уходят на второй план.

Для характеристики стадий Болезни Паркинсона используется шкала Хен–Яра, 1967:
- на 1-й стадии акинезия, ригидность и тремор выявляются в конечностях с одной стороны (гемипаркинсонизм);
- на 2-й стадии симптоматика становится двусторонней;
- на 3-й стадии присоединяется постуральная неустойчивость, но сохраняется способность к самостоятельному передвижению;
- на 4-й стадии симптомы паркинсонизма резко ограничивают двигательную активность;
- на 5-й стадии в результате дальнейшего прогрессирования заболевания больной оказывается прикованным к постели.
Выделяют три варианта темпа прогрессирования заболевания:
- При быстром смена стадий заболевания от первой к третьей занимает 2 года или менее.
- При умеренном — от 2 до 5 лет.
- При медленном — более 5 лет.
Осложнения болезни Паркинсона
Болезнь Паркинсона — не смертельное заболевание. Человек умирает с ним, а не от него. Однако поскольку симптомы ухудшаются, они могут вызвать инциденты, которые приводят к смерти. Например, в сложных случаях затруднение глотания может привести к тому, что пациенты начнут аспирировать пищу в легкие, что приведет к пневмонии или другим легочным осложнениям. Потеря равновесия может привести к падению, которое, в свою очередь, может привести к серьезным травмам или смерти. Серьезность этих инцидентов во многом зависит от возраста пациента, общего состояния здоровья и стадии заболевания.
На более поздних стадиях заболевания проявляются более выраженные симптомы болезни Паркинсона: дискинезия (непроизвольные движения или подергивание частей тела, которые могут возникнуть в результате длительного использования леводопы, застывания (внезапное отсутствие возможности двигаться) или семенящая походка (короткие, почти бегущие шаги, которые как будто ускоряются сами по себе).
Следует помнить, что болезнь Паркинсона очень индивидуальна по своему течению и у каждого протекает по своему сценарию.
Диагностика болезни Паркинсона
Паркинсонизм относится к числу тех расстройств, которые можно диагностировать на расстоянии, особенно при развёрнутой картине заболевания. Однако диагностировать болезнь Паркинсона на ранней стадии сложно. Ранняя и точная диагностика заболевания очень важна для разработки лучших стратегий лечения и поддержания высокого качества жизни как можно дольше. В практике возможна недооценка или переоценка болезни Паркинсона. Невролог, специализирующийся на расстройствах движения сможет поставить наиболее точный диагноз. Первоначальная оценка проводится на основе анамнеза, неврологического обследования с использованием специальных тестов для оценки симптомов заболевания. Неврологическое обследование включает в себя оценку координации, ходьбы и мелких моторных задач, оценку нейропсихологического статуса.
Практика получения второго мнения в значительной степени зависит от личного выбора пациента. Но имейте в виду, что болезнь Паркинсона часто трудно диагностировать точно, особенно когда симптомы незначительно выражены. Простейшего диагностического теста нет, и примерно 25% диагнозов болезни Паркинсона неверны. Болезнь Паркинсона начинается с мало видимых симптомов, поэтому многие врачи, которые не обучены в сфере двигательных расстройств, не могут поставить точный диагноз. На самом деле даже лучшие неврологи могут ошибаться. Если врач не имеет особого опыта в этой области, то необходимо консультироваться со специалистом по расстройствам движения. Хороший невролог поймет ваше желание подтвердить диагноз. Второе мнение может помочь принять своевременно правильные решения относительно диагноза и терапии.
Лечение болезни Паркинсона
Несмотря на то, что излечения болезни Паркинсона не существует, есть множество методов, которые могут позволить вести полноценную и продуктивную жизнь на многие годы вперед. Многие симптомы могут облегчаться лекарствами, хотя со временем они могут утратить свою эффективность и вызвать нежелательные побочные эффекты (например, непроизвольные движения, известные как дискинезия).
Существует несколько методов лечения, замедляющих появление моторных симптомов и улучшающих двигательные функции. Все эти методы лечения предназначены для увеличения количества дофамина в головном мозге либо путем его замещения, либо продления эффекта дофамина путем ингибирования его распада. Исследования показали, что терапия на ранней стадии может задержать развитие двигательных симптомов, тем самым улучшая качество жизни. [5]
На характер и эффективность лечения влияет ряд факторов:
- выраженность функционального дефицита;
- возраст больного;
- когнитивные и другие немоторные нарушения;
- индивидуальная чувствительность к препаратам;
- фармакоэкономические соображения.
Задача терапии при болезни Паркинсона — восстановить нарушенные двигательные функции и поддержать оптимальную мобильность в течение максимально длительного периода времени, сведя к минимуму риск побочных действий препаратов. [1]
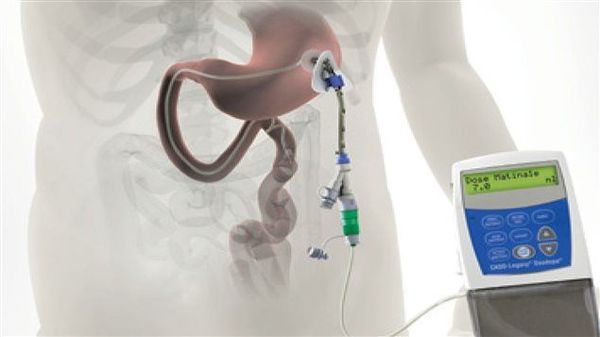
Исследуется альтернативный подход, использование допаминовых продуцирующих клеток, полученных из стволовых клеток. Хотя терапия стволовыми клетками имеет большой потенциал, требуется больше исследований, прежде чем такие клетки могут стать инструментом в лечении болезни Паркинсона. [8] [9]
При болезни Паркинсона очень полезна физическая нагрузка. Если дважды в неделю по 1–2 часа выполнять упражнения, то можно замедлить развитие заболевания: походка, осанка и когнитивные способности будут ухудшаться гораздо медленнее [12] .
Прогноз. Профилактика
Болезнь Паркинсона уникальна для каждого человека, никто не может предсказать, какие симптомы появятся и когда именно. Существуют общее сходство картины прогрессирования болезни, но нет никакой гарантии, что то, что наблюдается у одного, будет у всех с аналогичным диагнозом. Некоторые люди оказываются в инвалидных колясках; другие все еще участвуют в марафонах. Некоторые не могут застегнуть ожерелье, в то время как другие делают ожерелья вручную.
Пациент может сделать всё, чтобы активно повлиять на течение болезни Паркинсона и, по крайней мере, на одну очень вескую причину: ухудшение симптомов часто значительно медленнее у тех, кто проявляет позитивную и активную позицию по отношению к своему состоянию, чем те, кто этого не делает. В первую очередь рекомендуется найти врача, которому доверит пациент, и который будет сотрудничать по развивающемуся плану лечения. Снижение стресса обязательно — стресс ухудшает каждый симптом болезни Паркинсона. Рекомендуются занятия образовательного направления: рисование, пение, чтение стихов, рукоделие, изучение языков, путешествия, работа в коллективе, занятия общественной деятельностью.
К сожалению, даже если адекватно подобрать медикаментозную терапию, это не гарантирует того, что клетки перестанут гибнуть при болезни Паркинсона. Терапия должна быть направлена на создание благоприятных условий для двигательной активности с учётом индивидуальных особенностей клинической картины заболевания. Как показывают результаты многочисленных исследований, профессиональная двигательная реабилитация является необходимым условием для замедления прогрессирования заболевания и улучшения его прогноза. На сегодняшний день по данным клинических исследований показана эффективность реабилитационной программы по протоколам LSVT LOUD, LSVT BIG, теоретическая основа которых сводится к развитию нейропластичности вещества мозга. Она направлена на коррекцию дрожания, ходьбы, постуры, равновесия, мышечного тонуса и речи. [10]
Реабилитационные методики должны быть направленные не только на поддержание сохранившихся двигательных способностей, но и выработку новых навыков, которые бы помогали человеку с болезнью Паркинсона преодолевать ограниченность его физических возможностей, чему способствует программа танцевально-двигательной терапии при болезни Паркинсона, работающая более чем в 100 сообществах по всему миру, включая Россию. Танцевальная терапия позволяет частично решить конкретные проблемы болезни Паркинсона: потеря равновесия, ухудшение координации, шаркающая походка, тремор, застывания, социальная изоляция, депрессия и повышенный уровень тревожности.
Согласно американскому исследованию с участием 52 больных болезнью Паркинсона, регулярная практика аргентинского танца уменьшает симптомы болезни, улучшает баланс и улучшает выполнение сложных движений при болезни Паркинсона. [11]
Читайте также:

