Реферат метод валентных связей
Обновлено: 02.07.2024
Для глубокого понимания сущности ковалентной связи, характера распределения электронной плотности в молекуле, принципов построения молекул простых и сложных веществ необходим метод валентных связей (ВС, МВС).
Метод валентных связей описывает механизм возникновения ковалентной связи и базируется на следующих основных принципах:
1. Химическая связь между двумя атомами осуществляется за счет одной или нескольких общих электронных пар.
Такая химическая связь является двухцентровой.
2. При образовании общей электронной пары электронные облака перекрываются; область повышенной электронной плотности между ядрами способствует их притяжению. Чем сильнее перекрывание электронных облаков (соотношение R1 и R2), тем прочнее химическая связь (рис. 11).
3. При образовании общей электронной пары спины взаимодействующих электронов должны быть антипараллельны (т.к. электроны с параллельными спинами отталкиваются, и связь не образуется).

Рис. 11. Перекрывание электронных облаков

4. В образовании общих электронных пар по вышеописанному механизму могут участвовать только неспаренные электроны атомов (иначе говоря – только одноэлектронные облака). Например, изобразим образование молекулы F2 с помощью квантовых ячеек внешнего энергетического уровня (электронная формула атома F: 1s 2 2s 2 2p 5 ):

Спаренные электроны внешнего уровня атома для образования химических связей с другими атомами должны разъединяться (распариваться). Атом перейдет в новое валентное состояние. Затрата энергии на такой процесс возбуждения атома компенсируется энергией, выделяющейся при образовании химической связи (следует помнить, что возможности возбуждения атомов ограничены числом свободных орбиталей в соответствующих энергетических подуровнях).
5. Ковалентная связь обладает свойством насыщаемости, вследствие чего молекулы имеют вполне определенный состав.
Например, при образовании молекулы метана СН4 каждый из четырех неспаренных электронов возбужденного атома углерода соединился с электроном атома водорода, образовались 4 ковалентные связи; больше электронных пар в данном случае образоваться не может, молекулы СН5, СН6 и т. д. не существуют.
(Примечание: взаимодействие валентнонасыщенных соединений между собой возможно с образованием одной или нескольких дополнительных донорно-акцепторных связей по особому механизму).
6. Ковалентная связь направлена в пространстве, что обусловливает пространственную структуру молекул (свойство направленности).
В зависимости от того, какими электронами осуществляются связи – s-, р-, d- или f- электронами, существенно различны энергии связей, длины связей, а также их направление в пространстве.
Электронные облака имеют различную форму, поэтому их взаимное перекрывание осуществляется несколькими способами: различают – (сигма), – (пи) и (дельта)-связи.

Если перекрывание электронных облаков происходит вдоль линии, соединяющей ядра – это -связь; если облака перекрываются вне этой линии, возникают – и -связи. Разновидности связи при комбинировании s-, р- и d-орбиталей показаны на рисунках:

Если между атомами возникла одна общая электронная пара (обычно -связь), такая связь называется одинарной, если две и более, то кратной: двойной, тройной.
Например, образование молекулы азота N2 осуществляется тремя общими электронными парами. У каждого атома азота в образовании связей участвует 3 неспаренных р-электрона, направленных в трехмерном пространстве под углом 90 0 друг к другу и ориентированных соответственно по осям х, у, z (таковы свойства р-подуровня и р-орбиталей, диктуемые магнитным квантовым числом).

Два атома азота, соединяясь в молекулу N2, могут образовать одну -связь (перекрываются облака, ориентированные вдоль оси х) и две -связи (перекрываются облака, ориентированные вдоль осей у и z).

Угловая конфигурация молекулы воды Н2O, определяющая ее высокую полярность и особенности свойств, связана с направлением в пространстве двух химических -связей, в образовании которых участвовали два неспаренных р-электрона атома кислорода и по одному s-электрону атомов водорода.

Исходный угол в 90° между двумя р-орбиталями атома О увеличивается за счет взаимного отталкивания атомов Н, несущих избыток положительного заряда (вследствие смещения электронной плотности от Н к О).
Итак, структура молекул зависит прежде всего от вида и свойств тех орбиталей, которые атомы предоставляют для образования химических связей. Но, помимо этого фактора, на пространственное строение молекул влияет явление гибридизации орбиталей.
Гибридизацией называется образование новых равноценных по форме и энергии орбиталей из орбиталей разного типа. Смешанные, гибридные орбитали на схемах изображают условно:

Из одной s-орбитали и одной р-орбитали образуются две гибридные, смешанные орбитали sp-типа, направленные по отношению друг к другу на 180°

Из одной s-орбитали и двух р-орбиталей образуются три sp 2 -гибридные орбитали, расположенные в одной плоскости под углом 120° друг к другу:

sp 3 -гибридизация имеет место, если объединяются одна s-орбиталь и три р-орбитали; образуются четыре sp 3 -гибридные орбитали, ориентированные уже не в одной плоскости, а в объеме тетраэдра и направленные от центра тетраэдра к его 4 вершинам; валентный угол между двумя химическими связями составляет 109° 28

Возможны более сложные случаи гибридизации с участием d-электронов, (например, sp 3 d 2 – гибридизация).
Явление гибридизации, т.е. смешения, выравнивания электронной плотности, энергетически выгодно для атома, поскольку у гибридных орбиталей происходит более глубокое перекрывание и образуются более прочные химические связи. Небольшие затраты энергии на возбуждение атома и гибридизацию орбиталей с избытком компенсируются энергией, выделяющейся при возникновении химических связей. Валентные углы диктуются соображениями максимальной симметрии и устойчивости.
Примером sp 3 -типа гибридизации служит строение молекулы метана СН4. Атом углерода в возбужденном состоянии имеет четыре неспаренных электрона: один s- и три р-электрона. Казалось бы, четыре химические связи, образованные ими с s-электронами четырех атомов водорода, должны быть неравноценными. Однако экспериментально установлено, что все 4 связи в молекуле СН4 совершенно идентичны по длине и энергии, а углы между связями составляют 109°28. Следовательно, в молекуле СН4 имеет место sp 3 -гибридизация.

Другие примеры гибридизации: BeH2(sp-), BF3 (sp- 2 ), РСl5(sp 3 d-) и др.
На гибридных орбиталях, как и на обычных орбиталях, может располагаться не только по одному электрону, но и по два. Например, четыре sp 3 -гибридные орбитали атома кислорода О таковы, что две из них содержат по паре электронов, а две – одному неспаренному электрону. С современных позиций строение молекулы воды рассматривается с учетом гибридизации орбиталей атома О и тетраэдрической структуры молекулы Н2O в целом.
Характерной особенностью соединений, в которых имеет место донорно-акцепторная связь, является наличие группировок, между которыми происходит передача электронной пары с орбиталей донора (как правило, лиганда) на вакантную орбиталь акцептора (как правило, центрального атома) с образованием общей орбитали или системы орбиталей. Разновидностью донорно-акцепторной является семиполярная связь… Читать ещё >
Метод валентных схем (валентных связей) ( реферат , курсовая , диплом , контрольная )
Метод валентных схем или связей (МВС) — квантово-химический метод расчета электронных волновых функций молекул 1 .
Мак-Вини Р., Сатклиф Б. Квантовая механика молекул. М.: Мир, 1972.
Важным достижением МВС был расчет молекулы водорода В. Гайтлером и Ф. Лондоном (1927). Ими найдено, что качественно правильный вид зависимости энергии от межатомного расстояния получается с так называемой ковалентной волновой функцией, выражаемой через атомные орбитали 15-типа Ха и Хм разных атомов в молекуле Н2, ядра которых обозначены индексами а и Ь

Здесь цифрами 1 и 2 обозначены переменные, имеющие место для а (К) и р (К) электронов (К = 1, 2) — спиновых функций при разных значениях спина К-го электрона.
В (4.1) принимается, что один из электронов находится возле ядра а, а другой — возле ядра Ь. Если заменить выражение в квадратных скобках на [х"0)Х"( 2 ) + Х/>( 2 )Х/Х 1)]" то получается так называемая ионная волновая функция, для которой наиболее вероятно нахождение обоих электронов возле одного и того же ядра. Выражение в фигурных скобках в формуле (4.1) называется спиновой функцией, отвечающей спариванию электронов.
Возможность описания ковалентной связи одной ковалентной функцией в случае водорода способствовала развитию теории спин-валентности, согласно которой ковалентная связь обусловлена спариванием электронов. Классической структурной формуле молекулы соответствует при этом волновая функция, представляемая произведением функций вида (4.1), отвечающих отдельным валентным штрихам. Если молекуле отвечает несколько эквивалентных структур, более точную оценку энергии получают вариационным методом, когда волновую функцию молекулы Ч* представляют в виде линейной комбинации функций отдельных структур, а изменению энергии сопоставляют резонанс структур.
В молекулах, включающих атомы с различной электроотрицательностью, значительный вклад вносят резонансные структуры ионного типа. Так, строение С02 описывается резонансом трех структур

Межъядерное расстояние С—О в этой молекуле значительно меньше, чем в других молекулах со связями С=0.
Резонанс структур ведет к стабилизации основного состояния молекулы или иона. Мерой стабилизации служит энергия резонанса, которая тем больше, чем больше число резонансных структур и больше низкоэнергетичных эквивалентных структур участвует в резонансе. Энергию резонанса можно оценить как разность энергий основного состояния молекулы и ее изолированных связей или основного состояния и структуры сравнения, моделирующей наиболее устойчивую резонансную форму.
В теории резонанса используется понятие о гибридизации связей (Полинг Л. [2] , 1931).

К примеру, в метане (5р 3 -гибридизация, рис. 4.1) атом углерода образует четыре связи, находясь в возбужденном состоянии с электронной конфигурацией s [3] 2s2p 3 . Состояние четырех валентных электронов 2s2p 3 описывают различные одноэлектронные функции i|/2s, чi2px, v)f2pz, i|12ру после гибридизации — функции, представляющие собой эквивалентные линейные комбинации упомянутых функций:
Максимумы у, направлены в сторону образования связи (к вершинам тетраэдрической молекулы). Считается, что в результате гибридизации образуется более прочная связь, а энергия системы понижается.
Заметим, что представления о возбуждении электронных состояний здесь не являются случайными. Первая ступень расчетной процедуры в МВС — промотирование электронов на возбужденные уровни. Именно еитуация на этой стадии расчета в свое время явилась одним из серьезных аргументов для отказа от применения МВС в пользу использования метода молекулярных орбиталей для описания химической связи во фторидах ксенона. Промотирование валентных электронов с орбиталей ксенона в этом случае требует крайне высоких энергий, которые не окупаются при образовании химической связи (Дяткина М. Е., 1969).

Рис. 4.1. Контурная диаграмма гибридной $/* 3 -орбитали В табл. 4.1 представлены некоторые виды гибридизации, включая тот случай, когда комплексообразователь использует свои d-орбитали.
В общем случае ЧДМХ*) (Чаркин О. П., 1973) записывается в виде комбинации функций, отвечающих ковалентным и ионным структурам. Однако определение их весовых коэффициентов возможно только из неэмпирических расчетов по М ВС, что представляет сложную задачу и выполнено лишь для небольшого числа простейших молекул. Даже если ограничиться ковалентными структурами, Ч / К ()11(МХ| 7 принадлежала полносимметричному представлению точечной группы симметрии. Поэтому на каждый способ спаривания обычно накладывают ограничения, с помощью которых удается выделить часть детерминантов, дающих наибольший вклад в ^ков(МХА).
Здесь различают несколько случаев. Один из них — это т.н. валентное состояние полного спаривания, когда спин электрона на гибридной а,-АО атома М спаривается только со спином электрона на /,-АО i-го лиганда X, в сторону которого и направлена а,. Тогда для энергии атомизации (DatMXk) имеем:

где ?ВС(М) и ?ВС(Х,) — энергии возбуждения валентного состояиия х атомов М и X; ?пс — энергии полного спаривания, а в фигурных скобках приведена полная энергия межатомных взаимодействий, т. е. энергия, которая выделилась бы при образовании молекулы из атомов, предварительно возбужденных каким-либо способом в ВС.
В базисе комплексных АО энергия ?иПС выражается в виде линейной комбинации энергий термов спектроскопических состояний Ф: ?Ы1С = Yj a l, s [10] [4] ? (L [4] , Lz, S [4] , Sz), а последние могут быть.
В. С. Урусов даст пример, иллюстрирующий механизм формирования валентного состояния для атома углерода с конфигурацией основного состояния 2s 2 2p 2 и тетраэдрической гибридизацией sp 3 . При этом учитываются:
- • промотирование 2s 2 2p 2 =>2s x 2p 3 (с переходом электрона с основного состояния центрального атома — здесь это углерод на возбужденное);
- • гибридизация электронов;
- • разупорядочение спинов валентных электронов, так как в валентном состоянии все спины компенсированы.
Энергия, затрачиваемая на организацию валентного состояния, для атома углерода составляет 162 ккал/г-атом, причем промотирование требует затраты в 96 ккал/г-атом. В результате перехода в валентное состояние потенциалы ионизации принимают значения, отличные от ступенчатых потенциалов ионизации, табулированных во многих справочниках (они базируются преимущественно на обзорах III. Мур, National Bureau of Standard USA, 1950—1960;err.) (17, "https://referat.bookap.info").
Итак, MBC предполагает, что химическая связь является двухэлектронной и направленной, причем это предположение распространяется на комплексные соединения.
Продемонстрируем способ описания связи по МВС на трех примерах.
Ион аммония. Его образование связывают с $/? 3 -гибридизацией. Атом азота имеет 3 неспаренных электрона, дающие a-связи с s-электронами трех атомов водорода. Ион имеет так называемую неподеленную электронную пару (2s 2 ), не использованную для связи с другими атомами или ионами. Неноделенная пара осуществляет связи с четвертым атомом водорода. При этом происходит гибридизация трех 2/?-орбиталей и 2s-op6iiTa.in комплексообразователя (азота), причем гибридные орбитали направлены к вершинам тетраэдра, в центре которого находится азот. Все гибридные орбитали взаимодействуют с ls-орбиталями лигандов, в результате чего образуются 4 одинаковых двухэлектронных а-связи иона аммония.
Как видно, МВС активно использует идею о донорно-акцепторной связи, так как одна из связей образована путем передачи части электронной плотности неподеленной пары на ls-орбиталь лиганда.

Для -переходных металлов по МВС возможно существование двух типов комплексов — ионных и ковалентных или спин-свободных и спин-связанных.

Спин-свободные (внешнеорбитальные или ионные) комплексы. Гексароданокомплекс Мп (Н). Электроны на 3^-уровне не затрагиваются, но зато две электронные пары лигандов занимают более высоколежащий и виртуальный 4б/-уровень:

Здесь очевиден произвол в выполнении процедуры, который устраняется привлечением дополнительных сведений, например, полученных по данным статической магнитной восприимчивости. Подчеркнем, что процедура для объяснения тех же магнитных свойств вполне приемлема, однако сомнительна в предсказательном ключе.
МВС позволяет объяснить магнитные свойства веществ. Наличие спаренных электронов означает диамагнитное состояние. Существование в электронной оболочке комплекса неспаренных электронов может приводить к парамагнитному состоянию вещества, и комплекс имеет ненулевой магнитный момент. Магнитный момент вещества р, выраженный в магнетонах Бора 1 (рв, или М. Б.), можно рассчитать, но формуле: 1 = у]п (п + 2), где п — число неспареиных электронов.
В качестве примера рассмотрим комплексные ионы | Mn (CN)6] 4_ и [Mn (CNS)6] 4_ . Ион Mn (II) имеет пять неспаренных электронов. В случае cPsp 3 - и $р 3 2-гибридизации возможно различное магнитное поведение этих комплексов. В первом случае соединение должно иметь р = 1,79 М. Б. Во втором — 5,92 М. Б. По данным эксперимента имеем:

1 магнетон Бора = 5580 Гс • см 3 /моль.
Можно заключить, что для иона [Mn (CN)6] 4 имеет место г/ 2 5/; 3 -ги6ридизация, а для [Mn (CNS)6] 4_ — 5р 3 бР-гибридизация.
Ряд исследователей, основываясь на МВС, выдвинули тезис о магнитном критерии характера химической связи, т. е. о наличии ковалентных или ионных связей в координационных соединениях. С этой точки зрения комплексные соединения с ионными связями должны иметь такой же магнитный момент, как и свободный ион. Спаривание же электронов свидетельствует о наличии ковалентных комплексов.
Поясним сказанное примером. Ион Fe (III) характеризуется 5 неспаренными электронами. Для комплекса [Fe (CN)6] 3- число неспаренных электронов уменьшается до одного (этому отвечает р = 1,7—1,8 М. Б.). Таким образом, связи в этом ионе являются ковалентными. Для иона [FeF5(OII)2J 2- м = 5,9, что совпадает с ожидаемым для 5 неспаренных электронов. Это должно свидетельствовать, что связи — ионно-дипольные, т. е. осуществляются только за счет электростатического взаимодействия между центральным ионом и лигандами. По этот прием не всегда работает. Так, например, для [Fe (acac)3] 3+ по магнитным данным р=5,9 М. Б., т. е. он должен считаться ионным. Однако он проявляет свойство ковалентного комплекса: растворяется в органических растворителях и не является электролитом.
Нетрудно видеть, что метод валентных связей практически непосредственно базируется на концепции Льюиса. На той же концепции основываются и представления о донорно-акцепторной связи.
Характерной особенностью соединений, в которых имеет место донорно-акцепторная связь, является наличие группировок, между которыми происходит передача электронной пары с орбиталей донора (как правило, лиганда) на вакантную орбиталь акцептора (как правило, центрального атома) с образованием общей орбитали или системы орбиталей. Разновидностью донорно-акцепторной является семиполярная связь, к примеру, в соединениях типа R3P + — СН2, R3N + —О, образованная за счет переноса одного электрона от донора к акцептору с последующим спариванием неподеленных электронов и формированием общей связывающей орбитали а-типа.
В принципе, природа донорно-акцепторной связи не отличается от обычной полярной ковалентной, т. е. локализованной и направленной связи. Различие заключается лишь в описании образования этих связей.
Метод валентных связей (локализованных электронных пар) предполагает, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар.
Поэтому химическая связь представляется двухэлектронной и двухцентровой, т.е. локализована между двумя атомами. В структурных формулах соединений обозначается черточкой:
Рассмотрим в свете Метода ВС, такие особенности связи, как насыщаемость, направленность и поляризуемость.
Образование сигма-, пи- и дельта-связей
Валентность атома — определяется числом неспаренных (валентных) электронов, способных принять участие в образовании химической связи.
Валентность выражается небольшими целыми числами и равна числу ковалентных связей. Валентность элементов, проявляющуюся в ковалентных соединениях, часто называют ковалентностью.
Некоторые атомы имеют переменную валентность, например углерод в основном состоянии имеет 2 неспаренных электрона и будет двух валентен. При возбуждении атома, возможно распарить другие два спаренных электрона и тогда атом углерода станет четырех валентен:

Возбуждение атома до нового валентного состояния требует затраты энергии, которая компенсируется выделяемой при образовании связей энергией.
Взаимное перекрывание облаков, т.е. образование связи может происходить разными способами, ввиду их различной формы. Различают σ-, π- и δ-связи.
Как различить сигма-, пи- и дельта-связи?
Сигма – связи образуются при перекрывании облаков вдоль линии, проходящей через ядра атомов.
Пи – связи возникают при перекрывании облаков по обе стороны от линии, соединяющей ядра атомов.
Дельта – связи осуществляются при перекрывании всех четырех лопастей d – электронных облаков, расположенных в параллельных плоскостях.

σ– связь может возникнуть при перекрывании вдоль линии, соединяющей ядра атомов в следующих орбиталей:
σ– связь обладает свойствами локализованной двухцентровой связи, каковой она и является.
π– связь может образовываться при перекрывании по обе стороны от линии, соединяющей ядра атомов следующих орбиталей:
Итак, s— элементы способны к образованию только σ– связи,
р— элементы — σ– и π– связи,
d— элементы — σ–, π– и δ‑ связи,
f— элементы — σ– , π– , δ-связи.
При совместном образовании π– и σ- связей получается двойная связь.
Если же одновременно возникают две π–и σ- связь, то образуется тройная связь.
Количество возникших связей между атомами, называется кратностью связи.
Между двумя атомами может возникнуть только одна сигма-связь.
Направленность ковалентной связи
- При образовании связи с помощью s — орбиталей, ввиду их сферической формы, не возникает какого-либо преимущественного направления в пространстве, для наиболее выгодного образования ковалентных связей.
- В случае же р – орбиталей, электронная плотность распределена неравномерно, поэтому возникает определенное направление, по которому образование ковалентной связи наиболее вероятно.
Гибридизация атомных орбиталей
Рассмотрим пример. Представим, что четыре атома водорода соединились с атомом углерода и образовалась молекула метана CH4.
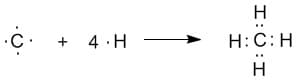
Рисунок показывает что происходит, но не объясняет, как ведут себя s- и р— орбитали, при образовании таких соединений.
Хотя р— орбиталь имеет две части, развернутые друг относительно друга, но она может образовывать только одну связь. В итоге, можно предположить, что в молекуле метана один атом водорода присоединяется к 2s- орбитали углерода, остальные – к 2р— орбитали.
Тогда, каждый атом водорода будет находиться по отношению к другому под углом 90°, но это не так. Электроны отталкиваются друг от друга и расходятся на большее расстояние.
Что же на самом деле происходит?
Происходит гибридизация атомных орбиталей, в результате которой все орбитали объединяются, перестраиваются и образуют 4 эквивалентные гибридные орбитали, которые направлены к вершинам тетраэдра.
Гибридизация — это смешение различных атомных орбиталей (например, s и p) и образование одинаковых по форме и энергии гибридных орбиталей (например, sp, sp 2 , sp 3 ).
Типы гибридизации атомных орбиталей
sp 3 -гибридизация
В нашем примере, каждая из гибридных орбиталей содержит некий вклад 2s- орбитали и некоторые вклады 2р— орбиталей.
Поскольку 4 гибридные орбитали образованы одной 2s— и тремя 2р— орбиталями, то такой способ гибридизации называют sp 3 -гибридизацией.

sp 3 -гибридизация орбиталей в молекуле метана
Как видно из рисунка, конфигурация гибридных орбиталей позволяет четырем атомам вдорода образовать ковалентные связи с атомом углерода, при этом орбитали будут располагаться относительно друг друга под углом 109,5°.
Такой же тип гибридизации присутствует в таких молекулах, как , например, NH3, H2O.
На одной из sp 3 -гибридных орбиталей, в молекуле NH3, находится неподеленная электронная пара, а три остальные орбитали используются для соединения с атомами водорода.
В молекуле H2O неподеленными электронными парами заняты две гибридные орбитали атома кислорода, а две другие используются для связывания с атомами водорода.

Гибридизация орбиталей молекул метана, аммиака, воды
sp 2 -гибридизация
Число гибридных орбиталей определяется числом одинарных связей, а также количеством неподеленных электронных пар в молекуле. Эти электроны находятся на гибридных орбиталях. Когда же происходит перекрывание негибридных орбиталей двух атомов, то образуется кратная связь. Например, в молекуле этилена связь реализуется следующим образом:
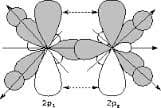
sp 2 -гибридизация атомов этилена
Плоское расположение трех связей вокруг каждого атома углерода дает основание предположить, что в данном случае имеет место sp 2 -гибридизация ( гибридные орбитали образованы одной 2s- и двумя 2р— орбиталями). При этом одна 2р— орбиталь остается неиспользованной (негибридной).
Орбитали будут располагаться относительно друг друга под углом 120°.
sp-гибридизация
Таким же образом, в молекуле ацетилена образуется тройная связь. В данном случае происходит sp-гибридизация атомов, т.е. гибридные орбитали образованы одной 2s- и одной 2р— орбиталями, а другие две 2р— орбитали являются негибридными.
Орбитали располагаются относительно друг друга под углом 180°
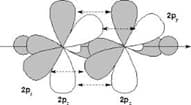
sp-гибридизация атомов ацетилена
Ниже в таблице приведены примеры гибридных орбиталей, их геометрическое расположение .
| Набор атомных орбиталей | Набор гибридных орбиталей | Геометрическое расположение гибридных орбиталей | Примеры |
| s,p | sp | Линейное (угол 180°) | Be(CH3)2, HgCl2 MgBr2, СаН2, ВаF2, C2H2 |
| s,p,p | sp 2 | Плоское тригональное (угол 120°) | BF3,GaCl3, InBr3,TeI3, C2H4 |
| s,p,p,p | sp 3 | Тетраэдрическое (угол 109,5°) | CH4, AsCl4 — , TiCl4, SiCl4, GeF4 |
| s,p,p,d | sp 2 d | Плоскоквадратнoe (угол 90°) | Ni(CO)4, [PdCl4] 2 — |
| s,p,p,p,d | sp 3 d | Тригонально-бипирамдальное (углы 120° и 90°) | PF5, PCl5, AsF5 |
| s,p,p,p,d,d | sp 3 d 2 | Октаэдрическое (угол 90°) | SF6, Fe(CN)6 3- , CoF6 3- |
Гибридные орбитали в пространстве располагаются различным образом:

Пространственное расположение гибридных орбиталей различных типов

В результате были получены уравнения, позволяющие найти зависимость потенциальной энергии Е системы, состоящей из двух атомов водорода, от расстояния r между ядрами этих атомов. При этом оказалось, что результаты расчета зависят от того, одинаковы или противоположны по знаку спины взаимодействующих электронов. При совпадающем направлении спинов сближение атомов приводит к непрерывному возрастанию энергии системы. В последнем случае для сближения атомов требуется затрата энергии, так что такой процесс оказывается энергетически невыгодным и химическая связь между атомами не возникает. При противоположно направленных спинах сближение атомов до некоторого расстояния го сопровождается уменьшением энергии системы. При r = r0 система обладает наименьшей потенциальной энергией, т.е. находится в наиболее устойчивом состоянии; дальнейшее сближение атомов вновь приводит к возрастанию энергии. Но это и означает, что в случае противоположно направленных спинов электронов образуется молекула Н2 - устойчивая система из двух атомов водорода, находящихся на определенном расстоянии друг от друга.

Таким образом, проведенное исследование позволило сделать вывод, что химическая связь в молекуле водорода осуществляется путем образования пары электронов с противоположно направленными спинами, принадлежащей обоим атомам. Разработанная на этой основе теория химической связи и для более сложных молекул получила название метода валентных связей. Важным положением является то, что всякий раз, когда химическая связь образуется, спины пары электронов должны быть антипараллельными. Это находится в соответствии с принципом Паули и подчеркивает, что при образовании химической связи электроны переходят в новое квантовое состояние.
Метод валентных связей дал теоретическое объяснение важнейших свойств ковалентной связи, позволил понять строение большого числа молекул. Хотя этот метод не оказался универсальным и в ряде случаев не в состоянии правильно описать структуру и свойства молекул, все же он сыграл большую роль в разработке квантово-механической теории химической связи и не потерял своего значения до настоящего времени в качественном понимании природы химической связи.
Основные положения метода валентных связей
Метод валентных связей описывает механизм возникновения ковалентной связи и базируется на следующих основных принципах:
- Химическая связь между двумя атомами осуществляется за счет одной или нескольких общих электронных пар.
Такая химическая связь является двухцентровой.
-
При образовании общей электронной пары электронные облака перекрываются; область повышенной электронной плотности между ядрами способствует их притяжению. Чем сильнее перекрывание электронных облаков (соотношение R1 и R2), тем прочнее химическая связь.

Например, изобразим образование молекулы F2 с помощью квантовых ячеек внешнего энергетического уровня (электронная формула атома F: 1s 2 2s 2 2p 5 ):

Спаренные электроны внешнего уровня атома для образования химических связей с другими атомами должны разъединяться (распариваться). Атом перейдет в новое валентное состояние. Затрата энергии на такой процесс возбуждения атома компенсируется энергией, выделяющейся при образовании химической связи (следует помнить, что возможности возбуждения атомов ограничены числом свободных орбиталей в соответствующих энергетических подуровнях).
- Ковалентная связь обладает свойством насыщаемости, вследствие чего молекулы имеют вполне определенный состав.
Например, при образовании молекулы метана СН4 каждый из четырех неспаренных электронов возбужденного атома углерода соединился с электроном атома водорода, образовались 4 ковалентные связи; больше электронных пар в данном случае образоваться не может, молекулы СН5, СН6 и т.д. не существуют.
(Примечание: взаимодействие валентнонасыщенных соединений между собой возможно с образованием одной или нескольких дополнительных донорно-акцепторных связей по особому механизму).
- Ковалентная связь направлена в пространстве, что обусловливает пространственную структуру молекул (свойство направленности).
В зависимости от того, какими электронами осуществляются связи - s-, р-, d- или f-электронами, существенно различны энергии связей, длины связей, а также их направление в пространстве.
Электронные облака имеют различную форму, поэтому их взаимное перекрывание осуществляется несколькими способами: различают σ- (сигма), π- (пи) и δ (дельта)-связи.
Если перекрывание электронных облаков происходит вдоль линии, соединяющей ядра - это σ-связь; если облака перекрываются вне этой линии, возникают π- и δ-связи.
Если между атомами возникла одна общая электронная пара (обычно σ-связь), такая связь называется одинарной, если две и более, то кратной: двойной, тройной.


Например, образование молекулы азота N2 осуществляется тремя общими электронными парами. У каждого атома азота в образовании связей участвует 3 неспаренных р-электрона, направленных в трехмерном пространстве под углом 90 0 друг к другу и ориентированных соответственно по осям х, у, z (таковы свойства р-подуровня и р-орбиталей, диктуемые магнитным квантовым числом).
Два атома азота, соединяясь в молекулу N2, могут образовать одну σ-связь (перекрываются облака, ориентированные вдоль оси х) и две π-связи (перекрываются облака, ориентированные вдоль осей у и z).
Гибридизация атомных орбиталей
Cтруктура молекул зависит прежде всего от вида и свойств тех орбиталей, которые атомы предоставляют для образования химических связей. Но, помимо этого фактора, на пространственное строение молекул влияет явление гибридизации орбиталей.

называется образование новых равноценных по форме и энергии орбиталей из орбиталей разного типа. Смешанные, гибридные орбитали на схемах изображают условно:
sp-гибридизация

Из одной s-орбитали и одной р-орбитали образуются две гибридные, смешанные орбитали sp-типа, направленные по отношению друг к другу на 180°.
Например: линейную форму имеют молекулы ВеН2 и SnCl2 с sp-гибридизацией атома бериллия и олова соответсвенно.
sp 2 -гибридизация

Из одной s-орбитали и двух р-орбиталей образуются три sp 2 -гибридные орбитали, расположенные в одной плоскости под углом 120° друг к другу.
Взаимная ориентация трех sp 2 -гибридных орбиталей - тригональная. Концепцию sp 2 -гибридизации применяют для описания плоских молекул тригональной формы.
Например: молекула фторида алюминия A1F3. Возбуждение атома алюминия сопровождается распариванием s 2 -электронов внешнего уровня на p-подуровень. Следовательно, электронная конфигурация внешнего уровня атома алюминия в возбужденном состоянии - 3s 1 3p 2 . Заселенные электронами орбитали атома алюминия гибридизируются и ориентируются в одной плоскости под углом 120° друг к другу. Каждое из трех электронных облаков гибридных sp 2 -орбиталей перекрывается с электронными облаками p-орбиталей трех атомов фтора.
sp 3 -гибридизация

sp 3 -гибридизация имеет место, если объединяются одна s-орбиталь и три р-орбитали; образуются четыре sp 3 -гибридные орбитали, ориентированные уже не в одной плоскости, а в объеме тетраэдра и направленные от центра тетраэдра к его 4 вершинам; валентный угол между двумя химическими связями составляет 109°28'.
Например: строение молекулы метана СН4. Атом углерода в возбужденном состоянии имеет четыре неспаренных электрона: один s- и три р-электрона. Казалось бы, четыре химические связи, образованные ими с s-электронами четырех атомов водорода, должны быть неравноценными. Однако экспериментально установлено, что все 4 связи в молекуле СН4 совершенно идентичны по длине и энергии, а углы между связями составляют 109°28'. Следовательно, в молекуле СН4 имеет место sp 3 -гибридизация.
Возможны более сложные случаи гибридизации с участием d-электронов, (например, sp 3 d 2 - гибридизация).
Явление гибридизации, т.е. смешения, выравнивания электронной плотности, энергетически выгодно для атома, поскольку у гибридных орбиталей происходит более глубокое перекрывание и образуются более прочные химические связи. Небольшие затраты энергии на возбуждение атома и гибридизацию орбиталей с избытком компенсируются энергией, выделяющейся при возникновении химических связей. Валентные углы диктуются соображениями максимальной симметрии и устойчивости.
На гибридных орбиталях, как и на обычных орбиталях, может располагаться не только по одному электрону, но и по два. Например, четыре sp 3 -гибридные орбитали атома кислорода О таковы, что две из них содержат по паре электронов, а две - одному неспаренному электрону. С современных позиций строение молекулы воды рассматривается с учетом гибридизации орбиталей атома О и тетраэдрической структуры молекулы Н2O в целом.
Валентность по обменному механизму метода
Способность атома присоединять или замещать определенное число других атомов с образованием химических связей называется . Согласно обменному механизму метода валентных связей каждый атом отдает на образование общей электронной пары (ковалентной связи) по одному неспаренному электрону. Количественной мерой валентности в обменном механизме метода валентных связей считают число неспаренных электронов у атома в основном или возбужденном состоянии атома. Это неспаренные электроны внешних оболочек у s- и p-элементов, внешних и предвнешних оболочек у d-элементов, внешних, предвнешних и предпредвнешних оболочек у f-элементов.
При образовании химической связи атом может переходить в возбужденное состояние в результате разъединения пары (или пар) электронов и переходе одного электрона (или нескольких электронов, равных числу разъединенных пар) в свободную орбиталь той же оболочки.
Например: электронная конфигурация кальция в основном состоянии записывается как:
В соответствии с обменным механизмом метода валентных связей валентность его равна нулю В=0. У атома кальция в четвертой оболочке (n=4) имеются вакантные р-орбитали. При возбуждении атома происходит распаривание электронов и один из 4s-электронов переходит в свободную 4р-орбиталь. Валентность кальция в возбужденном состоянии равна двум, т.е. при распаривании валентность увеличивается на две единицы:

В отличие от кислорода и фтора, электронные пары которых не могут разъединяться, так как во второй оболочке нет вакантных орбиталей, электронные пары атомов серы и хлора могут распариваться в вакантные орбитали 3d-подоболочки, соответственно сера кроме валентности основного состояния 1 и 2 , имеет еще валентности 4 и 6 в возбужденном состоянии, а хлор кроме валентности 1 в основном состоянии, имеет валентности 3, 5 и 7 в возбужденном состоянии.
| Элемент | Основное состояние | Возбужденное состояние | ||||||||
| Электронная конфигурация | Заполнение орбиталей | Валентность | Электронная конфигурация | Заполнение орбиталей | Валентность | |||||
| s | p | d | s | p | d | |||||
| Водород | 1s 1 |  | 1 | |||||||
| Гелий | 1s 2 |  | 0 | |||||||
| Бериллий | 2s 2 |  |  | 0 | 2s 1 2p 1 |  |  | 2 | ||
| Углерод | 2s 2 2p 2 |  |  | 1,2 | 2s 1 2p 3 |  |  | 1,2,4 | ||
| Кислород | 2s 2 2p 4 |  |  | 1,2 | ||||||
| Фтор | 2s 2 2p 5 |  |  | 1 | ||||||
| Сера | 3s 2 3p 4 |  |  |  | 1,2 | 3s 1 3p 3 3d 2 |  |  |  | 1,2,4,6 |
| Хлор | 3s 2 3p 5 |  |  |  | 1 | 3s 1 3p 3 3d 3 |  |  |  | 1,3,5,7 |
У атомов большинства d- и f-элементов на внешних оболочках в основном состоянии нет неспаренных электронов, поэтому их валентность в основном состоянии равна нулю, несмотря на то, что на предвнешних d- и f-подоболочках имеются неспаренные электроны. Последние не могут образовывать электронные пары с электронами других атомов, так как закрыты электронами внешней оболочки. При возбуждении атома распаренные электроны внешней оболочки вступают в химическую связь и открывают внутренние электронные оболочки.
Например: валентность железа в основном состоянии равна нулю:

В возбужденном состоянии происходит разъединение 4s-пары электронов:

Валентность железа в возбужденном состоянии определяется не только 4s-, 4p-, но и 3d-неспаренными электронами. Однако пара 3d-электронов не может разъединиться, потому что в третьей оболочке нет вакантных орбиталей, поэтому максимальная валентность железа равна шести.
У осмия при возбуждении могут разъединяться не только внешние 6s-электроны, но и предвнешние 5d-электроны, поскольку в пятой оболочке имеется еще 5f-подоболочка со свободными орбиталями, поэтому максимальная валентность осмия равна восьми:
Читайте также:

