Реферат металлы а группы
Обновлено: 30.06.2024
Цезий или галлий можно легко расплавить в ладони, а вольфраму для плавления нужна температура лишь вдвое меньше, чем температура поверхности Солнца; литий, натрий или калий можно резать ножом, а чистый хром не всякий резец возьмет.
Различна и химическая активность металлов - от почти полной химической инертности золота или платины до неукротимой реакционной способности калия или натрия.
Но, несмотря на все свое разнообразие, эти элементы образуют единую семью, потому что все они относительно легко расстаются со своими наружными электронами и превращаются в положительные ионы.
Содержание работы
1. Введение………………………………………………………………………3
2. Общая характеристика, краткие сведения об истории открытия элементов и их распространённости в природе…………………………………. 4
3. Изменение в группе величины радиусов атомов и ионов, потенциала ионизации……………………………………………………………………..6
4. Сравнение химических свойств простых веществ IА группы……. 7
5. Особенности комплексообразования ионов натрия и калия………………9
6. Биологическая роль натрия, калия: содержание в организме, суточная потребность, локализация в органах и тканях, значение для организма……………………………………………………………………..10
7. Антагонизм натрия и калия………………………………………………. 14
8. Соединения лития, натрия, калия как лекарственные средства………. 15
9. Список литературы
Файлы: 1 файл
хим реферат.docx
ГБОУ ВПО ОрГМА МИНЗДРАВСОЦРАЗВИТИЯ РОССИИ
КАФЕДРА ХИМИИ И ФАРМАЦЕВТИЧЕСКОЙ ХИМИИ
Реферат
на тему:
“ Химия и биологическая роль элементов IА группы ”
Выполнила:
Студентка 16 гр.
педиатрического факультета
Акишева С.Б.
Проверила:
Кузьмичёва Н.А.
- Введение………………………………………………………… ……………3
- Общая характеристика, краткие сведения об истории открытия элементов и их распространённости в природе…………………………………. .4
- Изменение в группе величины радиусов атомов и ионов, потенциала ионизации……………………………………………………… ……………..6
- Сравнение химических свойств простых веществ IА группы……. 7
- Особенности комплексообразования ионов натрия и калия………………9
- Биологическая роль натрия, калия: содержание в организме, суточная потребность, локализация в органах и тканях, значение для организма……………………………………………………… ……………..10
- Антагонизм натрия и калия………………………………………………. 14
- Соединения лития, натрия, калия как лекарственные средства………. 15
- Список литературы…………………………………………………… ……..18
В периодической системе металлы преобладают. По многим свойствам металлы очень отличаются друг от друга: литий вдвое легче воды, а осмий тяжелее ее в 22,5 раза.
Цезий или галлий можно легко расплавить в ладони, а вольфраму для плавления нужна температура лишь вдвое меньше, чем температура поверхности Солнца; литий, натрий или калий можно резать ножом, а чистый хром не всякий резец возьмет.
Различна и химическая активность металлов - от почти полной химической инертности золота или платины до неукротимой реакционной способности калия или натрия.
Но, несмотря на все свое разнообразие, эти элементы образуют единую семью, потому что все они относительно легко расстаются со своими наружными электронами и превращаются в положительные ионы.
Элемент легко отдает электроны, если их на внешнем энергетическом уровне мало (поэтому Элементы первых трех групп, не считая бора, - металлы) или если радиус атома так велик, что ядро не в состоянии прочно удерживать наружные электроны (поэтому висмут, атом которого имеет на внешнем энергетическом уровне пять электронов, все-таки относят к металлам).
Проследив, как изменяются свойства у элементов III периода, мы увидим, что с увеличением числа электронов во внешнем энергетическом уровне элементы постепенно переходят от активного металла натрия к активному неметаллу хлору. IV период тоже начинается активным металлом калием.
В конце этого периода перед инертным газом криптоном также стоит активный неметалл бром. Следовательно, и в этом периоде должен происходить такой же переход.
Почему же этот переход такой медленный? Дело в том, что у элементов IV периода от скандия до цинка "достраивается" не внешний энергетический уровень, а предыдущий.
И лишь после цинка (начиная с галлия) число электронов на внешнем энергетическом уровне увеличивается, так что у германия здесь четыре электрона. Он - "пограничный" элемент, за которым следуют неметаллы.
Поскольку у элементов от скандия до никеля на внешнем энергетическом уровне не больше двух электронов, то они металлы. Каждый большой период включает в себя подобный ряд, состоящий только из металлов.
У этих рядов четные номера, а из большинства расположенных в них металлов состоят побочные подгруппы периодической системы.
Цель: изучить элементы IА группы и их роль.
Для достижения поставленной цели необходимо решить следующие задачи:
-дать общую характеристику элементов IА группы;
-указать роль элементов IА группы;
-рассмотреть и изучить свойства элементов IА группы.
Общая характеристика, краткие сведения об истории открытия элементов и их распространённости в природе.
В группу IА входят следующие элементы: литий, калий, натрий, рубидий, цезий, франций, т.е. щелочные металлы.
Элементы первой группы периодической системы характеризуются прежде всего одинаковым строением внешнего электронного слоя атомов, в котором у всех членов группы содержится только один электрон. Но второй снаружи электронный слой у отдельных элементов группы построен различно. Это обстоятельство оказывает большое влияние на свойства соответствующих элементов.
Название "щелочные "металлы" присвоено элементам главной подгруппы первой группы ввиду того, что гидроокиси двух главных представителей этой группы - лития, натрия и калия - издавна были известны под названием "щелочей". Из этих щелочей, подвергая их в расплавленном состоянии электролизу, Дэви в 1807 г. впервые получил свободные калий и натрий. Имея в наружном слое только один электрон, удаленный от ядра на значительное расстояние, атомы щелочных металлов чрезвычайно легко отдают его, превращаясь в положительные однозарядные ионы с устойчивой оболочкой соответствующего инертного газа.
Поэтому щелочные металлы являются наиболее типичными представителями металлов. Все металлические свойства выражены у них особенно резко.
Щелочные металлы совершенно не способны присоединять электроны.
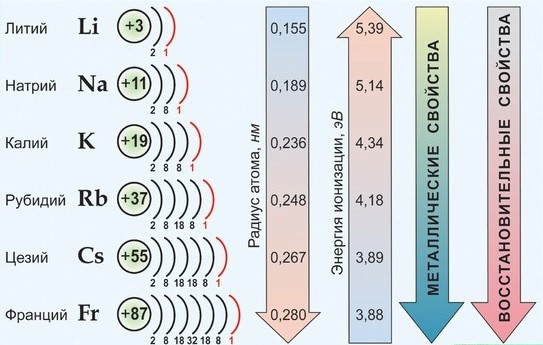
Одинаковое строение не только наружного, но и предпоследнего электронного слоя обусловливает большое сходство щелочных металлов друг с другом. Но в то же время увеличение заряда ядра и общего числа электронов в атоме при переходе от лития к цезию создает некоторые качественные различия между отдельными членами группы. Как и в других группах, эти различия проявляются главным образом в более легкой отдаче валентных электронов и усилении металлических свойств с возрастанием порядкового номера.
В Периодической системе они следуют сразу за инертными газами, поэтому особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на внешнем энергетическом уровне: их электронная конфигурация ns1. Очевидно, что валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа. Поэтому для всех щелочных металлов характерны восстановительные свойства
Литий был открыт шведским химиком Й. Арведсоном в 1817 г.
По предложению Й.Берцелиуса назван литием (от греч. литос – камень).
Натрий и калий были впервые получены английским химиком и физиком Г. Дэви в 1807 г. при электролизе едких щелочей. Й. Берцелиус предложил назвать один новый элемент натрием (от араб. натрун – сода), а второй элемент по предложению Гильберта назван калием (от араб. алкали – щелочь).
Франций был открыт в 1939г француженкой М. Пере. Она доказала, что этот элемент является продуктом распада актиния. Это радиоактивный элемент. Период его полураспада 22 минуты. В начале 50-х годов удалось получить франций искусственно.
все атомы имеют крайне низкие величины энергии сродства к электрону и ЭО.
Элементы данной подгруппы имеют значительное сходство друг с другом, что обусловлено одинаковым строением внешнего электронного слоя атомов и аналогией в их важнейших характеристиках:
— все атомы имеют очень низкие значения Eион и легко превращаются в катионы Me + ;
В чистом виде щелочные металлы представляют собой легкие, мягкие вещества серебристо-белого цвета на срезе, быстро тускнеющие на воздухе вследствие окисления (цезий имеет золотисто-желтый оттенок). Металлы отличаются высокой электро- и теплопроводностью.
Пары щелочных металлов интенсивно окрашены в различные цвета: Na — пурпурный, К — сине-зеленый, Rb — зеленовато-синий.
Щелочные металлы очень легкоплавки: Cs и Rb плавятся в руках; самый тугоплавкий Li имеет т. пл. 180°С. Плотность этих металлов также невелика — натрий и калий легче воды, а литий плавает даже в керосине.
Щелочные металлы хорошо растворяются в жидком аммиаке, полученные растворы имеют темно-синюю окраску (образуются коллоидные растворы).
Уже на воздухе щелочные Me немедленно окисляются, a Rb и Cs — самовоспламеняются
При повышении Т все металлы сгорают с образованием ослепительного пламени.
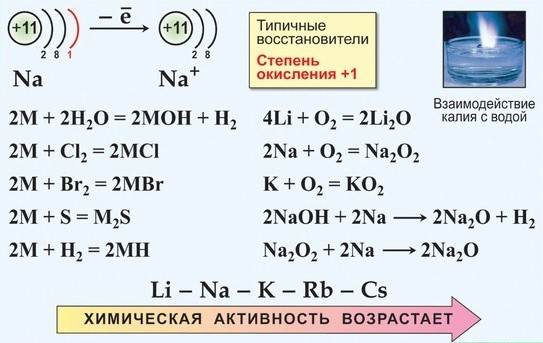
Все щелочные металлы очень химически активны, сильные восстановители:
С активными окислителями, водой и кислотами реакции протекают настолько бурно, что происходит самовоспламенение или взрыв. Часто реакции проводят в охлаждаемой среде. Реакции с неметаллами осуществляют в вакууме или в среде инертных газов.
а) только Li при горении образует нормальный оксид:
б) Na при горении образует бесцветный или слегка желтоватый пероксид
в) К, Rb и Cs сгорают с образованием окрашенных супероксидов:
г) К, Rb и Cs легко реагируют с озоном, образуя озониды:
Соединение щел. Me с галогенами протекает очень бурно, часто в режиме горения, особенно с F2 и Cl2:
а) все щел. Me реагируют с фосфором и серой (металлы предварительно нагревают):
2Na + S = Na2S сульфид натрия
3Na + Р = Na3Р фосфид натрия
б) с углеродом и кремнием реагирует непосредственно только литий:
2Li + 2С = Li2C2 карбид лития
Наиболее легко реакция протекает между водородом и предварительно слабо нагретым литием:
Атомы элементов IА–IIIА групп имеют сходство в строении электронных оболочек и закономерностях изменения свойств, что приводит к некоторому сходству их химических свойств и свойств их соединений.
Металлы IA (первой группы главной подгруппы) также называются «щелочные металлы«. К ним относятся литий, натрий, калий, рубидий, цезий. Франций – радиоактивный элемент, в природе практически не встречается. У всех металлов IA группы на внешнем энергетическом уровне, на s-подуровне в основном состоянии есть один неспаренный электрон:
… ns 1 — электронное строение внешнего энергетического уровня щелочных металлов
Металлы IA группы — s-элементы. В химических реакциях они отдают один валентный электрон, поэтому для них характерна постоянная степень окисления +1.
Рассмотрим характеристики элементов IA группы:
Все щелочные металлы — сильные восстановители. Это самые активные металлы, которые могут непосредственно взаимодействовать с неметаллами. С ростом порядкового номера и уменьшением энергии ионизации металлические свойства элементов усиливаются. Щелочные металлы образуют с кислородом оксиды Э2О. Оксиды щелочных металлов реагируют с водой с образованием основания (щелочи):
Водородные соединения щелочных металлов — это гидриды с общей формулой ЭН. Степень окисления водорода в гидридах равна -1.
Металлы IIA (второй группы главной подгруппы) — щелочноземельные. Раньше к щелочноземельным металлам относили только кальций, стронций, барий и радий, но по решению ИЮПАК бериллий и магний также называются щелочноземельными.
У щелочноземельных металлов на внешнем энергетическом уровне расположены два электрона. В основном состоянии это два спаренных электрона на s-подуровне:
… ns 2 — электронное строение внешнего энергетического уровня элементов IIA группы
Щелочноземельные металлы — s-элементы. Отдавая два валентных электрона, они проявляют постоянную степень окисления +2. Все элементы подгруппы бериллия — сильные восстановители, но восстановительные свойства выражены слабее, чем у щелочных металлов.
Характеристики элементов IIA группы:
Металлы подгруппы бериллия довольно активны. На воздухе они легко окисляются, образуя основные оксиды с общей формулой ЭО. Этим оксидам соответствуют гидроксиды Э(ОН)2.
Первый элемент IIA группы, бериллий, по большинству свойств гораздо ближе к алюминию (диагональное сходство). Это проявляется в свойствах бериллия. Например, он не взаимодействует с водой. Магний взаимодействует с водой только при нагревании. Кальций, стронций и барий — это типичные металлы. Они реагируют с водой при обычных условиях.
Элементам IIA группы соответствуют гидриды с общей формулой ЭН2.
Элементы IIIA (третьей группы главной подгруппы) — это бор, алюминий, галлий, индий, таллий и нихоний. В основном состоянии содержат на внешнем энергетическом уровне три электрона, которые распределены по s- и р-подуровням:
… ns 2 nр 1 — электронное строение внешнего энергетического уровня элементов IIIA группы
Все элементы подгруппы бора относятся к р-элементам. В химических соединениях проявляются степень окисления +3. Хотя для таллия более устойчивая степень окисления +1.
Характеристики элементов IIA группы:
Металлические свойства у элементов подгруппы бора выражены слабее, чем у элементов IIA подгруппы. Элмент бор относится к неметаллам. Энергия ионизации атома у бора наибольшая среди элментов IIIA подгруппы. Алюминий относится к типичным металлам, но оксид и гидроксид алюминия проявляют амфотерные свойства. У таллия более сильно выражены металлические свойства, в степени окисления +1 он близок по свойствам к щелочным металлам. Наибольшее практическое значение среди элементов IIIA подгруппы имеет алюминий.
Цезий или галлий можно легко расплавить в ладони, а вольфраму для плавления нужна температура лишь вдвое меньше, чем температура поверхности Солнца; литий, натрий или калий можно резать ножом, а чистый хром не всякий резец возьмет.
Различна и химическая активность металлов - от почти полной химической инертности золота или платины до неукротимой реакционной способности калия или натрия.
Но, несмотря на все свое разнообразие, эти элементы образуют единую семью, потому что все они относительно легко расстаются со своими наружными электронами и превращаются в положительные ионы.
Содержание работы
1. Введение………………………………………………………………………3
2. Общая характеристика, краткие сведения об истории открытия элементов и их распространённости в природе…………………………………. 4
3. Изменение в группе величины радиусов атомов и ионов, потенциала ионизации……………………………………………………………………..6
4. Сравнение химических свойств простых веществ IА группы……. 7
5. Особенности комплексообразования ионов натрия и калия………………9
6. Биологическая роль натрия, калия: содержание в организме, суточная потребность, локализация в органах и тканях, значение для организма……………………………………………………………………..10
7. Антагонизм натрия и калия………………………………………………. 14
8. Соединения лития, натрия, калия как лекарственные средства………. 15
9. Список литературы
Файлы: 1 файл
хим реферат.docx
ГБОУ ВПО ОрГМА МИНЗДРАВСОЦРАЗВИТИЯ РОССИИ
КАФЕДРА ХИМИИ И ФАРМАЦЕВТИЧЕСКОЙ ХИМИИ
Реферат
на тему:
“ Химия и биологическая роль элементов IА группы ”
Выполнила:
Студентка 16 гр.
педиатрического факультета
Акишева С.Б.
Проверила:
Кузьмичёва Н.А.
- Введение………………………………………………………… ……………3
- Общая характеристика, краткие сведения об истории открытия элементов и их распространённости в природе…………………………………. .4
- Изменение в группе величины радиусов атомов и ионов, потенциала ионизации……………………………………………………… ……………..6
- Сравнение химических свойств простых веществ IА группы……. 7
- Особенности комплексообразования ионов натрия и калия………………9
- Биологическая роль натрия, калия: содержание в организме, суточная потребность, локализация в органах и тканях, значение для организма……………………………………………………… ……………..10
- Антагонизм натрия и калия………………………………………………. 14
- Соединения лития, натрия, калия как лекарственные средства………. 15
- Список литературы…………………………………………………… ……..18
В периодической системе металлы преобладают. По многим свойствам металлы очень отличаются друг от друга: литий вдвое легче воды, а осмий тяжелее ее в 22,5 раза.
Цезий или галлий можно легко расплавить в ладони, а вольфраму для плавления нужна температура лишь вдвое меньше, чем температура поверхности Солнца; литий, натрий или калий можно резать ножом, а чистый хром не всякий резец возьмет.
Различна и химическая активность металлов - от почти полной химической инертности золота или платины до неукротимой реакционной способности калия или натрия.
Но, несмотря на все свое разнообразие, эти элементы образуют единую семью, потому что все они относительно легко расстаются со своими наружными электронами и превращаются в положительные ионы.
Элемент легко отдает электроны, если их на внешнем энергетическом уровне мало (поэтому Элементы первых трех групп, не считая бора, - металлы) или если радиус атома так велик, что ядро не в состоянии прочно удерживать наружные электроны (поэтому висмут, атом которого имеет на внешнем энергетическом уровне пять электронов, все-таки относят к металлам).
Проследив, как изменяются свойства у элементов III периода, мы увидим, что с увеличением числа электронов во внешнем энергетическом уровне элементы постепенно переходят от активного металла натрия к активному неметаллу хлору. IV период тоже начинается активным металлом калием.
В конце этого периода перед инертным газом криптоном также стоит активный неметалл бром. Следовательно, и в этом периоде должен происходить такой же переход.
Почему же этот переход такой медленный? Дело в том, что у элементов IV периода от скандия до цинка "достраивается" не внешний энергетический уровень, а предыдущий.
И лишь после цинка (начиная с галлия) число электронов на внешнем энергетическом уровне увеличивается, так что у германия здесь четыре электрона. Он - "пограничный" элемент, за которым следуют неметаллы.
Поскольку у элементов от скандия до никеля на внешнем энергетическом уровне не больше двух электронов, то они металлы. Каждый большой период включает в себя подобный ряд, состоящий только из металлов.
У этих рядов четные номера, а из большинства расположенных в них металлов состоят побочные подгруппы периодической системы.
Цель: изучить элементы IА группы и их роль.
Для достижения поставленной цели необходимо решить следующие задачи:
-дать общую характеристику элементов IА группы;
-указать роль элементов IА группы;
-рассмотреть и изучить свойства элементов IА группы.
Общая характеристика, краткие сведения об истории открытия элементов и их распространённости в природе.
В группу IА входят следующие элементы: литий, калий, натрий, рубидий, цезий, франций, т.е. щелочные металлы.
Элементы первой группы периодической системы характеризуются прежде всего одинаковым строением внешнего электронного слоя атомов, в котором у всех членов группы содержится только один электрон. Но второй снаружи электронный слой у отдельных элементов группы построен различно. Это обстоятельство оказывает большое влияние на свойства соответствующих элементов.
Название "щелочные "металлы" присвоено элементам главной подгруппы первой группы ввиду того, что гидроокиси двух главных представителей этой группы - лития, натрия и калия - издавна были известны под названием "щелочей". Из этих щелочей, подвергая их в расплавленном состоянии электролизу, Дэви в 1807 г. впервые получил свободные калий и натрий. Имея в наружном слое только один электрон, удаленный от ядра на значительное расстояние, атомы щелочных металлов чрезвычайно легко отдают его, превращаясь в положительные однозарядные ионы с устойчивой оболочкой соответствующего инертного газа.
Поэтому щелочные металлы являются наиболее типичными представителями металлов. Все металлические свойства выражены у них особенно резко.
Щелочные металлы совершенно не способны присоединять электроны.
Одинаковое строение не только наружного, но и предпоследнего электронного слоя обусловливает большое сходство щелочных металлов друг с другом. Но в то же время увеличение заряда ядра и общего числа электронов в атоме при переходе от лития к цезию создает некоторые качественные различия между отдельными членами группы. Как и в других группах, эти различия проявляются главным образом в более легкой отдаче валентных электронов и усилении металлических свойств с возрастанием порядкового номера.
В Периодической системе они следуют сразу за инертными газами, поэтому особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на внешнем энергетическом уровне: их электронная конфигурация ns1. Очевидно, что валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа. Поэтому для всех щелочных металлов характерны восстановительные свойства
Литий был открыт шведским химиком Й. Арведсоном в 1817 г.
По предложению Й.Берцелиуса назван литием (от греч. литос – камень).
Натрий и калий были впервые получены английским химиком и физиком Г. Дэви в 1807 г. при электролизе едких щелочей. Й. Берцелиус предложил назвать один новый элемент натрием (от араб. натрун – сода), а второй элемент по предложению Гильберта назван калием (от араб. алкали – щелочь).
Франций был открыт в 1939г француженкой М. Пере. Она доказала, что этот элемент является продуктом распада актиния. Это радиоактивный элемент. Период его полураспада 22 минуты. В начале 50-х годов удалось получить франций искусственно.
Читайте также:

