Реферат лучевая диагностика в онкологии
Обновлено: 07.07.2024
Проведен анализ современных методов лучевой диагностики, применяемых для выявления рака желудка и метастазов. В последние годы наблюдается инновационное развитие всех технологий лучевой диагностики. Если раньше действовал принцип последовательного перехода от простого метода исследования к сложному, то в последние годы выбирают наиболее результативный, в том числе дорогостоящий метод, или сочетание методов для получения максимально быстрого и эффективного результата. Наиболее информативными, эффективными и современными методами диагностики органов пищеварения во всем мире в настоящее время считаются компьютерная томография (КТ), магнитно-резонансная томография (МРТ), позитронно-эмиссионная томография (ПЭТ) и сочетание методов. Вместе с тем, наиболее актуальными в борьбе с раком желудка являются скрининговые программы по выявлению заболеваний на ранней стадии до развития классической картины болезни в связи с тем, что сегодня ни один из практических методов клинического и инструментального обследования однозначно определить раннее раковое поражение желудка не может.

1. Августинович А.В. Особенности лимфогенного метастазирования и выбор оптимального объёма лимфодиссекции при раке желудка: Автореф. дис. канд. мед. наук. – Томск, 2009. – 23 с.
4. Валенкевич Л.Н., Яхонтова О.И. Болезни органов пищеварения: рук-во по гастроэнтерологии для врачей. – СПб.: ДЕАН, 2006. – 656 с.
5. Воропаева Л.А., Диомидова В.Н. Оптимизация протокола магнитно-резонансной томографии в диагностике рака желудка // Казанский мед. журн. – 2010. – Т. 91, № 3. – С. 359–362.
6. Воропаева Л.А. Значение использования онкомаркеров в активном выявлении изъязвленного рака желудка // Вестн. Чувашского университета. – 2010. – № 3. – С. 88–92.
7. Воропаева Л.А. Диагностическая значимость онкомаркеров в активном выявлении изъязвленного рака желудка // Медицинский Альманах. – 2011. – Т. 2, № 15. – С. 48–50.
9. Горшков А.Н. Возможности трансабдоминального ультразвукового исследования и рентгеновской компьютерной томографии в комплексной диагностике раннего рака желудка // Вопросы онкологии. – 2003. – Т. 49, № 2. – С. 217–222.
11. Диомидова В.Н. Комплексное ультразвуковое исследование с применением трехмерной визуализации в диагностике и оценке распространенности рака желудка (клиническое наблюдение) / В.Н. Диомидова, Л.А. Воропаева, О.В. Валеева // Ультразвуковая и функциональная диагностика. – 2010. – № 4. – С. 69–74.
12. Долгушин Б.И., Тюрин И.Е. Современное состояние и перспективы развития лучевой диагностики в онкологии // Мед. визуал. Спец. вып. – 2009. – С. 7–10.
13. Медведев М.В. Перспективы развития трехмерной эхографии в России // Sono Ace International. – 2008. – Вып. 18. – С. 4–6.
14. Передерий В.Г. Cкрининг, ранняя диагностика и стратегии предупреждения рака желудка / В.Г. Передерий, С.М. Ткач, А.Ю. Иоффе и др. // Рос. журн. гастроэнтерол., гепатол. и колопроктол. – 2007. – Т. 20, № 1. – С. 60–61.
16. Портной Л.М. Новые взгляды на лучевую диагностику рака желудка (медико-семиотические и организационные аспекты) / Л.М. Портной, О.В. Вятчанин, Г.А. Сташук. – М.: Видар, 2004. – 278 с.
17. Ройтберг Г.Е. Современные методы инструментальной диагностики рака желудка / Г.Е. Ройтберг, В.Д. Креймер, С.А. Тарабарин // Вестн. Нац. медико-хир. Центра им. Н.И. Пирогова. – 2012. – Т. 7, № 3. – С. 119–122.
18. Рязанцев А.А. Применение трехмерной ультразвуковой визуализации в выявлении опухолей дистальных отделов желчевыводящих протоков и большого дуоденального сосочка // Ультразвуковая и функциональная диагностика. – 2008. – № 5. – С. 23–34.
19. Сельчук В.Ю., Никулин М.П. Рак желудка // Рус. мед. журн. – 2003. – Т. 11, № 26. – С. 16–18; 1141–1148.
20. Хи Н.Х. Трехмерное ультразвуковое изображение абдоминальных структур // Sono Ace Ultrasound. – 2002. – Vol. 10. – P. 12–15.
21. Чернеховская Н.Е. Эндоскопическая диагностика заболеваний пищевода, желудка и тонкой кишки / В кн.: Н.Е. Чернеховская, В.Г. Андреев, Д.П. Черепянцев и др. – М.: МЕДпресс-информ, 2008. – 200 с.
23. Шахов Б.Е. Диагностическая ценность магнитно-резонансной томографии при изъязвлениях желудка / Б.Е. Шахов, Л.А. Воропаева, В.Н. Диомидова // Медицинский Альманах. – 2010. – Т. 3, № 12. – С. 137–141.
24. Bentrem D. Clinical correlation of endoscopic ultrasonography with pathologic stage and outcome in patients undergoing curative resection for gastric cancer / D. Bentrem, H. Gerdes, L. Tang et al. // Ann. Surg. Oncol. – 2007. – Vol. 14. – P. 1853–1859.
25. Blackshaw G. Laparoscopy significantly improves the perceived preoperative stage of gastric cancer / G. Blackshaw, J. Barry, P. Edwards et al. // Gastric Cancer. – 2003. – Vol. 6. – P. 225–229.
26. Blake M.A. Practical Issues in Abdominal PET/CT / M.A. Blake, J. Slattery, D.V. Sahani et al. // Appl. Radiol. – 2005. – Vol. 34, № 11. – P. 8–18.
27. Burbidge S. The role of CT and staging laparoscopy in the staging of gastric cancer / S. Burbidge, K. Mahady, K. Naik // Clinical Radiology. – 2013. – Vol. 68. – P. 251–255.
28. Chen C.Y. Gastric cancer: preoperative local staging with 3D multi-detector row CT – correlation with surgical and histopathologic results / C.Y. Chen, J.S. Hsu, D.C. Wu et al. // Radiology. – 2007. – Vol. 242, № 2. – 472–482.
29. Cheung T.K., Wong B.C. Treatment of Helicobacter pylori and prevention of gastric cancer // J. Dig. Dis. – 2008. – Vol. 9, № 1. – P. 8–13.
30. de Graaf G.W. The role of staging laparoscopy in oesophagogastric cancers / G.W. de Graaf, A.A. Ayantunde, S.L. Parsons et al. // Eur. J. Surg. Oncol. – 2007. – Vol. 33. – P. 988–992.
31. Fukao A. The evolution of screening for gastric cancer in Miyagi prefecture , Japan: A population-based case-control study / A. Fukao, Y. Tsubono, I. Tsuhi et al. // Int. J. Cancer. – 1995. – Vol. 60. – P. 45–48.
32. Furukawa K. Diagnosis of the invasion depth of gastric cancer using MDCT with virtual gastroscopy: comparison with staging with endoscopic ultrasound / K. Furukawa, R. Miyahara, A. Itoh et al. // Am. J. Roentgenol. – 2011. – Vol. 197, № 4. – P. 867–875.
33. Hamashima C. The Japanese guidelines for gastric cancer screening / C. Hamashima, D. Shibuya, H. Yamazaki et al. // Jpn. J. Clin. Oncol. – 2008. – Vol. 38. – P. 259–267.
34. Ince A.T. Conventional video-gastroscopes for the recognition of early gastric cancers / A.T. Ince, E. Senateş, O. Bahadir et al. // Hepatogastroenterol. – 2011. – Vol. 58, № 107–108. – P. 1081–1085.
35. Ishigami S. Preoperative assessment of the depth of early gastric cancer invasion by transabdominal ultrasound sonography (TUS): a comparison with endoscopic ultrasound sonography (EUS) / S. Ishigami, H. Yoshinaka, F. Sakamoto et al. // Hepatogastro¬enterol. – 2004. – Vol. 51, № 58. – P. 1202–1205.
36. Kawaguchi Т. Clinical evaluation of JCGC and TNM staging on multidetector-row computed tomography in preoperative nodal staging of gastric cancer / Т. Kawaguchi, D. Ichikawa, S. Komatsu et al. // Hepatogastroenterol. – 2011. – Vol. 58, № 107-108. – P. 838–841.
37. Kim J.H. Diagnostic performance of virtual gastroscopy using MDCT in early gastric cancer compared with 2D axial CT: focusing on interobserver variation / J.H. Kim, H.W. Eun, J.H. Choi et al. // Am. J. Roentgenol. – 2007. – Vol. 189, № 2. – P 299–305.
38. Kwee R.M., Kwee T.C. Imaging in assessing lymph node status in gastric cancer // Gastric Cancer. – 2009. – Vol. 12. – P. 6–22.
39. Lynch H. Gastric cancer. New genetic developments / H. Lynch, W. Grady, G. Suriano et al. // J. Surg. Oncol. – 2005. – Vol. 3. – P. 116–133.
40. Mukai K. Usefulness of preoperative FDG-PET for detection of gastric cancer / K. Mukai, Y. Ishida, K. Okajima et al. // Gastric Cancer. – 2006. – Vol. 9, № 3. – P. 192–196.
41. National cancer control programs in Korea // J. Korean Med. Sci. – 2007. – Vol. 22 (suppl). – P. 3–4.
42. Nishi M. Chronological changes of characteristics of early gastric cancer and therapy: experience in the Cancer Institute Hospital of Tokyo, 1950-1994 / M. Nishi, S. Ishihara, T. Nakajima et al. // J. Cancer Res. Clin. Oncol. – 1995. – Vol. 121. – P. 535–541.
43. Park S.R. Endoscopic ultrasound and computed tomography in restaging and predicting prognosis after neoadjuvant chemotherapy in patients with locally advanced gastric cancer / S.R. Park, J.S. Lee, C.G. Kim et al. // Cancer. – 2008. – Vol. 112. – P. 2368–2376.
44. Puli S.R. Endoscopic ultrasound: it’s accuracy in evaluating mediastinal lymphadenopathy? A meta-analysis and systematic review / S.R. Puli, Batapati Krishna J. Reddy, M.L. Bechtold et al. // World J. Gastroenterol. – 2008. – Vol. 14. – P. 3028–3037.
45. Roviello F. Perforated gastric carcinoma: a report of 10 cases and review of the literature / F. Roviello, S. Rossi, D. Marrelli et al. // World J. Surg. Oncol. – 2006. – Vol. 4. – P. 19.
46. Shimizu K. Diagnosis of gastric cancer with MDCT using the water-filling method and multiplanar reconstruction: CT-histologic correlation / K. Shimizu, K. Ito, N. Matsunaga et al. // Am. J. Roentgenol. – 2005. – Vol. 185, № 5. – P. 1152–1158.
47. Sim S.H. The role of PET/CT in detection of gastric cancer recurrence / S.H. Sim, Yu.J. Kim, D-Y. Oh et al. // BMC Cancer. – 2009. – Vol. 9. – P. 73. doi:10.1186/1471-2407-9–73.
48. Takuji G. Incidence in lymph node metastasis from early gastric cancer: estimation with a largenumber of cases at two large centers / G.Takuji, A. Yanagisawa, M. Sasako et al. // Gastric Cancer. – 2000. – Vol. 3. – P. 219–225.
49. Tashiro A. Comparing mass screening techniques for gastric cancer in Japan / A. Tashiro, M. Sano, K. Kinameri et al. // World. J. Gastroenterol. – 2006. – Vol. 12, № 30. – P. 4873–4874.
Сегодня общепризнано, что только массовая профилактика и ранняя диагностика рака желудка (РЖ) может разрешить проблему успешной борьбы с этим заболеванием [19], но в настоящее время нет эффективного и экономически корректного метода диагностики, который мог бы быть использован для массовых обследований на предмет выявления предрака и рака желудка [15, 14]. Наилучших успехов в выявлении РЖ на ранних стадиях достигла Япония благодаря массовому скринингу населения и принятым национальным программам по борьбе с раком [48]: до 60 % случаев диагностируется на стадиях раннего рака, высока выявляемость и пограничных изменений [22, 44, 39], тогда как в Европе, США и других странах выявляемость РЖ на ранних стадиях составляет не более 20 % [48]. Однако во всем мире, кроме Японии и Кореи, не существует реально работающих программ скрининга по РЖ [31, 42, 33, 41].
В России при высоком уровне заболеваемости РЖ только в 5–10 % рак выявляется на ранних стадиях [3, 22, 4], что обусловлено, среди прочих факторов, и отставанием в современной диагностике предраковых заболеваний органов пищеварения [2, 29], 80 % больных обращаются за медицинской помощью уже при III-IV стадии опухолевого процесса, тогда как известно, что стойкое излечение возможно только на начальных стадиях процесса, когда практически отсутствуют клинические проявления заболевания [1].
Обычно в странах с высокой заболеваемостью раком желудка, таких как Корея и Япония, практикуется скрининг всего населения, включающий методы рентген-флюорографии или эндоскопии [33]. Наиболее старая модель скрининга (рентген-флюорография) уже десятилетиями успешно работает в Японии и доказала свою эффективность [31].
В настоящее время ни один из практических методов клинического и инструментального обследований сам по себе не позволяет однозначно решить вопросы раннего выявления рака, поэтому важно использование различных комбинаций методов [5, 11]. В последние годы наблюдается инновационное развитие всех технологий лучевой диагностики, если раньше действовал принцип последовательного перехода от простого метода исследования к сложному, то в последние годы выбирают наиболее результативный, в том числе дорогостоящий метод, или сочетание методов для получения максимально быстрого и эффективного результата [12].
Относительно простым и недорогим методом исследования желудка является рентгеноскопия. Чувствительность определения раннего РЖ составляет 60–75 %, специфичность достигает 95 %. При рентгеноскопии желудка с двойным контрастированием чувствительность выявления малигнизации повышается до 90–95 % [49]. Особое место в диагностике рака желудка занимает прогрессивно развивающееся ультразвуковое исследование, которое благодаря своей экономичности, безвредности, возможности одновременного исследования органов брюшной полости и забрюшинного пространства стало одним из методов первичного обследования больных [16, 10].
Рутинное абдоминальное ультразвуковое исследование используется в основном для выявления отдаленных метастазов из-за недостаточной точности и достоверности определения глубины инвазии и размера первичной опухоли [24, 43, 44]. Точность определения глубины инвазии при раннем РЖ не превышает 66 % [35]. Чувствительность и специфичность обнаружения метастатического поражения лимфоузлов составляет 12–80 % и 56–100 % соответственно [38]. Однако диагностические возможности метода расширились с появлением трехмерной эхографии (3D-режим) [13, 18], результаты комплексной эхографии желудка в целом становятся более значимыми, чем данные, полученные при фиброгастроскопии и компьютерной томографии [20].
Магнитно-резонансная томография (МРТ), также как и КТ, в основном используется для определения отдаленных метастазов и стадирования рака желудка на поздних стадиях. Чувствительность и специфичность выявления метастазов в лимфоузлы составляет 54–85 % и 50–100 % соответственно [38]. Точность в определении глубины инвазии опухоли не превышает 82 %. Кроме того, практически отсутствует информация о МРТ полых органов пищеварения, не изучены достоинства метода в диагностике рака желудка, особенно его ранних стадий [10]. Предварительные результаты использования МРТ в диагностике рака желудка у пациентов с эндоскопически установленным диагнозом показали наибольшую значимость метода в уточнении локализации процесса по отделам желудка, толщины и изменения МР-сигнала от инфильтрированной желудочной стенки [5, 23].
Позитрон-эмиссионная томография (ПЭТ) основана на регистрации распределения в организме радиофармпрепаратов (РФП), меченных позитрон-излучающими радионуклидами. Наиболее распространенным РФП является 18F-2-дезокси-2-флюоро-D-глюкоза (ФДГ) [26]. Для повышения чувствительности метода ведутся разработки по созданию РФП с высокой тканеспецифичностью и туморотропностью. В настоящее время с помощью ПЭТ может быть выявлено лишь около 26 % больных с ранним РЖ [40]. В большей степени ПЭТ помогает определить агрессивность течения рака желудка, наличие отдаленных метастазов и ответ на проводимую противоопухолевую терапию. Сегодня наиболее диагностически значима ПЭТ для выявления опухолей лимфатической природы и лимфодиссеминированных процессов [17].
В ряде случаев при РЖ прибегают к диагностической лапароскопии. Этим методом можно оценить вероятность удаления опухоли и ее распространенность по брюшной полости, а также сделать биопсию или взять жидкость для исследования [17]. Кроме того, диагностическая лапароскопия с биопсией позволяют правильно установить и подтвердить гистологически диагноз у 96 % больных с диссеминацией рака по брюшной полости и тем самым избежать пробной лапаротомии у 36 % больных. У 72 % пациентов с установленным диагнозом РЖ лапароскопия помогает правильно оценить состояние регионарных лимфатических узлов [4,21]. Лапароскопия является надежным методом определения резектабельности опухоли с диагностической точностью до 89 % [45, 30]. Сочетание КТ и лапароскопии позволяет обнаружить подавляющее большинство опухолей еще до хирургического вмешательства, при этом лапароскопия должна оставаться неотъемлемой частью диагностики для всех пациентов с раком желудка [25, 27].
Таким образом, в настоящее время рентгенологический метод с помощью контрастного исследования желудочно-кишечного тракта не потерял своей актуальности. Как правило, рентгенологическое исследование сочетается с эндоскопией желудка, ультразвуковым исследованием органов брюшной полости, применением методов виртуальной и конвенциональной эндоскопии [32, 34]. Эта сочетанная методика дает возможность выявлять наряду с эндофитными опухолями образования, имеющие интрамуральный и/или экзофитный характер распространенности [17]. Однако наиболее информативными, эффективными и современными методами диагностики органов пищеварения во всем мире в настоящее время считаются компьютерная томография (КТ), магнитно-резонансная томография (МРТ), позитронно-эмиссионная томография (ПЭТ) и сочетание методов [47, 36].
Рецензенты:
Трудно переоценить роль радиологических методов исследования в диагностике онкологических заболеваний, а также в оценке результатов лечения и динамики болезни. Лучевые методы диагностики позволяют обнаружить многие новообразования на ранних стадиях, поэтому их широкое применение является очень важным аспектом в развитии современной медицины.
У онкологических пациентов, а также у всех, кто хочет пройти обследование, чтобы быть уверенным в отсутствии угрозы заболевания, возникает множество вопросов по методам современной лучевой диагностики, о необходимости и достаточности проведения тех или иных исследований.
На наиболее часто встречающиеся вопросы пользователей сайта отвечает заведующий отделением лучевой диагностики НИИ онкологии им.Н.Н.Петрова, д.м.н., профессор Андрей Владимирович Мищенко.

Какой метод лучевой диагностики является наиболее эффективным в онкологии? Пациенты спрашивают, почему, например, в одних случаях назначают КТ, в других МРТ?
Сегодня в арсенале современной клиники имеется довольно широкий спектр лучевых методов. Зачастую приходиться объяснять не только пациентам, но и консультировать врачей, какой метод лучевой диагностики в данной ситуации наиболее предпочтителен. Лучевая диагностика на сегодняшний день объединяет в себе пять основных методов исследований:
- Рентгенодиагностика
- Компьютерная томография (КТ)
- Магнитно-резонансная томография (МРТ)
- Ультразвуковая диагностика (УЗИ)
- Радионуклидная диагностика
Каждый из методов лучевой диагностики имеет свои особенности, позволяющие увидеть те или иные ткани организма человека. Так, головной и спинной мозг, мягкие ткани (мышцы, сухожилия), органы малого таза лучше визуализируется при магнитно-резонансной томографии.
Ультразвуковое исследование дает хорошее отображение поверхностных структур, мышц, молочной железы, щитовидной железы, лимфатических узлов. С помощью УЗИ исследуются паренхиматозные органы живота, малого таза, особенно при использовании специальных датчиков для исследования женских половых органов и предстательной железы у мужчин.
КТ наиболее часто используется для диагностики органов груди (легкие, средостение), живота, на томографе хорошо видны костные изменения. Однако, иногда можно быстрее и с минимальным воздействием решить вопросы патологии легких или костей при помощи классической рентгенографии.
Радионуклидная диагностика применяется в онкологической практике в основном в виде сцинтиграфии для диагностики метастатического поражения костей, а при использовании специальных препаратов также позволяет диагностировать поражения лимфатических узлов.
При назначении обследования онкологического пациента в каждом конкретном случае учитывается не только тип самой опухоли и степень ее злокачественности, но и проведенное лечение (операция, лучевая терапия, химиотерапия или их комбинации), давность проведенного лечения, состояние организма пациента, сопутствующая патология и другие факторы.
Что делать, если при обследовании в другом лечебном учреждении выявлена опухоль, а пациент не уверен в правильности диагноза?
Когда пациенты приезжают на лечение в НИИ онкологии из других регионов России, они часто предоставляют результаты КТ и МРТ-исследований, лучше если это будет запись на компакт-диске. К сожалению, иногда на практике мы встречаемся с тем, что качество этих исследований оставляет желать лучшего. Мы всегда стараемся при экспертном анализе предоставленных данных предоставить максимальную информацию врачу-онкологу для принятия решения. В том случае, если этого будет недостаточно, пациенту может быть назначено повторное исследование.
Какие существуют рекомендации по проведению лучевых исследований после проведенного лечения, операции?
Как правило, больные после лечения онкологических заболеваний выписываются под наблюдение онкологов районных поликлиник с четкими рекомендациями: какие исследования и в какие периоды необходимо проходить. При наблюдении за процессом лечения принципиальным моментом является анализ динамики изменений органов, а также самой опухоли, если она осталась.
При сравнении предыдущей картины с сегодняшними данными для врача очень важно соблюдение методики исследования. В связи с этим я рекомендую проходить лучевые исследования по поводу опухолей исключительно в специализированных и проверенных учреждениях.
Сегодня отмечается увеличение заболеваемости раком во всем мире. Наряду с этим, развитие радиологических методов диагностики и их широкое применение, способствуют диагностике онкологических заболеваний на ранних стадиях…

Сегодня отмечается увеличение заболеваемости раком во всем мире. Наряду с этим, развитие радиологических методов диагностики и их широкое применение, способствуют диагностике онкологических заболеваний на ранних стадиях. Процент выживаемости при онкологических заболеваниях напрямую зависит от степени тяжести рака.
В онкологии применяются следующие основные методы лучевой диагностики:
-
— (визуальная методика, основанная на использовании ультразвуковых волн для получения изображения)
- Рентгенодиагностика (рентгенологический метод) — принцип получения изображения построен на особенностях поглощения рентгеновских лучей различными тканями организма (КТ) — метод рентгеновского исследования, основанный на получении послойных изображений в поперечной плоскости и их компьютерной реконструкции (МРТ) — метод, основанный на получении послойных изображений органов и тканей с помощью явления магнитного резонанса
- Радионуклидная диагностика или ядерная медицина — метод лучевой диагностики, основанный на регистрации излучения от введенных в организм искусственных радиофарм препаратов
- Соответствующие дополнительные исследования и биопсия должны быть выполнены в отношении любых локализаций, подозрительных на злокачественный процесс, так как точное установление стадии болезни определяет лечение и исход основного заболевания
Применение лучевой диагностики в онкологии направлено на решение основных задач:
Виды рака и методы его диагностики
Опухоли яичников
Методы визуализации, такие как магнитно-резонансная томография (МРТ), которая может дать дополнительную информацию, но не являются необходимыми исследованиями при проведении предоперационной оценки в рутинной практике. При сомнительных результатах по данным УЗИ, использование МРТ усиливает специфичность метода визуализации, тем самым снижая риск неверного диагноза
КТ не является методом выбора при раке яичников, а используется при невозможности выполнения МРТ, также для оценки поражения лимфоузлов.
Рак шейки матки
- Магнитно-резонансная томография (МРТ) рассматривается как дополнительный метод обследования, превосходящий КТ-исследование в оценке распространенности опухоли, но в оценке поражения лимфатических узлов оба метода равнозначны. Для поиска метастазов также проводится Магнитно-резонансная томография малого таза и брюшной полости
- Компьютерная томография может быть использована для выявления метастатического поражения органов грудной клетки
Рак эндометрия
- При вовлечении в процесс шейки матки, рекомендовано выполнение магнитно-резонансная томография (МРТ) с контрастным усилением и брюшной полости используется для определения метастазов
Опухоли пищевода
Для определения распространенности процесса, поиска метастазов, как дополнительный метод используется КТ грудной клетки и брюшной полости с контрастированием
Опухоли желудка
Методы лучевой диагностики (МРТ, КТ) используются для поиска метастазов в брюшной полости и забрюшинном пространстве, в малом тазу, легких и головном мозге. Для этого предпочтительней делать МРТ органов брюшной полости, малого таза, головного мозга и КТ легких
Опухоли поджелудочной
КТ и МРТ с контрастом считаются оптимальными методами диагностики.
МРТ даст более точную информацию по выявлению опухоли, а КТ более точно определит инвазивный рост, что важно для оперативного хирургического объема.
Все органы брюшной полости и забрюшинного пространства имеют склонность к метастазированию в легкие, головной мозг, малый таз.
Опухоли печени
- Оптимальным методом диагностики образований в печени считается МРТ с контрастным усилением, а использование гепатоспецифических контрастных препаратов имееют дополнительное преимущество для данной патологии
- Для адекватного стадирования опухоли используется КТ органов грудной клетки и КТ органов брюшной полости
Рак желчного пузыря и желчных протоков
Диагноз должен быть основан на данных радиологического исследования МРТ и патоморфологическом подтверждении диагноза.
Рак ободочной кишки
Виртуальная колоноскопия (неинвазивный метод, основанный на лучевой диагностике) способна точно визуализировать локализацию опухоли, что особенно полезно в сочетании с эндоскопическим методом в планировании объема хирургической операции
Колоректальный рак
- Магнитно резонансная томография прямой кишки может дать исчерпывающую информацию хирургу в отношении стадии процесса, определит особенности кровоснабжения, поможет сформировать понимание объема операции и хирургического доступа
- Компьютерная томография, в данном случае, проводится с целью обнаружения метастазов (брюшная полость, легкие, головной мозг)
Опухоли толстой кишки
- В качестве скринингового метода диагностики применяется виртуальная колоноскопия (неинвазивный метод, основанный на лучевой диагностике)
- КТ используется для поиска метастазов
Опухоли легких и средостения
- Основным методом диагностики считается КТ грудной клетки
- Так как рак легких часто метастазирует в брюшную полость и головной мозг, то целесообразно проведение КТ / МРТ брюшной полости и МРТ головного мозга
Опухоли почек
- Данное заболевание диагностируется на КТ, определяются связи с почечными артериями, степень прорастания в чашечно-лоханочную систему и экстраорганное распространение и воздействие
- Магнитно-резонансная томография также широко используется в этой области. И КТ и МРТ исследования проводятся с применением контраста
Опухоли мочевого пузыря
- Выполняется МРТ малого таза с контрастом
- Наличие метастазов смотрят на КТ в легких и брюшной полости
Рак предстательной железы и яичек
- Магнитно-резонансная томография малого таза, позволяет детально оценить структуру предстательной железы, распространенность патологического процесса, вовлечение в процесс окружающих тканей, лимфатических узлов
- Т.к. рак простаты часто метастазирует в кости, то на поздних стадиях заболевания проводится остеосцинтиграфия
Лимфопролифераливные заболевания / лимфомы
Лучевая диагностика (компьютерная, магнитно-резонансная томография с контрастом) позволяет выявить наличие опухолевых образований в различных анатомических областях, которые не доступны врачу при внешнем осмотре
Опухоли головного мозга
- Основной метод диагностики — МРТ. Данный вид исследования необходим для уточнения локализации опухоли, определения степени распространенности
- МР — трактография сможет обозначить степень вовлечения проводящих путей головного мозга (трактов)
- Компьютерная томография используется как дополнительный метод в случае если в процесс вовлечены костные структуры. Также КТ выполняют при наличии абсолютных противопоказаний к МРТ исследованию
Опухоли спинного мозга
Магнитно-резонансная томография используется для определения локализации опухоли, ее уровня и положения (интрамедуллярные или экстрамедуллярные опухоли, т.е. находящиеся в структуре спинного мозга или вне его). В случае противопоказаний к МРТ проводят КТ
Меланома
Лучевая диагностика не используется для выявления меланомы как таковой, но ввиду активного метастазирования, проводится КТ и МРТ.
8 ноября — День рентгенолога. В этот день, в 1895 году, немецкий физик Вильгельм Конрад Рентген, проводя очередной эксперимент, открыл рентгеновское излучение. Сегодня это самый доступный и распространенный метод диагностики в мире.
Ни один метод лучевой диагностики не является универсальным, каждый имеет свои преимущества и недостатки, поэтому в реальной клинической практике врачи применяют все возможности медицинской визуализации, обсуждая в рамках мультидисциплинарной команды оптимальный алгоритм обследования пациента. С помощью Сергея Сергеевича Багненко, доктора медицинских наук, профессора, заведующего научным отделением диагностической и интервенционной радиологии НМИЦ онкологии им. Н.Н. Петрова, разбираемся, какие лучевые исследования нужно делать при конкретных онкопатологиях.

Методы лучевого исследования
Принято считать, что всего существует пять методов лучевой диагностики. В целом, деление базируется на видах лучевого воздействия, которое применяется в том или ином случае.
Рентгеновский метод — рентгеновское излучение, ультразвуковое (УЗИ) – ультразвуковые волны, МРТ – электромагнитные колебания, радионуклидный метод (позитронно-эмиссионная томография — ПЭТ, одно-фотонная эмиссионная томография – ОФЭКТ) — гамма и другие виды ионизирующего воздействия. Исключение – компьютерная томография (КТ). Данный вариант лучевой визуализации в своей основе предполагает рентгеновское излучение, и должен был бы относиться к рентгеновскому, однако его появление настолько расширило возможности классической рентгенодиагностики, что в свое время было принято решение вынести КТ в самостоятельный метод.
По большому счету, задачи, которые они выполняют, следующие:
Рентгенодиагностика — оценка состояния костей и органов грудной клетки, как правило, в рамках первичной диагностики, а также желудочно-кишечного тракта, желчных протоков и сосудов, если речь идет о рентген-контрастных методиках.
УЗИ — первичная диагностика практически любой онкопатологии, а также экспертная оценка при злокачественных поражениях щитовидной и паращитовидных желез, наружных половых органах, опухолях мягких тканей, имеющих поверхностное расположение, в том числе патологии молочных желез.
КТ — анализ состояния грудной клетки, скелета и органов живота в рамках предоперационного планирования (инвазия сосудов, поражение лимфатических узлов и пр.)
МРТ — головной, спинной мозг, молочные железы, связки и мышцы, органы малого таза и другие мягкотканные структуры.
Радионуклидный метод — решение отдельных вопросов дифференциальной диагностики (доброкачественный/злокачественный процесс и др.), оценка функционального состояния органов, а также стадирование онкологического заболевания (визуализация отдаленных метастазов и пр.).
Независимо от конкретного варианта лучевой диагностики, нативное исследование (без применения контрастных веществ) изредка может быть оправдано, однако в подавляющем большинстве случаев, особенно, если речь идет об онкопатологии, применение контрастных препаратов является обязательным.
Виды рака и методы лучевой диагностики
Рассмотрим лучевую диагностику по отдельным анатомическим локализациям.
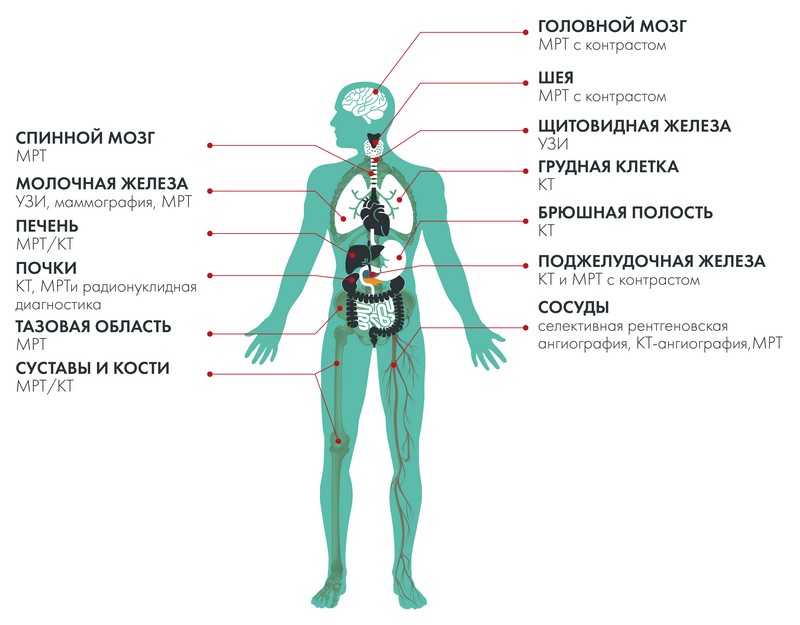
Головной мозг
Основной метод оценки непосредственно вещества головного мозга (в том числе первичных опухолей и метастазов) — МРТ с применением контрастного усиления.
Вопросы стадирования (поиск отдаленных метастазов) лучше всего решаются с помощью ПЭТ, в том числе с метионином.
Компьютерная томография используется как дополнительный метод в случае, если требуется оценка состояния костных структур, а также при наличии абсолютных противопоказаний к МРТ исследованию (наличие металла в теле — например, кардиостимулятора, ферромагнитных инородных металлических соединений: пластины, протезы, импланты и т.п.)
Первичный метод диагностики опухолей шеи — УЗИ.
Экспертная оценка – МРТ с контрастом.
КТ используется, когда необходимо оценить процесс разрушения (деструкции) костной ткани, требуется детальный анализ состояния гортани, а также есть показания к выполнению исследования сосудов (КТ-ангиография).
Радионуклидная диагностика – определение наличия онкологического процесса как такового, а также стадирование заболевания (применяются различные фармпрепараты: 18F-дезоксиглюкоза, метионин и пр.).
Щитовидная железа
Основной метод диагностики опухолевого процесса в щитовидной и паращитовидных железах — УЗИ. Отсутствие лучевой нагрузки, высокая разрешающая способность, а также доступность оборудования являются очевидными достоинствами эхографии. Особенно справедлив данный тезис, если речь идет об УЗИ с контрастным усилением и применением эластографии. Так называемое, мультипараметрическое УЗИ, то есть вариант исследования с включением в процедуру максимально количества различных методик, является наиболее перспективным вариантом реализации сонографической диагностики, особенно при злокачественной патологии.
Радионуклидная диагностика (к примеру, ПЭТ с 18F-DOPA) информативна в рамках подтверждения злокачественного характера имеющегося процесса, а также для выявления отдаленных метастазов.
Грудная клетка
У пациентов с острой патологией (например, реанимационных больных) может быть оправдано применение УЗИ (плевриты и др.).
МРТ эффективно для диагностики нейрогенных образований, которые располагаются в заднем средостении, а также как дополнительный метод диагностики при стадировании других опухолей средостения, например, рака пищевода.
Молочная железа
В настоящее время основными методами исследования молочных желез являются: маммография, УЗИ и МРТ. Все они обладают очевидными достоинствами и активно конкурируют между собой. Классическим вариантом визуализации (широкодоступным и понятным подавляющему большинству специалистов) является рентгеновская маммография.
МРТ решает большинство рассматриваемых вопросов, также не предполагает лучевой нагрузки, но имеет определенные ограничения в плане доступности и стоимости процедуры.
Печень
Первичная диагностика – УЗИ.
Экспертная оценка — КТ/МРТ с динамическим контрастированием.
КТ – доступнее, необременительна для пациента (само сканирование происходит за считанные секунды/минуты), позволяет в ходе одного визита исследовать в том числе легкие (что часто требуется в рамках онкоскриннинга).Это более простой, а потому более стандартизированный метод, который позволяет детально оценить состояние сосудов, что крайне важно при предоперационном планировании. Независимо от того, в каком центре проводится исследование, качество собранных данных будет, как правило, на достаточном уровне.
МРТ дает максимум информации в плане выявления и дифференциальной диагностики очаговой патологии печени, особенно если сканирование проводится с гепатотропными контрастными препаратами. Не предполагает лучевой нагрузки (то есть безвредно), а потому может выполняться многократно, в том числе беременным и детям. Однако многое зависит от того, в каком конкретно центре выполнено исследование (аппарато- и операторозависимость), занимает больше времени (сложности при обследовании пожилых, ослабленных пациентов), имеет ограничения в плане исследования легких (МРТ легких обычно не проводится и для их анализа приходится совершить визит в КТ отделение), имеет абсолютные противопоказания (например, металл в теле), уступает КТ в отношении предоперационной оценки.
Поджелудочная железа
По большому счету ситуация аналогична применяемым методам лучевой диагностики печени, однако есть некоторые нюансы. Так, из-за центрального расположения органа в теле визуализация при УЗИ может быть затруднена (тучные пациенты, при метеоризме — вздутие кишечника). Локальные обызвествления значительно лучше выявляются при КТ.
МРТ эффективнее для дифференциальной диагностики выявленных изменений.
Почки
Основные методы диагностики опухоли почки — КТ, МРТ и радионуклидный. Только в совокупности эти три составляющие могут дать врачам-онкологам полную информацию о состоянии органов. Традиционное УЗИ активно применяется для первичной оценки зоны интереса. Большие перспективы связывают с внедрением в клиническую практику УЗИ с контрастным усилением, однако по ряду технических моментов доступность данной методики сейчас ограничена.
Малый таз
Суставы и кости
В онкологической практике основными методами диагностики опухолей костно-мышечной системы являются МРТ и КТ.
Определенный приоритет имеет МРТ, однако, если требуется детальная оценка структуры кости или речь идет о параметрах деструкции, без КТ не обойтись.
Также в НИМЦ онкологии им. Петрова используется SLOT-рентгенография костей, когда с помощью специальной методики вся конечность, позвоночник или весь скелет целиком визуализируются на одном рентгеновском изображении. Этот метод позволяет точно определить параметры опухоли и соотнести ее с размером кости, что чрезвычайно важно хирургам при планировании вмешательства, подбора протеза или изготовления импланта.
Сосуды
Определенную информацию о состоянии некоторых сосудов можно получить при допплерографическом УЗИ, однако в онкологической практике чаще требуется более детальная информация и приходится прибегать к ангиографическим методикам.
Наиболее информативны – артериография на фоне плоскодетекторной компьютерной томографии (ПДКТ-артериография) и селективная цифровая субтракционная ангиография (ЦСА).
В 2021 году в НМИЦ онкологии им. Н.Н. Петрова в рентгеноперационной отделения рентгенохирургических методов диагностики и лечения был установлен современный ангиографический комплекс Artis Zee Flor (Siemens), позволяющий выполнять весь спектр диагностических и лечебных вмешательств, применяемых в интервенционной онкологии (в том числе с использованием ПДКТ-артериографии, ЦСА, внутрисосудистой и чрескожной 3D навигации). Однако основным недостатком данных методов визуализации является их инвазивность, требующая госпитализации пациентов для проведения вмешательства с соблюдением строгих правил асептики и антисептики.
Поэтому в рутинной практике чаще прибегают к менее инвазивным КТ-ангиографии и неинвазивной МР-ангиографии. Эти варианты визуализации позволяют проследить ход сосудов, выявить наличие тромбов, оценить наличие и степень опухолевой инвазии. КТ быстрее и обеспечивает более высокое пространственное разрешение изображений. Если применение йодсодержащих контрастов противопоказано (аллергические реакции, почечная недостаточность), выполняют магнитно-резонансное исследование. Современные технологии позволяют проводить сканирование с ЭКГ синхронизацией (требуется при изучении сосудов сердца), а также выполнять бесконтрастную МР-ангиографию (без введения контрастных препаратов в сосудистое русло).
Спинной мозг
Основной метод диагностики опухолей в спинном мозге — МРТ с контрастом. Он позволяет определить локализацию патологического процесса (интрамедуллярный или экстрамедуллярный, то есть находящийся в структуре спинного мозга или вне его), оценить его распространённость, вовлечение соседних структур. Если есть противопоказания к МРТ, а также, когда нужно детально разобраться с состоянием расположенных рядом позвонков, проводят КТ.

Автор:
Ирина Фигурина
специалист по связям с общественностью НМИЦ онкологии им. Н. Н. Петрова
Оренбургский государственный университет, факультет филологии
Читайте также:

