Реферат химический элемент магний
Обновлено: 05.07.2024
Нахождение в природе
Магний — один из десяти наиболее распространенных элементов земной коры. В ней содержится 2,35% магния по массе. Из-за высокой химической активности в свободном виде магний не встречается, а входит в состав множества минералов — силикатов, алюмосиликатов, карбонатов, хлоридов, сульфатов и др. Так, магний содержат широко распространенные силикаты оливин (Mg,Fe)2[SiO4] и серпентин Mg6(OH)8[Si4O10]. Важное практическое значение имеют такие магнийсодержащие минералы, как асбест, магнезит, доломит MgCO3·CaCO3, бишофит MgCl2·6H2O, карналлит KCl·MgCl2·6H2O, эпсомит MgSO4·7H2O, каинит KCl·MgSO4·3H2O, астраханит Na2SO4·MgSO4·4H2O и др. Магний содержится в морской воде (4% Mg в сухом остатке), в природных рассолах, во многих подземных водах.
Физические и химические свойства
Металлический магний обладает гексагональной кристаллической решеткой. Температура плавления 650°C, температура кипения 1105°C, плотность 1,74 г/см3 (магний — очень легкий металл, легче только кальций и щелочные металлы). Стандартный электродный потенциал магния Mg/Mg2+ –2,37В. В ряду стандартных потенциалов он расположен за натрием перед алюминием.
Поверхность магния покрыта плотной пленкой оксида MgO, при обычных условиях надежно защищающей металл от дальнейшего разрушения. Только при нагревании металла до температуры выше примерно 600°C он загорается на воздухе. Горит магний с испусканием яркого света, по спектральному составу близкого к солнечному. Поэтому раньше фотографы при недостаточной освещенности проводили съемку в свете горящей ленты магния. При горении магния на воздухе образуется рыхлый белый порошок оксида магния MgO:
Одновременно с оксидом образуется и нитрид магния Mg3N2:
C холодной водой магний не реагирует (или, точнее, реагирует, но крайне медленно), а с горячей водой он вступает во взаимодействие, причем образуется рыхлый белый осадок гидроксида магния Mg(OH)2:
Mg + 2H2O = Mg(OH)2 + H2.
Если ленту магния поджечь и опустить в стакан с водой, то горение металла продолжается. При этом выделяющийся при взаимодействии магния с водой водород немедленно загорается на воздухе. Горение магния продолжается и в атмосфере углекислого газа:
2Mg + CO2 = 2MgO + C.
Способность магния гореть как в воде, так и в атмосфере углекислого газа существенно усложняет тушение пожаров, при которых горят конструкции из магния или его сплавов.
Оксид магния MgO представляет собой белый рыхлый порошок, не реагирующий с водой. Раньше его называли жженой магнезией или просто магнезией. Этот оксид обладает основными свойствами, он реагирует с различными кислотами, например:
MgO + 2HNO3 = Mg(NO3)2 + H2O.
Отвечающее этому оксиду основание Mg(OH)2 — средней силы, но в воде практически нерастворимо. Его можно получить, например, добавляя щелочь к раствору какой-либо соли магния:
2NaOH + MgSO4 = Mg(OH)2 + Na2SO4.
Металлический магний при комнатной температуре реагирует с галогенами, например, с бромом:
При нагревании магний вступает во взаимодействие с серой, давая сульфид магния:
Если в инертной атмосфере прокаливать смесь магния и кокса, то образуется карбид магния состава Mg2C3 (следует отметить, что ближайший сосед магния по группе — кальций — в аналогичных условиях образует карбид состава СаС2). При разложении карбида магния водой образуется гомолог ацетилена — пропин С3Н4:
Mg2C3 + 4Н2О = 2Mg(OH)2 + С3Н4.
Поэтому Mg2C3 можно назвать пропиленидом магния.
В поведении магния есть черты сходства с поведением щелочного металла лития (пример диагонального сходства элементов в таблице Менделеева). Так, магний, как и литий, реагирует с азотом (реакция магния с азотом протекает при нагревании), в результате образуется нитрид магния:
Как и нитрид лития, нитрид магния легко разлагается водой:
Mg3N2 + 6Н2О = 3Mg(ОН)2 + 2NН3.
Сходство с литием проявляется у магния и в том, что его карбонат MgCO3 и фосфат Mg3(PO4)2 в воде плохо растворимы, как и соответствующие соли лития.
С кальцием магний сближает то, что присутствие в воде растворимых гидрокарбонатов этих элементов обусловливает жесткость воды. Как и в случае гидрокарбоната кальция (см. ст. Кальций), жесткость, вызванная гидрокарбонатом магния Mg(HCO3)2, — временная. При кипячении гидрокарбонат магния Mg(HCO3)2 разлагается и в осадок выпадает его основной карбонат — гидроксокарбонат магния (MgOH)2CO3:
2Mg(HCO3)2 = (MgOH)2CO3 + 3CO2 + Н2О.
Большое значение в органической химии имеют магнийорганические соединения, содержащие связь Mg—C. Особенно важную роль среди них играет так называемый реактив Гриньяра — соединения магния общей формулы RMgHal, где R — органический радикал, а Hal = Cl, Br или I. Эти соединения образуются в эфирных растворах при взаимодействии магния и соответствующего органического галоида RHal и используются для самых разнообразных синтезов.
Основная часть добываемого магния используется для получения различных легких магниевых сплавов. В состав этих сплавов, кроме магния, входят, как правило, алюминий, цинк, цирконий. Такие сплавы достаточно прочны и находят применение в самолетостроении, приборостроении и для других целей.
Высокая химическая активность металлического магния позволяет использовать его при магниетермическом получении таких металлов, как титан, цирконий, ванадий, уран и др. При этом магний реагирует с оксидом или фторидом получаемого металла, например:
2Mg + TiO2 = 2MgO + Ti.
2Mg + UF4 = 2MgF2 + U.
Широкое применение находят многие соединения магния, особенно его оксид, карбонат и сульфат.
Магний широко используют в медицине: служит надежным слабительным. Чистый оксид магния (жженая магнезия) применяется при повышенной кислотности желудочного сока, изжоге, отравлении кислотами. Пероксид магния – известное дезинфицирующее средство при желудочных расстройствах.
Статистика утверждает, что у жителей районов с более теплым климатом спазмы кровеносных сосудов встречаются реже, чем у северян. Известно, что внутривенные и внутримышечные вливания растворов некоторых солей магния снимают спазмы и судороги. Накопить в организме необходимый запас этих солей помогают фрукты и овощи (особенно богаты магнием абрикосы, персики, цветная капуста). В Азии, например, где пищевой рацион богаче магнием, атеросклероз и другие сердечные заболевания встречаются реже, чем в Европе или США. Английские врачи рекомендуют съедать ежедневно по четыре банана, чтобы покрывать примерно половину суточной потребности организма в магнии (она составляет 0,3-0,5 грамма).
Биологическая роль магния
Магний — биогенный элемент, постоянно присутствующий в тканях всех организмов. Он входит в состав молекулы зеленого пигмента растений — хлорофилла, участвует в минеральном обмене, активирует ферментные процессы в организме, повышает засухоустойчивость растений. С участием ионов Mg+ осуществляется биолюминесценция и ряд других биологических процессов. Широкое практическое применение находят магниевые удобрения — доломитовая мука, жженая магнезия и др.
В организм животных и человека магний поступает с пищей. Суточная потребность человека в магнии — 0,3-0,5 г. В организме среднего человека (масса тела 70 кг) содержится около 19 г магния. Нарушения обмена магния приводят к различным заболеваниям. В медицине применяют препараты магния — его сульфат, карбонат, жженую магнезию.
особенности химии магния и возможности использования его соединения в препаратах различных фармакотерапевтических групп
Выполнила:
Студентка 1 курса 7 факультета
Группы 31-Б
Олейниченко А. О.
Оглавление
Особенности химии магния 5
Физические свойства 6
Химические свойства 7
Физические и химические свойства 8
Использования соединений магния в препаратах различных фармакотерапевтических групп 12
Биологическая роль магния 12
Магний как лекарственное средство 13
Введение
Соединения магния были известны человеку очень давно. Магнезитом (по-гречески Magnhsia oliqV) называли мягкий белый, мылкий на ощупь минерал (мыльный камень, или тальк), который находили в районе Магнезии в Фессалии. При прокаливании этого минерала получали белый порошок, который стали именовать белой магнезией.
В 1695 Н.Гро, выпаривая минеральную воду Эпсомского источника (Англия), получил соль, обладавшую горьким вкусом и слабительным действием (MgSO 4 ·7H 2 O). Спустя несколько лет выяснилось, что при взаимодействии с содой или поташом эта соль образует белый рыхлый порошок, такой же, какой образуется при прокаливании магнезита.
В 1808 английский химик и физик Гемфри Дэви при электролизе слегка увлажненной белой магнезии с окисью ртути в качестве катода получил амальгаму нового металла, способного образовывать белую магнезию. Его назвали магнием. Дэви получил загрязненный металл, а чистый магний был выделен лишь в 1829 французским химиком Антуаном Бюсси (Bussy Antoine) (1794–1882).
Магний есть в кристаллических горных породах в виде нерастворимых карбонатов или сульфатов, а также (в менее доступной форме) в виде силикатов. Оценка его общего содержания существенно зависит от используемой геохимической модели, в частности, от весовых отношений вулканических и осадочных горных пород. Сейчас используются значения от 2 до 13,3%. Возможно, наиболее приемлемым является значение 2,76%, которое по распространенности ставит магний шестым после кальция (4,66%) перед натрием (2,27%) и калием (1,84%).
Большие области суши, такие как Доломитовые Альпы в Италии состоят преимущественно из минерала доломита MgCa(CO3)2. Там встречаются и осадочные минералы магнезит MgCO3, эпсомит MgSO4·7H2O, карналлит K2MgCl4·6H2O, лангбейнит K2Mg2(SO4)3.
Залежи доломита есть во многих других районах, в том числе в Московской и Ленинградской областях. Богатые месторождения магнезита найдены на Среднем Урале и в Оренбургской области. В районе г.Соликамска разрабатывается крупнейшее месторождение карналлита. Силикаты магния представлены базальтовым минералом оливином (Mg,Fe)2(SiO4), мыльным камнем (тальк) Mg3Si4O10(OH)2, асбестом (хризотил) Mg3Si2O5(OH)4 и слюдой. Шпинель MgAl2O4 относится к драгоценным камням.
Большое количество магния содержится в водах морей и океанов и в природных рассолах (см. ХИМИЯ ГИДРОСФЕРЫ). В некоторых странах именно они являются сырьем для получения магния. По содержанию в морской воде из металлических элементов он уступает только натрию. В каждом кубометре морской воды содержится около 4 кг магния. Магний есть и в пресной воде, обусловливая, наряду с кальцием, ее жесткость.
Магний всегда содержится в растениях, так как входит в состав хлорофиллов.
Особенности химии магния
Получение
Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl2 (бишофит), натрия NaCl и калия KCl. В этом расплаве электрохимическому восстановлению подвергается хлорид магния:
Разработан и другой способ получения магния — термический. В этом случае для восстановления оксида магния при высокой температуре используют кокс:
или кремний. Применение кремния позволяет получать магний из такого сырья, как доломит CaCO3·MgCO3, не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции:
2MgO + CaO + Si = Ca2SiO4 + 2Mg.
Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырье, но и морскую воду.
Физические свойства
Магний — очень легкий, довольно хрупкий металл, постепенно окисляется на воздухе, превращаясь в белый оксид магния. Кристаллическая решетка α-формы Ca (устойчивой при обычной температуре) гранецентрированная кубическая, а = 5,56Å. Атомный радиус 1,97Å, ионный радиус Ca2+, 1,04Å. Плотность 1,74 г/см³(20 °C). Выше 464 °C устойчива гексагональная β-форма. t пл = 650 °C, t кип = 1105 °C; температурный коэффициент линейного расширения 22•10-6 (0-300 °C); теплопроводность при 20 °C 125,6 Вт/(м•К) или 0,3 кал/(см•сек•°C); удельная теплоемкость (0-100 °C) 623,9 дж/(кг•К) или 0,149 кал/(г•°C); удельное электросопротивление при 20 °C 4,6•10-8 ом•м или 4,6•10-6ом•см; температурный коэффициент электросопротивления 4,57•10-3 (20 °C). Модуль упругости 26 Гн/м² (2600 кгс/мм²); предел прочности при растяжении 60 Мн/м² (6 кгс/мм²); предел упругости 4 Мн/м² (0,4 кгс/мм²), предел текучести 38 Мн/м² (3,8 кгс/мм²); относительное удлинение 50 %; твердость по Бринеллю 200—300 Мн/м² (20-30 кгс/мм²). Магний достаточно высокой чистоты пластичен, хорошо прессуется, прокатывается и поддается обработке резанием.
Химические свойства
С месь порошкового магния с перманганатом калия KMnO 4 — взрывчатое вещество! Раскаленный магний реагирует с водой:
Mg (раск.) + Н 2 О = MgO + H 2 ;
Щелочи на магний не действуют, в кислотах он растворяется легко с выделением водорода:
Mg + 2HCl = MgCl 2 + H 2 ;
При нагревании на воздухе магний сгорает, с образованием оксида, также с азотом может образовываться небольшое количество нитрида:
2Mg + О 2 = 2MgO;
3Mg + N 2 = Mg 3 N 2
Магний хорошо горит даже в углекислом газе:

Металлический магний — сильный восстановитель, применяется в промышленности для восстановления титана до металла из тетрахлорида титана и металлического урана из его тетрафторида

Физические и химические свойства
Магний – серебристо-белый блестящий металл, сравнительно мягкий и пластичный, хороший проводник тепла и электричества. На воздухе он покрывается тонкой оксидной пленкой, придающей ему матовый цвет. Кристаллическая решетка магния относится к гексагональной системе.
Атомный радиус, Å 1,6
Радиус иона Mg2+, Å 0,74
Энергия ионизации, эв, для Mg0 ® Mg+ 7,64
для Mg+ ® Mg2+ 15,03
Плотность (20 oC), г/см3 1,739
Температура плавления., oC 651
Температура кипения, oC 1107
Теплота плавления, кал/г-атом 2100
Теплота испарения, кал/г-атом 31000
Теплота возгонки (при 25 oC), кал/г-атом 35000
Удельная теплоемкость (20 oC), кал/г-град 0,248
Теплопроводность (20 oC), кал/смсек. град 0,37
Удельное электрическое сопротивление, Омсм 4,510-6
Поперечное сечение захвата тепловых электронов, барн 0,059
Электропроводность (Hg=1) 22
При нагревании магний взаимодействует с галогенами с образованием галогенидов; при 500–600 oC при взаимодействии с серой образуется MgS; при более высокой температуре возможно образование карбидов MgC2 и Mg2C3, силицидов MgSi и Mg3Si2, фосфида Mg3P2.Нормальный электродный потенциал магния в кислой среде составляет -2,37 в, в щелочной -2,69 в. Магний – сильный восстановитель, может вытеснить большин-ство металлов из их солей, H2 из воды и кислот.Холодная вода на магний почти не действует, с горячей водой он медленно взаимо-действует с выделением водорода. В разбавленных кислотах магний растворяется даже на холоду. В HF магний не растворяется, поскольку на поверхности образуется пленка из труд-но растворимого в воде MgF2; в концентрированной H2SO4 почти не растворяется.Нормальный потенциал магния равен -2,37 в (в кислой среде) и -2,69 в (в щелочной среде).Поэтому оба металла должны были бы разлагать воду. Однако при обычной темпера-туре такое разложение практически не происходит. Обусловлено это малой растворимостью оксида магния, образующего защитный слой на поверхности металла.С водным раствором аммиака магний почти не реагирует, зато он растворим при дей-ствии на него растворов солей аммония. Реакция в этом случае идет по схеме 2NH4++Mg=Mg2++H2+2NH3.Растворы щелочей на магний не действуют.
Использования соединений магния в препаратах различных фармакотерапевтических групп
Биологическая роль магния
В человеческом организме количество магния составляет всего несколько десятых или сотых долей процента, однако он играет немаловажную роль в процессах жизнедеятельности. Доказано, что недостаток магния в организме способствует заболеванию инфарктом миокарда. Недостаточное количество магния в крови – признак переутомления или стрессового состояния.
Основные продукты, содержащие магний – это абрикосы, персики, цветная и белокочанная капуста, помидоры, картофель.
Потребность взрослого организма в магнии составляет 300–500 мг/день. Обычно магний в достаточном количестве поступает с пищей, в случае нехватки его недостаток проще всего восполнить, потребляя минеральную воду. В организме усваивается менее 40% поступающего в него магния, так как его соединения плохо всасываются кишечником. Магний усиливает процессы обмена углеводов в мышцах, укрепляет кости; если в организме нарушено магние-кальциевое равновесие, то почти весь магний включается в состав костных тканей, вытесняя оттуда кальций. Это ведет к заболеванию рахитом.
В нервной системе также содержатся большие количества магния, особенно в спинном мозге. Большое значения магния для деятельности нервной системы подтверждается тем, что при инъекции магния в кровь человек или животное впадает в состояние, близкое к наркотическому. Это свойство магния используется в медицине.
В организмах некоторых животных содержание магния сравнительно высоко. Так, например, в организме известковой губки содержится 4% магния, в талломе некоторых водорослей – больше 3%.
Магний входит в состав хлорофилла и, следовательно, играет незаменимую роль в фотосинтезе и в газообмене планеты; общее содержание магния в тканях растений на Земле по некоторым оценкам составляет порядка 10 11 тонн.
Кроме хлорофилла, магний во всех тканях растений участвует также в образовании жиров, в превращении фосфорных соединений. Особенно много магния в соке каучуконосных растений. Нехватка магния приводит к уменьшению количества хлорофилла и к побледнению и смене окраски листьев на красную и желтую.
Магний как лекарственное средство
Английская соль (MgSO47H2O) используется как слабительное и желчегонное средство. При инъекциях она вызывает состояние, близкое к наркотическому, и используется для борьбы с судорогами, для лечения гипертонии, психического возбуждения; в сочетании с другими препаратами – для обезболивания при родах.
Водные растворы тиосульфата магния используются для лечения ожогов и других заболеваний кожи.
Белая магнезия (MgCO3) входит в состав зубных порошков и присыпок; кроме того, она уменьшает кислотность желудочного сока.
Жженая магнезия (MgO) тоже нейтрализует желудочный сок. Кроме того, она применяется внутрь при кислотных отравлениях.
Заключение
Магний – один из жизненно необходимых нашему организму химических элементов, он принимает активное участие более чем в трехстах пятидесяти ферментативных реакциях.
Роль магния для здоровья человека переоценить сложно, ведь он является составной частью абсолютно всех тканей и клеток организма человека.
Магний участвует в таких процессах жизнедеятельности организма, как:
- образование новых клеток;
- укрепление нервной системы;
- здоровая работа почек;
- формирование и укрепление костей и зубов;
- тонус и работа мышц.
Также магний активизирует усвоение витаминов группы В и витамина С, поддерживает нормальный уровень кальция.
Чтобы понять степень необходимости присутствия этого минерала в нашем организме, достаточно посмотреть, к чему приводит недостаток магния. Вот перечень лишь основных заболеваний, связанных с дефицитом магния в организме человека:
- депрессия, повышенная тревожность, быстрая утомляемость, физическая и психологическая усталость, бессонница;
- негативные изменения внутричерепного и артериального давления;
- появление заболеваний сердечнососудистой системы;
- нарушение концентрации внимания, проблемы с памятью;
- мышечные спазмы, судороги, онемение конечностей;
- постоянные головные боли, мигрень;
- разрушение зубных тканей, кариес, выпадение зубов;
- ломкость и выпадение волос.
Магний так необходим нашему организму, что создается обманчивое впечатление, что чем больше этого вещества, тем лучше. Однако, это совсем не так. Избыток магния не менее опасен, чем недостаток. Как правило, передозировка магния возникает в случае неправильного и чрезмерного приема магнийсодержащих препаратов. Определить переизбыток магния довольно сложно, это можно сделать только в медучреждениях при помощи анализов и рентгена. Однако видимыми симптомами избытка магния могут служить постоянная тошнота, диарея, вялость, нарушения сердечного ритма.
Оптимальной суточной дозой магния принято считать:
Для мужчин 20-40 лет – 400 мг, после 40 лет – 420 мг.
Для женщин 20-50 лет – 300 мг, после 50 лет – 280 мг.
Это общие рекомендации, но у каждого конкретного организма своя потребность в магнии. Так, для спортсменов, кормящих женщин и подростков потребность в магнии увеличивается.
Человек получает магний с водой и пищей, а также с солью и некоторыми минеральными водами. Магнием богаты орехи (миндаль, арахис), кунжут, семечки, бобовые (фасоль, чечевица), крупы (гречневая, овсяная, пшенная, перловая), бананы, тыква, отруби и какао. Кроме того магний содержится в морской капусте, морской рыбе, кальмарах, яйцах, зелени, цитрусовых и в свежих молочных продуктах.
О том, что для организма человека очень полезен такой химический элемент, как магний, сейчас говорят часто. Этот микроэлемент является основным действующим веществом различных лекарств и входит в состав многих поливитаминов. Но также один из видов вещества применяется в металлургии. Неудивительно, что в настоящее время ведётся активная добыча этого представителя периодической таблицы Менделеева.
- История открытия
- Определение и физическая характеристика
- Химические свойства
- Нахождение в природе
- Получение в промышленности
- Применение вещества
- Магний в организмах
- Переизбыток и недостаток

История открытия
Новая эра развития химии началась в XVII веке. В этот период химик из Англии по фамилии Гро совершил открытие, приблизившее учёных к выделению магния. В 1695 г. во время выпаривания эпсомской минеральной воды он получил горькую соль, обладавшую свойством слабительного.
Через несколько лет исследования показали, что взаимодействие вещества с содой и карбонатом калия даёт белый рыхлый порошок. Этот же результат был получен во время прокаливания минерала, который был найден рядом с городом Магнезия в Греции. Из-за этого сходства соль стали назвать белой магнезией.
Следует отметить, что реактив имел различные примеси. Чистый элемент в 1829 г. вывел французский химик Антуан Александр Брутус Бюсси.
Определение и физическая характеристика
Вещество является представителем II группы периодической системы химических элементов.
Ему можно дать следующую характеристику:
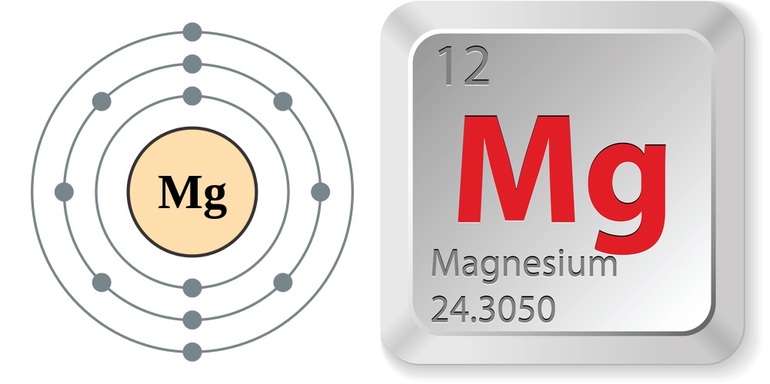
- Магний принято обозначать Mg.
- Атомный номер вещества 12.
- Молярная масса элемента составляет 24,305 атомных единиц.
- Заряд ядра равен 12.
- В каждом атоме число электронов — 12.
- Кристаллическая решётка вещества имеет α-форму Ca гранецентрированная кубическая. Она отличается устойчивостью при обычной температуре.
- Плотность — 1,738 г/см³.
- Плавится металл при температуре 650 °C.
- Кипит вещество при 1090 °C.
- Чистый элемент отличается пластичностью. Его можно легко прессовать, прокатывать и резать.
Реагент в компактном состоянии представляет собой блестящий металл серебристо-белого цвета. Под воздействием воздуха он тускнеет, так как на поверхности образуется плёнка окиси.
Горит металлический реагент ослепительным пламенем белого цвета. Скорость, с которой вспыхивает вещество, во много раз превосходит скорость одёргивания руки. Из-за этого физического свойства магния человеку, поджигающему элемент, необходимо соблюдать все положенные правила техники безопасности. В противном случае, он получит серьёзный ожог кожи. Для наблюдения за процессом горения следует использовать тёмные очки или стекло. Без этих мер предосторожности повышает риск получения ожога сетчатки, который приводит к временной слепоте.
Химические свойства
Все стабильные соединения элемента имеют валентность равную двум, а электронная формула магния или схематичное строение его атома имеет вид: 1s2 2s2 2p6 3s2.

Даже при нагревании до 350 °C компактный магний подвергается незначительному окислению, поскольку он покрыт оксидной плёнкой. Горит реагент при температуре от 600 до 650 °C, при этом образуются оксид и нитрит элемента. Нитрит также можно получить, нагрев вещество до 500 °C в азотной среде.
Элемент относится к активным веществам. Кроме того, выделяют следующие химические свойства магния:

- Не вступает в реакцию с холодной водой, которая не насыщена воздухом.
- Постепенно вытесняет водород из кипятка.
- С водяным паром реагирует при температуре не ниже 400 °C.
- В жидком виде выделяет из влажного воздуха водород, поглощая его.
- Застывая, элемент практически полностью выводит водород.
- При нагревании водородной атмосферы до 400−500 °С вещество вступает в реакцию с ней, образуя гидрид магния.
- Вытесняет большую часть металлических элементов из растворов их солей, образованных на основании воды.
- В холодных условиях, соединяясь с влажным хлором, образует хлорид магния.
- В нагретом состоянии вступает в реакцию с галогенами.
- Большая часть солей элемента хорошо растворяется в воде.
- При контакте с едкими щелочами выпадает осадок, образованный из растворов солей магния.
- При пониженной температуре не вступает в реакцию с водными щелочными растворами, но подвержен растворению в гидрокарбонатах щелочных металлических реагентов и аммониевых солей.
- Не растворяется в концентрированной серной кислоте.
- От растворения в плавиковой кислоте защищён плёнкой из устойчивого фторида.
- Взаимодействует с разбавленными минеральными кислыми соединениями при низких температурах.
Реагент представляет собой сильный восстановитель. Нагретый магний вытесняет некоторые металлы и неметаллы из оксидов и галогенидов. Существует множество металлоорганических соединений вещества, которые делают его одним из важнейших элементов органического синтеза.
Реагент легко создаёт сплавы со многими металлами, а потому на нём основывается производство множества очень важных лёгких материалов.
Нахождение в природе
Земля очень богата магнием. Всего шесть химических реагентов встречаются в природе чаще, чем это вещество. Большая часть элемента находится в мантии планеты, в земной коре его меньше. Чаше всего его обнаруживают в основных породах и граните. И также элемент содержится в различных минералах, образованных магмой.
В основном чистый магний добывают из трёх минералов:
- карналлита;
- доломита;
- магнезита.

В России самые большие залежи магнезита находятся на Среднем Урале и в Оренбургской области. Карналлит добывается около города Соликамска, следует отметить, что это месторождение самое крупное в мире. Наиболее распространённый минерал доломит встречается в Московской и Ленинградской областях, а также других регионах страны.
В биологической среде планеты соединения магния постоянно перемещаются и изменяются. Лишь малая часть элемента задерживается в круговороте веществ, происходящем на материках, большое количество реагента уносится реками в океан. Несмотря на то что по содержанию в морской воде магний уступает только натрию, непосредственно сама жидкость не имеет насыщения элементом, а его соли в открытом океане не выпадают в осадок.
Вещество в составе различных соединений накапливается в солях, остающихся после того, как из лагун испаряется вода.
Получение в промышленности
В промышленных условиях для получения магния чаще всего применяют электролиз безводного хлорида или обезвоженного карналлита. Процесс проходит следующим образом:

- Электролиз проходит при температуре от 720 до 750 °C.
- По мере выделения элементов состав ванны корректируется, часть электролита при этом удаляется, а сырьё добавляется.
- Расплавленный искомый металл всплывает на поверхность, и его регулярно извлекают.
- Полученное вещество содержит много примесей. Для очистки элемент проходит рафинирование в специальных печах под слоем флюсов.
- Очищенный металл разливают в изложницы.
- Следующая очистка заключается в том, что реагент сублимируют несколько раз в вакууме.
Кроме этого метода, на производстве применяются металлотермический и углетермический способы получения магния. В первом случае брикеты из раскалённого и разложившегося доломита смешивают с восстановителем и нагревают в вакууме при температуре 1300 °C. Полученные в результате магниевые пары образуют конденсат, когда температура опускается до 400−500 °С. Чтобы очистить металл, применяют переплавку под флюсом или в вакууме. Чистый элемент разливают в изложницы.
При использовании второго метода брикеты, состоящие из угля и магниевой окиси, разогревают в электрических печах до 2100 °C. Превратившийся в пар металл отгоняют и конденсируют.
Также вещество добывают из морской воды. Для этого сырьё в очень больших баках смешивают с суспензией гидроксида кальция, который получают, перемалывая морские раковины. В результате происходящей химической реакции образуется особая суспензия, которая после высыхания становится хлоридом магния. После этого продукт подвергают электролитическим процессам.
Кроме морской воды, для выгонки магния может использоваться вода некоторых соленых озер. В Российской Федерации такие озёра находятся в Крыму, Поволжье и других регионах.
Применение вещества
Наибольшее количество металла потребляет металлургия. На его основе создаётся множество сплавов. Часто вещество используют в металлотермических процессах, чтобы получить редкие металлы, а также те, которые трудно восстановить. Применяется реагент для раскисления и десульфурации металлических веществ. Различные порошковые смеси на основе магния используются в качестве осветительных и зажигательных.
Соединения, содержащие реагент, нашли широкое применение в различных сферах жизнедеятельности. К примеру, в медицине, лекарства с магнием позволяют избавить пациентов от спазмов и судорог, успокоить нервы и так далее.
Магний в организмах
Магний содержится во всех растениях и животных. Вещество концентрируется в некоторых морских организмах. Максимальное количество металлического элемента содержится в известковых губках — до 4%.
Люди и животные получают металлический элемент с пищей. Суточная норма потребления для человека составляет от 0,3 до 0,5 г. У детей и беременных женщин потребность в веществе несколько выше. У здорового человека в крови должно содержаться около 4,3 мг/% магния. В организме основным потребителем реагента является печень, но большая часть поглощённого ею металла постепенно переходит в кости и мышцы.
Переизбыток и недостаток
Магний практически безвреден для организма, хотя некоторым его соединениям и присвоен II класс опасности. В основном же металл в разных видах приносит лишь пользу. А страдают люди, животные и растения чаще всего от недостатка или переизбытка вещества.
Когда металла в организме слишком мало, увеличивается риск развития сахарного диабета, болезней почек и кишечника. У людей, страдающих от недостатка микроэлемента, часто болит голова, начинается бессонница, появляются спазмы мышц, быстро наступает утомление. При отсутствии лечения это может привести к различным более серьёзным заболеваниям, повышается возможность заболеть раком.

Прежде чем приступать к восстановлению уровня вещества в организме, необходимо проконсультироваться с врачом и установить степень потребности в веществе. После сдачи анализов доктор назначит переменный или постоянный на протяжении какого-то времени приём соответствующих лекарственных препаратов, принимать которые следует строго по инструкции.
При переизбытке микроэлемента у людей появляются следующие болезни:
- артрит;
- нарушение речи;
- тошнота;
- сонливость;
- и так далее.
Когда в почве содержится недостаточное количество вещества, у растений начинается мраморность листвы и хлороз. Отсутствие магния в рационе вызывает у крупного рогатого скота травяную тетанию.
Магний относится к жизненно необходимым микроэлементам. Сложно переоценить роль этого вещества в животных и растительных организмах. Его отсутствие в достаточном количестве способно возбудить множество заболеваний.
| Вложение | Размер |
|---|---|
| magniy.doc | 89.5 КБ |
| prezentaciya_-_magniy.ppt | 1.12 МБ |
Предварительный просмотр:
XXXX городская научно-творческая конференция
Удивительные свойства магния
Выполнил: Харитонов Андрей,
учитель химии Щербатых Н.В.
2. Теоретическая часть 4
2.1. История открытия магния 4
2.2. Физические свойства магния 6
2.3. Химические свойства магния 6
2.4. Применение магния 7
2.5. Занимательные факты о магнии 10
3. Практическая часть 12
3.1. Горение магния в воде 12
3.2. Горение магния в оксиде кремния (IV) 12
3.3. Горение магния в углекислом газе………………………………………12
3.4. Взаимодействие магния с нитратом серебра 12
3.5. Горение магния в кислороде 13
Список литературы 15
Объектом нашего исследования является магний.
Цель работы: рассмотреть историю открытия магния, его физические и химические свойства, его применение . В условиях школьной химической лаборатории проделать ряд занимательных опытов, характеризующих свойства магния и снять учебный видеоролик, посвященный магнию.
2. Теоретическая часть
2.1. История открытия магния
Первые попытки выделить металлическую основу магнезии в чистом виде были предприняты в начале XIX в. знаменитым английским физиком и химиком Гемфри Дэви (1778–1829), после того, как он подверг электролизу едкий кали и едкий натр и получил металлический Na и K. Он решил попытаться аналогичным образом осуществить разложение оксидов щелочноземельных металлов и магнезии. В своих первоначальных опытах Дэви пропускал ток через влажные оксиды, предохраняя их от соприкосновения с воздухом слоем нефти; однако при этом металлы сплавлялись с катодом и их не удавалось отделить.
Дэви пробовал применять множество различных методов, но все они по разным причинам оказывались малоуспешными. Наконец, его постигла удача – он смешал влажную магнезию с оксидом ртути, поместил массу на пластинку из платины и пропустил через нее ток; амальгаму перенес в стеклянную трубку, нагрел, чтобы удалить ртуть, и получил новый металл. Тем же способом Дэви удалось получить барий, калий и стронций. Выделив металлическую основу, Дэви назвал новый металл magnium, так как считал, что слово magnesium легко спутать с manganese, то есть с марганцем. Тем не менее название magnesium вошло в употребление во многих языках, так что новый металл лишь короткое время был известен под названием, которое дал
ему Дэви. Правда, русское название этого металла звучит очень сходно с первоначальным.
В компактной форме и в ощутимых количествах магний был впервые получен в 1828 г. Антуаном Александром Брутом Бусси (1794–1882) путем нагревания смеси безводного MgCl 2 c калием в стеклянной трубке. В результате реакции калий соединился с хлором, вытесняя магний с образованием KCl и Mg. С этих опытов начался первый этап металлургии магния, который был полностью основан на химических методах. По технологии, сходной с методом Брута Бусси, во Франции, Англии и Соединенных Штатах работали небольшие заводы, производившие металлический магний. Такое производство существовало до конца прошлого века, пока не был создан электролитический способ получения магния. Конкурировать с ним химический способ не смог, поскольку использовал дорогостоящие восстановители – металлический натрий и калий, кроме того, при химическом способе не удавалось создать периодический технологический процесс.
В 1830 г. Майкл Фарадей получил несколько граммов металлического магния путем пропускания электрического тока через расплав MgCl 2 . В 1852 г. этот метод был детально исследован и усовершенствован Робертом Бузеном (1811–1897), который также осуществил первое массовое производство магния. С помощью его электролизера, состоящего из фарфорового тигля и двух угольных электродов пилообразной формы, погружаемых сверху в расплав обезвоженного MgCl 2 , ему удавалось всего за несколько секунд получать “королек” магния весом в несколько грамм. Пилообразная форма электродов была необходима для удержания капелек магния во избежание их подъема на поверхность и самовоспламенения. При этом принципиальное значение для повышения производительности играла полная обезвоженность MgCl 2 .
Технология электролитического получения магния за время своего применения подверглась значительным усовершенствованиям, однако ее принципы, естественно, остались без кардинальных изменений.
2.2. Физические свойства магния
Магний - серебристо-белый блестящий металл, сравнительно мягкий и пластичный, хороший проводник тепла и электричества. Почти в 5 раз легче меди, в 4,5 раза легче железа; даже алюминий в 1,5 раза тяжелее магния. Плавится магний при температуре 651 о С, но в обычных условиях расплавить его довольно трудно: нагретый на воздухе до 550 о С он вспыхивает и мгновенно сгорает ослепительно ярким пламенем. Полоску магниевой фольги легко поджечь обыкновенной спичкой, а в атмосфере хлора магний самовозгорается даже при комнатной температуре. При горении магния выделяется большое количество ультрафиолетовых лучей и тепла - чтобы нагреть стакан ледяной воды до кипения, нужно сжечь всего 4 г магния. Магний расположен в главной подгрупп второй группы периодической системы элементов Д.И. Менделеева. Порядковый номер его - 12, атомный вес - 24,312. Электронная конфигурация атома магния в невозбужденном состоянии 1S 2 2S 2 P 6 3S 2 ; валентными являются электроны наружного слоя, в соответствии с этим магний проявляет валентность II. В тесной связи со строением электронных оболочек атома магния находится его реакционная способность. Из-за наличия на внешней оболочке только двух электронов атом магния склонен легко отдавать их для получения устойчивой восьмиэлектронной конфигурации; поэтому магний в химическом отношении очень активен. На воздухе магний окисляется, но образующаяся при этом окисная пленка предохраняет металл от дальнейшего окисления. В разбавленных кислотах магний растворяется уже на холоде. Во фтористо-водородной кислоте нерастворим вследствие образования пленки из труднорастворимого в воде фторида MgF 2 ; в концентрированной серной кислоте почти нерастворим. Магний легко растворяется при действии растворов солей аммония. Растворы щелочей на него не действуют. Магний поступает в лаборатории в виде порошка или лент. Если поджечь магниевую ленту, то она быстро сгорает с ослепительной вспышкой, развивая высокую температуру. Температура кипения магния 1107 о С, плотность = 1,74 г/см 3 , радиус атома 1,60 НМ.
2.3. Химические свойства магния
Магний - активный металл. Если разрушить оксидную пленку на его поверхности, он легко окисляется кислородом воздуха. При нагревании магний энергично взаимодействует с галогенами, серой, азотом, фосфором, углеродом, кремнием и другими элементами:
2 Мg + O 2 = 2 МgО (оксид магния);
Мg + Сl 2 = МgСl 2 (хлорид магния);
3 Mg + N 2 = Мg 3 N 2 (нитрид магния);
3 Мg + 2 Р= Мg 3 Р 2 (фосфид магния);
2 Мg + Si = Мg 2 Si (силицид магния).
Магний не растворяется в воде, однако, при нагревании довольно активно взаимодействует с парами воды:
Мg + Н 2 О = Мg(ОH) 2 + Н 2 .
Магний легко отнимает кислород и галогены у многих металлов, поэтому его используют для получения редких металлов из их соединений:
3Мg + МоО 3 = 3 МgО + Мо;
2Мg + ZrСl 4 = 2 МgСl 2 + Zr.
Он горит в атмосфере углекислого газа:
Мg + СО 2 = МgО+ СО или 2 Мg + СО 2 = 2 МgО + С
и хорошо растворяется в кислотах:
Мg + Н 2 SO 4 = МgSО 4 + Н 2 ;
4 Мg + 10 НNО 3 = 4 Мg(NО 3 ) 2 + N 2 O + 5 Н 2 О.
2.4. Применение магния
Свойство магния (в виде порошка, проволоки или ленты) – гореть белым ослепительным пламенем – широко используется в военной технике для изготовления осветительных и сигнальных ракет, трассирующих пуль и снарядов, зажигательных бомб. Так, например, алюминиевомагниевый сплав электрон , который применяли во время второй мировой войны для изготовления корпусов зажигательных авиабомб, содержал не менее 90% магния. Сигнальные составы обязательно содержат магний. Примеры двух нитратных составов зеленого огня:
1. Нитрат бария -40%, магний-28%, гексахлорбензол -30%, льняное масло -20%
2. Нитрат бария -59%, магний-19%, поливинилхлорид -22%
И еще в одной грандиозной работе – аккумуляции солнечной энергии – участвует магний. Он входит в состав хлорофилла, который поглощает солнечную энергию и с ее помощью превращает углекислый газ и воду в сложные органические вещества (сахар, крахмал и др.), необходимые для питания человека и животных. Без хлорофилла не было бы жизни, а без магния не было бы хлорофилла – в нем содержится 2% этого элемента. Много ли это? Судите сами: общее количество магния в хлорофилле всех растений Земли составляет около 100 млрд т! Элемент №12 входит и в состав практически всех живых организмов. Если вы весите 60 кг, то приблизительно 25 г из них приходится на магний.
2.5. Занимательные факты о магнии
Сырье на мостовой
При желании магний можно добывать даже из. простого булыжника: ведь в каждом килограмме камня, используемого для мощения дорог, содержится примерно 20 г магния. В таком процессе, правда, пока нет необходимости - магний из дорожного камня был бы слишком дорогим удовольствием.
Магний, секунда и эра
Вкусные лекарства
Статистика утверждает, что у жителей районов с более теплым климатом спазмы кровеносных сосудов случаются реже, чем у северян. Медицина объясняет это особенностями питания тех и других. Ведь известно, что внутривенные и внутримышечные вливания растворов некоторых солей магния снимают спазмы и судороги. Накопить в организме необходимый запас этих солей помогают фрукты и овощи. Особенно богаты магнием абрикосы, персики и цветная капуста. Есть он и в обычной капусте, картофеле, помидорах.
Магний и. инфаркт
Берегите магний!
3. Практическая часть
3.1. Горение магния в воде
В 1808 г английский химик Гемфри Дэви первым получил металлический магний. В то время о свойствах этого металла не было известно ничего. Когда кусочки полученного магния случайно загорелись Дэви стал тушить их водой. Последовала вспышка, опалившая ему лицо.
Попробуем повторить опыт Дэви, но обезопасим себя, надев очки и защитный халат.
Зажжем в металлической ложечке немного порошка магния и быстро опустим ложечку с горящим магнием в воду. Как только горящий магний коснется воды, она забурлит. Водород, выбрасываемый водой, может вспыхнуть и гореть над ее поверхностью. Магний в воде горит ярким пламенем, а вода вокруг него мутнеет.
Горящий магний разлагает воду, превращаясь в гидроксид магния, выделяющийся водород воспламеняется.
Mg + 2 H 2 O = Mg(OH) 2 + H 2
3.2. Горение магния в оксиде кремния (IV)
Горящий магний нельзя потушить ни водой, ни песком. Ведь песок, так же как и вода, будет взаимодействовать с горящим магнием с образованием оксида магния и аморфного кремния.
В пробирку насыпем смесь оксида кремния (IV) и магния. Пробирку закрепим в лапке штатива. Нагреем содержимое пробирки. Через некоторое время будем наблюдать появление огня в пробирке и изменение цвета смеси.
SiO 2 + 2 Mg = Si + 2MgO
3.3. Горение магния в углекислом газе
Когда при случайном возгорании магниевой ленты этого металла ее пытаются затушить «углекислотным огнетушителем, то ничего хорошего из этого не получается. Удивительно, но этот металл продолжает пылать и в углекислом газе, который, как известно, не поддерживает горение.
Посмотрим как это происходит. Стеклянную колбу наполним оксидом углерода (IV). Для этого в колбу насыпем карбонат кальция ,нальем соляной кислоты и закроем пробкой с газоотводной трубкой, конец которой опустим в пустую колбу.
CaCO 3 + 2 HCl = CaCl 2 + CO 2 + H 2 O
Затем порошок магния поместим в железную ложечку и нагреем в пламени спиртовки. Как только магний загорается, помещаем его в колбу с углекислым газом. И что же? Магний продолжает гореть.
2 Mg + CO 2 = 2 MgO + C
3.4. Взаимодействие магния с нитратом серебра
Насыпали на огнеупорную поверхность смесь мелко растертого нитрата серебра и магниевой стружки (или порошка). Общая масса веществ - порядка 0.5 гр. Сверху на горку смеси капнули одну капельку теплой воды. Практически сразу произошла ослепительная вспышка. На замедленной съемке опыта видно, что в первый момент реакции происходит выделение черного металлического серебра, затем бурого дыма NO 2 , дальше следует яркая вспышка. После реакции остается смесь черных частичек серебра и белых окиси магния. Реакцию можно условно выразить уравнением:
3Mg + AgNO 3 = 3MgO + 0.5N 2 + Ag
3.5. Взаимодействие магния с кислородом
Как и любой металл магний реагирует с кислородом. Получим кислород разложением перманганата калия. В пробирку насыпаем кристаллический перманганат калия. Закрепляем в лапке штатива. Закроем пробирку пробкой с газоотводной трубкой. Конец которой опустим в чистую пробирку. При нагревании перманганат калия начинает разлагаться, выделяющийся кислород поступает по газоотводной трубке в колбу. Кислород тяжелее воздуха, поэтому не покидает колбу и постепенно заполняет ее.
2 KMnO 4 = K 2 MnO 4 + MnO 2 + O 2 ↑
Закрываем пробирку с кислородом пробкой.
Подожжем порошок магния на пламени спиртовки.
В воздухе металл горит. В атмосфере кислорода магний вспыхивает ослепительным белым пламенем. При горении магния выделяются ультрафиолетовые лучи.
Продукт горения магния – белый порошкообразный оксид.
При горении магния выделяется большое количество теплоты, поэтому магний может сам себя разогреть до высоких температур. Для этого необходимо только достаточное количество металла.
В результате проделанной работы я познакомился с физическими и химическими свойствами магния. Узнал много интересного из истории его открытия и применения. Познакомился с правилами техники безопасности при работе с химическими веществами. В условиях школьной химической лаборатории проделал многочисленные опыты с магнием. Снял фильм об удивительных свойствах магния и сделал учебный видеоролик в программе “Vegas Pro”.
- Большая энциклопедия Кирилла и Мефодия 2005г.
- Химическая энциклопедия в пяти томах: т.4 -М.:Советская энциклопедия, 1988
- Б.Д.Степин Л.Ю. Аликберова Книга по химии для домашнего чтения. М.: Химия, 1995
Гроссе Э., Вайсмантель X.Химия для любознательных. Основы химии и занимательные опыты.2-е русское изд. - Л.: Химия, 1985. -- Лейпциг, 1974.
Перевод с немецкого Л. Н. Исаевой под ред. Р. Б. Добротина (гл. 1-3) и А. Б. Томчина (гл. 4-8)
© Urania-Verlag Leipzig-Jena-Berlin. Verlag fur popularwissenchaftliche Literatur. Leipzig, 1968
© Перевод на русский язык, Издательство "Химия", 1978
OCR and Spellcheck Афанасьев Владимир
Читайте также:

