Реферат физико химические свойства газа
Обновлено: 05.07.2024
Данный реферат раскрывает физико-химические свойства газов, освещая, во-первых, основные параметры газов с приведением расчетных формул для их нахождения, а именно: плотность, удельный объем, массовый расход, линейную скорость, массовую скорость, давление, вязкость, влажность, сжимаемость, а также критические параметры; во-вторых, такие термодинамические свойства газов, как теплоемкость системы, теплопроводность, теплота сгорания, рассмотрят процесс дросселирования; в-третьих, токсичные и теплотворные свойства природных газов. В работе также приводятся графики и номограммы для определения тех или иных свойств.
Задачей является изучение физических параметров газа, его термодинамические и тепловые свойства, обусловленные химическим составом; изучение токсических свойств и их возможное влияние на организм человека; получение практических знаний и умений в нахождении того или иного параметра газа, исходя из расчетных формул и справочных материалов; закрепить и углубить изученный ранее материал.
1. Физико химические свойства горючих газов. Горение углеводородов и их тепловой эффект.
Ацетилен – согласно ГОСТ 5191-79 обозначается буквой А
Ацетилен – один из основных горючих газов, применяемых при газовой резке и сварке металлов, химическая формула С2Н2.
Технический ацетилен (с примесями) обладает специфичным резким неприятным запа-хом, вызванный содержащимися в нем примесями сернистого водорода, фосфористого водо-рода, аммиака и т. д. Длительное вдыхание его вызывает тошноту, головокружение и даже отравление. Ацетилен обладает наркотическим действием.
Газообразный ацетилен легче воздуха и накапливается в высших точках слабо проветри-ваемых помещений, где возможно образование ацетилено-воздушной смеси. С воздухом и кислородом ацетилен образует взрывоопасные смеси.
Ацетилен обладает способностью самовоспламеняться в чистом виде (термический рас-пад ацетилена) и в смеси с воздухом, температура самовоспламенения – 335 оС. При длительном соприкосновении ацетилена с медью и серебром образуются взрывоопасные соединения.
Пропан-бутановая смесь – согласно ГОСТ 5191-79 обозначается буквой П.
Пропан-бутан – смеси искусственных газов пропана С3Н8 – до 30% и бутана С4Н10 – до 70%, присутствуют, кроме того, в небольших количествах некоторые другие газы. Легко сжижаем, хранится в баллонах в сжиженном состоянии.
Пропан-бутановые смеси значительно тяжелее воздуха, поэтому при утечке они скапли-ваются внизу над полом помещения и во всевозможных углублениях, что может привести к образованию взрывоопасных концентраций.
Природный газ (метан) – в соответствии с ИСО 5175-87 обозначается буквой М
Природный газ представляет собой смесь различных углеводородов с преимуществен-ным содержанием метана СН4 (до 90 – 98 % по объему), не имеет цвета, обладает легким за-пахом чеснока и токсичными удушающими свойствами, в два раза легче воздуха, поэтому при утечках скапливается в верхней части помещения.
Горение углеводородов развивается по типу сильно разветвленной и потому крайне быстрой цепной реакции, и чем сложнее молекула углеводорода, тем большее число элементарных актов составляет цепь и образуется больше разнообразных промежуточных продуктов. Химизм сгорания сложных углеводородов и их смесей изучен очень мало. Тем не менее накоплен большой экспериментальный материал, позволяющий во многих случаях управлять процессом горения, вести инженерные расчеты тепловых двигателей и разрабатывать мероприятия по повышению эффективности использования топлива.
Горение углеводородов идет, как показывают исследования, тоже с образованием промежуточных продуктов - гидроксила, формальдегида и метилового спирта и, кроме того, связано с термическим разложением ( крекингом) углеводородов с выделением сажистого углерода, придающего пламени светящийся характер.
Горение углеводородов представляет собой Свободнорадикальное цепное замещение молекулярным кислородом с последующими сложными превращениями.
Горение углеводородов имеет еще более сложный механизм, чем горение окиси углерода и водорода. Для реакций горения углеводородов характерен большой период индукции, исчисляемый минутами и даже часами. Наличие его объясняется тем, что наряду с образованием цепей происходит и их обрыв.
Горение углеводородов протекает еще более сложно. Механизм этих реакций во многих деталях еще не раскрыт. Для них характерен большой период индукции, исчисляемый минутами и даже часами, период, в который протекание реакции чрезвычайно затягивается, а температура повышается очень медленно.
Горение углеводородов протекает еще более сложно, чем горение окиси углерода, и обусловлено это тем, что этот процесс протекает с большим количеством цепей, возникающих за счет распада сравнительно сложных молекул углеводорода.
Горение углеводородов - процесс сложный, почти совершенно не изученный, вероятно вследствие многочисленных путей, по которым он может протекать в зависимости ют тех или иных условий.
Горение углеводородов в двигателе внутреннего сгорания также может быть неполным.
Схема цепного горения водорода. Зависимость тепловыделения и потерь тепла от температуры.Температура воспламенения горючих газов. Схема цепного горения водорода.| Зависимость тепловыделения и потерь тепла от температуры.Температура воспламенения горючих газов.
Горение углеводородов происходит, как показывают исследования, тоже с образованием промежуточных продуктов - гидроксила ОН и нестойких веществ - метилового спирта СН3ОН и формальдегида СНОН и, кроме того, связано с термическим разложением (крекингом) углеводородов с выделением сажистого диспер-сного углерода, придающего пламени светящийся характер.
Горение углеводородов осложняется тем, что параллельно с окислением происходит термическое разложение с образованием сажистого углерода, водорода и метана. Поэтому механизм горения тяжелых углеводородов в значительной степени сводится к механизму горения метана, водорода и гетерогенному горению углерода.
Горение углеводородов представляют протекающим по следующей схеме. Оно начинается с присоединения ими кислорода с образованием спиртов и альдегидов.
Горение углеводородов развивается по типу сильно разветвленной и потому крайне быстрой цепной реакции, и чем сложнее молекула углеводорода, тем большее число элементарных актов составляет цепь и образуется больше разнообразных промежуточных продуктов. Химизм сгорания сложных углеводородов и их смесей изучен очень мало. Тем не менее накоплен большой экспериментальный материал, позволяющий во многих случаях управлять процессом горения, вести инженерные расчеты тепловых двигателей и разрабатывать мероприятия по повышению эффективности использования топлива.
Реакция горения углеводородов протекает более сложно, чем горение водорода или окиси углерода. Первая реакция протекает медленно, причем температура повышается также медленно. Возникновение индукционного периода связано с тем, что наряду с образованием происходит и обрыв цепей, что тормозит протекание реакции.
2. Температуры горения газов. Виды. Разных видов.
В теплотехнике различаются следующие температуры горения газов: жаропроизводительность, калориметрическую, теоретическую и действительную (расчетную). Жаропроизводительность tж — максимальная температура продуктов полного сгорания газа в адиабатических условиях с коэффициентом избытка воздуха α = 1,0 и при температуре газа и воздуха, равной 0°C:
где Qн — низшая теплота сгорания газа, кДж/м3; ΣVcp — сумма произведений объемов диоксида углерода, водяного пара и азота, образовавшихся при сгорании 1 м3 газа (м3/м3), и их средних объемных теплоемкостей при постоянном давлении в пределах температур от 0°С до tж (кДж/(м3•°С).
В силу непостоянства теплоемкости газов жаропроизводительность определяется методом последовательных приближений. В качестве начального параметра берется ее значение для природного газа (≈2000°С), при α = 1,0 определяются объемы компонентов продуктов сгорания, по табл. 8.3 находится их средняя теплоемкость и затем по формуле (2.1) считается жаропроизводительность газа. Если в результате подсчета она окажется ниже или выше принятой, то задается другая температура и расчет повторяется.
Жаропроизводительность распространенных простых и сложных газов при их горении в сухом воздухе приведена в табл. 1.
При сжигании газа в атмосферном воздухе, содержащем около 1 вес. % влаги, жаропроизводительность снижается на 25–30°С.
Калориметрическая температура горения tK — температура, определяемая без учета диссоциации водяных паров и диоксида углерода, но с учетом фактической начальной температуры газа и воздуха. Она отличается от жаропроизводительности tж тем, что температура газа и воздуха, а также коэффициент избытка воздуха α принимаются по их действительным значениям. Определить tK можно по формуле:
tК = (Qн + qфиз)/(ΣVcp) (2.2)
где q физ — теплосодержание (физическая теплота) газа и воздуха, отсчитываемое от 0°С, кДж/м3.
Природные и сжиженные углеводородные газы перед сжиганием обычно не нагревают, и их объем по сравнению с объемом воздуха, идущего на горение, невелик. Поэтому при определении калориметрической температуры теплосодержание газов можно не учитывать. При сжигании газов с низкой теплотой сгорания (генераторные, доменные и др.) их теплосодержание (в особенности нагретых до сжигания) оказывает весьма существенное влияние на калориметрическую температуру.
Зависимость калориметрической температуры природного газа среднего состава в воздухе с температурой 0°С и влажностью 1% от коэффициента избытка воздуха а приведена в табл. 1, для сжиженного углеводородного газа при его сжигании в сухом воздухе — в табл. 3. Данными табл. 1–3 можно с достаточной точностью руководствоваться при установлении калориметрической температуры горения других природных газов, сравнительно близких по составу, и углеводородных газов практически любого состава. При необходимости получить высокую температуру при сжигании газов с малыми коэффициентами избытка воздуха, а также для повышения КПД печей, на практике подогревают воздух, что приводит к росту калориметрической температуры (см. табл. 2).
Теоретическая температура горения tT — максимальная температура, определяемая аналогично калориметрической tK, но с поправкой на эндотермические (требующие теплоты) реакции диссоциации диоксида углерода и водяного пара, идущие с увеличением объема:
СО2 ‹–› СО + 0,5О2 — 283 мДж/моль (2.3)
Н2О ‹–› Н2 + 0,5О2 — 242 мДж/моль (2.4)
При высоких температурах диссоциация может привести к образованию атомарного водорода, кислорода и гидроксильных групп ОН. Кроме того, при сжигании газа всегда образуется некоторое количество оксида азота. Все эти реакции эндотермичны и приводят к снижению температуры горения.
Теоретическая температура горения может быть определена по следующей формуле:
tT = (Qн + qфиз – qдис)/(ΣVcp) (2.5)
где qдис — суммарные затраты теплоты на диссоциацию СО2 и Н2О в продуктах сгорания, кДж/м3; ΣVcp— сумма произведения объема и средней теплоемкости продуктов сгорания с учетом диссоциации на 1 м3 газа.
Как видно из табл. 2, при температуре до 1600°С степень диссоциации может не учитываться, и теоретическую температуру горения может принять равной калориметрической. При более высокой температуре степень диссоциации может существенно снижать температуру в рабочем пространстве. На практике особой необходимости в этом нет, теоретическую температуру горения необходимо определять только для высокотемпературных печей, работающих на предварительно нагретом воздухе (например, мартеновских). Для котельных установок в этом нужды нет.
Действительная (расчетная) температура продуктов сгорания tд — температура, которая достигается в ¬реальных условиях в самой горячей точке факела. Она ниже теоретической и зависит от потерь теплоты в окружающую среду, степени отдачи теплоты из зоны горения излучением, растянутости процесса горения во времени и др. Действительные усредненные температуры в топках печей и котлов определяются по тепловому балансу или приближенно по теоретической или калориметрической температуре горения в зависимости от температуры в топках с введением в них экспериментально установленных поправочных коэффициентов:
где η— т.н. пирометрический коэффициент, укладывающийся в пределах:
- для качественно выполненных термических и нагревательных печей с теплоизоляцией — 0,75–0,85;
- для герметичных печей без теплоизоляции — 0,70–0,75;
- для экранированных топок котлов — 0,60–0,75.
В практике надо знать не только приведенные выше адиабатные температуры горения, но и максимальные температуры, возникающие в пламени. Их приближенные значения обычно устанавливают экспериментально методами спектрографии. Максимальные температуры, возникающие в свободном пламени на расстоянии 5–10 мм от вершины конусного фронта горения, приведены в табл. 3. Анализ приведенных данных показывает, что максимальные температуры в пламени меньше жаропроизводительности (за счет затрат тепла на диссоциацию Н2О и СО2 и отвода теплоты из пламенной зоны).
Природный газ относится к полезным ископаемым, одно из важнейших горючих ископаемых, занимающее ключевые позиции в топливно-энергетических балансах многих государств. Природный газ является важным сырьем для химической промышленности. В пластовых условиях (условиях залегания в земных недрах) находится в газообразном состоянии — в виде отдельных скоплений (газовые залежи) или в виде газовой шапки нефтегазовых месторождений, либо в растворённом состоянии в нефти или воде.
Содержание
1.Введение………………………………………………………………….. 3
2.Состав и физические свойства природного газа………………………. 4
3.Список использованной литературы……………………………………10
Работа содержит 1 файл
РЕФЕРАТ_ТПП.doc
Министерство образования и науки Российской Федерации
Государственное образовательное учреждение высшего профессионального образования
Уфимский государственный нефтяной технический университет
Кафедра разработки и эксплуатации нефтяных и газовых месторождений
Проверил: старший преподаватель ___________ Д.Ф. Ситдикова
- Введение………………………………………………………… ……….. 3
- Состав и физические свойства природного газа………………………. 4
- Список использованной литературы……………………………………10
Приро́дный газ — смесь газов, образовавшаяся в недрах земли при анаэробном разложении органических веществ.
Природный газ относится к полезным ископаемым, одно из важнейших горючих ископаемых, занимающее ключевые позиции в топливно-энергетических балансах многих государств. Природный газ является важным сырьем для химической промышленности. В пластовых условиях (условиях залегания в земных недрах) находится в газообразном состоянии — в виде отдельных скоплений (газовые залежи) или в виде газовой шапки нефтегазовых месторождений, либо в растворённом состоянии в нефти или воде.
Энергетическая и химическая ценность природного газа определяется содержанием в нём углеводородов. Очень часто в месторождениях он сопутствует нефти. Разница в составе природного и попутного нефтяного газа имеется. В последнем, как правило, больше сравнительно тяжёлых углеводородов, которые обязательно отделяются, прежде чем использовать газ.
Состав и физические свойства природного газа
Природные углеводородные газы представляют собой смесь предельных углеводородов вида СnН2n+2. Основную часть природного газа составляет метан CH4 — до 98 %.
В состав природного газа могут также входить более тяжёлые углеводороды — гомологи метана:
а также другие неуглеводородные вещества:
- диоксид углерода (СО2),
Чистый природный газ не имеет цвета и запаха. Чтобы можно было определить утечку по запаху, в газ добавляют небольшое количество веществ, имеющих сильный неприятный запах, так называемых одорантов. Чаще всего в качестве одоранта применяется этилмеркаптан.
Для облегчения транспортировки и хранения природного газа его сжижают, охлаждая при повышенном давлении.
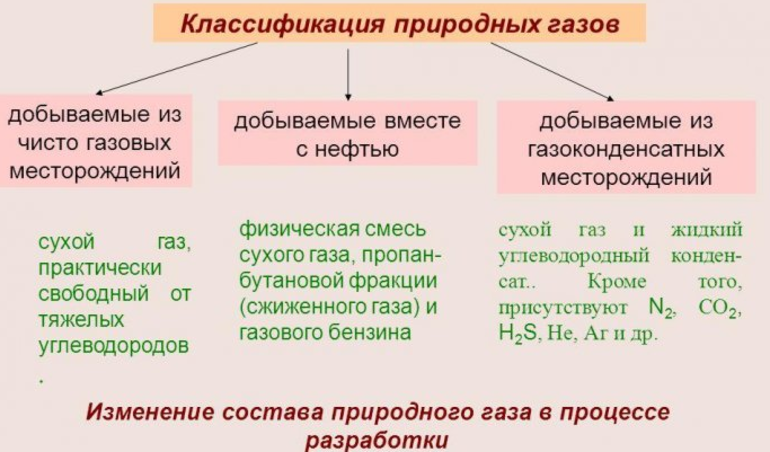
Природные газы подразделяют на следующие группы:
1. Газ, добываемый из чисто газовых месторождений и представляющий собой сухой газ, свободный от тяжелых углеводородов.
2. Газы, добываемые вместе с нефтью (растворенные или попутные газы). Это физические смеси сухого газа, пропанобутановой фракции (жирного газа) и газового бензина.
3. Газы, добываемые из газоконденсатных месторождений — смесь сухого газа и жидкого углеводородного конденсата. Углеводородный конденсат состоит из большого числа тяжелых углеводородов (С5 + высш., С6 + высш. и т.д.), из которых можно выделить бензиновые, лигроиновые, керосиновые, а иногда и более тяжелые масляные фракции.
4. Газы газогидратных залежей.
Компонентный состав и свойства отдельных компонентов природного газа приведены в таблице 1.
Таблица 1. Основные свойства компонентов природных газов в стандартных условиях.
| Свойство | Обозначение | CH4 | C2H6 | C3H8 | i-C4H10 | n-C4H10 |
| Молекулярная масса | М | 16,04 | 30,07 | 44,10 | 58,12 | 58,12 |
| Объем 1кг газа, м 3 | V | 1,40 | 0,74 | 0,51 | 0,39 | 0,39 |
| Плотность по воздуху | 0,554 | 1,038 | 1,522 | 2,006 | 2,006 | |
| Масса 1м 3 газа, кг | m | 0,71 | 1,35 | 1,97 | 2,85 | 2,85 |
| Критическое давление, МПа | ркр | 4,58 | 4,86 | 4,34 | 3,85 | 3,57 |
| Критическая температура, К | Ткр | 191 | 305 | 370 | 407 | 425 |
Во многих случаях состав природных углеводородных газов определяется не полностью, а лишь до бутана (С4Н10) или гексана (С6Н14) включительно, а все остальные компоненты объединяются в остаток (или псевдокомпонент).
Газ, в составе которого тяжелые углеводороды составляют не более 75 г/м 3 , называют сухим. При содержании тяжелых углеводородов более 150 г/м 3 газ называют жирным.
Газовые смеси характеризуются массовыми или молярными концентрациями компонентов. Для характеристики газовой смеси необходимо знать ее среднюю молекулярную массу, среднюю плотность в килограммах на кубический метр или относительную плотность по воздуху.
Молекулярная масса М природного газа:
где М – молекулярная масса i-го компонента; xi – объемное содержание i-го компонента, доли ед.
Для реальных газов обычно М=16 – 20.
Плотность газа ρг рассчитывается по формуле:
где Vм – объем 1 моля газа при стандартных условиях.
Обычно ρг находится в пределах 0,73 – 1,0 кг/м 3 .
Плотность газа в значительной степени зависит от давления и температуры, и поэтому для практического применения этот показатель неудобен. Чаще пользуются относительной плотностью газа по воздуху ρг.в., равной отношению плотности газа ρг к плотности воздуха ρв, взятой при тех же давлении и температуре:
Если ρг и ρв определяются при стандартных условиях, то ρв = 1,293 кг/м 3 и ρг.в. = ρг / 1,293.
Плотность нефтяных газов колеблется от 0,554 (для метана) до 2,006 (для бутана) и выше.
Вязкость газа характеризует силы взаимодействия между молекулами газа, которые преодолеваются при его движении. Она увеличивается при повышении температуры, давления и содержания углеводородных компонентов. Однако при давлениях выше 3МПа увеличение температуры вызывает понижение вязкости газа.
Вязкость нефтяного газа незначительна и при 0 о С составляет 0,000131 пз; вязкость воздуха при 0 о С равна 0,000172 пз.
Уравнения состояния газов используются для определения многих физических свойств природных газов. Уравнением состояния называется аналитическая зависимость между параметрами газа, описывающая поведение газа. Такими параметрами являются давление, объем и температура.
Состояние идеальных газов в условиях высоких давления и температуры определяется уравнением Клапейрона — Менделеева:
где р — давление; Vи — объем идеального газа, N— число киломолей газа; R— универсальная газовая постоянная; Т — температура.
Идеальным называется газ, силами взаимодействия между молекулами которого пренебрегают. Реальные углеводородные газы не подчиняются законам идеальных газов. Поэтому уравнение Клапейрона—Менделеева для реальных газов записывается в виде:
где Z — коэффициент сверхсжимаемости реальных газов, зависящий от давления, температуры и состава газа и характеризующий степень отклонения реального газа от закона для идеальных газов.
Коэффициент сверхсжимаемости Z реальных газов — это отношение объемов равного числа молей реального V и идеального Vи газов при одинаковых термобарических условиях (т. е. при одинаковых давлении и температуре):
Значения коэффициентов сверхсжимаемости наиболее надежно могут быть определены на основе лабораторных исследований пластовых проб газов. При отсутствии таких исследований (как это чаще всего бывает на практике) прибегают к расчетному методу оценки Z по графику Г. Брауна (рис.1). Для пользования графиком, необходимо знать, так называемые, приведенные псевдокритическое давление и псевдокритическую температуру.
Критической называется такая температура, выше которой газ не может быть превращен в жидкость ни при каком давлении. Критическим давлением называется давление, соответствующее критической точке перехода газа в жидкое состояние.
С приближением значений давления и температуры к критическим свойства газовой и жидкой фаз становятся одинаковыми, поверхность раздела между ними исчезает и плотности их уравниваются.
С появлением в системе двух и более компонентов в закономерностях фазовых изменений возникают особенности, отличающие их поведение от поведения однокомпонентного газа. Не останавливаясь на подробностях, следует отметить, что критическая температура смеси находится между критическими температурами компонентов, а критическое давление смеси всегда выше, чем критическое давление любого компонента.
Для определения коэффициента сверхсжимаемости Z реальных газов, представляющих собой многокомпонентную смесь, находят средние из значений критических давлений и температур каждого компонента. Эти средние называются псевдокритическим давлением pп.кр. и псевдокритической температурой Тп.кр. Они определяются из соотношений:
где ркр. и Ткр. – критические давления и температура i-го компонента; xi – доля i-го компонента в объеме смеси (в долях единицы).
Приведенные псевдокритические давление и температура, необходимые для пользования графиком Брауна, представляют собой псевдокритические значения, приведенные к конкретным давлению и температуре (к пластовым, стандартным или каким-либо другим условиям):
где р и Т – конкретные давления и температура, для которых определяется Z.
Коэффициент сверхсжимаемости Z обязательно используется при подсчете запасов газа для правильного определения изменения объема газа при переходе от пластовых условий к поверхностным, при прогнозировании изменения давления в газовой залежи и при решении других задач.
Рисунок 1. Графики зависимости коэффициента сверхсжимаемости Z углеводородного газа от приведенных псевдокритических давления рпр. и температуры Тпр. (по Г.Брауну).
Список использованной литературы
1. Коршак А.А., Шаммазов А.М., Основы нефтегазового дела. Изд. «УГНТУ. Уфа. 2005г.

Природный газ широко используется в качестве топлива котельными установками, которые обеспечивают теплом и горячей водой жилые помещения, частные дома, административные здания и иные типы объектов.
Преимуществами природного газа как горючего являются:
- высокие теплоэнергетические показатели;
- безопасность для окружающей среды;
- невысокая себестоимость.
Химические свойства природного газа
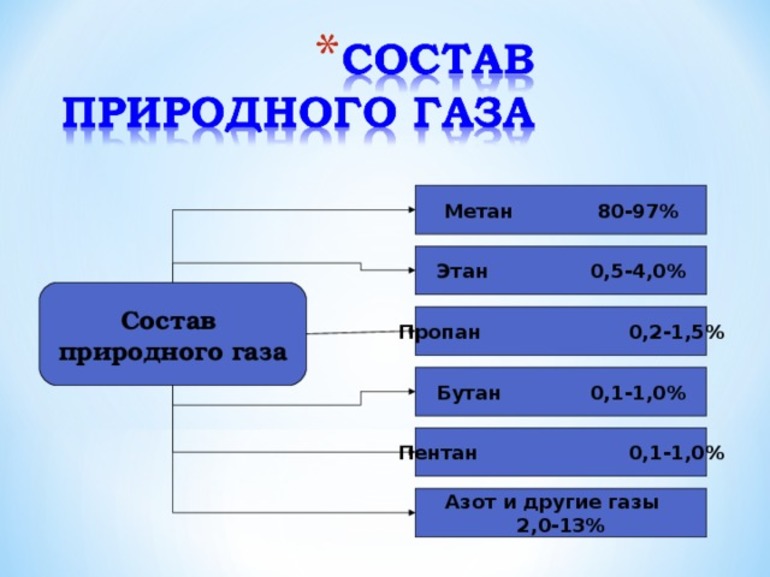
Основным элементом природного газа является метан (СH4), на долю которого приходится 70-98% общего состава. Остальную часть занимают:
- органическое соединение этан (C2H6);
- легкие углеводороды пропан (С3Н8) и бутан (С4Н10);
- насыщенный ациклический углеводород пентан (C5H12);
- химические элементы - водород (H2), азот (N2), гелий (He);
- сероводород (H2S);
- бесцветный углекислый газ (СО2);
- другие инертные газы.
Физические характеристики природного газа
Физические свойства напрямую зависят от состава и условий эксплуатации, поэтому приведенные ниже параметры указаны для общих случаев:
Чистый газ горит пламенем голубого цвета, но примеси могут изменять окраску, что позволяет оценить качество сгорания. В частности, желтый оттенок проявляется при недостатке кислорода и сигнализирует о неполном сгорании газа и, как следствие, повышенном образовании копоти и угарного газа.
Природный газ и воздух
Природный газ в чистом виде характеризуется отсутствием запаха и цвета, что требует добавления одорантов - специальных веществ, которые придают газу неприятный и резкий запах, а также помогают определить утечки в случае аварийной ситуации. При этом природный газ при утечке поднимается вверх, так как он легче воздуха в 1,8 раза.
При попадании природного газа в воздух образуется взрывоопасная смесь. Нижний предел взрываемости находится в пределах от 3 до 6%, а верхний — от 12 до 16%.
Природный газ — это полезное ископаемое, представляющее собой углеводороды в газообразном состоянии. Образуются они в недрах земли. Составляющие применяются как топливный ресурс. Газ взрывоопасен и горюч. Запаха и какого-либо оттенка он не имеет, легче воздуха примерно в 1,8 раза. В пластах он залегает в виде шапки из газа нефтегазовых месторождений либо же в качестве отдельных скоплений, может иметь кристаллическое состояние.

Классификация и свойства
Природный газ подразделён на 3 основные категории. Они описываются следующими характеристиками:
- Исключает присутствие углеводородов, в которых более 2 углеродных соединений. Их называют сухими и получают только в тех местах, которые предназначаются для добычи.
- Добывается наряду с первичным сырьём сжиженный и сухой газ и газообразный бензин, смешанные между собой.
- Присутствует в составе большое количество тяжёлых углеводородов и сухой газ. Имеется и незначительный процент примесей. Добывают из месторождений газоконденсатного типа.
Природный газ считается смешанным составом, в котором присутствуют несколько подвидов вещества. Именно по этой причине нет точной формулы компонента. Главным является метан, которого содержится более 90%. Он наиболее устойчив к температуре. Легче воздуха и малорастворим в воде. При горении на открытом воздухе образуется пламя голубого цвета. Мощнейший взрыв происходит в том случае, если соединить метан с воздухом в пропорции 1:10. Если человек вдыхает большую концентрацию этого элемента, то его здоровью может быть нанесён вред.
Применяют его как сырьё и промышленное топливо. Также его активно используют, чтобы получить нитрометан, муравьиную кислоту, фреоны и водород. При распаде углеводородных связей под влиянием тока и температур получается применяемый в промышленности ацетилен. При окислении аммиака с метаном образуется синильная кислота.
В составе природного газа имеет такой список компонентов:

- Этан — газообразное вещество, не имеющее цвета. При горении освещает слабо. В воде практически не растворяется, а в спирте может при соотношении 3:2. В качестве топлива его не нашёл применения. Основной целью использования считается производство этилена.
- Пропан — хорошо применяемый тип топлива, который в воде не растворяется. При сгорании выделяется большое количество тепла.
- Бутан — со специфическим запахом, небольшую токсичность. Отрицательно воздействует на здоровье человека: может поражать нервную систему, вызывает аритмию и асфиксию.
- Азот может использоваться для того, чтобы в буровых скважинах поддерживать соответствующее давление. Чтобы получить этот элемент, необходимо сжижать воздух и разделить его путём разгонки. Применяется для изготовления аммиака.
- Диоксид углерода — соединение может переходить в газообразное из твёрдого состояния при атмосферном давлении. Находится в воздухе и в минеральных источниках, а также выделяется при дыхании существ. Является пищевой добавкой. является довольно токсичным элементом. Он может негативно отразиться на работе нервной системы человека. Имеет запах протухших яиц, сладковатый привкус и является бесцветным. Отлично растворяется в этаноле. С водой не реагирует. Необходим для получения сульфитов, серной кислоты и серы.
- Гелий считается уникальным веществом. Он может скапливаться в земной коре. Получают его путём заморозки газов, в состав которых он входит. При нахождении в газообразном состоянии никак себя внешне не проявляет, в жидком — может поражать живые ткани. Он не способен взрываться и воспламеняться. Но если в воздухе будет присутствовать большая его концентрация, то это может привести к удушью. Применяют для заполнения дирижаблей и воздушных шаров, при работе с металлическими поверхностями.
- Аргон — это не имеющий внешних характеристик газ. Его применяют при резке и сварке металлических деталей, а также для того чтобы увеличить срок хранения пищевых продуктов (благодаря этому веществу вытесняется вода и воздух).
Физические свойства природного ископаемого следующие: температура самовозгорания составляет 650 градусов по шкале Цельсия, плотность природного газа — 0,68−0,85 (в газообразном состоянии) и 400 кг/м3 (жидкий). При смешении с воздухом взрывоопасными считаются концентрации 4,4−17%. Октановое число ископаемого составляет 120−130. Рассчитывают его исходя из соотношения легковоспламеняющихся компонентов к трудно окисляющимся при сжатии. Теплотворность приблизительно равна 12 тысячам калорий на 1 метр кубический. Теплопроводность газа и нефти одинаковая.
При добавлении воздуха природный источник может быстро воспламеняться. В бытовых условиях он поднимается к потолку. Именно оттуда и начинается возгорание. Связано это с лёгкостью метана. А вот воздух примерно в 2 раза тяжелее этого элемента.
В соответствии с химическими характеристиками, ресурс может вступать в реакции дегидрирования, пиролиза и замещения. Когда в составе будет присутствовать более 4% тяжёлых углеводородов, свойства начнут меняться.
Месторождение и добыча

Газ сжижают уже после его добычи. Именно по этой причине мировые запасы считают в кубических метрах. В год может достигаться до 3,6 миллиарда кубометров. Основными странами поставщиками являются Россия, Аравия, Иран, Туркмения, Катар, США, Венесуэла и Объединённые Эмираты.
Мировым лидером по добыче считается Российская Федерация. Основная часть залежь приходится на Уренгой. Там находится приблизительно 16 триллионов кубических метров газа. Также гигантским является и Ямбургское месторождение, где насчитывается 8,2 триллиона газа.
На важность природного ископаемого указывает расход. Скважины бурят по вечной мерзлоте. Для добычи ямбургского топлива необходимо преодолеть 1−3 километра. Из них примерно 50 метров приходится на мерзлоту.
Имеется ещё и Бованенковское месторождение, запасы которого составляют 4,9 триллиона кубических метров. Для местного населения предприятие по добыче и переработке считается местом занятости и дохода.

На днище Баренцева моря были обнаружены залежи ископаемого. Глубина его зарождений — не более 400 метров. На этой местности добыча в полном объёме не разрабатывается. Примерный объём залежей составляет 4 триллиона.
На юге Карского моря тоже имеются источники газа. Там было открыто Ленинградское (примерно 3 триллиона кубометров) и Русановское (779 миллиардов кубов топлива) месторождения.
Транспортировка топлива

Природный газ из недр в скважины поставляется обычным путём. Лёгкая субстанция имеет свойство просачиваться через имеющиеся в породе поры. Область низкого давления создают в скважине. В местах скопления ресурса оно высокое. На крупные залежи бурят несколько скважин, которые располагаются на равном друг от друга расстоянии.
К окончательной транспортировке топливо следует хорошо подготовить. Это обусловлено наличием примесей, которые могут вызывать осложнения с перемещением или же последующим применением. К примеру, из-за водяных паров при определённых условиях могут получаться гидраты, которые будут оседать в различных местах. Это вызовет затруднительное передвижение. Из-за сероводорода на оборудовании может возникать коррозия.
Кроме того, следует произвести тщательную подготовку трубопровода. Широкое применение получили азотные установки, благодаря которой получается инертная среда.

Трубопроводный способ на сегодняшний день обладает большой популярностью. Обслуживание и монтаж труб является довольно дорогой процедурой. Но несмотря на высокую стоимость, такой метод является наиболее выгодным для транспортировки на ближние и средние дистанции.
Помимо трубопровода, газ могут перевозить в специальных газовозах. Это суда со специальными изотермическими ёмкостями, температурный показатель в которых может составлять -160 градусов. Этот способ на расстояния более 2 тысяч километров считается экономически выгодным.
Применение в различных сферах деятельности
Топливо является основной областью применения. Для транспортировки источника по трубопроводу, необходимо ресурс осушить, в противном случае он может вызвать коррозию на поверхности. Также следует из состава убрать углекислый газ и сероводород.
Чтобы избежать неприятных ситуаций, ископаемое одоризируют — добавляют пахучие элементы, которые будут свидетельствовать про утечку. Без обработки могут быть большие потери топлива, так как, с точки зрения химии, запаха оно не имеет.
Помимо этого, газ является горючим веществом для работы кухонных плит и отопительных котлов. Уже появились и газовые лампы для освещения улиц и помещений.
Из метана в химической промышленности добывают аммиак и некоторые пластификаторы. Из него синтезируются цианистый водород, ацетилен и метанол. Из метана производят и синтетический каучук. Происхождение полиэтилена было открыто при работе с природным газом.
Читайте также:

