Реферат антибиотики и их продуценты
Обновлено: 07.07.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Получение антибиотиков.
Антибиотики вырабатываются микроорганизмами в результате совместного действия продуктов 10 - 30 генов, что усложняет использование генно-инженерных подходов для управления их синтезом. Однако данная проблема разрешима в тех случаях, когда синтез антибиотиков определяется мультиферментными комплексами, кодируемыми одним опероном (например, в случае антибиотиков пептидной природы). Это открывает новые перспективы в биотехническом получении антибиотиков. Внедрение соответствующих генов из одного микроорганизма в клетки другого близкородственного может приводить к получению “гибридного” антибиотика, обладающего новыми свойствами. Этот подход был успешно применен в 1988 г. биохимиком Михаэлем Хопвудом в США. При объединении генов биосинтеза актинородина и медермицина был получен новый антибиотик, получивший название “медерродин”. В другом случае этот же автор создал штамм, продуцирующий “гибридный” антибиотик дигидрогранатиродив. Высокая продуктивность штаммов микроорганизмов иногда достигалась за счет увеличения в клетках количества копий генов биосинтеза антибиотика. Таким образом, удалось, например, существенно увеличить выход актинородина.
Широко применяют антибиотики в медицине, сельском хозяйстве (для лечения, а также для улучшения роста и развития молодняка), в пищевой промышленности (консервирующие средства). В 1987 г. за рубежом стоимость всех антибиотиков, использованных в качестве антибактериальных препаратов, составила 3,5 млрд. долл.; ожидается, что в 1992 г. она достигнет 4,2 млрд. долл.
В борьбе с болезнетворными бактериями вместо антибиотиков иногда используют другую бактерию - антагонист патогенного штамма. Примером может служить дикий патогенный штамм бактерии Streptococcus mutans, разрушающий зубную эмаль и дентин. При введении в ротовую полость мутантного штамма этого же вида выделяется белковый продукт, губительный для дикого штамма. В данном случае бактерии-антагонисты выступают в роли биостерилизаторов. Описаны аналогичные способы защиты сельскохозяйственных растений. В частности, это относится к инфекционному заболеванию рассады томатов, вызываемому почвенными бактериями Fusarium oxysporum. Заболевание связано с действием фузаровой кислоты, продуцируемой этими бактериями. В качестве биостерилизатора в этом случае используют клетки Pseudomonas solanactarum, способные накапливать фузаровую кислоту и этим снижать ее токсичное воздействие на томаты.
Создание микроорганизмов-продуцентов.
Природные микроорганизмы, как правило, обладают низкой продуктивностью тех веществ, производство которых необходимо. Для биотехнологии нужны высокопродуктивные штаммы микроорганизмов. Их создают методами селекции - направленного отбора спонтанных или индуцированных (химическими мутагенами или радиацией) мутантов. Получение таких штаммов занимаются иногда многие годы. В результате селекции производительность продуцентов удается увеличить в сотни или тысячи раз. Например, в работе с Penicillium методами селекции выход пенициллина был увеличен в конце концов, примерно в 10 тыс. раз по сравнению с исходным диким штаммом.
Отбору высокопроизводительных штаммов предшествуют тонкие манипуляции селекционера с генетическим материалом исходных штаммов. При этом используют весь спектр естественных способов рекомбинирования генов, известных у бактерий: конъюгацию, трансдукцию, трансформацию и другие генетические процессы. Например, конъюгация (обмен генетическим материалом между бактериями) была успешно использована при создании штамма Pseudomonas putida, способного утилизовать углеводороды нефти. Очень часто прибегают к трансдукции (перенос гена из одной бактерии в другую посредством бактериальных вирусов - бактериофагов) и амплификации (увеличение числа копий нужного гена).
Так, у многих микроорганизмов гены биосинтеза антибиотиков или их регуляторы находятся не в основной хромосоме, а в плазмидах. Путем амплификации удается увеличить число этих плазмид в клетках и существенно повысить производство антибиотиков.
Еще один подход в генетико-селекционной работе - получение генетических рекомбинантов путем слияния разных штаммов бактерий, лишенных стенок (протопластов). Так, слиянием протопластов двух штаммов Streptomyces был сконструирован новый высокоэффективный штамм-продуцент рифампицина С: мутанты Nocardia mediterranei, в которых не синтезировался рифампицин, после слияния сформировали штаммы, продуцирующие три новых рифампицина. Слияние протопластов позволяет объединять генетические материалы и таких микроорганизмов, которые в естественных условиях не скрещиваются.
Биотехнологическое получение антибиотиков.
Антибиотики - самый большой класс фармацевтических препаратов, которые синтезируются микроорганизмами. Некоторые из антибиотиков используют в сельском хозяйстве против различных сельскохозяйственных вредителей (например, полиоксин, баридакицин, косгалицин), другие - в медицинских целях (пенициллины, тетрациклины, цефалоспорин С и др.).
Шесть родов феламентозных грибов производят около 1000 различных антибиотиков. Много антибиотиков синтезируют актиномицеты (один только вид Streptomyces griscus производит более 50 антибиотиков). В практике реально используют небольшое число из известных пауке антибиотиков, производимых микроорганизмами. Это в первую очередь пенициллины и цефалоспорины, продуцируемые грибами родов Penicillum; стрептомицин, гентамицин, канамицин, эритромицин и тетрациклины, синтезируемые актиномицетами рода Streptomyces и бактериями родов Micromonospora и Bacillus, и некоторые другие.
До “эры” генной инженерии ценные для промышленности штаммы-продуценты антибиотиков с повышенной продуктивностью получали в основном с помощью мутагенеза и селекции природных микроорганизмов. Например, в результате селекции и улучшения техники ферментации промышленный выход пенициллина достиг 20 г/л, что в 10 тыс. раз выше уровня, который имелся в исходном штамме Penicillum chrysogenum.
Разработан также метод так называемого мутасинтеза, позволяющий получать модифицированные антибиотики. В этом случае используют мутантные штаммы-продуценты, в которых нарушен синтез определенных участков молекулы антибиотика. Для биосинтеза функционально-активного антибиотика в среду культивирования продуцента вносят аналоги этих участков. В связи с постепенным приобретением патогенными бактериями устойчивости к антибиотикам созданы методы внесения специальных модификаций в структуры антибиотиков, сохраняющие их антибактернальные эффекты. В настоящее время широко распространены полусинтетические антибиотики, например ампициллин, цефалексин, метициллин и др.

Лекции

Лабораторные

Справочники

Эссе

Вопросы

Стандарты

Программы

Дипломные

Курсовые

Помогалки

Графические
Доступные файлы (1):
РЕФЕРАТ
Осложнения антибактериальной терапии.…………………………………. 7
Спектр действия антибиотиков………………………………………………. 9
Методы определения чувствительности к антибиотикам…………….10
Производство антибиотиков………………………………………. 15
ИСПОЛЬЗОВАННАЯ ЛИТЕРАТУРА………………………………………..17
ВВЕДЕНИЕ
Антибиотики – это химические соединения биологического происхождения, оказывающие избирательное повреждающее или губительное действие на микроорганизмы. Антибиотики, применяемые в медицинской практике, продуцируются актиномицетами (лучистыми грибами), плесневыми грибами, а также некоторыми бактериями. К этой группе препаратов относят также синтетические аналоги и производные природных антибиотиков.
природные, продуцируемые микроорганизмами (бензил-пенициллина натриевая и калиевая соли, эритромицин);
полусинтетические, получаемые путем модификации структуры природных (ампициллин, оксациллин, кларитромицин, доксициклин, метациклин, рифампицин);
синтетические (циклосерин, цефуроксим, левомицетин, азлоциллин, мезлоциллин).
бактериостатического действия - приостанавливающие рост и развитие микроорганизмов.
бактерицидного действия - вызывающие гибель микроорганизмов.
Во вторую группу включены пенициллины, цефалоспорины, аминогликозиды, которые прекращают жизнедеятельность микроорганизмов, т. е. обладают бактерицидным свойством. Эти антибиотики угнетают синтез белка, что приводит к гибели микроорганизмов.
Каждый антибиотик эффективен в отношении определенной группы микроорганизмов: одних он подавляет сильнее, других слабее, а в отношении некоторых не действует вовсе.
химическая классификация: β-лактамные антибиотики, включают группу пенициллинов, цефалоспоринов, карбопенемов и монобактамов; группа тетрациклинов, группа макролидов и другие;
по спектру действия:
- действуют преимущественно на граммположительные бактерии – пенициллины, линкомицин;
- действуют преимущественно на граммотрицательные бактерии – полимиксины монобактамы;
- ингибиторы синтеза белка на рибосомах аминогликозиды, тетрациклины, группа левомицетина;
- нарушающие молекулярную организацию и функцию одноклеточных мембран – полимиксины, полиеновые антибиотики (нистатин, леворин, амфотерицин);
Из таблицы видно, что бактерицидный эффект оказывают преимущественно те антибиотики, которые нарушают синтез клеточной стенки, изменяют проницаемость цитоплазмы мембран или нарушают синтез РНК в микроорганизмах. Бактериостатическое действие характерно для антибиотиков, нарушающих внутриклеточный синтез белка.
Наиболее часто используют смешанную классификацию антибиотиков, основанную на спектре и механизме действия с учетом химического строения.
β-лактамные антибиотики (пенициллины, цефалоспорины, карбопенемы, монобактамы).
Макролиды и близкие к ним антибиотики.
Аминогликозиды.
Тетрациклины.
Полимиксины.
Полиены (противогрибковые антибиотики).
Препараты хлорамфениколя (левомицетина).
Гликопептидные антибиотики.
Антибиотики разных химических групп.
Осложнения антибактериальной терапии.
Выделяют две группы осложнений терапии антибактериальными препаратами: со стороны макроорганизма и со стороны микроорганизма.
Аллергические реакции – наиболее известное и чаще всего встречающееся осложнение. Степень выраженности аллергии может быть различна (от легких форм до тяжелейших проявлений, вплоть до анафилактического шока).
Прямое токсическое (органотоксическое) действие препаратов. Противоопухолевые антибиотики обладают гемато-, гепато- и кардиотоксичностью, все аминогликозиды – ото- и нефротоксичностью. Ципрофлоксацин (ципробай, цифран) может оказать токсическое действие на центральную нервную систему, а фторхинолоны могут обусловливать появление артропатий. Некоторые антибиотики (тетрациклины) способны проходить через плаценту и выделяться с грудным молоком, что необходимо учитывать при их назначении. Тетрациклины также нарушают формирование зубов и костей у плода, детей и подростков, вызывают гипоплазию эмали и желтую окраску зубов у взрослых людей.
Побочные токсические (органотропные) эффекты. Они связаны не с прямым, а с опосредственным действием антибиотиков. Фурагин, проникая через плаценту, вызывает гемолитическую анемию плода из-за незрелости его ферментных систем. Хлорамфеникол (левомицетин) может подавлять синтез белков не только в микробной клетке, но и в клетках костного мозга, что приводит у части больных к развитию стойкой лейкопении. Антибиотики, действующие на синтез белка и нуклеиновый обмен, угнетают иммунную систему человека в целом.
Реакции обострения. Применение бактерицидных антибиотиков в первые дни болезни при общем тяжелом состоянии больного нередко приводит к резкому ухудшению его состояния, вплоть до развития эндотоксического шока. В основе этого явления лежит массовая гибель возбудителя (граммотрицательных бактерий), сопровождающаяся освобождением большого количества эндотоксина и других токсических продуктов распада бактериальных клеток. Такая реакция чаще развивается у детей, у которых механизмы процесса детоксикации развиты слабее, чем у взрослых.
Дисбактериоз. На фоне использования антибиотиков широкого спектра действия наблюдается развитие дисбактериоза – нарушение качественного и количественного состава нормальной микрофлоры.
На основе развития устойчивости к антибиотикам лежат мутации хромосомных генов или приобретение плазмид лекарственной устойчивости.
Прежде всего существуют природно-устойчивые к антибиотикам роды и семейства микроорганизмов, в геноме которых есть гены, контролирующие этот признак. Например, для рода аципетобактер, устойчивость к пенициллину – токсономический признак. Полирезистенты к антибиотикам псевдомонады, неклостридиальные анаэробы и другие. Эти микроорганизмы формируют природные банки (хранилища) генов лекарственной устойчивости.
Как известно, мутации, в том числе и по признаку лекарственной устойчивости, спонтанны и возникают всегда.
Плазмидная устойчивость приобретается микробными клетками в результате процессов генетического обмена. Высокая частота передачи R-плазмид обеспечивает широкое и достаточно быстрое распространение устойчивых бактерий в популяции, а селективное давление антибиотиков - отбор и закрепление их в биоценозах.
Каждый антибиотик обладает определенным спектром действия. Некоторые антибиотики оказывают влияние на многие виды микроорганизмов, поэтому имеют широкий спектр действия. Например, тетрациклины эффективны против многих граммположительных (гонококки, холерный вибрион, кишечная палочка, сальмонеллы) бактерий. В то же время существуют антибиотики с узким спектром антимикробного действия. Например, циклосерин в достаточно безопасных дозах эффективен лишь в отношении возбудителя туберкулеза, а гризеофульвин подавляет рост грибов и не действует на бактерии.
Широкое применение антибиотиков сопровождается распространением бактерий, устойчивых к их действию. Результатом устойчивости микроорганизмов является ослабление или полное прекращение специфического действия антибиотиков при лечении инфекционных заболеваний в течение определенного периода времени.
образованием в микроорганизмах специфических ферментов, инактивирующих или разрушающих антибиотик (например, некоторые штаммы стафилококков вырабатывают фермент пенициллиназу, разрушающую пенициллин);
уменьшением проницаемости микробной клетки для антибиотиков;
изменением обменных процессов в микробной клетке.
Применение антибиотиков может сопровождаться нежелательными явлениями, иногда опасными для жизни больного. Наиболее часто во время лечения пенициллинами и стрептомицинами наблюдаются аллергические реакции: крапивница, отек Квинке, дерматиты и другие. Самым тяжелым и опасным для жизни аллергическим осложнением является анафилактический шок. Следует отметить, что разные антибиотики вызывают примерно одинаковые симптомы аллергических реакций.
Токсические осложнения, характеризующиеся определенной спецификой, возможны при применении любого антибиотика. Стрептомицины вызывают поражение слухового аппарата, вплоть до глухоты; цефалоридин и полимиксины поражают почки (нефротоксическое действие); левомицетин кроветворение. Выраженность токсического действия зависит от дозы применяемых веществ.
Антибиотики могут, помимо угнетения жизнедеятельности возбудителей инфекционных заболеваний, одновременно подавлять нормальную микрофлору организма, при этом некоторые непатогенные или условно-патогенные микроорганизмы начинают усиленно размножаться и могут стать источником нового заболевания (суперинфекции). К суперинфекции относятся кандидозы – заболевания, вызванные дрожжеподобными грибами рода кандида. Кандидозы развиваются главным образом при лечении антибиотиками широкого спектра действия (тетрациклины).
Дозы антибиотиков выражаются в единицах действия (ЕД) или весовых количествах. Для пенициллина единица действия равняется 0,5988 мкг.
Методы определения чувствительности к антибиотикам.
Антибактериальную активность антибиотиков выражают в единицах действия (ЕД). Для большинства антибиотиков 1 ЕД соответствует 1 мкг химически чистого препарата. Исключение составляют пенициллин (1 ЕД = 0,6 мкг), нистатин (1 ЕД = 0,333 мкг), полимиксин (1 ЕД = 0,1 мкг), для которых сохранены единицы действия, установленные на эталонных тест-микробах до получения химически чистых препаратов этих антибиотиков.
Чувствительность микроорганизмов к антибиотикам и другим химиопрепаратам определяют 2-мя группами методов: диско-диффузным (метод диффузии в агар с применением бумажных дисков с антибиотиками) и методом разведений антибиотика в плотной или жидкой питательной среде. Выбор метода зависит от цели исследования и возможностей лаборатории.
Чувствительность микроорганизмов к антибиотикам и другим химиотерапевтическим препаратам необходимо определять в каждом случае инфекции и периодически - в ходе лечения. Главным показателем чувствительности является минимальная ингибирующая концентрация – МИК (мкг/мл), т. е. минимальная концентрация антибиотика, задерживающая рост микроба-возбудителя в стандартном опыте. Значение величины МИК определяют методом серийных разведений или методом диффузии в агар (дисками или Е-тестами). В любом случае критерием чувствительности является значение величины терапевтического индекса: Т = МИК/К, где К – концентрация данного антибиотика (мкг/мл) в очаге инфекции (или в крови) при введении терапевтических доз препарата.
Микроб чувствителен, а антибиотик обычно клинически эффективен при Т
Ингредиенты
Номер опытной пробирки (конечная концентрация антибиотика мкг/мл)
Контроль
1 2 3 4 5 (64) (32) (16) (8) (4)
Культуры
Буль
Учетным признаком при этом является наличие или отсутствие мутантности бульона в пробирках. В контроле культуры должна быть мутантность, в остальных контролях – нет. Величина МИК соответствует той минимальной концентрации, при которой отсутствует мутность (бульон в пробирках прозрачен). Так, если бульон будет мутным в 4-й или 5-й опытных пробирках, МИК тетрациклина = 16 мкг/мл. Известно, что величина К тетрациклина при введении среднетерапевтических доз – 2 мкг/мл (при использовании максимальных доз – 10 мкг/мл). Следовательно, в данном случае терапевтический индекс будет равен Т = 16 /2 = 8 (> 0,3), т. е. возбудитель устойчив к антибиотику и лечение тетрациклином не дает антимикробного эффекта в отношении Staphylococcus aureus у данного больного даже при введении максимальных доз (Т = 16 /10 = 1,6).
Метод серийных разведений считается наиболее точным, но относительно трудоемким.
Диско-диффузный метод.
Метод серийных разведений в планшетах. Используют готовые стерильные полистироловые 96-луночные планшеты, в лунки которых внесены и лиофильно высушены убывающие концентрации антибиотиков в бульоне. После вскрытия планшета стандартизованную суспензию испытуемой культуры в одинаковой дозе (например, 0,1 мл) асептически вносят в соответствующие ряды лунок, закрывают крышкой и инкубируют при оптимальной температуре. Среда при этом восстанавливается, что позволяет после инкубирования планшета отметить рост (помутнение бульона) в тех лунках, где антибиотик не действует. При помутнении бульона в контроле культуры и опытных лунках определяют величину МИК. Учет можно вести как визуально, так и с помощью специальных микробиологических анализаторов.
Метод пограничных концентраций можно считать усеченным методом серийных разведений. В соответствии с ним испытуемую культуру вносят только в две лунки (пробирки), где находятся высокая (С) и низкая (с) концентрации антибиотика. Концентрация С соответствует границе между устойчивыми и умеренно-устойчивыми штаммами, а концентрация с – границе между умеренно-устойчивыми и чувствительными штаммами. Если после инкубирования рост отсутствует в обеих лунках, штамм относят к чувствительным, если только в лунке с концентрацией С – к умеренно-устойчивым штаммам, а если в обеих лунках имеется рост, штамм относят к устойчивым.
Важными условиями являются:
- использование только чистых культур и соблюдение правил асептики;
- применение стандартных питательных сред, соответствующих питательным потребностям испытуемого микроорганизма (среда Миеллера-Хинтона, агар АГВ, среда НТМ и др.);
- внесение испытуемой культуры в стандартной дозе и соблюдение установленного соотношения инокулюм/среда;
- правильный режим инкубирования и метод учета.
Чувствительность к антибиотикам желательно проверять у свежевыделенных культур, выделенных из материала до начала антибиотикотерапии, и повторять исследование с культурами, выделенными в ходе лечения.
В последние годы в практике стали применять ПЦР для выявления у микробов специфических генов, ответственных за формирование лекарственной устойчивости (геноиндикация антибиотикоустойчивых культур).
Производство антибиотиков.
Производство антибиотика пенициллина с момента его открытия в 1928 году спасло миллионы жизней. С тех пор благодаря селекции высокопродуктивных мутантных штаммов, а также разработке методов культивирования, выделения и очистки производство пенициллина возросло примерно в 2000 раз, а каждый год открываются примерно 50 новых антибиотиков.
Основными продуцентами антибиотиков являются бактерии, актиномицеты и микроскопические грибы. Бактерии, продуцирующие антибиотики, представлены в основном родом Bacillus. К антибиотикам, образуемым бактериями, относятся: грамицидин С (В. brevis), полимиксины (В. polymyxa), бацитрацины (В. licheniformis), ницины (Streptococcus Lacus). Актиномицеты, синтезирующие антибиотики в основном представлены родом Streptomyces (S. griseus, S. fradiae, S. kanamyceticus, S. aurefaciens и др.). Антибиотики, образуемые актиномицетами, ранообразны по химическому строению: амино-гликозиды, тетрациклины, актиномицины, макролиды и другие. Грибы - продуценты антибиотиков представлены родом Renicullium и Aspergillus. К антибиотикам, образуемым мицелиальными грибами, относятся пенициллин и цефалоспорин.
Антибиотики – это препараты, направленные на уничтожение живых болезнетворных бактерий, они вошли в нашу жизнь более полувека назад и прочно обосновались в ней.
История антибиотиков
Источники антибиотиков
Основными источниками получения антибиотиков являются актиномицеты (продуцируют около 80% природных антибиотиков), плесневые грибы и типичные бактерии, но являются далеко не единственными. На сегодняшний день науке известно около 30 000 антибиотиков природного происхождения, но это вовсе не означает, что все существующие ныне антибиотики продуцированы живыми клетками. Ученые химики еще с 60-х годов научились существенно улучшать противомикробные свойства антибиотиков, произведенных природными микроорганизмами, модифицируя их химическими методами. Полученные таким образом препараты относятся к полусинтетическим антибиотикам. Из всего многообразия антибиотиков в медицинских целях используют всего около ста.
Способы получения антибиотиков
- Биологический синтез (культивация продуцентов и выделение ними антибиотиков в процессе своей жизнедеятельности)
- Боисинтез с химическими модификациями (полусинтетические антибиотики)
- Химический синтез (синтетические аналоги природных антибиотиков)
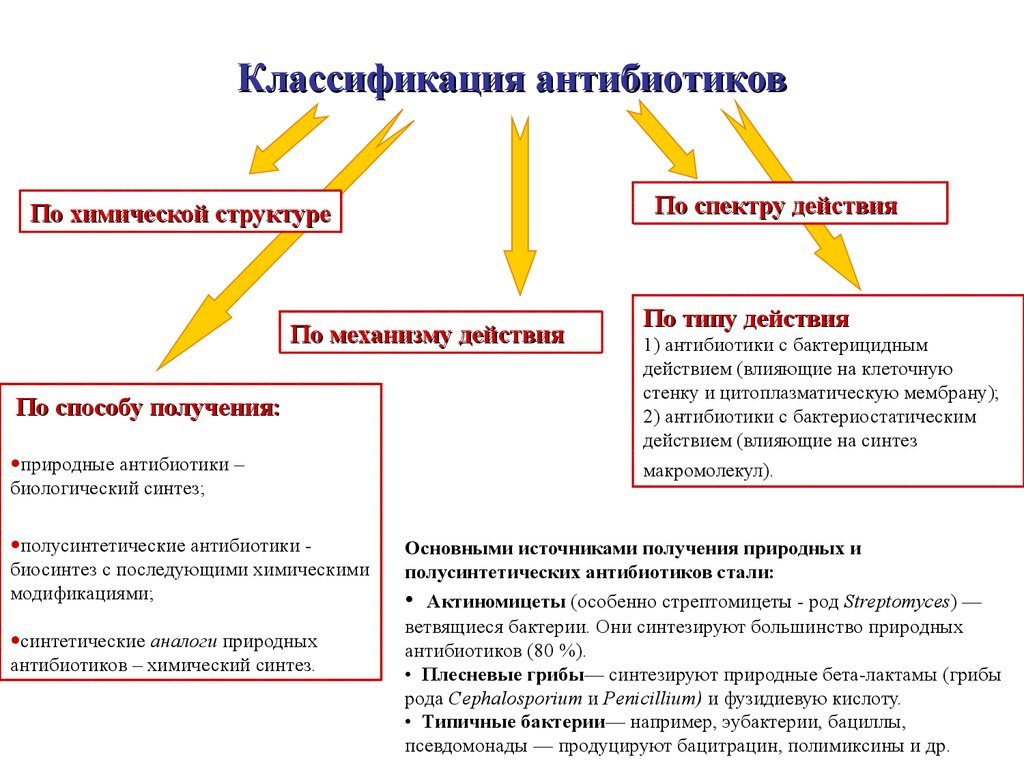
Классификация антибиотиков
- Бета-лактамы (пенициллины, цефалоспорины, карбапенемы, монобактамы)
- Гликопептиды (ванкомицин, тейкопланин)
- Аминогликозиды (стрептомицин, мономицин, канамицин, неомицин – I-го поколения; гентамицин и т.д. - II-го поколения)
- Тетрациклины
- Макролиды (и азалиды)
- Линкозамиды
- Левомицетин (хлорамфеникол)
- Рифамицины
- Полипептиды
- Полиены
- Разные антибиотики (фузидиевая кислота, фузафунжин и др.)
- Антибактериальные антибиотики (самая многочисленная группа препаратов):
- активные в отношении грамположительных микроорганизмов;
- широкого спектра действия - действуют одновременно на грамположительные и грамотрицательные бактерии;
- противотуберкулезные, противолепрозные, противосифилитические препараты;
- противогрибковые
- Противоопухолевые антибиотики
- Антипротозойные и противовирусные антибиотики
Как действуют антибиотики?
Главной задачей антибиотика, когда он попадает в организм, является присоединение к бактерии с целью ее уничтожить либо лишить возможности размножаться, вследствие чего она самостоятельно погибнет. Для этого у каждого антибиотика есть своя мишень, как правило, это белок, фермент или часть ДНК патогенного микроорганизма, и механизм воздействия на бактерию. Именно поэтому назначают те или иные антибактериальные препараты в зависимости от возбудителя заболевания. В медицинской практике применяют лекарственные препараты, которые прицельно бьют по мишеням, не затрагивая клетки нашего организма.
Лечение антибиотиками
Самостоятельно назначать себе прием антибиотиков нельзя, такое назначение может делать только доктор. Антибактериальные препараты применяют для предотвращения и лечения воспалительных процессов, вызванных патогенными бактериями. Лечение вирусных заболеваний, например, ОРВИ будет не эффективно.

Не следует сопровождать терапию антибиотиками другими лекарственными препаратами, способными повлиять на их действие, а также важно соблюдать равный интервал времени между приемами противомикробного средства и ни в коем случае не сочетать лечение с алкоголем. Не прекращайте прием антибиотиков, если вы почувствовали облегчение, курс лечения, назначенный квалифицированным специалистом, необходимо пройти в полном объеме. В случае если прием антибиотика не дает результата в течение 72 часов от начала лечения, необходимо обратиться к вашему лечащему врачу, с просьбой заменить назначенный препарат.
Для идентификации антибиотиков могут быть использованы различные цветные реакции на соответствующие функциональные группы; спектральные характеристики в видимой, УФ- и ИК-областях спектра; хроматографические методы.
Для количественного определения антибиотиков используют биологические, химические, физико-химические методы.
Биологические методы основаны на непосредственном биологическом действии антибиотика на применяемый тест-организм, чувствительный к данному антибиотику. Применяемый при этом диффузионный метод основан на способности молекул антибиотиков диффундировать в агаровых средах. Оценивается размер зоны, в которой используемые тест-организмы не развиваются. Этот размер зависит от химической природы антибиотика, его концентрации, рН и состава среды, температуры эксперимента.
Прикрепленные файлы: 1 файл
биотехнология антибиотиков.docx
Антибиотики - вещества природного или полусинтетического происхождения (обычно производятся различными грибками), оказывающие сильное подавляющее действие на рост и размножение бактерий и при этом относительно мало повреждающие или вовсе не повреждающие клетки микроорганизма.
Антибиотики в отличие от антисептиков обладают антибактериальной активностью не только при наружном применении, но и в биологических средах организма при их системном применении.
Антибиотики используются для предотвращения и лечения воспа-лительных процессов, вызванных бактериальной микрофлорой. По влиянию на бактериальные организмы различают бактерицидные (убивающие бактерий, например, за счёт разрушения их внешней мембраны) и бактериостатические (угнетающие размножение микроорганизма) антибиотики.
Антибиотики природного происхождения чаще всего продуцируются актиномицетами, реже - немицелиальными бактериями. Некоторые антибиотики оказывают сильное подавляющее действие на рост и размножение бактерий и при этом относительно мало повреждают или вовсе не повреждают клетки макроорганизма, и поэтому применяются в качестве лекарственных средств. Некоторые антибиотики используются в качестве цитостатических (противоопухолевых) препаратов при лечении онкологических заболеваний. Антибиотики не воздействуют на вирусы, и поэтому бесполезны при лечении заболеваний, вызываемых вирусами (например, грипп, гепатиты А, В, С, ветряная оспа, герпес, краснуха, корь).
Изобретение антибиотиков можно назвать революцией в медицине. Множество болезней, веками мучавших человечество и несших смерть, стали банальными, как обычная простуда. Разработка и производство антибиотиков активно началась в конце XIX века. Первым антибиотиком, выпущенным в промышленное производство, стал сальварсан (1910 год).
Принцип работы антибиотика состоит в торможении или подавлении химической реакции, необходимой для существования бактерии. Пенициллин блокирует молекулы, участвующие в строительстве новых клеточных оболочек бактерий - похоже на то, как наклеенная на ключ жевательная резинка не дает открыть замок. (Пенициллин не оказывает влияния на человека или животных, потому что наружные оболочки наших клеток коренным образом отличаются от клеток бактерий.)
В течение 1930-х годов предпринимались безуспешные попытки улучшить качество пенициллина и других антибиотиков, научившись получать их в достаточно чистом виде. Первые антибиотики напоминали большинство современных противораковых препаратов - было неясно, убьет ли лекарство возбудителя болезни до того, как оно убьет пациента. И только в 1938 году двум ученым Оксфордского университета Говарду Флори и Эрнсту Чейну удалось выделить чистую форму пенициллина. В связи с большими потребностями в медикаментах во время второй мировой войны массовое производство этого лекарства началось уже в 1943 году. В 1945 году Флемингу, Флори и Чейну за их работу была присуждена Нобелевская премия.
Начало развития науки об антибиотиках относится к 40-м годам нашего столетия, когда было открыто сильное химиотерапевтическое средство против бактериальных инфекций - пенициллин. В результате большой работы советских ученых и медицинской промышленности СССР в сравнительно короткое время было организовано производство всех важнейших антибиотиков, имеющих значение для медицинской практики.
Работа по изысканию антибиотиков требует тесного сотрудничества микробиологов (изыскание продуцентов новых антибиотиков), химиков (выделение активно действующих веществ из культуральной жидкости продуцентов), химиотерапевтов, фармакологов, гистологов, испытывающих лечебное действие новых антибиотиков в опытах на животных.
В этом комплексе необходимо также участие инженеров и технологов, располагающих специальным оборудованием, необходимым для получения образцов новых антибиотиков в количествах, требуемых для дальнейшего изучения.
Для успешной работы в этом направлении в нашей стране были созданы специализированные научные институты: НИИ по изысканию новых антибиотиков АМН СССР, Ленинградский НИИ антибиотиков; Всесоюзный НИИ антибиотиков Министерства медицинской промышленности СССР.
Развитие отечественной науки об антибиотиках (изыскание, установление строения, разработка производственных методов получения) связано с именами крупнейших советских ученых: 3.В. Ермольевой, М.М. Шемякина, Г.Ф. Гаузе, М.Т. Бражниковой, А.С. Хохлова, С.М. Навашина и других.
Известно уже около 3000 антибиотических веществ, из которых химио-терапевтическим действием обладает около 300. По своей химической природе антибиотики представляют органические соединения, относящиеся к самым различным классам соединений.
Антибиотики, в отличие от других продуктов жизнедеятельности, имеют два характерных свойства:
- проявляют высокую биологическую активность по отношению к чувствительным к ним организмам. Даже в очень небольших концентрациях они проявляют высокое физиологическое действие, например пенициллин оказывает бактерицидное действие в отношении чувствительных к нему бактерий в концентрации 0,000001 г/мл;
Производственное получение антибиотиков, как правило, осуществляется путем биосинтеза и имеет много общих стадий, основными из которых являются: подбор высокопроизводительных штаммов и питательных сред; процесс биосинтеза; выделение антибиотика из культуральной жидкости и его очистка.
Интенсивность биосинтеза того или другого антибиотика зависит в первую очередь от свойств штамма продуцента. Природные штаммы в большинстве своем малоактивны и не могут использоваться для промышленных целей. Поэтому после отбора наиболее активного природного штамма продуцента антибиотика для повышения его продуктивности применяют различные приемы и методы, основанные на законах генетики.
Большое значение для биосинтеза антибиотика имеет подбор рациональ-ного состава питательных сред, которые определяются в соответствии со штаммом продуцента. У каждого штамма потребность в источниках питания неодинакова, поэтому состав питательных сред не может быть постоянным для всех продуцентов.
Методы выделения и очистки антибиотиков весьма разнообразны и определяются химической природой антибиотика.
Основные классификации антибиотиков
В основу классификации антибиотиков положено несколько разных принципов.
По способу получения их делят:
- на природные;
- синтетические;
- полусинтетические (на начальном этапе получают естественным путем, затем синтез ведут искусственно).
- по преимуществу актиномицеты и плесневые грибы;
- высшие растения (фитонциды);
- ткани животных и рыб (эритрин, эктерицид).
По направленности действия:
По спектру действия - числу видов микроорганизмов, на которые действуют антибиотики:
- препараты широкого спектра действия (цефалоспорины 3-го поколения, макролиды);
- препараты узкого спектра действия (циклосерин, линкомицин, бензилпенициллин, клиндамицин). В некоторых случаях могут быть предпочтительнее, так как не подавляют нормальную микрофлору.
Классификация по химическому строению
По химическому строению антибиотики делятся на:
- бета-лактамные антибиотики;
- аминогликозиды;
- тетрациклины;
- макролиды;
- линкозамиды;
- гликопептиды;
- полипептиды;
- полиены;
- антрациклиновые антибиотики.
Классификация антибиотиков по механизму антимикробного действия
По механизму антимикробного действия антибиотики можно разделить на следующие группы:
- ингибиторы синтеза клеточной стенки (муреина);
- вызывающие повреждение цитоплазматической мембраны;
- подавляющие белковый синтез;
- ингибиторы синтеза нуклеиновых кислот.
Способы получения антибиотиков.
В настоящее время различают три способа получения антибиотиков: биологический, метод получения полусиитетических препаратов и синтез химических соединений - аналогов природных антибиотиков
Изучение химической структуры антибиотиков дало возможность получать их методом химического синтеза. Одним из первых антибиотиков, полученных таким методом, был левомицетин. Большие успехи в развитии, химии привели к созданию антибиотиков с направленно измененными свойствами, обладающих пролонгированным действием, активных в отношении устойчивых к пенициллину стафилококков. К пролонгированным препаратам от носятся экмоновоциллин, бициллин 1,3,5.
Читайте также:
- Как закалялась сталь реферат
- Спорт явление культурной жизни реферат
- Уголовная ответственность за мошенничество реферат
- Предмет и задачи экологии реферат
- Реферат пейзаж в фотографии

