Реакция трансплантат против хозяина реферат
Обновлено: 04.07.2024
Трансплантология - наука и отрасль медицины, которая занимается пересадкой органов и тканей от одного лица (реципиент) к другой (донор) с целью замены этих органов и тканей при их функциональной недостаточности и неэффективности консервативного лечения. Ежегодно количество пациентов, нуждающихся проведения трансплантации растет. Существует ряд заболеваний, которые лечатся способом трансплантации (миелома, острая лимфобластными и миелобластный анемия, талассемия, серповидно-клеточная анемия, тяжелый комбинированный и ряд врожденных иммунодефицитов, терминальная почечная, сердечная, легочная недостаточность, кардиомиопатия). Переливание крови и ее препаратов - также своего рода трансплантация, как и использование препаратов криоконсервированных эмбриональных тканей.
Трансплантация
Трансплантацией называют пересадку тканей или органов, хирургически изъятых из одного организма (донора), во внутреннюю среду другого организма (реципиента).
Виды трансплантации
В зависимости от взаимоотношений между организмами донора и реципиента выделяют следующие виды трансплантаций.
Аутотрансплантация — пересадка органа в пределах одного организма (донор и реципиент одновременно одно и то же лицо).
Изотрансплантация — пересадка осуществляется между двумя генетически идентичными организмами (однояйцевые близнецы). Подобные операции редки, так как количество однояйцевых близнецов невелико, а кроме того, они часто страдают схожими хроническими заболеваниями.
Аллотрансплантация (гомотрансплантация) — пересадка между организмами одного и того же вида (от человека человеку), имеющими разный генотип. Это наиболее часто используемый вид трансплантации. Возможен забор органов у родственников реципиента, а также у других посторонних людей.
Ксенотрансплантация (гетеротрансплантация) — орган или ткань пересаживают от представителя одного вида — другому, например, от животного — человеку. Метод получил крайне ограниченное применение (использование ксенокожи (кожа свиньи), клеточной культуры β-клеток поджелудочной железы свиньи)
ПО ТИПУ ТРАНСПЛАНТАТОВ:
1. пересадку органов (комплексов органов),
2. пересадку тканей и клеточных культур (пересадка костного мозга, культуры β-клеток поджелудочной железы, эндокринных желез и пр.)
ПО МЕСТУ ИМПЛАНТАЦИИ ОРГАНА все трансплантации делятся на два вида.
Ортотопическая трансплантация. Донорский орган имплантируется на то же место, где находился соответствующий орган реципиента. Таким образом осуществляют пересадку сердца, легких, печени.
Гетеротопическая трансплантация. Донорский орган имплантируют не на место нахождения органа реципиента, а в другую область. Причем неработающий орган реципиента может быть удален, а может и находиться на своем типичном месте. Гетеротопическую трансплантацию производят при пересадке почки, органной пересадке поджелудочной железы. Почку, например, обычно пересаживают на подвздошные сосуды.
Пластика - это, как правило, замещение дефекта органа или анатомической структуры трансплантатами без сшивания кровеносных сосудов. Термин применяется для обозначения трансплантации тканей, но не целых органов.
Пересадка - это трансплантация (замена) органа со сшиванием кровеносных сосудов. Такая трансплантация может быть ортотопической, т.е. на обычное для данного органа место, и гетеротопической, т.е. на место, не свойственное данному органу.
Подсадка - это трансплантация донорского органа без удаления такого же органа у реципиента.
РТПХ может возникать после аллогенной трансплантации. В зависимости от источника гемопоэтических (кроветворных) клеток различают два типа трансплантации — аллогенную и аутологичную. При аллогенной трансплантации клетки берут у другого человека. При аутологичной трансплантации клетки берут у самого пациента.
РТПХ возникает, когда иммунные клетки донора (трансплантат) воспринимают обычные клетки тела реципиента (хозяина) как инородные и атакуют их. Симптомы иммунной реакции зависят от того, какая часть организма будет повреждена донорскими клетками.
РТПХ возникает примерно у 20–50% пациентов, перенесших трансплантацию. Она может возникнуть в любое время после трансплантации. РТПХ может с трудом поддаваться лечению и в тяжелых случаях угрожать жизни пациента.
РТПХ может быть двух типов:
Острая РТПХ
Под острой РТПХ обычно понимают заболевание, развивающееся в первые 100 дней после трансплантации. Но она может развиться в любое время. Признаки и симптомы обычно включают поражение кожи, желудочно-кишечного тракта (ЖКТ) и печени . Участвующие в реакции иммунные клетки донора — это в основном T-клетки .
Признаки и симптомы острой РТПХ
Признаки и симптомы могут быть слабыми, умеренными или тяжелыми. К ним могут относиться:
- Тошнота
- Рвота
- Потеря аппетита
- Водянистая или кровавая диарея
- Боль в области живота
- Низкий уровень альбумина
- Желтуха
Печень
- Повышение уровня билирубина
- Нарушения в работе печени
Хроническая РТПХ
Хроническая РТПХ обычно определяется как заболевание, развивающееся спустя более чем 100 дней с момента трансплантации. Но она может развиться и раньше. Она напоминает аутоиммунные заболевания и может влиять на многие органы и системы органов. В основном за ее развитие отвечают T-клетки и B-клетки донора.
Признаки и симптомы хронической РТПХ
Признаки и симптомы могут быть слабыми, умеренными или тяжелыми. К ним могут относиться:
- Кожные симптомы — сыпь и зуд, шелушение кожи, утрата части кожного покрова, потемнение кожи, уплотнение текстуры кожи, рубцевание, ограничивающее подвижность суставов, например пальцев
- Повреждение или выпадение ногтей
- Выпадение волос
- Тугоподвижность суставов
- Сухость и язвы во рту и пищеводе
- Сухость и покраснение глаз
- У женщин — сухость влагалища и других слизистых оболочек
- У мужчин — укорочение и изменения пениса
- Кашель, одышка, хрипы
- Иссыхание и рубцевание легких
- Поражение или недостаточность печени
- Желтуха
Факторы риска
Факторы риска возникновения РТПХ указаны ниже.
- Степень расхождения между донором и пациентом (HLA-типирование)
Донорами при трансплантации могут быть братья или сестры, другие члены семьи или люди из Национального реестра доноров костного мозга, не являющиеся родственниками пациентов.
Маркеров HLA много. Половина из них наследуется от матери, вторая половина — от отца. У каждого из братьев и сестер, имеющих общих родителей, есть 25%-ный шанс (1 из 4) иметь похожий набор HLA. Вероятность совпадения HLA у других членов семьи совсем низкая. Для примерно 70% пациентов, нуждающихся в трансплантации, в семье не находится полностью совместимого донора.
Если степень совместимости донора высокая, то шансы на развитие РТПХ снижаются по сравнению с теми пациентами, у которых нет совпадения с донорами.
Исследования показывают, что клетки от более молодых доноров обеспечивают несколько лучшую долговременную выживаемость пациентов. В 85% случаев врачи заказывают клетки от доноров в возрасте 18–44 лет. В Национальном реестре доноров костного мозга учитываются доноры в возрасте от 18 до 60 лет.
- Источник гемопоэтических (кроветворных) клеток
Некоторые исследования показывают, что при наличии большого количества Т-клеток в трансплантате риск РТПХ повышается.
- Интенсивность режима подготовки к трансплантации
Некоторые исследования показывают, что при менее интенсивной химиотерапии риск ниже по сравнению с более интенсивной.
Профилактика
Лечащая группа примет меры для профилактики РТПХ.
- Выбор донора — врачи подберут для пациента наиболее близкого по HLA донора.
- Обработка донорских клеток — донорские клетки (трансплантат) подвергают обработке для того, чтобы сократить количество Т-клеток в попытке предотвратить иммунную реакцию, вызывающую РТПХ. Эта обработка может проводиться в специальной лаборатории подготовки клеток до введения клеток пациенту или путем назначения специальных лекарственных препаратов, которые дают пациенту после введения клеток.
- Иммуносупрессивные препараты — пациентам могут давать лекарства, снижающие активность донорских иммунных клеток. Чаще всего используются циклоспорин, такролимус, сиролимус, метотрексат, микофенолата мофетил, циклофосфамид, антитимоцитарный глобулин (АТГ) и алемтузумаб.
Что могут сделать пациенты и члены их семей
Важно, чтобы сами пациенты и члены их сетей принимали активное участие в профилактике РТПХ.
- Соблюдайте указания по приему препаратов. Крайне важно, чтобы пациенты принимали лекарства в точности так, как предписано врачами.
- Следите за ранними симптомами. Сообщайте врачам о любых изменениях. Они могут указывать на РТПХ. Как правило, РТПХ лучше лечится на ранних стадиях. Быстрое реагирование может положительно сказаться на здоровье пациента в долгосрочной перспективе.
- Защищайте кожу от солнца. Пребывание на солнце может вызвать или усугубить РТПХ. Пациентам, выходящим на улицу, нужно носить шляпу, одежду с длинными рукавами, брюки и наносить солнцезащитный крем с SPF 30 или выше. Лучше всего стараться вообще не бывать на солнце.
Диагностика и наблюдение
Пациентов тщательно наблюдают для выявления признаков РТПХ. Наблюдение может включать в себя медицинские осмотры, изучение истории болезни, лабораторные анализы и процедуры диагностической визуализации.
Дальнейшие исследования зависят от симптомов. Исследования могут включать получение образца тканей путем биопсии, в том числе кожи, эндоскопию верхних отделов ЖКТ и (или) колоноскопию , лабораторные анализы и визуализирующие методы исследования.
Лечение
Лечение направлено на подавление гиперактивности донорского иммунного ответа и на переобучение иммунной системы, чтобы она не атаковала нормальные ткани хозяина. Пациентов лечат по-разному в зависимости от выраженности их симптомов.
Лекарственные препараты
Кортикостероиды , такие как метилпреднизолон , дексаметазон и преднизон, — основной метод лечения РТПХ. Эти препараты могут приниматься перорально, внутривенно, в виде крема или мази, капель для глаз или полоскания для рта.
Другие лекарства — это иммуносупрессивные препараты (как те, что перечислены выше, в разделе о профилактике), а также препараты иммунотерапии и таргетной терапии.
Светолечение
Для лечения РТПХ используются фототерапия узкополосным ультрафиолетовым излучением (ультрафиолет В) и экстракорпоральный фотофорез (ЭКФ).
Облучение ультрафиолетом B используется для лечения кожных проблем, вызванных РТПХ.
ЭКФ предполагает взятие крови и разделение ее на эритроциты, лейкоциты и тромбоциты. Лейкоциты затем обрабатывают препаратами и облучают ультрафиолетом. Затем эти клетки вместе с остальными возвращают в организм. Обработанные клетки могут стимулировать иммунную систему для борьбы с РТПХ.
Примечание. Существует распространенное ошибочное мнение о том, что РТПХ — необходимое явление для успешной трансплантации. Это не так. Для успеха трансплантации пациенту не нужно переносить РТПХ.
При алло-трансплантации гемопоэтических стволовых клеток наиболее грозным осложнением и одной из основных причин смерти остается острая РТПХ. В патогенезе этого осложнения лежат отсутствие полной совместимости клеток донора и реципиента по HLA-системе и реакция зрелых донорских Т-лимфоцитов на клетки реципиента.
Индукция острой реакции трансплантат против хозияина происходит в связи с высвобождением после назначения режимов кондиционирования клетками реципиента провоспалительных цитокинов: ИЛ-1, ИЛ-6, ИЛ-8, фактора некроза опухоли (ФИО). Это сопровождается экспрессией HLA-антигенов I и II классов, молекул адгезии на клетках реципиента и донора. Цитокины также индуцируют активацию трансплантированных Т-лимфоцитов и NK-клеток (естественные киллеры), что влечет за собой повреждение тканей реципиента и выделение цитокинов, активирующих Th1 (T helper 1)-лимфоциты (ИЛ-2, ИФу).
Частота и степень выраженности острой реакции трансплантат против хозияина зависят от возраста реципиента (реже встречается у детей), источника гемопоэтических стволовых клеток (КМ, ПСКК, пуповинная кровь), совместимости между донором и реципиентом по HLA-системе, режима кондиционирования, профилактики с помощью различных имму-нодепрессантов, варианта гемобластоза, способов деконтаминации кишечника.
Острая реакция трансплантат против хозияина подразделяется на I, II, III и IV степени по отношению к интенсивности клинических проявлений и оценивается в соответствии с критериями Glucksberg и IBMTR Index.
Клинические проявления острой реакции трансплантат против хозяина (РТПХ):
— поражение кожи в виде сыпи, в более тяжелых случаях — разрушение эпидермиса, образование булл;
— нарушение функции желудочно-кишечного тракта (тошнота, рвота, диарея, боли в животе);
— поражение печени, сопровождающееся желтухой.
Безрецидивная и общая выживаемость больных, которым выполнили аутологичную трансплантацию костного мозга (ТКМ) или осуществляли химиотерапию
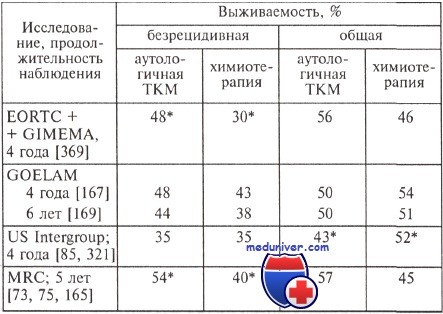
* Статистически значимые различия
Таким образом, вероятность развития острой реакции трансплантат против хозяина (РТПХ) после алло-ТГСК колеблется от 30 и 80 %, по данным ЕВМТ составляет 64,3 %, что связано с включением в исследование различных по своим характеристикам групп пациентов.
Степень выраженности острой реакции трансплантат против хозяина (РТПХ) влияет на выживаемость больных после алло-ТГСК. Трехлетняя безрецидивная выживаемость составила при острой реакции трансплантат против хозяина (РТПХ) I и II стадий 61 и 57 %, при III и IV - 34 и 7 % соответственно.
При сравнении вероятности развития острой реакции трансплантат против хозяина (РТПХ) при алло-ТКМ и алло-ТПСКК показано отсутствие определенных закономерностей. Однако ряд исследований подтверждает более частое возникновение острой реакции трансплантат против хозяина (РТПХ) после алло-ТПСКК. По данным других авторов, число острой и хронической реакции трансплантат против хозяина (РТПХ) после алло-ТКМ и алло-ТПСКК было одинаковым, при этом алло-ТКМ ассоциировалась с большей частотой развития тяжелой степени острой РТПХ (III—IV степень) по сравнению с алло-ТПСКК (24 и 8 % соответственно).
Очевидно, что возникновение острой реакции трансплантат против хозяина (РТПХ) у больных после алло-ТПСКК не доминирует по сравнению с алло-ТКМ, несмотря на явные различия в клеточном составе трансплантата. Это может быть связано с развитием цитокининдуцированной КСФ-Г поляризации Т-лимфоцитов в Th2 (T helper 2)-клетки при получении аллогенного трансплантата из ПСКК, в то время как в инициации острой реакции трансплантат против хозяина (РТПХ) в основном участвуют Th1-клетки. Эффект усиливается большим количеством в трансплантате из ПСКК дендритических клеток, которые главным образом также индуцируют ответ Th2-лимфоцитов и увеличенным содержанием моноцитов, подавляющих пролиферацию Т-лимфоцитов секрецией ИЛ-10.
Данные другого исследования предполагают возможное влияние дозы CD34+-клеток на развитие клинических проявлений острой РТПХ. Так, риск возникновения острой РТПХ зависел от способа профилактики при дозе CD34+-клеток в трансплантате менее 8 • 106/кг. Острая РТПХ развивалась реже при использовании такролимуса, а не циклоспорина А — соответственно в 18 и 39 % случаев. При концентрации CD34+-клеток более 8 • 106/кг выбор им-муносупрессивной терапии не имел принципиального значения.
Клинические и экспериментальные данные подтверждают, что удаление Т-лимфоцитов из трансплантата значительно снижает вероятность развития острой реакции трансплантат против хозяина (РТПХ). Минимальное количество CD3+ T-лимфоцитов в трансплантате, необходимое для индукции острой реакции трансплантат против хозяина (РТПХ), колеблется от 0,5 до 1 • 106/кг. Дозы CD3+-клеток от 0,05•106/кг и менее, от 0,05 • 10б/кг до 0,1 • 106/кг и более чем 0,1 • 106/кг сопровождаются риском развития острой реакции трансплантат против хозяина (РТПХ) I—IV стадии у 18, 35 и 44 % больных соответственно (р = 0,007). При анализе на основании Сох regression model в этом исследовании для развития острой РТПХ I—IV стадии имели значение четыре независимых фактора: 1) увеличение дозы CD34+-клеток (р = 0,02); 2) увеличение дозы CD3+-клеток (р = 0,02); 3) женский пол реципиента (р = 0,01); 4) возраст реципиента старше 2 лет (р = 0,007).
Таким образом, окончательное заключение о значении клеточных взаимодействий в развитии острой реакции трансплантат против хозяина (РТПХ) после алло-ТГСК может быть определено в будущем, после проведения экспериментальных и клинических рандомизированных исследований.
При анализе факторов, индуцирующих развитие острой реакции трансплантат против хозяина (РТПХ), установлено влияние возраста и стадии болезни. После алло-ТГСК при ХМЛ меньше вероятность развития острой реакции трансплантат против хозяина (РТПХ) и ниже степень у молодых больных и пациентов, которым трансплантация была выполнена в первый год с момента постановки диагноза. Пол донора и реципиента, источник трансплантата, метод профилактики острой реакции трансплантат против хозяина (РТПХ) не имели какого-либо значения.
Основу профилактики острой реакции трансплантат против хозяина (РТПХ) составляют препараты циклоспорин А, такролимус (FK506) и их сочетание с другими иммунодепрессантами.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

В 1966 г. Биллингемом были сформированы следующие условия для ее развития:
- трансплантат должен содержать иммунокомпетентные клетки;
- антигены реципиента должны быть признаны чужеродными для донора из-за несоответствия по аллоантигенам;
- реципиент не способен к иммунному ответу против клеток трансплантата.
Посттрансфузионная РТПХ (ПТ-РТПХ) является редким осложнением переливания крови и более чем в 90 % случаях приводит к полиорганной недостаточности и смерти.
Она возникает как результат проникновения иммунокомпетентных лимфоцитов при переливании крови и ее компонентов реципиенту, который находится в состоянии иммуносупрессии и/или не способен к иммунному ответу из-за гомологичности по HLA антигенам с донором, что позволяет донорским лимфоцитам избежать иммунного ответа и затем начать уничтожать клетки реципиента из-за иммунологических различий.
Точная частота ПТ-РТПХ неизвестна, так как этот диагноз зачастую упускается из-за схожей клинической картины с вирусной инфекцией или реакцией на проводимую терапию.
Хотя автор не проводил анализ трансфузионного анамнеза каждого пациента, он отметил, что переливание было проведено до и после операции свежей кровью. В то время переливание каждому пациенту неконсервированной цельной крови было обычной практикой среди хирургов. Это наблюдение и более поздние клинические случаи привели к выводу (Aoki с соавт.), что ПОЭ и ПТ-РТПХ являются одним и тем же заболеванием.
Факторы риска развития ПТ-РТПХ полностью не определены, но чаще данное осложнение наблюдается при трансфузии лицам с врожденным или приобретенным иммунодефицитом от кровных родственников, среди популяций с относительно гомогенными фенотипами HLA (например, в Японии), при внутриутробных переливаниях.
Любой незамороженный гемокомпонент, содержащий жизнеспособные лимфоциты, может потенциально вызвать ПТ-РТПХ (даже свежая плазма). При использовании замороженных компонентов крови ПТ-РТПХ возникает гораздо реже, предположительно из-за снижения жизнеспособности лимфоцитов в холодильном хранилище. Подсчитано, что данное осложнение может возникать при переливании более чем 80 тыс. лимфоцитов (Carey PM, Sacher RA: Transfusion-associated graft versus host disease).
При ПТ-РТПХ донорские лимфоциты не элиминируются иммунной системой реципиента, и HLA-антигены хозяина предоставляются донорским Т-лимфоцитам с помощью антигенпредставляющих клеток, таких как дендритные клетки или макрофаги. Интерлейкин-1 (IL-1), продуцируемый макрофагами, стимулирует Т-хелперные клетки. Т-хелперные клетки в свою очередь высвобождают интерлейкин-2 (IL-2), который стимулирует цитотоксические CD8+ Т-лимфоциты, а они в свою очередь уничтожают клетки реципиента, несущие молекулы HLA I класса (то есть все клетки, за исключением эритроцитов), где также принимают участие NK.
Под влиянием воспалительных цитокинов, таких как IL-1 и фактор некроза опухолей (TNF-a), высвобождаемых поврежденной тканью хозяина после лучевой терапии, химиотерапии или инфекционного заболевания, повышается экспрессия антигенов гистосовместимости хозяина и других молекул адгезии (ICAM-1, VCAM-1), что приводит к распознаванию ткани хозяина донорскими Т-лимфоцитами, тем самым усиливая процесс.
Так как клетки костного мозга и иммунной системы имеют донорское происхождение при трансплантации стволовых клеток, то костный мозг не поражается при данной ситуации. Однако при ПТ-РТПХ он имеет реципиентное происхождение, и это приводит к его поражению, что проявляется панцитопенией, глубокой нейтропенией, частыми инфекционными осложнениями и/или кровотечениями и высокой смертностью.
В клинической картине при РТПХ в первую очередь поражается кожа, желудочно-кишечный тракт и печень. Лихорадка и проявления со стороны кожных покровов обычно являются первичными показателями. Изменения кожи могут различаться от эритематозных пятен до геморрагических булл, при этом поражается большая поверхность, что может имитировать вирусные экзантемы и аллергические реакции. Желудочно-кишечные проявления включают тошноту, диарею, которая может быть профузной. Печеночная дисфункция, связанная с РТПХ, обычно оценивается лабораторными показателями, часто отмечается повышение щелочной фосфатазы, трансаминаз и прямого билирубина наряду с определяемой желтухой.
При появлении лихорадки, сыпи, изъязвлений на коже, дисфункции печени и жалоб со стороны желудочно-кишечного тракта следует заподозрить ПТ-РТПХ. Установить диагноз ПТ-РТПХ можно при помощи биопсии кожи (чаще всего), печени или кишечника. Гистологические изменения, подтверждающие РТПХ, представлены эпидермальными мононуклеарными инфильтратами, дегенерацией базальной мембраны и образованием булл в отсутствие эозинофилов.
Присутствие эозинофилов более характерно для лекарственной реакции, что помогает при дифференциальном диагнозе с ПТ-РТПХ. В печени обнаруживается лимфоцитарный инфильтрат в портальной триаде без клеток острого воспаления, однако эти гистопатологические данные не являются специфическими для РТПХ и рассматриваются при анализе полученных результатов.
Аналогично, результаты биопсии желудочно-кишечного тракта (кишечника) включают лимфоцитарные инфильтраты с апоптотическими эпителиальными клетками. При биопсии костного мозга — аплазия, гипоклеточность с лимфогистиоцитарными инфильтратами.
Поскольку в патогенезе ПТ-РТПХ играют большую роль сходства и различия по HLA-антигенам, определение генетического химеризма (то есть сосуществование в одном организме клеток и донора, и реципиента) может быть легко осуществлено с помощью полимеразной цепной реакции периферической крови (сравнительный анализ коротких тандемных повторов), что также подтверждает данный диагноз.
Нафамостат мезилат (nafamostat mesilate) — ингибитор сериновой протеазы, воздействующий на цитотоксические Т-клетки, — приводит к временному улучшению. Также как форма терапии рассматривается хлорохин —другой ингибитор сериновой протеазы, подавляющий цитолитические Т-клетки in vitro. Некоторые из новых анти-GVHD-реагентов, таких как даклизумаб, антитело рецептора к интерлейкину-2, который показал свою перспективность в лечении стойких к стероидам острых РТПХ, могут быть рассмотрены при лечении этого заболевания.
Поскольку лечение данного осложнения очень редко приводит к положительному результату, необходима профилактика его возникновения, основой которой является облучение любых компонентов крови с помощью гамма- или рентгеновских лучей. Фактически, вплоть до настоящего времени, это единственный метод, демонстрирующий постоянное и надежное предотвращение ПТ-РТПХ у людей.
Дозы радиации отличаются по разным протоколам, но обычно составляют от 15 до 50 Гр (FDA рекомендовано 25 Гр). Срок хранения компонентов также варьирует, от 14 до 38 дней с момента облучения.
Лейкодеплеция (то есть применение лейкоцитарных фильтров) сама по себе не может использоваться в качестве единственного метода для предотвращения ПТ-РТПХ, так как клетки, оставшиеся в продукте крови, остаются жизнеспособны, а определить их количество не представляется возможным. Поэтому данный метод используется в комбинации с облучением.
Клинический случай
Девочка 5-ти лет доставлена в больницу с лихорадкой, петехиальной сыпью на туловище и нижних конечностях, кровянистыми выделениями из прямой кишки в течение 5-ти дней. За месяц до госпитализации в связи с тромбоцитопенией получала курс стероидной терапии в течение 2 недель.
При объективном осмотре на момент поступления кожные покровы бледные с множественными петехиями, преимущественно на туловище и нижних конечностях. Также выявлена умеренная гепатоспленомегалия (печень на 5 см ниже правого края и селезенка на 3 см ниже левого берегового края), увеличение паховых и шейных лимфоузлов.
В гемограмме — панцитопения (общее количество лейкоцитов 2,8 × 10 9 /л и количество тромбоцитов 1 × 10 9 /л), анемия (гемоглобином 44 г/л). Высказано предположение об остром лейкозе: в периферической крови — лейкоэритробластическая картина крови, 66 % — крупные гранулированные лимфоциты.
Костный мозг гипоклеточный с относительным преобладанием гранулоцитов и множественными интерстициальными агрегатами зрелых лимфоцитов, миелоидный гемопоэз, уменьшение мегакариоцитарного ростка. Сывороточная биохимия, включая исследования функции печени и почек, находилась в пределах нормы.
Жаропонижающая терапия не привела к желаемому результату, при посеве крови роста бактерий нет. Ввиду цитопении пациентке перелита одна доза необлученной эритроцитарной массы от неродственного донора.
На девятый день после переливания крови лихорадка поднялась до более высоких цифр, появилась пурпурная сыпь по всему телу, постоянная диарея и повышение ферментов печени. Был рассмотрен вариант ПТ- РТПХ, выполнена биопсия кожи: некротические кератиноциты и экзоцитоз нейтрофилами в эпидермисе, что соответствует РТПХ II степени; панцитопения по гемограмме.
В костном мозге при биопсии — гипоклеточные пространства с множественными междоузельными агрегатами лимфоцитов. Полученные результаты согласуются с ПТ-РТПХ. Пациентке введен метилпреднизолон 30 мг/кг парентерально в течение 3 дней с последующим переходом на преднизолон 2 мг/кг/день перорально вместе с Г-КСФ.
Отмечен положительный ответ на проведенное лечение: сыпь на коже исчезла, повышенные ферменты печени нормализовались, лихорадка исчезла. Панцитопения сохранялась, клинически пациентка стабильна и выписана на амбулаторное наблюдение.
Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии им. Д. Рогачева, Москва, Россия, 117997
Кожные проявления хронической реакции трансплантат против хозяина
Журнал: Клиническая дерматология и венерология. 2016;15(1): 85-87
Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии им. Д. Рогачева, Москва, Россия, 117997





В статье представлены особенности клинической картины, диагностики и лечения кожных проявлений хронической реакции трансплантат против хозяина.
Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии им. Д. Рогачева, Москва, Россия, 117997
Хроническая реакция трансплантат против хозяина (РТПХ) представляет собой мультисистемное алло/аутоиммунное заболевание, характеризующееся иммунной дисрегуляцией, иммунодефицитом и поражением внутренних органов.
Актуальность темы обусловлена тем, что РТПХ — частое осложнение трансплантации гемопоэтических стволовых клеток (ТГСК). По данным зарубежных коллег [1], РТПХ возникает у половины больных после аллогенной трансплантации кроветворных стволовых клеток и является одной из основных причин смертности этих пациентов.
Хроническая РТПХ развивается спустя 100 дней после аллогенной ТГСК. Через 2 года после ТГСК РТПХ регистрируется у 25—80% пациентов. Лимитированная кожная форма составляет 30—50%, по данным разных авторов, а 5-летняя общая выживаемость при экстенсивных формах данного осложнения не превышает 40%.
Биологические механизмы формирования хронической РТПХ не столь очевидны по сравнению с острой РТПХ. В основе патогенеза данного состояния лежит реакция несовместимых по тканевым антигенам иммунокомпетентных клеток донора, против иммунонекомпетентных клеток реципиента [2]. К главным органам-мишеням РТПХ относят кожу, кишечник и печень. Хроническая РТПХ в коже представлена мононуклеарным воспалительным инфильтратом, лимфоцитарной деструкцией сальных и потовых желез, неравномерным акантозом, гиперкератозом или атрофией эпидермиса, фиброзом и склерозом дермы. Помимо этого, происходит деструкция слезных и слюнных желез, эпителия респираторного тракта, кишечника, желчных протоков. Повреждение эндотелия сосудов в период кондиционирования, т. е. подготовке к ТГСК с целью создания иммуносупрессивного состояния, приводит к стимуляции синтеза клеток-предшественников эндотелиоцитов и васкуляризации. Васкуляризация в свою очередь облегчает распространение иммунных клеток к органам-мишеням. Затем образовавшиеся сосуды сами становятся мишенью для аллореактивных донорских T-клеток, что приводит к фиброзу кровеносных сосудов. Алло-аутоиммунный характер процесса, нарушение как гуморального, так и клеточного звеньев иммунитета объясняют полиморфизм клинической картины [2].
К факторам риска возникновения хронической РТПХ относят наличие острой РТПХ, возраст пациента (риск развития хронической РТПХ увеличивается с возрастом), женский пол донора (для реципиента мужского пола) и периферическую кровь, как источник стволовых клеток. Если в качестве источника гемопоэтических стволовых клеток (ГСК) используются периферические стволовые клетки крови здорового человека, полученные после стимуляции костного мозга рекомбинантными факторами роста — гранулоцитарным/гранулоцитарно-макрофагальным колониестимулирующим фактором (Г-КСФ, ГМ-КСФ) — риск развития РТПХ возрастает [3].
Клиническая картина хронической РТПХ может быть представлена как изолированно кожными поражениями, так и экстенсивными формами, с вовлечением в патологический процесс внутренних органов. У 50% пациентов с хронической РТПХ в патологический процесс включено несколько систем внутренних органов. Кожный процесс при хронической РТПХ может имитировать пойкилодермию, красный плоский лишай, склеродермию, атрофодермию, ихтиоз, пруриго. Хроническая РТПХ, имитирующая витилиго или атопический дерматит, развивается редко (5,3 и 4,9% случаев соответственно). Склеродермоподобная форма хронической РТПХ представляет особый фенотип хронической РТПХ, который часто связан с тяжелой формой инвалидности после аллогенной ТГСК [4, 5]. Склероз слезных каналов может приводить к формированию синдрома Шегрена. Тяжесть течения хронической РТПХ определяется степенью вовлечения в патологический процесс внутренних органов. Снижение массы тела, диарея, диспноэ, сухость глаз, быстрая утомляемость являются неблагоприятными прогностическими признаками [3].
Эффлоресценции при хронической РТПХ могут быть как истинно, так и ложно полиморфными. Первичные элементы представлены папулами, бляшками, розеолой; вторичные — атрофией, гиперпигментацией, депигментацией, лихенификацией, рубцовыми изменениями. Кожные высыпания, сопряженные с нарушением целостности кожного покрова (экскориации, трещины, эрозии и язвы), наиболее опасны для пациентов с хронической РТПХ, так как на фоне иммуносупрессивной терапии могут приводить к инфекционным осложнениям. Хроническая РТПХ может сопровождаться алопецией и ониходистрофией (онихогрифоз, онихолизис).
Дифференциальную диагностику проводят с системной склеродермией, токсидермией, вирусными экзантемами и фототоксическими реакциями [6].
В общем и биохимическом анализах крови при хронической РТПХ определяется лимфоцитопения, эозинофилия, гипер-, гипогаммаглобулинемия [3].
Диагностика кожной формы хронической РТПХ методами патоморфологического исследования сложна в силу неоднозначности интерпретации. Так, в ходе многоцентрового исследования, в котором из 72 центров, занимающихся аллогенной трансплантацией костного мозга, лишь 25 центров участвовали в описании клинической картины и только 17 центров участвовали в интерпретации гистологической картины. При этом только 88% опрошенных согласились, что гистологическая картина при кожной форме РТПХ специфична и может быть использована для постановки диагноза [7]. Для патоморфологической картины склеродермоподобной формы хронической РТПХ характерны утолщение, гомогенизация и уплотнение коллагена в дерме [3, 8]. Для кожной формы хронической РТПХ описаны критерии гистологической диагностики, однако, по мнению ряда авторов [8—11], они являются неспецифичными и их интерпретация субъективна.
Для контроля эффективности лечения кожной формы РТПХ методом экстракорпоральной фотохимиотерапии используются цитологические тесты (оцениваются апоптоз мононуклеарных клеток и пролиферация лимфоцитов) [12]. Имеется единичное описание использования ультразвукового метода исследования (20 MHz) с акцентом на плотность и толщину очагов поражения [13].
На сегодняшний день не существует валидизированной шкалы, позволяющей оценивать кожные проявления хронической РТПХ, с этой целью используется шкала NIH (0—3). Эта шкала эффективна в определении степени тяжести хронической РТПХ с кожными проявлениями, но не достаточно чувствительна для динамического наблюдения [7, 14].
Патогенетическое лечение проводится гематологами, однако пациенты с кожными проявлениями хронической РТПХ нуждаются также и в симптоматическом лечении кожных проявлений. Пациенты с хронической РТПХ получают стандартную системную иммуносупрессивную терапию. Эффективными являются фототерапия и фотоферез. Так, в исследовании F. Taverna и соавт. [12] показано, что при проведении фототерапии отмечается общая тенденция снижения интенсивности кожных проявлений РТПХ, благодаря чему может быть ограничено использование системных ГКС. Местное лечение подразумевает применение топических ГКС, нестероидных топических иммуномодуляторов, топических ингибиторов кальциневрина [3].
Вышесказанное диктует необходимость разработки методов местного лечения и ухода за пораженной кожей больных с хронической РТПХ.
Читайте также:

