Реакции ионного обмена реферат
Обновлено: 25.06.2024
Значительное количество протекающих в природе и осуществляемых на практике процессов являются ионообменными. Ионный обмен лежит в основе миграции элементов в почвах и организме животных и растений. В промышленности его применяют для разделения и получения веществ, обессоливания воды, очистки сточных вод, концентрирования растворов и др. Обмен ионами может происходить как в гомогенном растворе, так и в гетерогенной системе. В данном случае под ионным обменом понимают гетерогенный процесс, посредством которого осуществляется обмен между ионами, находящимися в растворе и в твердой фазе, называемой ионитом или ионообменником. Ионит сорбирует ионы из раствора и взамен отдает в раствор ионы, входящие в его структуру.
Ионный обмен - это процесс, в результате которого ионы, находящиеся в твердой фазе, обмениваются с ионами, находящимися в растворе. Нерастворимое твердое вещество может представлять собой какой-либо природный материал либо синтетическую смолу. Природные материалы, используемые для ионного обмена, включают цеолиты (комплексные алюмосиликаты натрия) и глауконитовый песок. Синтетические смолы представляют собой сложные полимерные вещества. Обычно они изготовляются в виде маленьких нерастворимых шариков.
Способность ионитов к ионному обмену объясняется их специфической структурой. Ионит состоит из твердой нерастворимой в воде молекулярной сетки, к отдельным местам которой на поверхности и внутри ее массы присоединены химически активные функциональные группы атомов ионита. С электрохимической точки зрения каждая молекула является своеобразным твердым электролитом. В результате электролитической диссоциации ионита вокруг нерастворимого в воде ядра образуется ионная атмосфера, представляющая собой ограниченное пространство вокруг молекулы ионита, в котором находятся подвижные и способные к обмену ионы. Если эти подвижные ионы имеют положительный заряд, ионит называется катионитом, если отрицательный - анионитом

Реакции ионного обмена подчиняются правилам, действующим для реакции обычных электролитов:эквивалентность обмена ионов, обратимостьэтого процесса,селективность.
Эквивалентностьзаключается в том, что обмен ионов между раствором и ионитом происходит в эквивалентных соотношениях так, чтобы соблюдался принцип электронейтральности раствора. Однако следует отметить, что суммарное количество ионов в растворе может меняться после ионирования вследствие протекания вторичных реакций (нейтрализации, образования малодиссоциируемых соединений). Если вода щелочная, то выделяющийся водород вступает во взаимодействие с ионами ОН – и образует малодиссоциируемое соединение – воду, при этом количество ионов в растворе уменьшается.
Обратимостьпроцесса позволяет экономно использовать ионит в технологических схемах. Преимущественное направление реакции обмена определяется согласно закону действующих веществ. При истощении ионита можно, повысив в растворе концентрацию первоначальных обменных
ионов, сдвинуть реакцию ионного обмена в направлении восстановления
ионита в исходное состояние, т.е. произвести регенерацию ионита.
Способность ионита к преимущественной сорбции одних видов ионов перед другими называетсяселективностью.Причиной, вызывающей селективность, является различие энергий притяжения различных ионов твердой фазой, обусловленной значениями радиусов сорбируемых ионов и их зарядов. При увеличении заряда иона (т.е. при повышении его валентности) увеличивается энергия притяжения его по закону Кулона противоположно заряженной твердой фазой. Поэтому с повышением валентности ионов селективность их сорбции ионитом возрастает. Соответственно: двухвалентные ионы сорбируются лучше чем одновалентные, а трехвалентные поглощаются лучше двухвалентных.
Установлены ряды селективности для катионов и анионов, в которых каждый последующий ион сорбируется лучше, чем предыдущий. Например, для сильнокислотного катионита КУ-2 получен следующий ряд: H + + + 2+ 2+ 2+ 2+ 3+ …
Для ионов высокоосновного анионита действует следующий ряд:
ОН – – – – – – 2 – .
Требования к качеству ионитов:
Качество ионитов определяется рядом физико-химических и технологических свойств, важнейшими из которых являются:
фракционный состав, насыпная плотность, химическая стойкость, механическая прочность, обменная емкость, кислотность или основность.
Фракционным составом ионитов называется распределение частиц по размерам. Мелкозернистый катионит имеет более высокую емкость, чем крупнозернистый вследствие более развитой поверхности. С другой стороны, чем мельче зерна катионита, тем больше его гидравлическое сопротивление и расход электроэнергии на фильтрование воды, поэтому оптимальные размеры зерен ионитов 0,3¸2,0 мм. Коэффициент неоднородности засыпаемых в фильтр фракций не должен превышать kн = d80/d10 3 ). Различают полную обменную емкость, емкость “до проскока” и рабочую. Полная обменная емкостьпоказывает количество ионов, которое может быть сорбировано
ионитом при полной замене всех обменных ионов. Если фильтрование заканчивается в момент проскока поглощаемого иона, т.е. концентрация его в фильтрате близка к нулю, то обменная емкость ионита определяется как емкость “до проскока”. Однако на практике фильтрование часто прекращают в момент, когда концентрация поглощаемого иона в фильтрате составляет некоторое весьма малое значение. В этом случае обменная емкость определяется как рабочая, которая часто настолько мало отличается от емкости “до проскока”, что их можно принимать равными друг другу. Рабочая обменная емкость зависит от условий регенерации, обменного иона, природы поглощаемых ионов, значения рН, скорости фильтрования, геометрических характеристик слоя.
Азотнокислым кальцием и содой. В чем заключается сущность этих реакций? Каким одним ионным уравнением они могут быть выражены? Можно ли приготовить растворы, содержащие одновременно следующие пары веществ: а) ZnCl2 и NaOH; б) AgNO3 и Mg (CH3COO)2? Составьте молекулярные уравнения этих реакций и объясните порядок их составления. Реакции в растворах выражаются следующими ионными уравнениями… Читать ещё >
- методические указания и контрольные задания по химии
Реакции ионного обмена ( реферат , курсовая , диплом , контрольная )
Раствор поваренной соли, предназначенный для электролиза, освобождают от ионов кальция и магния с помощью карбоната натрия. Составьте молекулярные и ионные уравнения этих реакций.
Составьте молекулярные и ионные уравнения реакций между водными растворами: а) карбоната натрия и серной кислоты; б) силикатом натрия и хлористоводородной кислоты; в) йодида калия и нитрата свинца (II).
Составьте два различных уравнения в молекулярной форме, которые будут соответствовать данному уравнению в сокращенной ионной форме: Ni2+ + S2- = NiS.
Составьте молекулярные и ионные уравнения реакций между водными растворами: а) сульфида калия и соляной кислоты; б) сульфата железа (II) и гидроксида натрия; в) нитрата никеля (II) и хлорида натрия.
Реакции в растворах выражаются следующими ионными уравнениями:
а) 2Н+ + СО32- = СО2 + H2O; б) Ni2++S2-= NiS; в) Н + + ОН- = Н2О.
Напишите в молекулярной и ионной формах уравнения реакций взаимодействия между следующими водными растворами: а) гидроксида хрома (III) и гидроксида калия; б) нитрата меди (II) и сульфита натрия; в) хлорида кальция и йодида натрия.
Можно ли приготовить растворы, содержащие одновременно следующие пары веществ: а) ZnCl2 и NaOH; б) AgNO3 и Mg (CH3COO)2?
Составьте молекулярные и ионные уравнения возможных реакций.
Составьте молекулярные и ионные уравнения реакций взаимодействия между следующими веществами: а) нитратом бария и сульфатом натрия; б) карбонатом натрия и серной кислотой.
Перечислите условия необратимого протекания реакций ионного обмена. Приведите примеры, запишите уравнения реакций в молекулярной и ионной формах.
Выразите молекулярными уравнениями реакции, проходящие в растворах между следующими веществами: а) хлористым кальцием и углекислым аммонием;
б) азотнокислым кальцием и содой. В чем заключается сущность этих реакций? Каким одним ионным уравнением они могут быть выражены?
Вы можете изучить и скачать доклад-презентацию на тему Реакции ионного обмена. Презентация на заданную тему содержит 14 слайдов. Для просмотра воспользуйтесь проигрывателем, если материал оказался полезным для Вас - поделитесь им с друзьями с помощью социальных кнопок и добавьте наш сайт презентаций в закладки!













Цели и задачи Цель: развитие знаний обучающихся о необратимых реакциях на примере реакций ионного обмена (РИО) и условий их протекания Для достижения поставленной цели требуется решить следующие задачи: ознакомиться с РИО изучить экспериментально условия протекания РИО закрепить полученные знания
Основные понятия Реакция называется необратимой, если один из продуктов реакции является нерастворимым, газообразным или малодиссоциирующим веществом Реакция называется обратимой, если не происходит связывания ионов в нерастворимые, газообразные или малодиссоциирующие вещества
Основные понятия Реакциями ионного обмена называются реакции, протекающие между ионами в растворах электролитов Сущность РИО заключается в связывании ионов электролитов в нерастворимые, газообразные и малодиссоциирующие вещества Реакции ионного обмена являются необратимыми
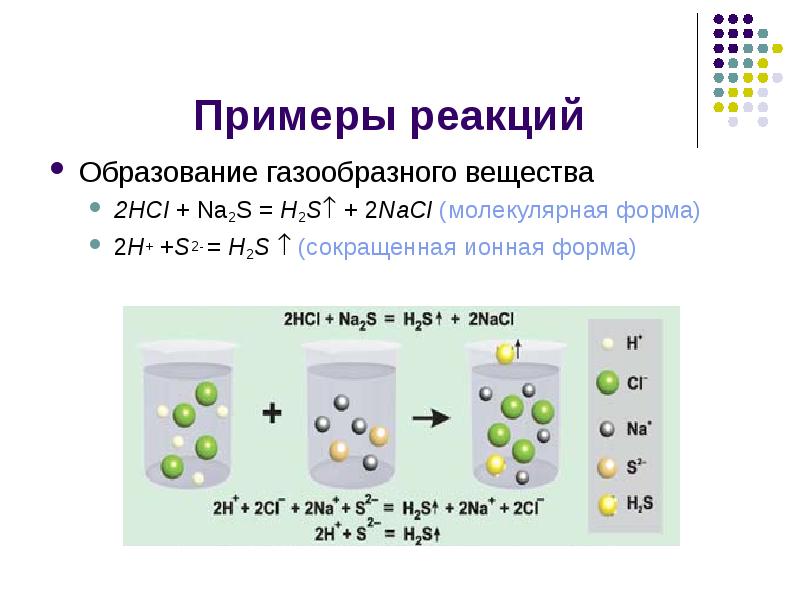
Условия протекания РИО Образование осадка (нерастворимого вещества) Образование газообразного вещества Образование малодиссоциирующего вещества (например, воды)
Примеры реакций Образование осадка BaCl2 + Na2SO4 = BaSO4 + 2NaCl (молекулярная форма) Ba2+ + SO42- = BaSO4 (сокращенная ионная форма)
Примеры заданий для самостоятельной работы Какие из перечисленных реакций относятся к РИО? Ответ обоснуйте AgNO3 + NaCl = AgCl + NaNO3 Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O Na2CO3 + 2HCl = 2NaCl + CO2 +H2O Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3 K2S + H2SO4 = K2SO4 + H2S 2KCl + Na2SO4 = 2NaCl + K2SO4
Примеры заданий для самостоятельной работы По схемам сокращенных ионных уравнений составить молекулярные и полные ионные уравнения 2H+ + 2OH- 2H2O 3Ca2+ + 2PO43- Ca3(PO4)2 Pb2+ + S2- PbS SO32- + 2H+ SO2 + H2O CO32- + 2H+ CO2 + H2O Cu2+ +2OH- Cu(OH)2
Примерный перечень контрольных вопросов Какие реакции называются необратимыми и обратимыми? Какие реакции называются реакциями ионного обмена? Являются ли реакции ионного обмена обратимыми? В чем заключается сущность реакций ионного обмена?
Примерный перечень контрольных вопросов Приведите примеры реакций ионного обмена в молекулярной и сокращенной ионной формах с образованием осадка с образованием газообразного вещества с образованием малодиссоциирующего вещества
Рефлексия С какими новыми понятиями вы познакомились на уроке? Какие трудности усвоения материала по данной теме у вас возникли? Понимание каких реакций ионного обмена вызвало у вас затруднение? Что на данном занятии было вам интересно?

Цель моей работы – дать общие понятия ионообменных реакций, рассказать об их роли в жизни.
Химические реакции в растворах электролитов ( кислот , оснований и солей ) протекают при участии ионов , которые образуются за счет воды. Если такие реакции не сопровождаются изменением степеней окисления , они называются реакциями двойного обмена [1].
Вода является универсальным растворителем для всех веществ. Это объясняется полярным характером молекулы воды и способностью ее молекул образовывать химические связи с другими молекулами [2]. Эту гипотезу доказали И.А. Каблуков и В.А. Кистяковский используя химическую теорию растворов Д.И. Менделеева [1].
При растворении электролита в воде происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем диссоциация на ионы.
Молекулы воды представляют собой диполь, так как атомы водорода в воде расположены под углом 104,5 градусов, благодаря чему молекула имеет угловую форму (рисунок 1).
Рисунок 1 – Строение молекулы воды
Как правило легче всего диссоциируют вещества с ионной кристаллической решеткой, так как они уже состоят из готовых ионов. При их растворении диполи воды ориентируются противоположными заряженными концами вокруг положительных и отрицательных ионов электролита. Между молекулами воды и ионами электролита возникаю силы притяжения. В результате связь между ионами ослабевает и происходит переход ионов из кристалла в раствор (рисунок 2).
Упрощенно происходящие процессы можно отразить с помощью следующего уравнения: NaCl → Na + + Cl –
Рисунок 2 – Схема электролитической диссоциации хлорида натрия
на гидратированные ионы
Аналогично диссоциируют и молекулы электролитов с ковалентной полярной связью, только в этом случае под влиянием молекул воды происходит превращение ковалентной полярной связи в ионную (Рисунок 3) [1].
Рисунок 3 – Схема электролитической диссоциации полярной молекулы хлороводорода на гидратированные ионы
Надо заметить, что в водном растворе возможен частичный или полный гидролиз. В следствии частичного гидролиза меняется лишь pH среды, но полный гидролиз уже будет являться полноценной реакцией. Рассмотрим пример того, когда потенциальный электролит перестает быть таковым вследствие полного гидролиза. Al 2 S 3 – соль слабого основания и слабой кислоты, реагирует с водой, образуя гидроксид алюминия и сероводород, следовательно такое и многие некоторые соединения нельзя рассматривать, как поставщика ионов в раствор [3].
Все ионнообменные реакции в растворах электролитов протекают согласно Закону Бертолле.
Реакции обмена протекают только тогда, когда образуется малорастворимое соединение (осадок), легколетучее вещество (газ), или малодиссоциирующее соединение (очень слабый электролит, в том числе и вода) [4]. Примеры реакций ,идущих согласно правилу Бертолле:
1) BaS+2HCl=BaCl 2 +H 2 S↑
2) Na 2 SiO 3 +2HCl=H 2 SiO 3 ↓+2NaCl
3) H 2 SO 4 +Ba(OH) 2 =BaSO 4 +2H 2 O
Стоит учесть, что данное правило работает только для ненасыщенных растворов, так, например, реакция не идущая при смешение слабых растворов, пойдет, если слить сильные растворы двух солей: Возьмем, например реакцию между растворами хлорида калия и нитрата натрия-NaNO 3 +KCl=KNO 3 +NaCl,согласно правилу Бертолле такая реакция идти не должна, так как продукты реакции, являются сильными электролитами, но сливая насыщенные растворы таких соединений выпадет осадок (температура воды 30°C), который оказывается хлоридом натрия, всему виной тут разные значения растворимости NaNO 3 , KCl, KNO 3 и NaCl на одинаковый объем при температуре в 30 градусов. Так как в осадок выпала именно поваренная соль следует предположить, что у нее наименьшая растворимость, так и есть. При понижение температуры в осадок выпадают и другие соединения, уже при 22 градусах по Цельсию в осадок уходит KNO3 [4].
Вследствие этого факта, в дальнейшее будут рассматриваться реакции между не насыщенными растворами электролитов.
Реакцию обмена в растворе принято изображать тремя уравнениями: молекулярным, полным ионным и сокращённым ионным. В ионном уравнении слабые электролиты, газы и малорастворимые вещества изображают молекулярными формулами.
Na 2 SO 4 + BaCl 2 = BaSO 4 ↓ + 2NaCl
Так как сильные электролиты существую в растворе в виде ионов распишем их.
2Na + + SO 4 2– + Ba 2+ + 2Cl – = BaSO 4 ↓ + 2Na + + 2Cl –
При исключении из правой и левой части одинаковые ионы мы получаем сокращенное ионное уравнение
Ba 2+ + 2Cl – = BaSO 4 ↓
Это уравнение показывает, что сущность процесса сводится к взаимодействию ионов бария и сульфат-ионов, в результате которых выпадает осадок сульфата бария. При этом совершенно не имеет никакого значения в состав каких электролитов они входят. Сокращенное ионное уравнение показывает сущность химической реакции и показывает какие ионы реагируют и какое вещество получается в результате.
Рассмотрим примеры реакций протекающих с образованием газа (а) и малодиссоциируемого вещества (б) [1].
а) Na 2 S + 2HCl = 2NaCl + H 2 S↑
2Na + + S 2– + 2H + + 2Cl – = 2Na + + 2Cl – + H 2 S↑
2H + + S 2– = H 2 S↑
б) NaOH + HCl = NaCl + H 2 O
Na + + Cl – + H + + Cl – = Na + + Cl – + H 2 O
Ионно-молекулярные уравнения помогаю понять особенности протекания реакций между растворами электролитов. Рассмотрим в качестве примера несколько реакций, протекающих с участием слабых электролитов.
- Ионные реакции в растворах слабых электролитов
Нейтрализация сильной кислоты сильным основанием сопровождается одним и тем же тепловым эффектом, так как сводится к одному и тому же процессу – образованию молекул воды из ионов водорода и гидроксид ионов. Однако при нейтрализации слабой кислоты сильным основанием или сильной кислоты слабым основанием, тепловые эффекты различны. Напишем реакцию нейтрализации слабой кислоты сильным основанием.
CH 3 COOH + NaOH = CH 3 COONa + H 2 O
CH 3 COOH + Na + + OH – = CH 3 COO – + Na + + H 2 O
Как видно не претерпевают изменений в ходе реакции только ионы натрия. Поэтому сокращенное ионное уравнение имеет вид.
CH 3 COOH + OH – = CH 3 COO – + H 2 O
Нейтрализация сильной кислоты слабым основанием.
HNO 3 + NH 4 OH = NH 4 NO 3 + H 2 O
H + + NO 3 – + NH 4 OH = NH 4 + + NO 3 – + H 2 O
Как видно не претерпевают изменений в ходе реакции только нитрат ионы. Поэтому сокращенное ионное уравнение имеет вид.
H + + NH 4 OH = NH 4 + + H 2 O
Нейтрализация слабой кислоты слабым основанием.
CH 3 COOH+ NH 4 OH = CH 3 COONH 4 + H 2 O
В приведенной реакции все вещества, кроме соли слабые электролиты. Поэтому полное и сокращенное ионное уравнение имеют один и тот же вид.
CH 3 COOH+ NH 4 OH = CH 3 COO – + NH 4 + + H 2 O
Сравнивая между собой полученные ионно-молекулярные уравнения, мы видим, что все они различные. Поэтому не одинаковые и теплоты этих реакций.
В реакциях нейтрализации, в которых хотя бы одно из веществ слабый электролит и при которых молекулы малодиссоциирующих веществ имеются не только в правой, но и в левой части уравнения, протекают не до конца. Они доходят до состояния равновесия, при которых соль существует вместе с кислотой и основанием, от которых она образованная. Поэтому уравнения подобных реакций правильнее записывать как обратимые реакции [5].
CH 3 COOH + OH – ↔ CH 3 COO – + H 2 O
H + + NH 4 OH ↔ NH 4 + + H 2 O
CH 3 COOH+ NH 4 OH ↔ CH 3 COO – + NH 4 + + H 2 O
- Применение ионообменных реакций в водном растворе .
Вероятно, чаще всего ионообменные реакции используют на кухне и в химической лаборатории. Сейчас речь пойдет о втором месте, там они очень активно используются в качественном анализе и количественном анализе.
Например, для определения катиона железа (III) ,можно использовать соли тиоциановой кислоты, так как гидраты роданида железа (III) окрашивают раствор красный цвет.
Так же кроме просто определения данного элемента, за счет ионообменных реакций, можно отделять нужный нам элемент в виде нерастворимого соединения. Так, осадительные методы отделения бария основаны,как правило, на низкой растворимости его сульфата и хромата в водных растворах. Кроме только качественного определения бария можно, за счет небольшой растворимости некоторых его соединений, можно количественно определить содержание бария в той или иной смеси. Так действует наиболее распространенный гравиметрический метод определения бария – сульфатный метод [6]
В химической промышленности (производство минеральных удобрений) довольно часто используют реакцию нейтрализации - реакцию ионного между кислотой и основанием, в ходе которой образуется соль и вода. При правильном мольном соотношение реагирующих веществ способ отделения данной соли становится довольно выгодным – его можно свести к выпариванию воды. Таким способом, к примру, получают селитры бария или кальция.
Читайте также:

