Распределение молекул по скоростям распределение максвелла опыт штерна реферат
Обновлено: 02.07.2024
Молекулы газа при своем движении постоянно сталкиваются. Скорость каждой молекулы при столкновении изменяется. Она может возрастать и убывать. Однако среднеквадратичная скорость остается неизменной. Это объясняется тем, что в газе, находящемся при определенной температуре, устанавливается некоторое стационарное, не меняющееся со временем распределение молекул по скоростям, которое подчиняется определенному статистическому закону. Скорость отдельной молекулы с течением времени может меняться, однако доля молекул со скоростями в некотором интервале скоростей остается неизменной.
Нельзя ставить вопрос: сколько молекул обладает определенной скоростью. Дело в том, что, хоть число молекул очень велико в любом даже малом объеме, но количество значений скорости сколь угодно велико (как чисел в последовательном ряде), и может случиться, что ни одна молекула не обладает заданной скоростью.
Основываясь на опыте Штерна, можно ожидать, что наибольшее число молекул будут иметь какую-то среднюю скорость, а доля быстрых и медленных молекул не очень велика. Необходимые измерения показали, что доля молекул , отнесенная к интервалу скорости Δv, т.е. , имеет вид, показанный на рис. 3.3. Максвелл в 1859 г. теоретически на основании теории вероятности определил эту функцию. С тех пор она называется функцией распределения молекул по скоростям или законом Максвелла.
Аналитически она выражается формулой,
где m – масса молекулы, k – постоянная Больцмана.
Установление этой зависимости позволило определить кроме уже известной среднеквадратичной скорости еще две характерные скорости – среднюю и наиболее вероятную. Средняя скорость – это сумма скоростей всех молекул, деленная на общее число всех молекул в единице объема.
Средняя скорость, подсчитанная на основании закона Максвелла, выражается формулой или
Наиболее вероятная скорость – это скорость, вблизи которой на единичный интервал скоростей приходится наибольшее число молекул. Она рассчитывается по формуле:
Сопоставляя все три скорости:
1) наиболее вероятную
3) среднюю квадратичную
– видим, что наименьшей из них является наиболее вероятная, а наибольшей – средняя квадратичная. Относительное число быстрых и медленных молекул мало (рис. 3.4).
При изменении температуры газа будут изменяться скорости движения всех молекул, а, следовательно, и наиболее вероятная скорость. Поэтому максимум кривой будет смещаться вправо при повышении температуры и влево при понижении температуры. Высота максимума не будет оставаться постоянной. Дело в том, что площадь заштри-хованной фигуры численно равна доле общего числа молекул n, которую образуют молекулы со скоростями в указанном интервале. Общая площадь, ограниченная кривой распределения и осью абсцисс (скоростей), таким образом, равна единице и не меняется при изменении температуры (рис. 3.5). Поэтому высота максимума и меняется при изменении температуры.
Кривые распределения молекул по скоростям начинаются в начале координат, асимптотически приближаются к оси абсцисс при бесконечно больших скоростях. Слева от максимума кривые идут круче, чем справа. То, что кривая распределения начинается в начале координат, означает, что неподвижных молекул в газе нет. Из того, что кривая асимптотически приближается к оси абсцисс при бесконечно больших скоростях, следует, что молекул с очень большими скоростями мало.
1. Сивухин Д.В., Общий курс физики. Термодинамика и молекулярная физика, 2 изд., Москва, 1979, пар.72-74
§4 Закон Максвелла о распределении по скоростям и энергиям
Закон распределения молекул идеального газа по скоростям, теоретически полученный Максвеллом в 1860 г. определяет, какое число dN молекул однородного ( p = const) одноатомного идеального газа из общего числа N его молекул в единице объёма имеет при данной температуре Т скорости, заключенные в интервале от v до v + dv .
Для вывода функции распределения молекул по скоростям f ( v ) равной отношению числа молекул dN, скорости которых лежат в интервале v ÷ v + dv к общему числу молекул N и величине интервала dv

Максвелл использовал два предложения:
а) все направления в пространстве равноправны и поэтому любое направление движения частицы, т.е. любое направление скорости одинаково вероятно. Это свойство иногда называют свойством изотропности функции распределения.
б) движение по трем взаимно перпендикулярным осям независимы т.е. х-компоненты скорости не зависит от того каково значения ее компонент или . И тогда вывод f ( v ) делается сначала для одной компоненты , а затем обобщается на все координаты скорости.
Считается также, что газ состоит из очень большого числа N тождественных молекул находящихся в состоянии беспорядочного теплового движения при одинаковой температуре. Силовые поля на газ не действуют.
Функции f ( v ) определяет относительное число молекул dN ( v )/ N скорости которых лежат в интервале от v до v + dv (например: газ имеет N = 10 6 молекул, при этом dN = 100
молекул имеют скорости от v =100 до v + dv =101 м/с ( dv = 1 м ) тогда .
Используя методы теории вероятностей, Максвелл нашел функцию f ( v ) - закон распределения молекул идеального газа по скоростям:

f ( v ) зависит от рода газа (от массы молекулы) и от параметра состояния (от температуры Т)

f ( v ) зависит от отношения кинетической энергии молекулы, отвечающей рассматриваемой скорости к величине kT характеризующей среднюю тепловую энергию молекул газа.
При малых v и функция f ( v ) изменяется практически по параболе . П ри возрастании v множитель уменьшается быстрее, чем растет множитель , т.е. имеется max функции f ( v ) . Скорость, при которой функция распределения молекул идеального газа по скоростям максимальна, называется наиболее вероятной скоростью найдем из условия




, следовательно, с ростом температуры наиболее вероятная скорость растёт, но площадь S , ограниченная кривой функции распределения остаётся неизменной, так как из условия нормировки (так как вероятность достоверного события равна 1), поэтому при повышении температуры кривая распределения f ( v ) будет растягиваться и понижаться.

В статистической физике среднее значение какой-либо величины определяется как интеграл от 0 до бесконечности произведения величины на плотность вероятности этой величины (статистический вес)

X >=
Тогда средняя арифметическая скорость молекул

и интегрируя по частям получили

Скорости, характеризующие состояние газа
§5 Экспериментальная проверка закона распределения Максвелла - опыт Штерна

Вдоль оси внутреннего цилиндра с целью натянута платиновая проволока, покрытая слоем серебра, которая нагревается током. При нагревании серебро испаряется, атомы серебра вылетают через щель и попадают на внутреннюю поверхность второго цилиндра. Если оба цилиндра неподвижны, то все атомы независимо от их скорости попадают в одно и то же место В. При вращении цилиндров с угловой скоростью ω атома серебра попадут в точки В’, B ’’ и так далее. По величине ω, расстоянию ? и смещению х = ВВ’ можно вычислить скорость атомов, попавших в точку В’.


Изображение щели получается размытым. Исследуя толщину осаждённого слоя, можно оценить распределение молекул по скоростям, которое соответствует максвелловскому распределению.
§6 Барометрическая формула
Распределение Больцмана
До сих пор рассматривалось поведение идеального газа, не подверженного воздействию внешних силовых полей. Из опыта хорошо известно, что при действии внешних сил равномерное распространение частиц в пространстве может нарушиться. Так под действием силы тяжести молекулы стремятся опуститься на дно сосуда. Интенсивное тепловое движение препятствует осаждению, и молекулы распространяются так, что их концентрация постепенно уменьшается по мере увеличения высоты.
Выведем закон изменения давления с высотой предполагая, что поле тяготения однородно, температура постоянна и масса всех молекул одинакова. Если атмосферное давление на высоте h равно p , то на высоте h + dh оно равно p + dp (при dh > 0, dp p уменьшается с увеличением h ).

Разность давления на высотах h и h + dh мы можем определить как вес молекул воздуха заключённого в объёме с площадью основания равного 1 и высотой dh .

плотность на высоте h , и так как , то = const .

Тогда
Из уравнения Менделеева-Клапейрона.






Пропотенцируем данное выражение (


Барометрическая формула, показывает, как меняется давление с высотой

При


,



n концентрация молекул на высоте h ,

n 0 концентрация молекул на высоте h =0.





потенциальная энергия молекул в поле тяготения


распределение Больцмана во внешнем потенциальном поле. Из него следует, что при T = const плотность газа больше там, где меньше потенциальная энергия молекул.
§7 Опытное определение постоянной Авогадро
Ж. Перрен (французкий ученый) в 1909 г. исследовал поведение броуновских частиц в эмульсии гуммигута (сок деревьев) с размерами осматривались с помощью микроскопа, который имел глубину поля - 1мкм. Перемещая микроскоп в вертикальном направлении можно было исследовать распределение броуновских частиц по высоте.
Применив к ним распределение Больцмана можно записать

n = - где m -масса частицы
m - масса вытесненной жидкости:
Если n 1 и n 2 концентрация частиц на уровнях h 1 и h 2 , а k = R / NA , то

NA=
Значение хорошо согласуется со справочным значением , что подтверждает больцмановское распределение частиц
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Челябинск 2016 г.
Предположение, что молекулы тела могут иметь любую скорость, сначала теоретически доказал в 1856 году английский физик Дж. Максвелл. Он считал, что скорость молекул в данный момент времени является случайной, и поэтому их распределение по скоростям носит статистический характер (распределение Максвелла).
Установленный им характер распределения молекул по скоростям графически представлен кривой, изображенной на рис. 1. Наличие у нее максимума (бугра) свидетельствует о том, что скорости большинства молекул приходятся на определенный интервал. Она несимметричная, поскольку молекул с большими скоростями меньше, чем с небольшими.
Быстрые молекулы определяют течение многих физических процессов при обычных условиях. Например, благодаря им происходит испарение жидкостей, ведь при комнатной температуре большинству молекул недостаточно энергии, чтобы разорвать связь с другими молекулами (она намного выше (3 / 2) • kT), а у молекул с высокими скоростями она достаточная.
Рисунок 1. Рисунок 2.
Рис. 1. Распределение молекул по скоростям (распределение Максвелла) Рис.2. Опыт О. Штерна
Распределение молекул по скоростям Максвелла на протяжении продолжительного времени оставалось экспериментально неподтвержденным, и лишь в 1920 году немецкий ученый О. Штерн сумел экспериментально измерить скорости теплового движения молекул .
В науке опыт Штерна окончательно подтвердил справедливость молекулярно-кинетической теории.
Приняв во внимание, что смещение l = v • t = ωRAt, а время полета молекул t = (RB — RA) / v, получим:
l = ω(RB — RA)RA / v.
Как видно из формулы, смешение молекулы от точки D зависит от скорости ее движения. Вычисления скорости молекул серебра по данным опыта Штерна при температуре спирали около 1200 °C давали значения в пределах от 560 до 640 м/c, что хорошо сочеталось с теоретически определенной средней скоростью молекул 584 м/с.
Средняя скорость теплового движения молекул газа может быть найдена с помощью уравнения p = nm0v̅2х:
E̅ = (3 / 2) • kT = m0v̅2 / 2.
Отсюда средний квадрат скорости поступательного движения молекулы равен:
Корень квадратный из среднего квадрата скорости молекулы называется средней квадратичной скоростью .
Учитывая, что k = R / NA и m0 = M / NA, из формулы v̅ = √(3kT / m0) получим:
По этой формуле можно вычислить среднюю квадратичную скорость молекул для любого газа. Например, при 20°C (T = 293K) для кислорода она равна 478 м/с, для воздуха — 502 м/с, для водорода — 1911 м/с. Даже при таких значительных скоростях (приблизительно равняется скорости распространения звука в данном газе) передвижение молекул газа не такое уж стремительное, поскольку между ними происходят многочисленные столкновения. Поэтому траектория движения молекулы напоминает траекторию движения броуновской частицы.
Средняя квадратичная скорость молекулы не существенно отличается от средней скорости ее теплового движения — она приблизительно в 1,2 раза больше.
С помощью закона распределения молекул по скоростям мы можем описать, как именно в макроскопической системе происходит распределение частиц (при условии ее нахождения в термодинамическом равновесии). Такое распределение называется стационарным, и воздействия внешних сил на систему при этом не происходит.
Данный закон распространяется как на жидкости, так и на газы, если на них действуют законы классической механики. Если мы знаем, как именно распределяются молекулы по своим скоростям, значит, мы можем ответить, какой объем молекул имеет определенную скорость в условиях заданной температуры в равновесном состоянии.
Чтобы лучше объяснить данный вопрос, начнем с введения такого понятия, как пространство скоростей. Оно изображено схематически на рисунке 1 .

Мы видим, что в декартовой системе координат здесь отмечены именно проекции скоростей, а не координаты. Тогда исходный вопрос можно переформулировать так: "Как именно будут распределяться молекулы в пространстве скоростей"?
Очевидно, что данное распределение не будет равномерным. Если в пространстве мы выделим параллелепипед, имеющий объем d ω = d υ x d υ y d υ z , то в нем окажется d N υ молекул. Обозначим буквой N число молекул газа, тогда f ( v ) будет некоторой функцией скорости.
Распределение Максвелла
Поскольку, как мы уже отмечали, газ находится в равновесном состоянии, то направления движений частиц являются равноправными. Значит, допустимо считать, что в пространстве скоростей распределение молекул является симметричным и имеет сферическую форму.
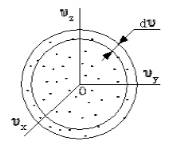
Определим, из скольких молекул состоит шаровой слой d υ . Разделим найденное выше число на количество частиц ( N ) и получим вероятность d W υ того, что пределы модуля скорости молекулы равны υ - υ + d v .
Здесь F ( v ) является функцией распределения вероятности значения v . Впервые данная функция теоретически была получена Д. Максвеллом.
Таким образом, закон распределения молекул по модулям скоростей имеет следующий вид:
d N υ = N 4 π m 0 2 πkT 3 2 e x p - m 0 υ 2 2 k T υ 2 d υ .
Здесь υ = υ x 2 + υ y 2 + υ z 2 , масса молекулы равна m 0 , а k – постоянная Больцмана.
По проекциям скоростей распределение Максвелла может быть записано так:
d N = N f υ x f υ y f υ z d υ x d υ y d υ z .
Важно учесть, что:
f υ i = m 0 2 πkT 1 2 e x p - m 0 υ i 2 2 k T ( i = x , y , z ) .
Параметры υ x , υ y , υ z означают проекции скоростей молекул на оси координат.
Также возможен следующий вариант записи распределения Максвелла:
d N = N 4 π υ v e r 3 e x p - υ υ v e r 2 υ 2 d υ .
Здесь υ υ e r обозначает наиболее вероятную скорость движения молекулы.
Как выглядит распределение Максвелла на графике
Кривая распределения молекул по скоростям на графике выглядит так:

При этом доля тех молекул, которые движутся со скоростями в интервале от υ до υ + d υ будет пропорциональна площади d S , которая на графике обозначена штриховкой.
Скорости всех молекул принадлежат интервалу от нуля до плюс бесконечности, значит, будет верным равенство:
∫ 0 ∞ f ( υ ) d υ = 1 .
Оно называется условием нормировки функции распределения.
Следовательно, распределение Максвелла по скоростям имеет зависимость от температуры газа и массы его молекул. Объем и давление можно не учитывать.
Условие: вычислите, какова будет наиболее вероятная скорость молекул газа при температуре Т в равновесном состоянии.
Решение
Нам потребуется распределение Максвелла (распределение по модулям скоростей).
d N υ = N 4 π m 0 2 π k T 3 2 e x p - m 0 υ 2 2 k T υ 2 d υ .
Максимум функции будет соответствовать самой вероятной скорости. Дифференциация выражения по скорости и сравнение ее с нулем даст нам следующий результат:
d N υ d υ = N 4 π m 0 2 πkT 3 2 2 υ υ e r e x p - m 0 υ υ e r 2 2 k T - υ υ e r 2 m 0 2 υ υ e r 2 k T e x p - m 0 υ υ e r 2 2 k T = 0 ;
2 υ υ e r - υ υ e r 2 m 0 2 υ υ e r 2 k T = 0 → 1 - υ υ e r 2 m 0 2 k T = 0 → υ υ e r 2 = 2 k T m 0 .
υ υ e r = 2 k T m 0 .
Ответ: наиболее вероятно, что скорость газа будет равна υ υ e r = 2 k T m 0 .
Условие: изобразите кривые распределения скоростей молекул газа при росте температуры Т .
Решение
Возьмем формулу наиболее вероятной скорости из предыдущей задачи.
υ υ e r = 2 k T m 0
Понятно, что чем больше будет температура, тем выше будет скорость молекул, т.е. произойдет смещение максимума в сторону больших скоростей. Поскольку площадь под кривой распределения является постоянной величиной, кривые на графике будут показаны следующим образом:

Условие: дан график функции, по которой молекулы будут распределяться с учетом проекций скорости υ x . Сопоставьте количества молекул, проекции скорости которых будут принадлежать интервалам от нуля до υ x 1 и от υ x 1 до υ x 2 .

Решение
Как мы уже указывали ранее, доля молекул газа, скорости которых лежат в первом интервале, будет пропорциональна площади фигуры, образуемой кривой распределения, вертикальной осью 0 1 N d N d υ x и вертикальным пунктиром, перпендикулярным оси проекций. Во втором интервале нужная доля будет пропорциональна площади фигуры, ограниченной кривой распределения и вертикальной прямой, параллельной оси о х и проходящей через точку υ x 1 . Очевидно, что площадь первой фигуры будет меньше площади второй. Значит, и молекул, проекции скоростей которых лежат в первом интервале, будет меньше, чем во втором.
Ответ: молекул, имеющих проекции скорости в интервалах: от 0 до υ x 1 меньше, чем молекул, имеющих проекции скорости в интервалах: от υ x 1 до υ x 2 .
Читайте также:

