Рак и беременность реферат
Обновлено: 04.07.2024
Во время беременности в организме женщины происходит множество изменений, в том числе гормональных. А, как известно, для развития некоторых видов рака высокий уровень женских половых гормонов благоприятен. В связи с этим возникает вопрос: влияет ли беременность на риск развития онкологических заболеваний?
На какие риски влияет беременность?
Многочисленные исследования показали, что беременность не увеличивает риск развития рака, а иногда даже снижает шансы заболеть. Исключение составляет только очень редкая гестационная трофобластическая болезнь. Это группа заболеваний, при которых из ткани будущей плаценты развивается опухоль. Иногда — злокачественная. В этом случае нужно провести химиотерапию и, возможно, операцию. Прогноз при гестационной трофобластической неоплазии очень хороший.
Известно, что чем больше беременностей, закончившихся родами, тем ниже риск развития рака яичника и рака эндометрия.
Риск развития рака молочной железы (РМЖ) тем больше, чем больше у женщины было менструальных циклов, то есть однотипных колебаний уровня гормонов. Раннее начало менструаций, поздняя менопауза, поздняя первая беременность (после 30 лет), отсутствие беременностей, закончившихся родами, — всё это увеличивает риск развития РМЖ. А вот ранняя беременность, несколько беременностей и кормление грудью в течение как минимум года снижают. Это, возможно, ещё связано с тем, что клетки молочной железы во время беременности и лактации претерпевают определённые изменения, и это теоретически может защищать их от превращения в раковые.
Вернётся ли рак?
По современным данным, у женщин, которые вылечились от рака, беременность не повышает риск рецидива. Но обычный совет врачей — не делайте попыток зачать в течение двух лет после прекращения лечения, потому что в это время заболевание возвращается чаще всего, а химиотерапия может быть губительной для плода. Надо тем не менее отметить, что женщины, которые, несмотря на такую рекомендацию, беременеют в первые два года после завершения терапии, по всей видимости, не имеют каких-то дополнительных проблем. Однако для некоторых пациенток есть более строгие рекомендации: после окончания применения тамоксифена беременеть строго нельзя как минимум 3 месяца, после трастузумаба — 7 месяцев. Это связано с влиянием таких препаратов на развитие плода.

Влияет ли ЭКО?
В некоторых случаях при бесплодии для достижения беременности используется экстракорпоральное оплодотворение (яйцеклетка оплодотворяется вне тела женщины, а затем подсаживается в матку). Если при этом используется не донорская яйцеклетка, то пациентка проходит процедуру стимуляции суперовуляции, чтобы созрело как можно больше яйцеклеток. Для этого используются препараты, регулирующие уровень различных гормонов. Это вызывало опасения у некоторых врачей: не повышают ли такие средства риск развития рака? Но крупный метаанализ 2013 года показал, что у женщин, прошедших процедуру ЭКО онкологические заболевания развиваются не чаще, чем у остальных.
Поскольку в настоящее время многие женщины впервые рожают после 40 лет и в это же время увеличивается заболеваемость некоторыми распространенными злокачественными новообразованиями, все чаще злокачественные опухоли диагностируют во время беременности. Выявление онкологического заболевания во время беременности ставит перед врачами много вопросов.
К счастью, пик заболеваемости для большинства злокачественных новообразований не совпадает с периодом наибольшей фертильности у женщин. При злокачественных опухолях у беременных, как и в любой редко встречающейся ситуации, трудно найти верное решение. С другой стороны, значительное число проведенных исследований может предложить некоторые руководства к действию.
В 1968 г. Barber и Brunschwig провели самый крупный на сегодня анализ случаев, при которых беременность сопровождалась развитием злокачественных новообразований. Было проанализировано 700 подобных случаев. Чаще всего у беременных отмечались злокачественные новообразования молочной железы и лейкозы/лимфомы, меланома, злокачественные новообразования половых органов и опухоли костей.
Другие авторы полагают, что опухоли половых органов находятся на 2-м месте после РМЖ. В таблице ниже представлена частота наиболее распространенных злокачественных заболеваний у беременных.
Частота злокачественных новообразований у беременных неизвестна, но предполагают, что они развиваются в 1 случае из 1000. Согласно наблюдениям в разных лечебных учреждениях, чаще всего у беременных развивается рак шейки матки (РШМ). Эти данные, вероятно, устарели, т. к. частота рака шейки матки (РШМ) в США и в большинстве развитых странах неуклонно снижается.
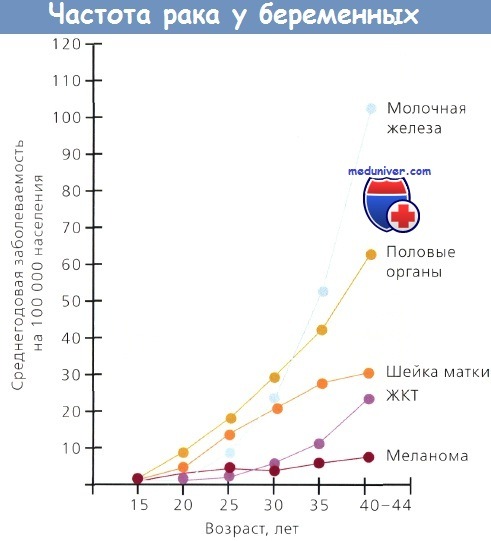
Зависимость частоты наиболее распространенных онкологических заболеваний во время беременности от возраста
В 1984 г. Haas провел популяционное исследование, проанализировав данные национального онкологического системного реестра ГДР за 1970-1979 гг. У женщин 15-44 лет общее число злокачественных новообразований составило 31 353, число родов — 2 103 112; злокачественные опухоли диагностированы у 355 беременных.
Dinh и Warshal подчеркнули, что риск злокачественных новообразований у беременных из расчета на 1000 успешных родоразрешений увеличивался от 0,02 у женщин 15—19 лет до 2,3 у женщин 40—44 лет. Риск злокачественных новообразований убывает в следующей последовательности: РШМ, РМЖ, РЯ, лимфома, меланома, злокачественные опухоли головного мозга и лейкоз.
Результаты SEER (Surveillance, Epidemiology, and End Results) в США за 1992-1996 гг. показали, что у беременных 15—44 лет злокачественные новообразования по убыванию частоты можно расположить следующим образом: РМЖ, меланома, злокачественные новообразования щитовидной железы, лимфома, РШМ и РЯ. За прошедшие 25 лет CDC ставит на 1-е место проблему развития злокачественных новообразований у беременных.
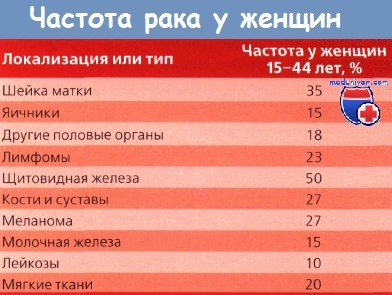
Доля женщин, рожающих до 30 лет, до начала 1990-х годов медленно увеличивалась, а затем стала неуклонно снижаться. Доля же рожающих женщин старше 30 лет постоянно растет, и в последние две декады она составила 67 %. Из-за изменения социальной роли женщины рождение ребенка откладывается на более поздний возраст. Из этого вытекают по крайней мере три следствия.
- Поскольку многие злокачественные новообразования проявляются с возрастом, разумно ожидать увеличения частоты некоторых типов опухолей во время беременности.
- Возникают вопросы относительно влияния гормональных изменений у беременных на течение злокачественных новообразований.
- С популяризацией органосохраняющего лечения опухолей ранних стадий для нерожавших женщин, которые хотят сохранить фертильность, увеличивается риск рецидивов независимо от того, наступит беременность или нет. Значительные физиологические изменения у беременных оказывают разностороннее влияние на возможность злокачественных новообразований.
Во-первых, многие полагают, что беременность ускоряет развитие опухолей, происходящих из органов и тканей, которые находятся под влиянием эндокринной системы; отсюда следует неверная рекомендация провести искусственный аборт.
Во-вторых, анатомические и физиологические изменения во время беременности могут скрывать ранние стадии заболевания.
В-третьих, повышенная васкуляризация и усиленный лимфоотток могут способствовать ранней диссеминации злокачественного процесса. Хотя все эти гипотезы заслуживают внимания, справедливость каждой из них неодинакова, даже в пределах одного и того же органа.
Кроме того, необходимо подчеркнуть, что хотя во время беременности проводят тщательные обследования, незначительные признаки злокачественного заболевания легко пропустить. Таким образом, из-за отсрочки в постановке диагноза многие злокачественные новообразования, обнаруженные во время беременности, имеют неблагоприятный прогноз. Беременность не ускоряет про-грессирование некоторых типов злокачественных опухолей.
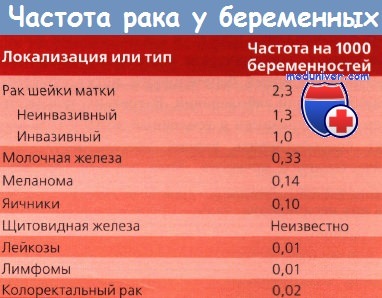
Многие опухоли, связанные с беременностью, отличаются плохим прогнозом для матери. Хотя некоторые авторы утверждали, что злокачественные новообразования не влияют на течение беременности, онкологи установили, что некоторые типы опухолей способны метастазировать в плаценту и даже в плод. В любом случае, если беременность сопровождается развитием злокачественного новообразования, то желательно, чтобы в оказании медицинской помощи участвовали специалисты разного профиля.
У беременных хирургические вмешательства оптимально проводить во II триместре. Применение XT ограничено лишь в I триместре беременности. Во время беременности безопасно выполнять некоторые лучевые исследования, но ЛТ в большинстве случаев следует проводить после родов. Полноценное питание — обязательное условие для беременных со злокачественными заболеваниями. Как правило, чтобы начать лечение, нет необходимости прерывать беременность.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
РМЖАБ наблюдается в 0,03% случаев среди беременных (1) и у 0,2-3,8% больных РМЖ (2). Под РМЖАБ понимается совпадение во времени беременности и выявления РМЖ, либо выявление РМЖ на фоне лактации или не позднее одного года после завершения беременности. Беременность может снижать риск развития РМЖ, а может провоцировать бурное прогрессирование этой опухоли. Потенциальный вред больной женщине от плода связан, прежде всего, с мощным эндокринным влиянием на опухоль. Вред для плода - это чаще всего ятрогенное воздействие, от кюретки гинеколога до химиотерапевтических препаратов. Метастатическое поражение плода при РМЖ не описано, хотя при меланоме и лимфоме оно наблюдалось (3).
1. Защитное действие беременности
Возраст первых родов - хорошо известный фактор, влияющий на заболеваемость РМЖ. Так, у женщин, имевших поздние первые роды (в возрасте старше 30 лет) или не имевших родов вообще, риск заболеть РМЖ в 2-3 раза выше, чем у рожавших до 20 лет (4). Каждые последующие роды в возрасте до 30 лет сопровождаются дальнейшим снижением риска развития РМЖ (5). Риск возникновения РМЖ в возрасте до 40 лет в 5,3 раза выше у женщин, рожавших в возрасте >30 лет по сравнению с рожавшими до 20 лет (6). Рожавшие женщины-носительницы мутаций BRCA1 или BRCA2 существенно чаще (в 1,71 раза) заболевают РМЖ в возрасте до 40 лет, чем не рожавшие. Каждая беременность у них ассоциируется с возрастанием риска возникновения РМЖ. Ранняя беременность не оказывает защитного действия у женщин, имеющих мутации BRCA1 или BRCA2 (7).
Лактация. Отсутствие лактации сопровождается повышением риска возникновения РМЖ в 1,5 раза (4). Позитивный защитный эффект лактации реализуется как у женщин репродуктивного периода, так и у находящихся в менопаузе, причём прослеживается обратная зависимость между общей длительностью лактаций и риском развития РМЖ (8, 9).
2. Диагностика рака молочной железы у беременных.
Трудности диагностики объективного (быстрый рост опухоли, изменение консистенции молочных желёз, осложнения лактации) и субъективного характера (психологическая неготовность больной и врача заподозрить РМЖ) приводят к запоздалой диагностике РМЖАБ, и лечение начинается при более распространённых стадиях болезни, чем у небеременных (10, 11, 12, 13).
В связи с опасностью лучевого воздействия на плод исключаются рентгенологические (кроме рентгенографии органов грудной клетки) и радионуклидные методы, а диагностика и определение стадии болезни основываются на ультразвуковом, магнитнорезонансном и гистологическом исследовании биопсийного материала (11, 14). Гиперпластические изменения ткани молочной железы на фоне беременности и лактации могут давать ложноположительную цитологическую картину РМЖ (15).
Определение уровня рецепторов эстрогенов в опухоли на фоне беременности биохимическим методом обычно даёт отрицательный результат, что отчасти связано с блокированием рецепторов эстрогенами, присутствующими в этот период в повышенных концентрациях. По данным иммуногистохимического исследования оказывается, что частота рецепторопозитивных опухолей у беременных не отличается от таковой у небеременных больных (16).
3. Лечение рака молочной железы, сочетающегося с беременностью.
Планирование лечения РМЖ после аборта или родов не отличается от такового у небеременных пациенток. Фактор бывшей беременности в таких случаях может учитываться как фактор плохого прогноза. Кормление молоком больной, получающей ХТ, ЛТ, эндокринную терапию не должно осуществляться.
При планировании лечения на фоне имеющейся беременности в каждом случае неизбежно обсуждение трёх тактических концепций:
1) концепция сохранения плода направлена на устранение каких-либо рисков для плода. Лечение РМЖ откладывается до естественного завершения беременности;
2) концепция спасения матери. Немедленное прекращение беременности (аборт, кесарево сечение, удаление матки с придатками) и начало лечения РМЖ.;
3) компромиссная концепция. РМЖ лечится без прерывания беременности так же, как и при её отсутствии, за исключением ХТ (не проводится в первый триместр беременности) и ЛТ (исключается на всём протяжении беременности).
Первая концепция обычно выдвигается больной. Выполнение органосохраняющей операции с отсрочкой ЛТ до послеродового периода связано с определённым риском, который весьма трудно оценить (17). Yip CH с соавторами описывают 6 больных РМЖ, выявленным на фоне беременности. Пять больных отказались от какого-либо лечения до наступления родов, одна согласилась только на операцию. На протяжении беременности наблюдалось прогрессирование болезни, и лечение было начато в более поздних стадиях, чем на момент диагностики. Все больные умерли в сроки от 14 до 52 месяцев (18).
Вторая концепция подразумевает немедленное прекращение беременности как источника гормональной стимуляции опухоли.
Предлагаем собственный опыт лечения РМЖАБ, проводившегося в 1961-1974 гг. в нашем Центре под руководством проф. О.В. Святухиной (10).
Проанализированы результаты лечения 47 больных раком молочной железы; стадия определена в соответствии с последней версией классификации TNM (19): I стадия - 2 больных, II стадия - 13 больных (T2N0M0 - 5, T1N1M0 - 2, T2N1M0 - 6), III стадия - 26 больных (T2-3N1-2M0 - 6, T4N0M0 - 1, T4N1M0 - 9, T4N2M0 - 10), IV стадия - 6 больных. У 26 из них лечению предшествовало прерывание беременности, у 2 больных - оперативное родоразрешение с двусторонним удалением придатков матки и ещё у 2 - пангистерэктомия. У 16 больных лечение начиналось на фоне лактации. Одной больной беременность была сохранена [РМЖ I стадии, возраст 35 лет, первая 24-недельная беременность, была выполнена радикальная резекция молочной железы (В.В. Вишнякова)]. У больных раком I, II и IIIa стадий лечение включало радикальную мастэктомию, двустороннее удаление придатков матки, ХТ тиофосфамидом и эндокринную терапию кортикостероидами или андрогенами. При раке IIIb стадии десяти больным проводилось аналогичное лечение; у девяти пациенток лечение включало ХТ, затем следовали радикальная мастэктомия, двустороннее удаление придатков матки, и профилактическая терапия; ещё у одной больной лечение началось с ЛТ, затем - радикальная мастэктомия, двустороннее удаление придатков матки, и профилактическая терапия.
Обе больные РМЖ I стадии прослежены без рецидива болезни 13 и 17 лет. Результаты лечения больных РМЖ II и III стадий представлены на графиках. Для РМЖ II стадии 5-летняя безрецидивная выживаемость и общая выживаемость составили 62±14% и 62±14%, 10-летние результаты - аналогичные. Для РМЖ III стадии 5-летняя безрецидивная выживаемость и общая выживаемость составили 38±10% и 46±9%, 10-летние результаты - 38±10% и 39±9% соответственно.
Третья из рассматриваемых нами концепций сформировалась на протяжении последних 20 лет. Предложение проводить противоопухолевое лечение беременным женщинам основывалось в основном на двух позициях. Во-первых, рядом исследований было показано отсутствие терапевтического эффекта аборта (20, 21, 22). Во-вторых, при оценке воздействия ХТ на плод было показано, что тератогенный эффект характерен при применении ХТ в первом триместре беременности, а ХТ, проводимая во втором и третьем триместрах, менее опасна для плода. Так, при проведении ХТ в первом триместре беременности частота врождённых уродств составляет 10-20%, возрастает частота спонтанных абортов. ХТ, проводимая во втором и третьем триместрах беременности, может осложниться преждевременными родами, миелосупрессией у матери и плода, кровотечением и инфекцией, задержкой роста плода, рождением мертвого плода (23, 11, 24, 25).
Практически не оцененными остаются риски возникновения рака, развития стерильности, мутаций половых клеток у людей, перенесших ХТ во внутриутробном периоде. Такая оценка произведена для лучевого воздействия у жителей Японии, подвергшихся атомным бомбардировкам. Наиболее частыми врождёнными аномалиями у лиц, облучённых во внутриутробном периоде, являются микроцефалия, умственная отсталость, задержка роста. Риск развития рака на протяжении жизни составляет 14% на 1 Гр облучения, а наследуемых болезней - 1% на 1 Гр (26).
24 больные РМЖАБ получали противоопухолевое лечение в M.D. Anderson Cancer Center. ХТ по схеме FAC проводилась амбулаторно с интервалом 3-4 недели после первого триместра беременности; в среднем было проведено 4 курса ХТ. Модифицированная радикальная мастэктомия была выполнена 18 больным, двум больным - органосохраняющая операция. Хирургическое лечение производилось в любом триместре беременности. ЛТ проводилась после родов. Осложнений от ХТ не наблюдали. Средний срок родов - 38 недель. Состояние новорожденных по всем показателям не отличалось от нормы (27).
Ibrahim E.M. с соавторами сообщают о 10 больных РМЖ, оперированных во время беременности, и о 7 больных, получавших ХТ во время второго или третьего триместров беременности; ЛТ на фоне беременности не проводили. У новорожденных не наблюдалось врождённых уродств. Результаты лечения РМЖАБ были такими же, как и в группе больных РМЖНАБ (12).
Выбор лечебной тактики у больных РМЖ на фоне беременности должен осуществляться индивидуально с участием онколога, акушера, больной и её родственников. При раке I и II стадий возможно выполнение операции во время любого триместра беременности, более надёжно выполнение модифицированной радикальной мастэктомии. Проведение профилактической ХТ в первом триместре беременности противопоказано.
При раке III стадии, выявленном в первом триместре беременности, возможности для лечения отсутствуют, В этой ситуации необходимо настаивать на прерывании беременности. Проведение предоперационной ХТ во втором и третьем триместрах беременности, по-видимому, возможно; при этом следует обсудить с пациенткой вопрос о необходимости длительного и тяжёлого лечения, проинформировать ее о плохом прогнозе и о нецелесообразности сохранения беременности. Аналогичный подход можно предложить и при диссеминированном РМЖ.
4. Прогноз при раке молочной железы, сочетающемся с беременностью.
По данному вопросу в литературе существует некоторое противоречие. Все согласны с тем, что РМЖАБ имеет худший прогноз, чем РМЖ в целом. Часть исследователей утверждает, что это обусловлено только большей распространённостью болезни, а в рамках одинаковых стадий течение болезни одинаково (10, 11, 28, 29); другие авторы считают, что даже в рамках одинаковых стадий беременность отягощает прогноз. Как и при анализе любого другого фактора прогноза, вывод будет зависеть от числа наблюдений, срока прослеженности, точности подбора групп сравнения и качества математического анализа. Рассматривая наши результаты лечения РМЖАБ III стадии, представленные в настоящей публикации, можно было бы сказать, что они не хуже результатов лечения РМЖ III стадии в целом в том же учреждении (10-летняя безрецидивная выживаемость 31,4±1,9%), (30), однако такой подход нельзя признать корректным.
Анализ отдалённых результатов лечения рака по материалам Memorial Sloan-Kettering Cancer Center показал, что 10-летняя общая выживаемость больных РМЖАБ I-IIа стадий составляет 73%, при РМЖНАБ - 74%. При раке IIIа стадии эти показатели составляют 0% и 35% соответственно (31). Кооперированное исследование, основанное на анализе 407 случаев РМЖ в возрасте от 20 до 29 лет, показало, что беременность повышает риск смерти больной в 2,83 раза вне зависимости от размера опухоли и числа поражённых лимфатических узлов. Каждое увеличение интервала между беременностью и выявлением РМЖ на 1 год снижает риск смерти на 15% (32).
Французское кооперированное исследование провело анализ влияния беременности у 154 больных РМЖАБ в сравнении с 308 больными РМЖНАБ. Показано, что беременность является независимым фактором, достоверно ухудшающим прогноз заболевания (33).
5. Беременность "после рака молочной железы".
В литературе практически отсутствуют сведения о повышении риска рецидива болезни, связанного с беременностью. Только Clark R.M. и Chua T. отмечали ухудшение выживаемости больных, забеременевших в течение 6 месяцев после завершения лечения по поводу РМЖ (22). Другие авторы не наблюдали ухудшения выживаемости больных РМЖ, имевших в последующем беременности (34-38). Collichio F.A. с соавт. сообщают, что сексуальная функция больных не зависит от объёма операции, а частота бесплодия пропорциональна возрасту больных, а также дозе применявшихся алкилирующих препаратов (39). Суждения же о минимальном безопасном интервале между лечением РМЖ и наступлением беременности колеблются от 6 месяцев до 5 лет (11).
Список литературы:
1. Kaiser HE, Nawab E, Nasir A, Chmielarczyk W, Krenn M. Neoplasms during the progression of pregnancy. In Vivo. 2000, 14, 1, 277-285.
2. Wallack M.K., Wolf J.A. Jr., Bedwinek J., et al. Gestational carcinoma of the female breast. Curr. Probl. Cancer, 1983, 7, 1.
3. PotterJ.F., Schoeneman M. Metastases of maternal cancer to the placenta and fetus. Cancer, 1970, 25, 380.
4. L.A.Brinton & S.S.Devesa. Incidence, Demographics, and Environmental Factors. In: Harris JR, Morrow M, Lippman ME, et al., eds.: Diseases of the Breast. Lippincott-Raven Publishers: Philadelphia, Pa, 1996, pp 159-168.
6. Tavani A, Gallus S, La Vecchia C, Negri E, Montella M, Dal Maso L, Franceschi S. Risk factors for breast cancer in women under 40 years. Eur J Cancer, 1999, 35, 9, 1361-1367.
7. Jernstrom H, Lerman C, Ghadirian P, et al. Pregnancy and risk of early breast cancer in carriers of BRCA1 and BRCA2. Lancet, 1999, 354(9193), 1846-1850.
8. Newcomb PA Lactation and breast cancer risk. J Mammary Gland Biol Neoplasia, 1997, 2, 3, 311-318.
9. Newcomb PA, Egan KM, Titus-Ernstoff L, et al. Lactation in relation to postmenopausal breast cancer. Am J Epidemiol 1999, 150, 2, 174-182.
10. Е.Б. Кампова-Полевая. Рак молочной железы у молодых женщин. Дисс. … к.м.н. Москва, 1975, 239с.
11. Petrek J.A. Breast cancer and pregnancy In: Harris JR, Morrow M, Lippman ME, et al., eds. Diseases of the Breast. Lippincott-Raven Publishers: Philadelphia, Pa, 1996, 883-892.
12. Ibrahim EM, Ezzat AA, Baloush A, et al. Pregnancy-associated breast cancer: a case-control study in a young population with a high-fertility rate. Med Oncol, 2000, 17, 4, 293-300.
13. Wohlfahrt J, Andersen PK, Mouridsen HT, Melbye M. Risk of late-stage breast cancer after a childbirth. Am J Epidemiol, 2001, 153, 11,1079-1084.
14. Nicklas AH, Baker ME. Imaging strategies in the pregnant cancer patient. Semin Oncol, 2000, 27, 6, 623-632.
15. Mitre BK, Kanbour AI, Mauser N. Fine needle aspiration biopsy of breast carcinoma in pregnancy and lactation. Acta Cytol, 1997, 41,4, 1121-1130.
16. Elledge R.M., Ciocca D.R., Langone G., et al. Estrogen receptor, progesterone receptor, and HER-2/neu protein in breast cancers from pregnant patients. Cancer ,1993,71,8,2499-2509.
17. Nettleton J., Long J., Kuban D., et al. Breast cancer during pregnancy: quantifying the risk of treatment delay. Obstetrics and Gynecology 1996, 87,3, 414-418.
19. TNM classification of Malignant Tumors. Fifth edition,1997, Willey-Liss, 227p.
20. King R.M., Welch J.S., Martin J.L., et al. Carcinoma of the breast associated with pregnancy. Surg. Gynecol. Obstet., 1985, 160, 228.
21. Nugent P., O`Connell T.X. Breast cancer and pregnancy. Arch. Surg., 1985, 120, 1221.
22. Clark R.M., Chua T. Breast cancer and pregnancy: the ultimate challenge. Clin.Oncol. 1989, 1, 11.
23. Schapira D.V., Chudley A.E., Successful pregnancy following continuous treatment with combination chemotherapy before conception and throughout pregnancy. Cancer, 1984, 54, 800.
24. Buekers TE, Lallas TA. Chemotherapy in pregnancy. Obstet Gynecol Clin North Am, 1998, 25, 2, 323-329.
25. Giacalone PL, Laffargue F, Benos P. Chemotherapy for breast carcinoma during pregnancy: A French national survey. Cancer, 1999, 86, 11, 2266-2272.
26. Greskovich JF Jr, Macklis RM. Radiation therapy in pregnancy: risk calculation and risk minimization. Semin Oncol, 2000, 27, 6, 633-645.
27. Berry DL, Theriault RL, Holmes FA, et al. Management of breast cancer during pregnancy using a standardized protocol. J Clin Oncol, 1999, 17, 3, 855-861.
28. Ezzat A, Raja MA, Berry J, et al. Impact of pregnancy on non-metastatic breast cancer: a case control study. Clin Oncol (R Coll Radiol) 1996, 8, 6, 367-370.
29. Gemignani ML, Petrek JA, Borgen PI. Breast cancer and pregnancy. Surg Clin North Am, 1999, 79, 5, 1157-1169.
30. Летягин В.П., Лактионов К.П., Высоцкая И.В., и др. Рак молочной железы, 1996, 150.
31. Anderson BO, Petrek JA, Byrd DR, Senie RT, Borgen PI. Pregnancy influences breast cancer stage at diagnosis in women 30 years of age and younger. Ann Surg Oncol, 1996, 3, 2, 204-211.
32. Guinee VF, Olsson H, Moller T, et al. Effect of pregnancy on prognosis for young women with breast cancer. Lancet, 1994, 343 (8913), 1587-1589.
33. Bonnier P, Romain S, Dilhuydy JM, et al. Influence of pregnancy on the outcome of breast cancer: a case-control study. Int J Cancer, 1997, 72, 5, 720-727.
34. Lethaby AE, O'Neill MA, Mason BH, et al. Overall survival from breast cancer in women pregnant or lactating at or after diagnosis. Int J Cancer, 1996, 67, 6, 751-755.
35. Malamos NA, Stathopoulos GP, Keramopoulos A, Papadiamantis J, Vassilaros S. Pregnancy and offspring after the appearance of breast cancer. Oncology, 1996, 53, 6, 471-475.
36. Kroman N, Jensen MB, Melbye M, Wohlfahrt J, Mouridsen HT. Should women be advised against pregnancy after breast-cancer treatment? Lancet, 1997, 350 (9074), 319-322.
37. Velentgas P, Daling JR, Malone KE, Weiss NS, Williams MA, Self SG, Mueller BA Pregnancy after breast carcinoma: outcomes and influence on mortality. Cancer, 1999, 85, 11, 2424-2432.
38. Gelber S, Coates AS, Goldhirsch A, et al. Effect of pregnancy on overall survival after the diagnosis of early-stage breast cancer. J Clin Oncol, 2001, 19, 6, 1671-1675.
39. Collichio FA, Agnello R, Staltzer J. Pregnancy after breast cancer: from psychosocial issues through conception. Oncology (Huntingt), 1998, 12, 5, 759-765, 769.
Copyright © Российское общество клинической онкологии (RUSSCO).
Полное или частичное использование материалов возможно только с разрешения администрации портала.

День открытых дверей будет проходить в формате-онлайн! 24.02.2022 в 12:00

График работы поликлинических отделений центра и кабинета взятия мазков на пцр-исследование covid-19 в связи с празднованием международного женского дня 8 марта

Информируем вас об изменениях в графике работы поликлинических отделений Центра в связи с празднованием Международного женского дня 8 марта:
5 марта – по расписанию понедельника, приемы во вторую смены сокращены на 1 час;
6 марта – по расписанию воскресенья;
7 и 8 марта – выходной и праздничный день;
9 марта и далее – по обычному расписанию.
Выездной семинар-практикум по вопросу внедрения стандартов Joint Commission International (JCI)


Отключение электроснабжения основного здания Центра (ФГБУ)

Сегодня 10.02.2022 с 14:00 до 16:00 будет отключение электроснабжения основного здания Центра (ФГБУ). На данный период с 14:00 до 16:00 подъезд №31 для приема биоматериала на выявление РНК коронавируса SARS-CoV-2 (COVID-19) будет закрыт. С 14 до 16 часов прием биоматериала (мазок из зева) на выявление РНК коронавируса SARS-CoV-2 (COVID-19) методом ПЦР беременным женщинам будет производиться в подъезде №4 ФПЦ.
Приносим извинения за причиненные неудобства
Внимание! Разрешен допуск посетителей

С 7 февраля возобновлен допуск посетителей в акушерские отделения Центра при условии одноместного размещения пациента, а также в отделения детской патологии, детской хирургии и детской реанимации.
Основное требование - ПЦР тест, сданный на территории Центра, сроком действия 48 часов.
Внимание! Хорошая новость!

Внимание! Изменения в Прейскуранте с 1 февраля 2022 года!

Обращаем ваше внимание, что с 1 февраля 2022 г. вступают в силу изменения в прейскуранте платных медицинских услуг.
Читайте также:

