Получение стирола из этилбензола реферат
Обновлено: 02.07.2024
Отходы и побочные продукты, образующиеся и накапливающиеся на нефтехимических предприятиях являются одними из самых многочисленных и разнообразных как в количественном, так и в качественном отношении. Решение проблемы переработки и применения этих отходов неразрывно связано с промышленной экологией и экологической безопасностью, комплексным использованием сырья и материалов. Это способствует увеличению производительности технологических процессов, более полному и экономичному использованию химического сырья.
Содержание
Введение………………………………………………………………………..
1.Аналитический обзор………………………………………………………..
1.1 Общие сведения……………………………………………………..
1.2 Физические свойства стирола………………………………………
1.3Способы получения стирола…………………………………………
2. Технологическая часть………………………………………………………
2.1. Химизм процесса……………………………………………………
2.2 Описание технологической схемы…………………………………
2.3. Технико-технологические расчеты ……………………………….
2.3.1 Материальный расчет……………………………………….
2.3.2. Расчет основных расходных коэффициентов……………..
2.3.3. Тепловой расчет…………………………………………….
2.3.4. Тепловой расчет первой ступени…………………………..
Заключение……………………………………………………………………….
Список использованных источников………………………………………….
Работа состоит из 1 файл
13 декабря.doc
Пояснительная записка с.23, 1 рис., 9 табл., 4 источника.
СТИРОЛ, ЭТИЛБЕНЗОЛ, ТОЛУОЛ, МЕТАН, РЕАКЦИОННАЯ СМЕСЬ, ТЕПЛОВОЙ БАЛАНС, РАСХОДНЫЙ КОЭФФИЦИЕНТ
Целью данного курсового проекта является производство стирола из этилбензола.
Курсовой проект содержит описание стирола, его физических и химических свойств, методов его получения, технико-технологические расчеты.
Рассмотрено влияние температуры на процесс. Описан химизм процесса.
Дано подробное описание технологической схемы получения стирола из этилбензола.
Проект содержит расчет материального баланса получения стирола из этилбензола мощностью 180000 т/год.
Графическая часть включает технологическую схему производства стирола - один лист формата А1.
1.2 Физические свойства стирола………………………………………
1.3Способы получения стирола…………………………………………
2.2 Описание технологической схемы…………………………………
2.3. Технико-технологические расчеты ……………………………….
2.3.1 Материальный расчет…………………………… ………….
2.3.2. Расчет основных расходных коэффициентов……………..
2.3.4. Тепловой расчет первой ступени…………………………..
Список использованных источников………………………………………….
Отходы и побочные продукты, образующиеся и накапливающиеся на нефтехимических предприятиях являются одними из самых многочисленных и разнообразных как в количественном, так и в качественном отношении. Решение проблемы переработки и применения этих отходов неразрывно связано с промышленной экологией и экологической безопасностью, комплексным использованием сырья и материалов. Это способствует увеличению производительности технологических процессов, более полному и экономичному использованию химического сырья.
Поиск путей рационального использования отходов затруднен сложностью их состава. Многочисленные отходы нефтехимических производств содержат в своем составе большое количество разнообразных реакционноспособных соединений и могут служить ценным исходным сырьем как для органического синтеза, так и для получения различных полимерных и композиционных материалов. Однако, при этом необходимо учитывать то, что во многих случаях методы переработки пригодные для одних промышленных отходов оказываются совершенно неприемлемыми для других. Разделение такой углеводородной смеси на индивидуальные компоненты, чаще всего, является очень сложной и трудоемкой задачей. Поэтому выделять из промышленных отходов индивидуальные соединения в большинстве случаев оказывается нецелесообразным с экономической точки зрения. Наиболее перспективным является получение на основе отходов таких продуктов, которые не требовали бы предварительного разделения смеси на индивидуальные компоненты.
В настоящее время продолжаются активные поисковые работы в направлениях использования и переработки отходов нефтехимических производств. Однако многие вопросы по их рекуперации и до настоящего времени не решены.
1.Аналитический обзор
Стирол является одним из важнейших мономеров для производства синтетических каучуков и пластических масс. Дегидрирование алкилароматических соединений имеет большое промышленное значение для получения стирола и его гомологов. При этом стадия дегидрирования завершает двухстадийный процесс, который начинается с алкилирования бензола олефином:
1. Получение этилбензола осуществляется по следующей реакции:
Синтез этилбензола алкилированием бензола этиленом осуществляют, применяя катализаторы на основе хлорида алюминия, фторида бора, фосфорной кислоты или цеолитов. Использование низких концентраций катализатора позволяет проводить процесс в жидкой фазе (катализатор суспензирован или растворен). Этот способ используют в России. Процесс проводят при 140-200 °С и давлении 0,3-1,0 МПа. В оптимальных условиях проведения процесса селективность получения этилбензола 99%. При проведении процесса очень важно не допускать избытка этилена в реакторе, так как это приводит к образованию диэтил- и полиэтилбензолов. Расход AlCl3 составляет 0,25 г на тонну этилбензола. Алкилирование бензола олефинами – типичная реакция электрофильного замещения.
Процесс проводят в присутствии катализатора. Наибольшее применение нашли катализаторы на основе оксида железа. Оптимальная температура при работе на этих катализаторах 600-630°С, равновесный выход стирола не превышает 40-50 %. Для более полного превращения этилбензола в стирол понижают парциальное давление паров этилбензола, разбавляя его водяным паром (массовое отношение водяной пар : этилбензол 2,5-3 :1).
Примерно 70% стирола используется в производстве полистирола и пенополистирола. Из стирола также получают различные сополимеры: акрилонитрил-бутадиен-стирол (АБС) – 9%, стирол-акрилонитрил (САН) – 1%, стирол-бутадиеновый каучук – 5%. Основное применение блоксополимеры находят в производстве обуви и адгезивов.
Используются они также в асфальтовых смесях вместе с резиновой крошкой, полученной из вышедших из эксплуатации изделий.
Подобный материал с улучшенными свойствами используется и как дорожное покрытие и как кровельный материал. Сополимеры этилен-бутилен-стирол и этилен-пропилен-стирол характеризуются широкой областью применения – от электроники и строительства до игрушек, бытовых изделий, мебельного производства. Все эти изделия длительное время выдерживают температуру до 110°С, а также обладают повышенной стойкостью к воде, растворителям, кислотам, щелочам, средствам химической чистки. Ударопрочный АБС сополимер используют для интерьеров, облицовки холодильников, рефрижераторов.
Стирол (винилбензол, фенилэтилен), С6Н5СН = СН2 — бесцветная жидкость со своеобразным запахом [3] с.459. Ниже приведены некоторые физические свойства стирола:
Таблица 1.1 Физические свойства стирола
| Плотность при 20ºС, г/см 3 | 0,9060 |
| Температура, ºС | |
| плавления | - 30,628 |
| кипения | 145,2 |
| вспышки | 34 |
| Показатель преломления | 1,5468 |
| Критич. давление, Мн/м 2 (кгс/см 2 ) | 4 (40) |
| Критич. температура, °С | 373 |
| Критич. объем, см 3 /г | 3,55 |
| Вязкость при 20°С, мн × сек/м 2 , или cпз | 0,781 |
| Давление паров при 20 ° С, н/м 2 (мм рт. ст.) | 652 (4,9) |
| Уд. теплоемкость, кдж/(кг × К) [кал/(г × °С)] | |
| жидкость при 20 ° С | 1,695 (0,4039) |
| пар при 25°С | 1,183 (0,2818) |
| Поверхностное натяжение при 20°С, мп/м, или дин/см | 32,2 |
| Темп-рный коэфф. объемного расширения при 25°С, ° С -1 | 9,719∙10 -4 |
| Теплота образования (жидкость) при 25°С, кдж/кг (кал/г) | 147,6 (35,22) |
| Теплота полимеризации (жидк-жидк.),кдж/кг (кал/г) | 716 (171) |
| Теплота испарения при 140°С, кдж/кг (кал/г) | 368 (87,7) |
Стирол смешивается с большинством органических растворителей, например, с низшими спиртами, ацетоном, эфиром, сероуглеродом; многоатомных спиртах растворим ограниченно. Растворимость стирола в воде 0,032% (по массе) при 25°С, воды в стироле 0,070%. В смеси с воздухом в объемных концентрациях 1,1—6,1% образует взрывоопасные смеси. Стирол легко полимеризуется и сополимеризуется с большинством мономеров по радикальному и ионному механизмам. На воздухе стирол окисляется с образованием перекисей, инициирующих полимеризацию стирола, бензальдегида и формальдегида.
Количественно стирол определяют присоединением уксуснокислой ртути к виниловой связи с последующим титрованием ртути в продукте присоединения раствором роданистого аммония.
Основной метод получения стирола— каталитическое дегидрирование этилбензола, получаемого каталитическим (А1С13, BF,) жидкофазным алкилированием бензола этиленом в мягких условиях. Дегидрирование проводят в токе водяного пара при 500—630°С на окисных катализаторах (железо-магниевых или хромо-цинковых) в реакторах различного типа — адиабатическом с неподвижным слоем катализатора, трубчатом изотермическом или секционном. Выход стирола более 90% от теоретического. Для очистки стирола от этилбензола, бензола и толуола применяют четырехступенчатую ректификацию под вакуумом.
Менее распространен синтез стирола с одновременным получением окиси пропилена (окисление этилбензола в гидроперекись, реакция с пропиленом в присутствии нафтената молибдена, дегидратация образующегося метилфенилкарбинола). В Японии разработан экономичный процесс экстрактивной ректификации стирола, образующегося при пиролизе бензина в этилен; ректификации подвергают фракцию, содержащую до 35%С.
Технический стирол содержит 99,6—99,8% основного продукта, а также этилбензол, изопропилбензол, серу, перекиси, альдегиды.
Стирол инертен по отношению к конструкционным материалам за исключением меди и ее сплавов, которые растворяются в стироле и окрашивают его. При хранении в стироле накапливается растворенный полимер и перекиси. Качественно полимер определяют осаждением большим избытком сухого метанола (10 мл СН3ОН на 1—2 мл стирола). Помутнение раствора при сильном встряхивании указывает на присутствие полимера. Стирол обычно ингибируют третбутилпирокатехином. Ингибиторы удаляют перегонкой мономера в вакууме или промывкой разбавленной щелочью (после чего мономер тщательно высушивают). Транспортируют стирол в стальных цистернах. Хранят в стальных емкостях под азотной подушкой.
Стирол (Рисунок 1) – бесцветная легко полимеризующаяся жидкость с характерным сладковатым запахом. Пары стирола способны вызывать раздражение слизистых оболочек глаз и дыхательных путей.

Рисунок 1 – Структурная формула стирола
Был выделен в 1839 из стиракса (смола амбрового дерева) Симоном. Производство стирола началось в США после Второй мировой войны.
Стирол применяется в качестве растворителя органических веществ, мономера в производстве полистирола и сополимеров с винилхлоридом, бутадиеном, акрилонитрилом и другими мономерами. Полимеры, получаемые из стирола, обладают рядом полезных характеристик и широко используются в индустрии, поэтому производство стирола занимает важное место в промышленном органическом синтезе.
Сырьем для получения стирола в промышленности является этилбензол, который извлекают из продуктов переработки нефти или каменного угля. Этилбензол также получают алкилированием бензола по реакции Фриделя-Крафтса.
Существует несколько способов производства стирола:
- Каталитическое дегидрирование этилбензола
- Из этилбензола через его гидропероксид
- Взаимодействие этилена со стильбеном
- Экстрактивная ректификация из фракции пиролиза бензина в этилен
Основным методом производства является дегидрирование этилбензола с использованием катализатора. Таким образом получают 90% мирового производства стирола.
В данном реферате рассмотрена технологическая схема производства стирола каталитическим дегидрированием этилбензола, как наиболее распространенного способа его получения, описаны физико-химические параметры процесса.
Дегидрирование этилбензола до стирола – каталитический, эндотермический, гетерогенный процесс, который описывается уравнением:
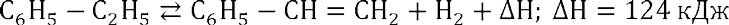
В качестве катализаторов применяются оксиды и сульфиды металлов восьмой группы. В промышленности используют катализаторы на основе оксида железа (III) с добавлением Cr2O3 и K2CO3, что обеспечивает требуемую активность и высокую селективность по стиролу.
Синтез стирола с использованием железооксидных катализаторов сопровождается побочными реакциями. Образуются газообразные продукты крекинга этилбензола, которые впоследствии взаимодействуют между собой (толуол, бензол, этан, метан, оксиды углерода).
Дегидрирование этилбензола протекает в кинетической области и зависит от температуры и давления. Процесс идет с поглощением тепла и увеличением объема газообразных продуктов, поэтому смещению равновесия вправо способствует повышение температуры и понижение общего давления и парциального давления этилбензола. Чтобы уменьшить парциальное давление этилбензола, в реакционную смесь добавляют перегретый водяной пар.
Технологический процесс производства стирола основан на принципе циркуляции – избыток этилбензола и конденсат водяного пара возвращаются обратно в цикл. Схема производства представлена на рисунке 2.
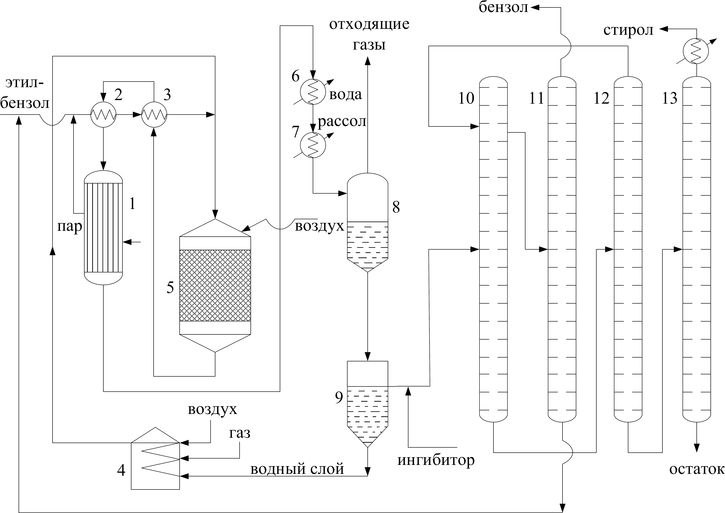
1 – котел-утилизатор, 2 – испаритель, 3 – теплообменник, 4 – трубчатая печь, 5 – реактор, 6 – водяной холодильник, 7 – рассольный холодильник, 8 – сепаратор отделения газа, 9 – сепаратор отделения конденсата, 10, 11, 12, 13 – ректификационные колонны
Рисунок 2 – Технологическая схема производства стирола дегидрированием этилбензола
Процесс производства стирола разделен на две стадии:
- Дегидрирование этилбензола
- Выделение стирола-ректификата
Свежий и возвратный этилбензол, смешиваемый с паром, который вырабатывается в котле-утилизаторе 1, проходят через испаритель 2 и теплообменник 3, обогреваемые горячей реакционной смесью.
Пары этилбензола нагреваются до 520-530ºC и смешиваются с перегретым до 700ºC водяным паром из трубчатой печи 4 и поступают в реактор 5. Продукты реакции охлаждаются в теплообменнике 3, испарителе 2, котле-утилизаторе 1, водяном холодильнике 6 и рассольном холодильнике 7.
После охлаждения продукты реакции подаются в сепаратор 8 для отделения конденсата от газа. Углеводородный газ идет на обогрев печи 4. Конденсат из сепаратора 8 поступает в сепаратор 9 для отделения водной фазы от углеводородной (печное масло). Водный слой направляется в печь 4 для выработки пара, печное масло – на ректификацию.
Состав печного масла:
- Стирол (55%)
- Остаточный этилбензол (40%)
- Бензол (2%)
- Толуол (2%)
- Смолы
Во избежание полимеризации стирола в печное масло добавляют ингибитор, и ректификацию проводят в вакууме для снижения температуры процесса.
Система ректификации состоит из четырех колонн. Печное масло из сепаратора 9 поступает в вакуум-ректификационную колонну 10, где отгоняется бензол, толуол и не прореагировавший этилбензол.
Дистиллят из колонны 10 поступает в колонну 11, разделяясь на бентол (безольно-толуольная фракция) и этилбензол, который подается обратно на дегидрирование. Кубовая фракция, содержащая стирол, подается из колонны 10 в колонну 12, где отгоняется остаток этилбензола и часть стирола.
Кубовая фракция колонны 12 (сырой стирол) подается в колонну 13 для окончательной ректификации; дистиллят содержит 99,8% стирола.
Основной аппарат технологической схемы – реактор дегидрирования 5, в большинстве случаев представляющий собой адиабатический реактор, тепло к которому подводится с перегретым водяным паром.
Адиабатический реактор – стальной аппарат цилиндрической формы с коническими крышкой и дном, футерованный изнутри огнеупорным материалом, диаметром 4 м, высотой 7,5 м.
Внутри реактора на решетке размещены слои насадки для равномерного распределения газового потока. Катализатор помещен между слоями насадки. Саморегенерируемый катализатор К-22 работает непрерывно в течение 1-2 месяцев.
Регенерацию проводят пропусканием воздуха для выжигания кокса, отложившегося на зернах катализатора.
Для снижения энергозатрат на процесс дегидрирования и очистку водного конденсата вместо водяного пара может использоваться инертный газ.
Стирол – важный продукт промышленного органического синтеза. Стирол является сырьем для получения полистирола и сополимеров, широко применяемых в различных областях благодаря ударопрочности, теплостойкости, высокой химической стойкости и другим свойствам. Эти пластмассы легко перерабатываются литьем, экструзией, прессованием.
Самый распространенный способ получения стирола – дегидрирование этилбензола. Это одностадийный химический процесс, где исходным сырьем служит доступный этилбензол, который получают алкилированием бензола олефинами.
При высокой селективности (90%) за один проход достигается высокая степень конверсии этилбензола (60-75%) за счет следующих технологических решений:
- введение пара между двумя-тремя слоями катализатора
- использование встроенных в реактор теплообменных устройств
- эффективная каталитическая система
- рециркуляционный поток бензола, связывающий разделительную и реакторную подсистемы
Во избежание термополимеризации стирола используется эффективная система разделения из нескольких вакуумно-ректификационных колонн.
Гетерогенно-каталитический характер процесса позволяет достаточно просто создавать аппараты и технологические линии большой единичной мощности.
1) Термическое декарбоксилирование коричной кислоты проводится при температуре 120-130 О С и атмосферном давлении. Выход стирола составляет около 40%

2) Дегидратация фенилэтилового спирта. Реакция может быть реализована как в газовой, так и в жидкой фазе. Жидкофазная дегидратация фенилэтилового спирта осуществляется в присутствии фосфорной кислоты или бисульфита калия. Дегидратация в паровой фазе проводится над катализаторами: оксидами алюминия, тория или вольфрама. При использовании оксида алюминия выход стирола составляет до 90% от теории.

3) Синтез из ацетофенона. Стирол можно получить по реакции ацетофенона с этиловым спиртом над силикагелем:

Выход составляет около 30%.
4) Получение стирола из галогенэтилбензола:


5) Получение стирола дегидрированием этилбензола.
6) Метод производства из этилбензола через гидропероксид этилбензола с одновременным получением оксида пропилена (халкон-процесс):
 | ||
 | ||
7)Получение стирола метатезисом этилена со стильбеном, полученным окислением толуола:
 |
8) Получение стирола каталитической циклодимеризацией бутадиена:

Все приведенные методы получения стирола (за исключением дегидрирования) многостадийны, используют повышенное давление и высокую температуру, что приводит к усложнению и удорожанию производства. Для некоторых методов используется не очень доступное сырье. Небольшие выходы.
Основным методом промышленного производства стирола является каталитическое дегидрирование этилбензола. Этим методом получают более 90% мирового производства этилбензола. В качестве катализаторов дегидрирования применяются сложные композиции на основе оксидов цинка или железа. Раньше наиболее распространенным был катализатор стирол-контакт на основе ZnO. В последнее время используют, главным образом, железо-оксидные катализаторы, содержащие 55-80% Fe2O3; 2-28% Cr2O3; 15-35% K2CO3 и некоторые оксидные добавки. В частности широко используется катализатор НИИМСК К-24 состава Fe2O3 – 66-70%; K2CO3 – 19-20%; Cr2O3 – 7-8%; ZnO2 – 2,4-3,0%; K2SiO3 – 2,0-2,6%. Значительное содержание K2CO3 в катализаторе обусловлено тем, что он способствует дополнительной саморегенерации катализатора за счет конверсии углеродистых отложений водяным паром. Катализатор работает непрерывно 2 месяца, после чего его регенерируют, выжигая кокс воздухом. Общий срок службы катализатора – 2 года.
Реакционный узел для дегидрирования этилбензола можно выполнять различными способами. Один из вариантов – трубчатый реактор, обогреваемый топочным газом по типу, изображенному на рисунке.

Его достоинство – близкий к изотермическому профиль температуры, что позволяет получать повышенную степень конверсии при хорошей селективности. Однако высокие металлоемкость и капитальные затраты на такой реактор привели к созданию других аппаратов – со сплошным слоем катализатора, не имеющих поверхностей теплообмена (рис.А).

Они работают в адиабатических условиях, и реакционная смесь постепенно охлаждается, причем водяной пар играет здесь и роль аккумулятора тепла, не давая смеси чрезмерно охладиться. При получении стирола в единичном адиабатическом реакторе обычная степень конверсии этилбензола составляет около 40%. Недостатки такого единичного реактора – существенное охлаждение смеси, одновременное смещение равновесия в нежелательную сторону и зависящее от этого снижение скорости и селективности. Степень конверсии нельзя довести до приемлемой величины, т.к. это повышает удельный расход пара. Другие установки (рис.Б) приближают процесс к изотермическому и лучше учитывают особенности равновесия реакции. В такой установке имеются 2 реактора (или два слоя катализатора). Охладившуюся в первом реакторе смесь до подачи во второй реактор нагревают перегретым паром. Реактор на рисунке В имеет два-три кольцевых слоя катализатора, причем в первый слой поступает весь этилбензол, но лишь часть водяного пара. В пространство между слоями катализатора подают дополнительное количество перегретого пара. С его помощью повышается температура смеси и происходит ступенчатое разбавление смеси с удалением ее от равновесного состояния, что способствует росту скорости и селективности реакции.

Совмещенное дегидрирование и окисление метанола. Получаемые и побочные продукты. Условия проведения процесса. Особенности оформления реакционного узла.
Дегидрированием или окислением первичных спиртов получают только формальдегид (из метанола). Формальдегид НСНО представляет собой в безводном состоянии бесцветный газ с острым раздражающим запахом (т. конд. -19ОС при 0,1 МПа). При хранении он легко полимеризуется и нередко выпускается в виде твердого полимера — параформальдегида (параформ), который легко деполимеризуется.
Большей частью формальдегид выпускают в виде 37%-ного водного раствора, называемого формалином. В нем формальдегид присутствует в виде гидрата НСНО•Н20 и низкомолекулярньтх полимеров (полиоксиметиленгликоли). Во избежание более глубокой полимеризации и выпадения осадка добавляют к формалину 7—12% (масс.) метилового спирта в качестве стабилизатора.
Совмещенное дегидрирование и окисление метанола. Дегидрирование первичных спиртов, в том числе метанола, менее благоприятно по сравнению с вторичными спиртами по условиям равновесия и селективности реакции. По этой причине, а также с целью устранения эндотермичности процесса осуществили совмещенное дегидрирование и окисление метанола:


Можно так подобрать соотношение этих реакций, чтобы суммарный тепловой эффект был только немного положительным, но достаточным для возмещения потерь тепла в окружающую среду и для нагревания исходной смеси до нужной температуры. Практически при получении формальдегида такое положение достигается, когда процесс на 55% идет через окисление и на 45% через дегидрирование, и тогда процесс можно осуществить в адиабатических реакторах, не имеющих поверхностей теплообмена. В этом состоит одно из преимуществ совмещенного процесса окисления и дегидрирования спиртов. При указанном соотношении реакций дегидрирования и окисления исходная паро-воздушная смесь должна содержать 45% (об.) метанола, что находится за верхним пределом взрываемости метанола в воздухе [34,7% (об.)].
При получении формальдегида кроме основных реакций протекают побочные процессы более глубокого окисления, дегидрирования и гидрирования, ведущие к образованию оксидов углерода, муравьиной кислоты, воды и метана:
Окислительное дегидрирование проводят при недостатке кислорода, поэтому глубокое окисление не получает значительного развития. В то же время само дегидрирование, инициируемое кислородом, протекает быстрее, и все ранее упомянутые побочные реакции не так заметны, как при дегидрировании первичных спиртов. Это позволяет работать при более высокой температуре (500—б00°С), большой скорости реакции и времени контакта 0,01—0,03 с. Выход формальдегида на пропущенное сырье достигает 80-85% при степени конверсии метанола 85-90%. Замечено, что добавление воды к исходному метанолу повышает выход и степень конверсии, по-видимому, в результате разложения ацеталей. Катализаторами синтеза формальдегида этим методом служит металлическая медь (в виде сетки или стружек) или серебро, осажденное на пемзе. Последний катализатор оказался более эффективным и широко применяется в промышленности.
Технологическая схема производства формальдегида окислительным дегидрированием метанола изображена на рис. 139. Метанол, содержащий 10-12% воды, из напорного бака 1 непрерывно поступает в испаритель 2. Туда же через распределительное устройство подают воздух, очищенный от пыли и других загрязнений. Воздух барботирует через слой водного метанола в нижней части испарителя и насыщается его парами. В 1 л образующейся паро-воздушной смеси должно содержаться 0,5 г метанола. Поддержание такого состава смеси очень важно для обеспечения взрывобезопасности и нормального протекания процесса. Поэтому работа испарительной системы полностью автоматизирована: поддерживают постоянные уровень жидкости в испарителе, ее температуру (48—50°С) и скорость подачи воздуха, благодаря чему обеспечиваются необходимые температурный режим и степень конверсии в адиабатическом реакторе.
Паро-воздушная смесь проходит брызгоуловитель, находящийся в верхней части испарителя, затем перегреватель З и поступает в реактор 4, в средней части которого находится катализатор. Реакционные газы сразу же попадают в подконтактный холодильпик 5 (смонтирован вместе с реактором), где происходит быстрое охлаждение смеси и предотвращается распад формальдегида. В разных схемах охлаждение осуществляют проточной водой или паровым конденсатом, когда холодильник играет роль генератора пара низкого, среднего или даже высокого давления. Полученный пар (или горячая вода) служит для перегрева постулающей смеси в теплообменнике 3 и для обогрева испарителя 2.
Охлажденные реакционные газы поступают в абсорбер 6, выполненный в виде тарельчатой колонны; жидкость на тарелках охлаждают внутренними или выносными холодильниками (на схеме не изображены). Абсорбер орошают таким количеством воды, чтобы в кубе получился 36—37%-ный формалина. Стадии абсорбции и разделения продуктов оформляют двумя разными способами.
По одному из них в абсорбере поглощают как форальдегид, так и непревращенный метанол, который содержится в продуктах реакции в количестве, как раз достаточном для стабилизации формальдегида. В этом случае верхнюю тарелку абсорбера охлаждают рассолом, а колонна 7 служит лишь для санитарной очистки газа, в то время как для получения безметанольного формалина (требуемого иногда для ряда целей) необходима установка для отгонки метанола. При втором способе в абсорбере поглощают преимущественно формальдегид; тогда колонна 7 служит для абсорбции метанола, который отгоняют от воды и возвращают на реакцию. В обоих случаях формалин из куба абсорбера б охлаждают в холодильнике 8 и собирают в сборнике 9.

Значительная эндотермичность дегидрирования обусловливает применение трубчатых реакторов, в межтрубном пространств которых циркулируют горячие газы от сжигания газообразного или жидкого топлива. Схема типичного реакционного узла дл дегидрирования спиртов представлена ниже. В топке З происходит сгорание топливного газа, подаваемого вместе с воздухом через специальные форсунки. Температура топочных газов слишком высока, поэтому их разбавляют обратным газом (циркуляция его в системе осуществляется газодувкой 4). Спирт поступает вначале в систему испарителей-перегревателей 1, где он нагревается до нужной температуры частично охлажденными топочными газами. Затем пары спирта попадают в реактор 2, где в трубе находится катализатор. Реакционная смесь подогревается горючими топочными газами, находящимися в межтрубном пространстве, что компенсирует поглощение тепла из-за эндотермичности процесса. По выходе из контактного аппарата реакционные га охлаждают в холодильнике-конденсаторе (на рисунке не показан), а в случае летучих продуктов их дополнительно улавливают водой. Полученный конденсат (и водные растворы) ректифицируют, выделяя целевой продукт и непрореагировавший спирт, возвращаемый на дегидрирование.
* Данная работа не является научным трудом, не является выпускной квалификационной работой и представляет собой результат обработки, структурирования и форматирования собранной информации, предназначенной для использования в качестве источника материала при самостоятельной подготовки учебных работ.
Московская государственная академия
тонкой химической технологии им. М. В. Ломоносова
Кафедра общей
Производство стирола по методу дегидрирования этилбензола
Выполнила: Лукашина О.В.
Группа: ХТ-404
Проверил: Брук Л.Г.
Стирол является одним из важнейших мономеров для производства синтетических каучуков и пластических масс. Дегидрирование алкилароматических соединений имеет большое промышленное значение для получения стирола и его гомологов. При этом стадия дегидрирования завершает двухстадийный процесс, который начинается с алкилирования бензола олефином:
Получение этилбензола
Синтез этилбензола алкилированием бензола этиленом осуществляют, применяя катализаторы на основе хлорида алюминия, фторида бора, фосфорной кислоты или цеолитов. Использование низких концентраций катализатора позволяет проводить процесс в жидкой фазе (катализатор суспензирован или растворен). Этот способ используют в России. Процесс проводят при и давлении 0,3-1,0 Мпа. В оптимальных условиях проведения процесса селективность получения этилбензола 99%. При проведении процесса очень важно не допускать избытка этилена в реакторе, так как это приводит к образованию диэтил- и полиэтилбензолов. Расход составляет 0,25 г на тонну этилбензола. Алкилирование бензола олефинами – типичная реакция электрофильного замещения.
Стадия дегидрирования этилбензола
увеличивают скорость процесса. Наряду с гидропероксидом этилбензола в процессе образуются побочные продукты: метилфенилкарбинол, ацетофенон и др. Процесс проводят при температуре 140-150, степень превращения этилбензола-15-17%, селективность- 82-85%.
Реакции разложения гидропероксида в условиях окисления вносят довольно заметный вклад в образование побочных продуктов. Для повышения селективности реакторная система должна быть максимально приближена к системе идеального вытеснения ( обычно каскад 3-х и более реакторов).Концентрация гидропероксида этилбензола на выходе из каскада 10-12%. Перед эпоксидированием поток укрепляется до 25 %. Ионы щелочных металлов, инициирующие окисление этилбензола, перед эпоксидированием необходимо удалять.
Реакция эпоксидирования пропилена:
Дегидратацию метилфенилкарбинола проводят в газовой фазе при температуре 180-280
Вторую стадию проводят в газовой фазе при 400
Процесс окислительной димеризации толуола в стильбен (через образование 1,2-дифенилэтана) идет при 600
Реакция эндотермическая, протекает с поглощением теплоты, соответственно, требует затрат энергии.
Подставляем полученные данные в выражение для константы равновесия:
Полученное уравнение можно использовать для анализа реакционной системы и определения условий проведения процесса.
Функция "чтения" служит для ознакомления с работой. Разметка, таблицы и картинки документа могут отображаться неверно или не в полном объёме!
. Принципы в технологии совместного получения стирола и пропиленоксида
. Принципы в технологии получения стирола дегидрированием этилбензола
Список использованной литературы
Стирол является одним из основных мономеров для производства полимерных материалов, без которых в настоящее время не может обойтись ни одна отрасль промышленности, как в России, так и за рубежом, Стирол используется для получения полистирола, термоэластопластов, различных лакокрасочных композиций. Основным способом получения стирола является процесс дегидрирования этилбензола. Этим определился выбор в качестве темы курсовой работы.
В данной работе описаны свойства стирола, его применение, основные методы получения и технологические процессы.
Целью работы является рассмотрение технологии получения стирола дегидрированием этилбензола, как основного метода получения рассматриваемого мономера. 1. Стирол. Свойства Стирол C8H8 (фенилэтилен, винилбензол) - бесцветная жидкость со специфическим запахом. Стирол практически нерастворим в воде, хорошо растворим в органических растворителях, хороший растворитель полимеров. Стирол относится ко второму классу опасности.
Молярная масса 104.15 г/моль
Плотность 0.909 г/см³
Температура плавления -30 °C
Температура кипения 145 °C
Стирол легко окисляется, присоединяет галогены, полимеризуется (образуя твердую стекловидную массу - полистирол) и сополимеризуется с различными мономерами. Полимеризация происходит уже при комнатной температуре (иногда со взрывом), поэтому при хранении стирол стабилизируют антиоксидантами (например, третбутилпирокатехином, гидрохиноном). Галогенирование, например, в реакции с бромом, в отличие от анилина идёт не по бензольному кольцу, а по виниловой группе с образованием 1,2-дибромэтилфенила.
. Галогенирование: С6Н5-СН=СН2 +Br2→ С6Н5-СНBr=CHBr2
3. Полимеризация: n CH2=CH-C6H5→(-CH2-CH-) n - C6H5
4. Сополимеризация: CH2=CH+CH2=CH-CH=CH2→-CH2-CH-CH2-CH=CH-CH2- C6H5 -C6H5
Стирол - яд общетоксического действия, он обладает раздражающим, мутагенным и канцерогенным эффектом и имеет очень неприятный запах (порог ощущения запаха - 0.07мг/м³). При хронической интоксикации у рабочих бывают поражены центральная и периферическая нервная система, система кроветворения, пищеварительный тракт, нарушается азотисто-белковый, холестериновый и липидный обмен, у женщин происходят нарушения репродуктивной функции. Стирол проникает в организм в основном ингаляционным путём. При попадании на слизистые оболочки носа, глаз и глотки паров и аэрозоля стирол вызывает их раздражение. Содержание метаболитов бензола в моче - миндальной, фенилглиоксиновой, гинуриновой и бензойной кислот - используют в качестве экспозиционного теста.
Средняя летальная доза составляет около 500-5000 мг/м³ (для крыс). Стирол относится ко второму классу опасности.
Читайте также:

