Пар и жидкость реферат
Обновлено: 13.06.2024
Вода и водяной пар нашли широкое применение в качестве рабочих тел в паровых турбинах тепловых машин, атомных установках и в качестве теплоносителей в различного рада теплообменных аппаратах химико-технологических производств.
Газообразное тело, сосуществующее с кипящей жидкостью называется паром и значительно отличается по своим термодинамическим свойствам от свойств идеального газа.
Парообразованием называется процесс превращения вещества из жидкого состояния в парообразное.
Кипением называется процесс превращения жидкости, кипящей во всем её объеме, в пар при подводе к ней теплоты, а при отводе от пара теплоты происходит обратный процесс – конденсация.
Процессы кипения и конденсации протекают при постоянной температуре и при неизменном давлении, то есть tКП = tН.
Пар, соприкасающейся с жидкостью, из которой он получается и находящейся с ней в термодинамическом равновесии называется насыщенным.
Сухой насыщенный пар – пар, не содержащий в себе жидкость.
Влажным паром называется механическая смесь, состоящая из сухого пара и мельчайших капелек жидкости и характеризуется степенью сухости – Х или степенью влажности – (1 – Х).
Перегретым паром называется пар, полученный из сухого насыщенного пара при подводе к нему при P = Const некоторого количества теплоты и вызванного этим повышением его температуры. Разность между температурами перегретого пара – tП и сухого насыщенного – tН называется степенью перегрева.
До сих пор для реальных газов предложено много уравнений состояния. Однако все они относятся только к ограниченной области состояний. Для технически важных веществ, например, для водяного пара разработаны довольно точные уравнения, с помощью которых рассчитаны параметры и функции состояния в широкой области температур и давлений и сведены в таблицы и на их основе эти характеристики графически представлены в виде диаграмм в P – V, T – S и h – S координатах. Эти диаграммы дают возможность наглядно представить процессы и их энергетические особенности.
Фазовая P – V диаграмма системы, состоящей из жидкости и пара, представляет собой график зависимости удельных объемов кипящей воды – v' и сухого насыщенного пара – v" от давления (см. рис.1.1).

График зависимости v' = f(P) представлен на рис.8.1 кривой АК, которая называется нижней пограничной кривой или линией кипящей жидкости и характеризуется степенью сухости Х = 0.
График зависимости v" = f(P) представлен на рис.8.1 кривой ВК, которая называется верхней пограничной кривой или линией сухого насыщенного пара и характеризуется степенью сухости Х = 1.
Бесплатно скачать Реферат: Реальные рабочие тела – вода и водяной пар. Параметры и функции состояния водяного пара. Термодинамические процессы с водяным паром
Вода и водяной пар нашли широкое применение в качестве рабочих тел в паровых турбинах тепловых машин, атомных установках и в качестве теплоносителей в различного рада теплообменных аппаратах химико-технологических производств.
Газообразное тело, сосуществующее с кипящей жидкостью называется паром и значительно отличается по своим термодинамическим свойствам от свойств идеального газа.
Парообразованием называется процесс превращения вещества из жидкого состояния в парообразное.
Кипением называется процесс превращения жидкости, кипящей во всем её объеме, в пар при подводе к ней теплоты, а при отводе от пара теплоты происходит обратный процесс – конденсация.
Процессы кипения и конденсации протекают при постоянной температуре и при неизменном давлении, то есть tКП = tН.
Пар, соприкасающейся с жидкостью, из которой он получается и находящейся с ней в термодинамическом равновесии называется насыщенным.
Сухой насыщенный пар – пар, не содержащий в себе жидкость.
Влажным паром называется механическая смесь, состоящая из сухого пара и мельчайших капелек жидкости и характеризуется степенью сухости – Х или степенью влажности – (1 – Х).
Перегретым паром называется пар, полученный из сухого насыщенного пара при подводе к нему при P = Const некоторого количества теплоты и вызванного этим повышением его температуры. Разность между температурами перегретого пара – tП и сухого насыщенного – tН называется степенью перегрева.
До сих пор для реальных газов предложено много уравнений состояния. Однако все они относятся только к ограниченной области состояний. Для технически важных веществ, например, для водяного пара разработаны довольно точные уравнения, с помощью которых рассчитаны параметры и функции состояния в широкой области температур и давлений и сведены в таблицы и на их основе эти характеристики графически представлены в виде диаграмм в P – V, T – S и h – S координатах. Эти диаграммы дают возможность наглядно представить процессы и их энергетические особенности.
Фазовая P – V диаграмма системы, состоящей из жидкости и пара, представляет собой график зависимости удельных объемов кипящей воды – v' и сухого насыщенного пара – v" от давления (см. рис.1.1).

График зависимости v' = f(P) представлен на рис.8.1 кривой АК, которая называется нижней пограничной кривой или линией кипящей жидкости и характеризуется степенью сухости Х = 0.
График зависимости v" = f(P) представлен на рис.8.1 кривой ВК, которая называется верхней пограничной кривой или линией сухого насыщенного пара и характеризуется степенью сухости Х = 1.
Обе кривые АК и ВК делят P – Vдиаграмму на три части: влево от линии АК – область жидкости; между линиями АК и КВ – двухфазная система, состоящая из смеси кипящей воды и сухого пара – область влажного пара характеризуется степенью сухости 0 0, то газ сжимается, а его скорость будет уменьшаться dw 0, то такие устройства (каналы) называются соплами.
Из уравнения (1.4) при условии, что w1 0 что следует из анализа уравнения для эффекта Джоуля – Томсона:

(1.12)
и это явление широко используется в холодильной технике.
Задачи для самостоятельного решения.
Параметры и функции состояния водяного пара.
Решение задач с помощью таблиц.
Задача № 1.1-1. Определить массу 10 м3 влажного водяного пара при Р = 30 бар и Х = 0,5 и его энтальпию.
Задача № 1.1-2. Состояние водяного пара заданно параметрами t = 180 °C, v = 0, 1939 м3/кг. Определить давление, энтропию и энтальпию пара. Изобразить состояние пара в P – V и T – S координатах.
Задача № 1.1-3. Смесь воды и пара заключена в объеме V = 30 л. Известна температура пара t = 180 °C и масса воды m = 0,08 кг. Определить паросодержание Х.
Пример. Определить состояние пара Р = 13 бар и v = 0,140 м3/кг, а также все параметры и функции состояния. Изобразить состояние пара в P –V и T – S координатах.
Решение. По таблице № 4 (см. приложение) находим, что (v' = 0,00114 м3/кг) h", то есть 2865 кДж/кг > 2790 кДж/кг, то пар во втором состоянии будет перегретым. По таблице №9, по давлению Р = 14 бар и энтальпии h2 = 2865 кДж/кг находим состояние пара, которое характеризуется параметрами t = 221 °C; v = 0,152 м3/кг; S = 6,61 кДж/(кг×К).
lP = P(v2 – vX) = 14 × 105 × (0,152 – 0,1349) = 23,94 кДж/кг.
Состояние пара в координатах P – V и T – S находится на пересечении двух каких-либо линий, например h = Const и P = Const (см. рис. 1.4).

Задача № 1.2-3. К 1 кг водяного пара при Р = 10 бар и Х = 0,5 при постоянном давлении подводятся 1600 кДж/кг тепла. Определить конечное состояние, работу, произведенную паром, и изменение внутренней энергии. Изобразить процесс в P – V и T – S координатах.
Задача № 1.2-4. К 1 кг пара при давлении 8 бар и степени влажности 70% подводится при постоянном давлении 820 кДж/кг тепла. Определить степень сухости, объем и энтальпию пара в конечном состоянии, изобразить процесс в P – V, h – S и T – S координатах.
Задача № 1.2-5.1 кг влажного пара при давлении 18 бар и влажности 3% перегревается при постоянном давлении до t = 400 °C. Определить работу расширения, количество сообщенного тепла и изменение внутренней энергии и изобразить процесс в T – S координатах.
Задача № 1.2-6.1 кг водяного пара при Р1 = 16 бар и t1 = 300 °Cнагревается при постоянном давлении до 400 °C. Определить количество тепла, работу расширения и изменение внутренней энергии пара.
Задача № 1.2-7.1 м3 водяного пара при давлении Р = 10 бар и Х = 0,65 расширяется при P = Const до тех пор, пока его удельный объем не станет равным v = 0,19 м3/кг. Определить конечные параметры, количество тепла, работу и изменение внутренней энергии в процессе.
Задача № 1.2-8. К 1 кг водяного пара, имеющего объем v1 = 0,0897 м3/кг, при постоянном давлении Р = 20 бар подводится 525 кДж/кг тепла. Определить конечное состояние и изменение внутренней энергии пара. Изобразить процесс в P – V, h – S и T – S координатах.
Задача № 1.2-9.2 кг пара, занимающего при Р = 8 бар объем V1 = 0,15 м3, изотермически расширяются до V2 = 0,35 м3. Определить работу расширения, количество подведенного тепла, степень сухости пара и изобразить процесс в P – V, h – S и T – S координатах.
Задача № 1.2-10.1 кг пара при давлении 6 бар и температуре t = 200 °C сжимается изотермически до конечного объема v2 = 0,11 м3/кг. Определить конечные параметры и количество тепла, участвующего в процессе. Изобразить процесс в P – V, h – S и T – S координатах.
Задача № 1.2-11.1. кг пара при Р = 18 бар и Х = 0,7 изотермически расширяется до Р = 8 бар. Определить конечные параметры, количество подведенного тепла, изменение внутренней энергии и работу расширения. Изобразить процесс в P – V, h – S и T – S координатах.
Задача № 1.2-12. К 1 кг водяного пара при Р1 = 30 бар и Х = 0,6 в процессе T = Const подводится 624 кДж тепла. Определить конечное состояние пара, работу расширения и изменение внутренней энергии. Изобразить процесс в P – V, h – S и T – S координатах.
Задача № 1.2-13. В паровом котле при давлении 4 бар находится 8250 кг пароводяной смеси паросодержанием Х = 0,0015. Сколько времени необходимо для поднятия давления до 10 бар при закрытых вентилях, если к пароводяной смеси подводится 18 × 106 Дж/мин.
Задача № 1.2-14. Определить количество тепла, которое нужно сообщить 6 кг водяного пар, занимающим объем 0,6 м3 при давлении 6 бар, чтобы при V = Const повысить его давление до 10 бар. Найти также конечную степень сухости пара.
Задача № 1.2-15. В закрытом сосуде содержится 1 м3 сухого насыщенного водяного пара при давлении 10 бар. Определить давление, степень сухости пара и количество отведенного им тепла, если его температура понизилась до 60 °C.
Задача № 1.2-16. В баллоне емкостью 1 м3 находится пар с Х = 0,73, а его давление Р = 1 бар. Сколько тепла нужно подвести к пару, чтобы он стал сухим насыщенным?
Задача № 1.2-17. Определить количество тепла, которое в процессе V = Const нужно подвести к 1 кг водяного пара, если Р1= 140 бар и Х = 0,78, чтобы он превратился в сухой насыщенный. Какое давление установится при этом? Изобразить процесс в P – V координатах.
Задача № 1.2-18.1 кг пара расширяется адиабатно от начальных параметров Р1 = 30 бар и t1 = 300 °Cдо Р2 = 0,5 бар. Найти значения h2, v2, x2, Δh, Δu и работу расширения. Представить процесс в P – V, h – S и T – S координатах.
Пример. От 1 кг сухого насыщенного пара при постоянной температуре Т = 523 К отводится тепло, так что в конце процесса его объем становится равным v = 0,020775 м3/кг. Определить конечное состояние, количество отведенного тепла, изменение внутренней энергии и работу пара. Изобразить процесс в P – V, h – S и T – S координатах.
Перегретая жидкость используется в пузырьковых камерах, изобретенных Д. Глезером в 1952 г., для визуализации треков релятивистских заряженных частиц, т. е. частиц, движущихся со скоростями, близкими к скорости света. Такие частицы создают в газах очень мало ионов, и их трек в камере Вильсона не виден. В жидкостях, где молекулы плотно упакованы, такие частицы создадут значительно больше ионов, чем… Читать ещё >
Кипение жидкостей, пересыщенный пар, перегретая жидкость ( реферат , курсовая , диплом , контрольная )
Кипение жидкостей, пересыщенный пар, перегретая жидкость
1. Кипение жидкостей. Перегретая жидкость Кипением называется процесс бурного парообразования не только с поверхности жидкости, но и по всему ее объему. Для этого жидкость должна быть нагрета до достаточно высокой температуры. При кипении в пузырьках находится воздух и пары воды. Пузырьки появляются в тех местах стенок сосуда, где нет полного смачивания. Такими местами могут являться следы жира на стенке или мелкие трещинки на ней.
При неизменной температуре пузырёк сохраняет свои размеры, значит, давления изнутри и извне, на его поверхность взаимно уравновешиваются. При повышении температуры пузырёк постепенно расширяется в такой мере, что сумма давления воздуха и пара в нём остаётся равной внешнему давлению. Когда пузырёк сделается достаточно большим, выталкивающая сила воды заставит его оторваться.
И, наоборот, при понижении давления температура кипения воды становится меньше 100 °C. Например, в горных районах (на высоте 3 км, где давление атмосферы составляет 70 кПа) вода кипит при 90 °C. Поэтому жителям этих районов, использующим такой кипяток, требуется значительно больше времени для приготовления пищи, чем жителям равнин. А сварить в этом кипятке например, куриное яйцо вообще невозможно, так как белок при температуре ниже 100 °C не сворачивается.
Давление насыщенного пара внутри пузырька, находящегося у поверхности жидкости, равно сумме внешнего давления на жидкость и давления под искривленной поверхностью с нас. = с внеш. + 2у/г, где г — радиус пузырька,
у — коэффициент поверхностного натяжения.
Если пузырек имеет размеры порядка нескольких миллиметров и больше, то вторым слагаемым можно пренебречь. Например, для воды при температуре 100 °C величина у = 58,8 * 10−3 Н/м, и если г = 1 мм, то 2у/г = 2 * 58,8 * 10−3/ 10−3 = 118 Па. В то же время нормальное атмосферное давление равно 1,01 * 105 Па, что примерно в 1000 раз больше. Следовательно, для достаточно больших пузырьков условие всплывания пузырька и его разрыва у поверхности жидкости запишется так:
Это и есть условие кипения.
Итак, кипение жидкости возможно в том случае, если в ней имеются пузырьки достаточно больших размеров (для воды — порядка миллиметра). Кипение начнется в том случае, когда давление насыщенного пара станет равно внешнему давлению над поверхностью жидкости. Как мы уже установили, давление насыщенного пара определяется только температурой жидкости. Из условия следует, что точка кипения зависит от внешнего давления — с ростом внешнего давления растет и точка кипения.
Уменьшение температуры кипения жидкости может играть и полезную роль. Так, например, при нормальном атмосферном давлении жидкий фреон кипит при температуре около 30 °C. При уменьшении же давления температуру кипения фреона можно сделать ниже О °С. Это используется в испарителе холодильника. Благодаря работе компрессора в нем создается пониженное давление, и фреон начинает превращаться в пар, отнимая теплоту от стенок камеры. Благодаря этому и происходит понижение температуры внутри холодильника.
Температуры кипения различных веществ при одном и том же атмосферном давлении различны. Например, жидкий кислород кипит при — 183 °C, а железо — при 2750 °C.
Различие в температурах кипения разных веществ находит широкое применение в технике, например в процессе перегонки нефти. При нагревании нефти до 360 °C та ее часть (мазут), которая имеет большую температуру кипения, остается в ней, а те ее части, у которых температура кипения ниже 360 °C, испаряются. Из образовавшегося пара получают бензин и некоторые другие виды топлива.
Если кипятить воду в стеклянном сосуде долго, то число мест на стенках сосуда, от которых отделяются пузырьки с паром, с течением времени уменьшается. Наконец, остаются только одно или два таких места, но и от них пузырьки будут отрываться всё реже и реже. Если измерить температуру жидкости, то она будет повышена на 1−2 °С по сравнению с начальной температурой кипения.
2. Пересыщенный пар Каждой температуре при обычных условиях соответствуют определённые плотность и давление насыщенных паров. Если в некотором объёме находятся пары какой-нибудь жидкости, например воды, то в обычных условиях понижение температуры приведёт к тому, что пары приблизятся к состоянию насыщения, а затем начнут конденсироваться, оседая в виде жидкости на стенках, а вдали от них образуются капельки тумана. Туман при охлаждении паров в одних случаях получается густой, в других — редкий, а при некоторых условиях может не появиться совсем.
Если в толстостенный стеклянный сосуд, содержащий несколько капель воды накачать воздух (при этом воздух в сосуде нагреется), затем выждав несколько минут, чтобы воздух в сосуде принял комнатную температуру и открыть сосуд, то можно увидеть, что в нём появится слабый туман. Причина этого такова. При открывании сосуда воздух в нём разредился и охладился. Это охлаждение привело к тому, что пар воды в сосуде дошёл до насыщения и сконденсировался. Если в сосуд бросить горящую спичку, то она погаснет, оставив в сосуде незаметный дым. Если повторить опыт, то можно увидеть, что сосуд после откупоривания наполнился туманом более густым, чем раньше. Частицы дыма служат центрами, около которых начинается конденсация паров (ядра конденсации). Поэтому при наличии дыма появляется (при тех же условиях) больше капелек тумана, чем в его отсутствии.
Если воздух в сосуде тщательно очистить от пыли, то туман при откупоривании сосуда со сжатым воздухом не появится даже при охлаждении значительно ниже температуры, при которой достигается насыщение. В этом случае получается пересыщенный пар, то есть пар, давление которого выше, чем давление насыщенного пара при данной температуре.
Однако опыт показывает, что образование капелек жидкости возможно лишь в том случае, если в газе имеются центры конденсации-пылинки, ионы, острия на поверхности твердых тел и т. п. Если же центры конденсации отсутствуют, то капли жидкости не образуются, и возникает метастабильное состояние — пересыщенный (переохлажденный) пар. Пар называют пересыщенным, если его плотность (давление) выше плотности (давления) насыщенного пара при той же температуре. Метастабильные состояния широко встречаются в природе и используются в науке и технике. В атмосфере ядрами конденсации служат чаще всего ничтожно малые крупинки морской соли, всегда носящиеся в воздухе. Немалую роль играет также дым. С существованием метастабильных состояний связаны, например, явления магнитного, электрического и упругого гистерезиса, образование перенасыщенных растворов, закалка стали, производство стекла и т. д.
Пересыщенный пар можно получить и путем изотермического сжатия пара до давления, которое превосходит давление насыщенного пара при данной температуре. Способность ионов играть роль центров конденсации используется в камере Вильсона. Заряженная частица на своем пути в переохлажденном паре ионизует молекулы пара. Ионы становятся центрами конденсации, вокруг которых образуются капельки жидкости. Благодаря этому вдоль траектории частицы образуется туман, и траектория становится видимой. Это позволяет исследовать заряженные частицы, их взаимодействие и т. д. Такие приборы называются камерами Вильсона. Они сыграли большую роль в научных исследованиях элементарных частиц.
Почему ионы становятся зародышами конденсации? Это обусловлено балансом энергии конденсации, поверхностной энергии и кулоновской энергии. Молекулы воды обладают большим дипольным моментом. Они окружают заряженный ион, ориентируясь по направлению к нему противоположным зарядом своего диполя. Образующийся в результате такого построения агрегат вне себя действует как заряд иона, в результате чего происходит присоединение следующего слоя молекул и образуется растущая капелька воды.
Камера Вильсона представляет собой стеклянный цилиндрический сосуд, покрытый сверху стеклом. Снизу сосуд покрыт слоем черного влажного бархата или сукна, над поверхностью которого образуется насыщенный пар. При быстром опускании поршня происходит адиабатное расширение газа, что сопровождается понижением его температуры. За счет охлаждения пар становится переохлажденным (пересыщенным).
Заряженные частицы, образующиеся при радиоактивном распаде, например били вчастицы, пролетая в газе, создают на своем пути цепочку ионов. На этих ионах как на центрах конденсации образуются капельки жидкости. Таким образом, при полете частица оставляет за собой след (трек), который хорошо виден и может быть сфотографирован. Треков б-частиц короткие и жирные, треки в-частиц прерывистые и длинные.
3. Исследование кинетики в СССР. Кафедра молекулярной физики Основное научное направление в исследовании физики жидкостей определилось по инициативе В. П. Скрипова в 1961 году. Им была спроектирована и изготовлена небольшая пузырьковая камера. Вслед за этим совместно с дипломниками В. И. Кукушкиным и В. Н. Черепановым были поставлены опыты по перегреву маленьких капелек в серной кислоте. В 1962 году в эту работу включился дипломник Г. В. Ермаков , а годом позже П. А. Павлов , В. Н. Чуканов и аспирант Е. Н. Синицын . С учетом дальнейшего развития работы, в которой участвовало много студентов, аспирантов, преподавателей кафедры, это направление можно сформулировать следующим образом: метастабильные состояния жидкостей (перегрев, переохлаждение), устойчивость и кинетика неравновесных фазовых переходов, сопровождающихся метастабильностью.
В 1972 году исследования перегретых жидкостей были, в основном, перенесены в Отдел физико-технических проблем энергетики Уральского научного центра АН СССР, преобразованный в 1988 году в Институт теплофизики УрО РАН. Разработанная программа исследований реализована здесь на классе криогенных жидкостей. Изучена кинетика зародышеобразования в перегретых аргоне, ксеноне, криптоне, кислороде, азоте, метане, водороде, неоне, пропане, бутане, жидком гелии. Полученные результаты подтвердили сделанные ранее выводы. Начаты новые исследования. Изучена кинетика зародышеобразования в бинарных растворах и диссоциирующих жидкостях вблизи критической точки системы жидкость-пар, влияние на нее различных инициирующих факторов: ионизирующих излучений, ультразвука, электрического поля, контакта с поверхностью. Поставлен цикл работ по гидродинамике вскипающих перегретых потоков жидкости. Разработаны и созданы комплексы экспериментальных установок для изучения уравнения состояния перегретых жидкостей, скорости и поглощения ультразвука, изохорной и изобарной теплоемкостей, вязкости и теплопроводности, поверхностного натяжения, проведены измерения указанных свойств большого числа жидкостей в широкой области параметров состояния. На основании полученных данных разработаны методики расчета указанных свойств, найдены способы определения границы устойчивости жидкой фазы — спинодали, на область метастабильных состояний расширены существующие таблицы данных по теплофизическим свойствам технически важных жидкостей. В этой работе активное участие приняли многие выпускники кафедры молекулярной физики физико-технического факультета.
В 1971 году В. Г. Байдаковым и С. П. Проценко начаты работы по компьютерному моделированию метастабильных состояний и фазового перехода жидкость-пар. Создается программа по методу Монте-Карло и исследуется устойчивость метастабильных фаз при фазовых переходах жидкость-газ и жидкость-кристалл. С 1973 года проводятся работы по методу молекулярной динамики применительно к двумерным системам.
Литература
жидкость кипение пересыщенный пар
Между жидкостью и паром, находящимся над ней может существовать динамическое равновесие, при котором число молекул, покидающих жидкость за некоторое время, равно числу молекул, возвращающихся их пара в жидкость за то же время. Пар, находящийся в равновесии со своей жидкостью называют насыщенным. Давление насыщенного пара не зависит от объема и определяется только температурой.
Прикрепленные файлы: 1 файл
физика.docx
Взаимное превращение жидкостей и газов.
Между жидкостью и паром, находящимся над ней может существовать динамическое равновесие, при котором число молекул, покидающих жидкость за некоторое время, равно числу молекул, возвращающихся их пара в жидкость за то же время. Пар, находящийся в равновесии со своей жидкостью называют насыщенным. Давление насыщенного пара не зависит от объема и определяется только температурой.
Жидкость кипит при температуре, при которой давление насыщенного пара в пузырьках становится равным давлению в жидкости. Чем больше внешнее давление, тем выше температура кипения. Кипение — процесс интенсивного парообразования, который происходит как со свободной поверхности жидкости, так и внутри неё.
С увеличением температуры плотность насыщенного пара растет, а плотность жидкости уменьшается. При температуре, называемой критической, исчезают различия между жидкостью и ее насыщенным паром. Их плотности становятся одинаковыми.
Атмосферный воздух представляет собой смесь различных газов и водяного пара. Содержание водяного пара в воздухе, т.е. влажность воздуха характеризуют рядом величин. Давление, которое производил бы водяной пар, если бы все остальные газы отсутствовали, называют парциальным давлением водяного пара. Относительной влажностью воздуха называют выраженное в процентах отношение парциального давления водяного пара, содержащегося в воздухе при данной температуре, к давлению насыщенного пара при той же температуре. Большое значение имеет знание влажности в метеорологии для предсказания погоды.
Теплововой двигатель — устройство, совершающее работу за счет использования внутренней энергии топлива, тепловая машина, превращающая тепло в механическую энергию, использует зависимость теплового расширения вещества от температуры. Действие теплового двигателя подчиняется законам термодинамики. Для работы необходимо создать разность давлений по обе стороны поршня . Для работы двигателя обязательно наличие топлива. Это возможно при нагревании газа, который совершает работу за счёт изменения своей внутренней энергии. Повышение и понижение температуры осуществ ляется, соответственно, нагревателем и охладителем.
Коэффициент полезного действия тепловой машины
Рабочее тело, получая некоторое количество теплоты Q1от нагревателя, часть этого количества теплоты, по модулю равную |Q2|,отдает холодильнику. Поэтому совершаемая работа не может быть больше A = Q1 — |Q2|.Отношение этой работы к количеству теплоты, полученному расширяющимся газом от нагревателя, называется коэффициентом полезного действия тепловой машины:
Основные части теплового двигателя
В современной технике механическую энергию получают главным образом за счет внутренней энергии топлива. Устройства, в которых происходит преобразование внутренней энергии в механическую, называют тепловыми двигателями. Для совершения работы за счет сжигания топлива в устройстве, называемом нагревателем, можно воспользоваться цилиндром, в котором нагревается и расширяется газ и перемещает поршень. Газ, расширение которого вызывает перемещение поршня, называют рабочим телом. Расширяется же газ потому, что его давление выше внешнего давления. Но при расширении газа его давление падает, и рано или поздно оно станет равным внешнему давлению. Тогда расширение газа закончится, и он перестанет совершать работу.
Как же следует поступить, чтобы работа теплового двигателя не прекращалась? Для того чтобы двигатель работал непрерывно, необходимо, чтобы поршень после расширения газа возвращался каждый раз в исходное положение, сжимая газ до первоначального состояния. Сжатие же газа может происходить только под действием внешней силы, которая при этом совершает работу (сила давления газа в этом случае совершает отрицательную работу). После этого вновь могут происходить процессы расширения и сжатия газа. Значит, работа теплового двигателя должна состоять из периодически повторяющихся процессов (циклов) расширения и сжатия.
Молекулы в жидкостях находятся близко друг к другу, примерно на расстояниях равных размерам самих молекул. Это является причиной высокого молекулярного ван-дер-ваальсового давления, которое равно . Для воды, например, он равен около 11000 атм. Удельный объем жидкостей в тысячи раз меньше чем газов, следовательно, отношение в жидкостях в миллионы раз больше, чем в газах. Поэтому можно пренебречь внешним давлением, и уравнение Ван-дер-Ваальса примет вид
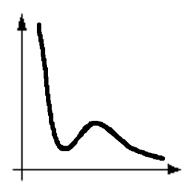
Большой величиной молекулярного давления объясняется ничтожно малая сжимаемость жидкостей. Это сразу видно из уравнения кривой Ван-дер-Ваальса, на которой жидкому состоянию соответствует участок AB (см. рис. 1). Коэффициент сжимаемости c жидкости – относительное изменение объема dV при изменении давления на единицу т.е.
Опыт показывает, что коэффициент сжимаемости большинства жидкостей лежит в пределах от 10 -4 до 10 -5 .
Коэффициент сжимаемости жидкости зависит от давления. Он возрастает с повышением температуры. К этому результату можно прийти и опытным путем и исходя из уравнения Ван-дер-Ваальса. Поскольку это уравнение связывает температуру, объем и давление, то из него можно вычислить величину . При расчете необходимо учитывать, что постоянные a и b на самом деле зависят от температуры. Совокупность опытных данных позволила получить эмпирическую формулу для коэффициента сжимаемости жидкости:
где A – некоторая функция, возрастающая с температурой, p – внешнее давление и p T – давление, связанное с силами Ван-дер-Ваальса ( a / V 2 ) при температуре T . Эта формула показывает, что коэффициент сжимаемости растет с повышением температуры и уменьшается с ростом давления.
Среди всех жидкостей наибольшей сжимаемостью обладает жидкий гелий, у которого при давлении в несколько атмосфер коэффициент c равен . Коэффициент сжимаемости воды равен , а ртути –.
Тепловое расширение жидкости
Тепловое расширение вещества характеризуется коэффициентом объемного расширения
т.е. относительным изменением объема V при изменении температуры T на 1 К.
Числовые значения коэффициента a сильно зависят от температуры и давления. Для различных жидкостей значения a при одинаковых температурах могут меняться весьма значительно. Так, например, для воды , для бензола , для жидкой углекислоты , глицерина и т.д. При повышении температуры a сильно возрастает. Так для жидкой углекислоты при повышении температуры от 0° до 20° коэффициент теплового расширения возрастает вдвое. Увеличение давления несколько снижает значение a .
Вода обладает аномальным тепловым расширением. В интервале от 0° до 3,98° коэффициент a отрицателен: при нагревании объем воды уменьшается и наибольшей плотности вода достигает при 3,98° C . При этой температуре a = 0.
Причиной этого явления является то, что молекулы воды имеют различный состав: не только H 2 O , но 2 H 2 O и 3 H 2 O . Относительные количества этих молекул меняются с температурой и давлением.
Внутренняя энергия жидкостей определяется не только кинетической энергией тепловых движений частиц, но и их потенциальной энергией взаимодействия. Поэтому закономерности, полученные для теплоемкостей идеальных газов из уравнений кинетической теории, не могут быть справедливы для жидкостей.
Опыт показывает, что теплоемкость жидкостей зависит от температуры, причем вид зависимости у разных жидкостей различный. У большинства из них теплоемкость с повышением температуры увеличивается, но есть и такие у которых, наоборот, - уменьшается. У некоторых жидкостей теплоемкость с повышением температуры сначала падает, а затем, пройдя через минимум, начинает расти. Такой ход теплоемкости наблюдается у воды. Жидкости с большим молекулярным весом обычно имеют большие значения теплоемкостей. Особенно это проявляется у органических жидкостей.
У жидкостей, как и газов, следует различать теплоемкость при постоянном объеме и при постоянном давлении. Разность молярных теплоемкостей равна C p – C V равна работе расширения pdV ( p – молекулярное давление ) моля жидкости при его нагревании на один градус, поэтому численное значение этой разности зависит от значения коэффициента объемного теплового расширения жидкости. В отличие от идеальных газов значение C p - C V у жидкостей не равно постоянной R , а может быть и больше и меньше в зависимости от значения коэффициента объемного расширения и от величины внутренних сил взаимодействия частиц жидкости, против которых совершается работа расширения (давление p в выражении pdV связано именно с этими силами).
Так, у жидкого аргона при 140 К теплоемкость , а и, следовательно . У воды же при температуре около 0° C теплоемкость , а , так что .
Таким образом, численные значения теплоемкостей жидкостей могут быть самыми разнообразными. Исключение составляют жидкие металлы, у которых молярная теплоемкость обычно близка к значению .
Явления переноса в жидкостях
В жидкостях, как и в газах, наблюдаются явления диффузии, теплопроводности и вязкости. Но механизм этих процессов в жидкостях иной, чем в газах.
В отличие от газов, в жидкостях отсутствует понятие длины свободного пробега. Это связано с тем, что в жидкостях среднее расстояние между молекулами такого же порядка, как и размеры самих молекул. Молекулы жидкости могут совершать лишь малые колебания в пределах, ограниченных межмолекулярными расстояниями.
Такие колебания молекул время от времени сменяются скачками на некоторое расстояние d , происходящими из-за получения молекулой в результате флуктуации избыточной энергии от соседних молекул. Колебания, сменяющиеся скачками, – и есть тепловые движения молекул жидкости.
Для явления диффузии в жидкости справедлив закон Фика. Он гласит:
где I – диффузионный поток в направлении оси X , D – коэффициент диффузии, а - градиент концентрации по оси X .
Обозначим время между скачками молекул через t , тогда величина - скорости молекулы. Это дает возможность сравнить со средней длинной свободного пробега, а - со средней скоростью молекул. Тогда по аналогии с идеальными газами коэффициент диффузии (точнее самодиффузии) жидкости равен:
Коэффициент самодиффузии сильно зависит от температуры, т.е. с повышением температуры он увеличивается.
Выражение коэффициента диффузии можно переписать в виде
где , причем n - частота вышеописанных колебаний, а w – энергия, необходимая для скачка молекулы, называемая энергией активации молекулы.
Численное значение коэффициента диффузии у жидкостей много меньше чем у газов. Например коэффициент диффузии NaCl в воде равен 1,1·10 -9 м 2 /с, в то время как для диффузии аргона в гелий он равен 7·10 -5 м 2 /с.
Внутреннее трение жидкостей возникает при движении жидкости из-за переноса импульса в направлении, перпендикулярном к направлению движения. Перенос импульса из одного слоя в другой осуществляется при скачках молекул, о которых говорилось выше.
Очевидно, что жидкость будет тем менее вязкой, чем меньше время t между скачками молекул, и значит, чем чаще происходят скачки. Исходя из этого, можно написать выражение для коэффициента вязкости, называемого уравнением Френкеля – Андраде:
Множитель C , входящий в это уравнение зависит от дальности скачка , частоты колебаний n и температуры. Однако температурный ход вязкости определяется множителем e w / kT . Как следует из этой формулы, с повышением температуры вязкость быстро уменьшается.
Теплопроводность в жидкостях имеет место при наличии градиента температуры. При этом энергия в жидкостях передается в процессе столкновения колеблющихся частиц. Частицы с более высокой энергией совершают колебания с большей амплитудой, и при столкновениях с другими частицами как бы раскачивают их, передавая им энергию. Такой механизм передачи энергии не обеспечивает ее быстрого переноса. Поэтому теплопроводность жидкостей очень мала.
Например, коэффициент теплопроводности этилового спирта составляет 1,76 Вт/м·К. Исключение составляют жидкие металлы, коэффициенты теплопроводности которых близки к значениям для твердых металлов. Это объясняется тем, что тепло в жидких металлах переносится не только вместе с передачей колебаний от одних частиц к другим, но и при помощи электронов, которые есть в металлах, но отсутствуют в других жидкостях.
Парообразование и кипение
В поверхностном слое и вблизи поверхности жидкости действуют силы, которые обеспечивают существование поверхности и не позволяют молекулам покидать объем жидкости. Благодаря тепловому движению некоторая часть молекул имеет достаточно большие скорости, чтобы преодолеть силы, удерживающие молекулы в жидкости, и покинуть жидкость. Это явление называется испарением. Оно наблюдается при любой температуре, но его интенсивность возрастает с увеличением температуры.
Если покинувшие жидкость молекулы удаляются из пространства вблизи поверхности жидкости, то, в конце концов, вся жидкость испарится. Если же молекулы, покинувшие жидкость не удаляются, то они образуют пар. Молекулы пара, попавшие в область вблизи поверхности жидкости, силами притяжения втягиваются в жидкость. Этот процесс называется конденсацией.
Таким образом, в случае неудаления молекул скорость испарения уменьшается со временем. При дальнейшем увеличении плотности пара достигается такая ситуация, когда число молекул, покидающих жидкость за некоторое время, будет равно числу молекул, возвращающихся в жидкость за то же время. Наступает состояние динамического равновесия. Пар в состоянии динамического равновесия с жидкостью называется насыщенным.
С повышением температуры плотность и давление насыщенного пара увеличиваются. Чем выше температура, тем большее число молекул жидкости обладает энергией, достаточной для испарения, и тем большей, должна быть плотность пара, чтобы конденсация могла сравняться с испарением.
Температурой кипения является та температура, при которой давление насыщенных паров становится равным внешнему давлению. При увеличении давления температура кипения увеличивается, а при уменьшении - уменьшается.
По причине изменения давления в жидкости с высотой ее столба, кипение на различных уровнях в жидкости происходит, строго говоря, при различной температуре. Определенную температуру имеет лишь насыщенный пар над поверхностью кипящей жидкости. Его температура определяется только внешним давлением. Именно эта температура имеется в виду, когда говорят о температуре кипения.
Количество тепла, которое необходимо подвести, для того чтобы изотермически превратить в пар определенное количество жидкости, при внешнем давлении, равном давлению ее насыщенных паров, называется скрытой теплотой парообразования. Обычно эту величину соотносят к одному грамму, или одному молю. Количество теплоты, необходимое для изотермического испарения моля жидкости называется молярной скрытой теплотой парообразования. Если эту величину поделить на молекулярный вес, то получится удельная скрытая теплота парообразования.
Читайте также:
- Реферат на тему город новая среда обитания человека и животных
- История развития социальной геронтологии реферат
- Восприятие времени в античности календарь праздники реферат
- Досократовская философия проблема первоначала реферат
- Реферат на тему сравнение топтания в первобытности с подобными ему современными техниками

