Оперативное лечение рака молочной железы реферат
Обновлено: 05.07.2024
Рак молочной железы – ведущая причина онкологической смертности у женщин. Раннее выявление новообразований молочной железы и общая онконастороженность – оптимальная тактика для профилактики заболевания.
Злокачественные опухоли молочной железы занимают лидирующую позицию в списке онкологической заболеваемости. В России с этой проблемой сталкивается каждая десятая женщина. Очень редко болезнь поражает мужчин (1%). Несмотря на наружную локализацию, нередко новообразование выявляют уже в терминальной фазе (при III и IV стадиях – порядка 30% случаев). Поэтому каждый медицинский работник обязан знать алгоритм диагностических мероприятий, направленных на раннее выявление злокачественных образований грудных желез.
Определение и классификация рака молочной железы
Рак молочной железы (РМЖ) – это злокачественное новообразование, берущее начало из эпителиальной ткани. Клетки опухоли постоянно размножаются, не имеют функции апоптоза (естественная, генетически запрограммированная гибель) и "атакуют" организм "хозяина". Как правило, с каждым последующим делением, образование становится более агрессивным. Новые клоны клеток отличаются низкой степенью дифференцировки, но при этом приобретают механизмы защиты, позволяющие "уходить" от иммунного ответа организма. "Поведение" опухоли в основном определяется ее гистологическим типом.
Аденокарцинома молочной железы (железистый рак) встречается намного чаще других морфологических вариантов данной патологии. В 90% случаев субстратом такой опухоли являются клетки грудных протоков, в 10% – дольки органа. Для аденокарциномы характерны три степени дифференцировки:
- G1 – высокая;
- G2 – средняя;
- G3 – низкая.
Низкая дифференцировка клеток служит предиктором неблагоприятного прогноза заболевания. Недифференцируемые опухоли отличаются высокой агрессивностью и трудно поддаются лечению.
Также РМЖ классифицируется по международной системе TNM и клиническим проявлениям (узловая, диффузная и атипические формы). Стадия болезни определяется с учетом всех характеристик основной опухоли и отдаленных очагов при их наличии. Обязательно оцениваются результаты иммуногистохимического анализа и определение специфических рецепторов, чувствительных к эстрогенам и прогестерону. Гормонозависимый рак встречается примерно у 65-70% женщин.
Для онкологов наибольшее значение имеет клиническая классификация злокачественных образований молочной железы, так как определенные виды патологии имеют свои особенности диагностики и лечения. Так, узловая форма представляет собой локально расположенный узел определенного размера. Диффузный РМЖ подразделяется на:
- отечно-инфильтративный;
- панцирный;
- маститоподобный;
- рожистоподобный.
К атипичным формам относят:
- рак Педжета (поражается ареолярно-сосочковая зона);
- эктопированная опухоль (злокачественные клоны, предшественниками которых были нормальные клетки молочной железы, находятся в других органах и тканях);
- мультицентричный рак (в одной грудной железе располагается несколько злокачественных узлов на расстоянии около 2-3 сантиметров друг от друга);
- синхронный рак обеих молочных желез (инвазивные и неинвазивные гистологические формы);
- злокачественные новообразования кожи и ее придатков, расположенные в области грудных желез.
Патогенез
РМЖ является полиэтиологическим заболеванием. Причины, которые вызывают болезнь и способствуют ее развитию, разделяют на эндогенные (внутренние) и экзогенные (внешние). К первым относят:
- любые нарушения в работе репродуктивной системы (воспалительные процессы в матке и яичниках, сбои менструального цикла (повышенный уровень эстрогенов), патология лактационного периода, аборты и т.д.);
- гормонально-метаболические изменения в женском организме (лишний вес, сахарный диабет, гипотиреоз, избыток или недостаток гормонов гипофиза, гипертония, атеросклероз, болезни печени и т.д.);
- наследственный фактор, когда женщина является носителем генетических поломок в определенных генах (BRCA1, BRCA, CHECK, NBS1, tP53), что приводит к формированию онкологического процесса в ткани молочной железы и некоторых других органах (гонады, легкие, гортань и другие).
К экзогенным неблагоприятным факторам относят:
- канцерогены химического (сигареты, алкогольные напитки), биологического (вирусы, бактерии) и физического происхождения (в первую очередь ионизирующая радиация);
- несбалансированное нерациональное питание, с преимущественным употреблением животных жиров;
- травмы молочной железы;
- длительный нерациональный прием гормональных препаратов;
- нарушение иммунной реактивности организма;
- стрессы, в том числе, хронические;
- любые другие факторы, стимулирующие пролиферацию железистых структур.
Чаще раковые клетки развиваются на фоне уже имеющихся нарушений в ткани грудных желез (мастопатия, маститы). В 80% случаев опухоль появляется после 50 лет. К этому возрасту комбинация неблагоприятных факторов, действующая длительное время, приводит к перерождению нормальных клеточных элементов в злокачественные клоны.
Симптомы и стадии развития
В начале своего развития РМЖ протекает в большинстве случаев бессимптомно. Как правило, высокодифференцированные аденокарциномы растут медленно и незаметно в течение нескольких лет. Агрессивные виды, напротив, отличаются молниеносным развитием, рано дают метастазы и имеют яркую клиническую картину.
С ростом опухолевой массы у пациентки могут появиться следующие характерные признаки:
При наличии отдаленных метастатических очагов будет проявляться симптоматика, характерная для поражения конкретной анатомической области (печень, кости, бронхолегочная система и т.д.).
Методы диагностики
Определение диагноза начинается с опроса и осмотра у онколога-маммолога. Врач подробно собирает анамнез болезни и жизни, выявляя потенциальные неблагоприятные факторы и генетическую предрасположенность. Доктор выполняет визуальную оценку, пальпацию молочных желез и расположенных рядом лимфатических узлов.
Инструментальные методы диагностики
В комбинации с рентгенологическим исследованием онкологи всегда рекомендуют проводить ультразвуковое исследование (УЗИ) молочных желез и регионарных лимфатических узлов. Оно позволяет детально оценить структуру железистой ткани и млечных протоков. Также для выявления онкологической патологии иногда назначают дуктографию и МРТ.
Для исключения распространенности злокачественного процесса используют дополнительные функциональные методы диагностики: остеосцинтиграфия всего тела, КТ легких, МРТ органов малого таза с контрастированием и т.д. Всем женщинам обязательно проводится гинекологический осмотр и УЗИ матки и придатков.
Для подтверждения злокачественной природы новообразования всегда выполняется забор биологического материала для цитологического (клеточного) или гистологического (тканевого) анализа. Для этого врач проводит прицельную биопсию всех подозрительных очагов под контролем УЗИ или рентген-аппарата. При наличии выделений из сосков или огромной опухоли с распадом и участками изъязвления делаются отпечатки на стекла.
Клинические показатели
Диагностика РМЖ включает в себя рутинные клинические анализы крови и мочи. Также оцениваются биохимические показатели и гормональный фон (эстрадиол, ФСГ, пролактин и т.д.).
Биопсийный материал подвергается иммуногистохимическому исследованию. В заключении указываются:
- гистологический вариант опухоли;
- степень дифференцировки;
- соотношение РЭ (рецепторы эстрогена) к РП (рецепторы прогестерона);
- статус HER2 (рецептор второго эпидермального человеческого фактора)
- уровень Ki67 (индекс пролиферации опухоли).
При наличии показаний проводится генетическое тестирование для определения поломок в генах BRCA1, BRCA2, CHECK, NBS1 и tP53. При выявлении даже одного показателя подтверждается наследственный вид рака. Согласно официальным клиническим рекомендациям, обязательно генетический тест выполняется:
- пациенткам, у которых был диагностирован РМЖ в возрасте до 45 лет;
- при первично-множественном поражении грудных желез;
- женщинам моложе 60 лет с тройным негативным фенотипом опухоли;
- мужчинам с неопалстическими образованиями молочных желез;
- при наличии отягощенного онкологического семейного анамнеза (злокачественные опухоли были у трех и более кровных родственников).
Также сдается кровь на онкологические маркеры (наибольшую специфичность имеет показатель СА15.3).
Дифференциальная диагностика
При подозрении на наличие РМЖ первым делом исключается доброкачественная патология органа (фиброаденома, липома, киста, мастит, мастопатия и т.д.). Решающее значение в постановке диагноза имеет морфологическая верификация материала, полученного из подозрительного очага.
Железистый рак дифференцируют с неэпителиальными злокачественными образованиями молочных желез (саркома, лимфома, метастатические опухоли). Рожистоподобную форму следует отличать от рожистого воспаления.
Лечение
Врачебная тактика при злокачественных образованиях молочных желез подбирается с учетом комплекса факторов (стадия процесса, возраст и общее соматическое состояние пациентки, степень дифференцировки и иммуногистохимические показатели опухоли). При локализованных узлах радикальным методом лечения считается оперативное вмешательство, которое в большинстве случаев сочетают с консервативными методиками (облучение или лекарственная терапия).
При распространенных процессах используется комплексный подход. Для гормоночувствительных форм рака обязательно применяются гормональные препараты.
Хирургическое вмешательство
При устранении опухоли молочной железы в последние годы используются органосохранные методики оперативных вмешательств. Если орган убирается полностью, последующим этапом выполняется его реконструкция (маммопротезирование). При выборе объема операции учитываются многие параметры, иногда хирург принимает решение непосредственно в ходе проводимого вмешательства.
Гормональная терапия
Все гормонозависимые опухоли молочной железы подлежат специфической терапии. Препаратами выбора являются:
- антиэстрогены (чаще в первой линии назначается Тамоксифен курсом на 5 лет);
- блокаторы лютеинизирующего-рилизинг фактора (Гозерелин и т. д.);
- ингибиторы ароматазы (Анастрозол и другие).
Химиотерапия
Как правило, при раке грудных желез химиотерапевтический метод применяется в комплексе с другими лечебными мероприятиями. Химиопрепараты назначаются совместно с облучением и таргетными средствами, перед операцией или после нее.
Есть несколько линий химиотерапии. Выбор всегда осуществляется индивидуально для каждой конкретной пациентки. Лечение инвазивного местнораспространенного рака молочной железы всегда начинается с назначения лекарственных препаратов.
Лучевая терапия
Аденокарциномы характеризуются хорошей восприимчивостью к радиотерапии. Облучение чаще выполняется вторым этапом после операции или химиотерапии. В область воздействия попадают молочные железы (или послеоперационная зона) и пути регионарного оттока лимфы. СОД (суммарная доза) обычно не превышает 45-50 Гр.
Паллиативная терапия
В запущенных случаях или при наличии медицинских противопоказаний к специальной терапии назначается симптоматическое лечение. Последнее направлено на поддержание нормального уровня жизни пациентки и снятие основных клинических проявлений (боль, отек, астения и т.д.). Ведущим методом паллиативной помощи считается лекарственная терапия. Иногда с целью улучшения клинической ситуации проводятся нерадикльные (циторедуктивные) операции.
Возможные осложнения
Среди основных осложнений при злокачественных образованиях молочной железы выделяют:
- вызванные прогрессированием болезни (выделение крови и гноя из распадающейся опухоли, сдавливание соседних анатомических структур и т.п.);
- связанные с проводимым лечением (низкий уровень клеток крови, послеоперационный лимфостаз верхней конечности, постлучевой бронхит и т.д.).
Для предупреждения возможных осложнений проводятся специальные профилактические мероприятия.
Прогноз заболевания
Высокодифференцированные аденокарциномы в большинстве случаев имеют благоприятный прогноз. При I стадии рака молочной железы и своевременно проведенном радикальном лечении пятилетняя выживаемость достигает 90-96%. При II стадии показатель составляет 80-90%, при III – не превышает 70%.
Профилактика
Все мероприятия по защите от рака молочной железы включены в две объемные группы:
- первичные (исключение абортов, правильное грудное вскармливание, недопущение союзов, где оба супруга имеют неблагоприятный семейный онкоанамнез и т.д.);
- вторичные (своевременная диагностика и лечение заболеваний грудных желез и болезней, способных нарушить гормональный баланс женского организма).
В целях профилактики очень важна просветительская работа с женским населением. Врачам любой профессии нужно объяснять пациенткам, как правильно проводить самоосмотры молочных желез (Рис. 1) и какие причины способствуют появлению и развитию атипичных клеток. Всем женщинам в любом возрасте необходимо следовать канонам здорового образа жизни и избегать влияния любых неблагоприятных факторов (стрессы, канцерогены, травмы и т. д.). Также нужно минимум 1 раз в год проходить комплексное обследование у гинеколога.
.jpg)
Рисунок 1. Схема самоосмотра молочных желез.
По распространенности рак молочной железы (РМЖ) занимает первое место среди онкологических заболеваний. Он поражает ежегодно 1 млн. 600 тыс. женщин в мире и свыше 66 тыс. в Российской Федерации.
В ближайшие 20 лет во всех странах прогнозируется почти двукратное увеличение заболеваемости женщин раком груди, что объясняется увеличением продолжительности жизни и улучшением методов диагностики.
За последние годы, благодаря более раннему выявлению опухолей, смертность от рака груди у женщин снижается. В развитых странах, где применяется маммографический скрининг населения, этот показатель снизился на 30–50%.
Биологические подтипы РМЖ
Рак молочной железы – это не единообразное заболевание. При лечении клиницисты учитывают принадлежность опухоли к конкретному подтипу. Генетическое тестирование и иммуногистохимический метод, позволяют надежно определить биологические подтипы РМЖ. Эти подтипы сами по себе включают многие факторы риска и предсказывающие признаки, что позволяет выбрать наиболее эффективную терапию для больного.
Доказанное с помощью молекулярно-генетического анализа и иммуногистохимического исследования патогенетическое разнообразие РМЖ позволяет индивидуализировать лечение.
Увеличение выживаемости при раке молочной железы связано не только с широкомасштабным внедрением маммографического скрининга, но и адекватным использованием системных видов лечения.
Диагностика рака молочной железы
Для выявления злокачественных опухолей молочной железы существует определенный алгоритм диагностики, и его первичный элемент — маммографический скрининг. Чувствительность этого метода диагностики для опухолей от 2 мм до 5 мм составляет около 85%. Маммографическое исследование выполняют в двух проекциях.
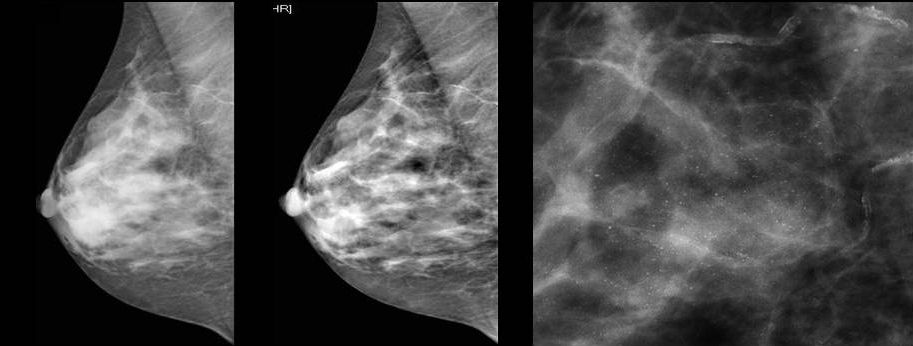
Молодым женщинам с плотным строением молочной железы необходимо включение в программу наблюдения методов УЗИ и МРТ.
Магнитно-резонансная томография
Поскольку традиционный маммографический скрининг у женщин до 40 лет малоэффективен, для скрининга может понадобиться альтернативная методика — МРТ. Современная контрастная магнитно-резонансная томография — высокочувствительный метод диагностики заболеваний молочной железы.
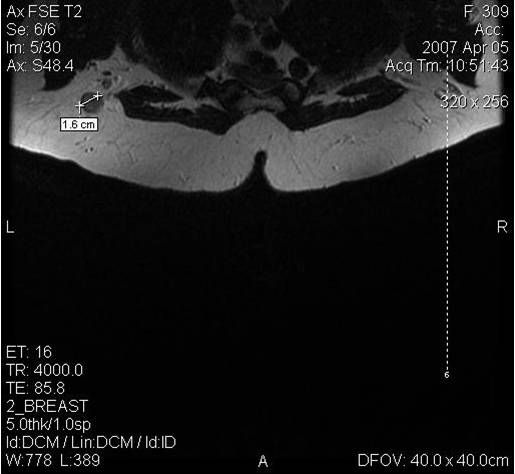
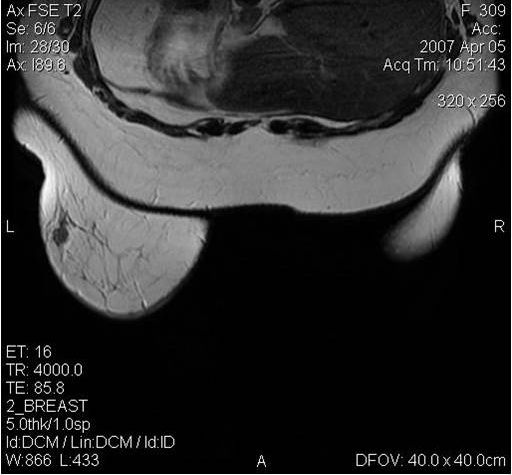
МРТ-диагностика рака молочной железы
У женщин с мутациями BRCA1 или BRCA2 при проведении МРТ возможно диагностировать рак молочной железы на самых ранних стадиях.
Пункция под контролем УЗИ
При ряде показаний женщинам назначается биопсия молочной железы под контролем УЗИ. Это исследование позволяет прицельно брать биологический материал для гистологического исследования, определения уровня экспрессии стероидных гормонов и статуса Her-2.
Факторы риска РМЖ
Известно множество факторов, повышающих риск возникновения рака молочной железы. На некоторые из них повлиять невозможно:
- семейная история по РМЖ,
- раннее менархе (начало месячных),
- позднее наступление менопаузы.
В то же время существуют и модифицируемые факторы, такие как:
- избыточный вес в постменопаузе,
- использование заместительной гормонотерапии,
- потребление алкоголя,
- курение
Стратегические шаги, направленные на снижение риска возникновения РМЖ включают контроль веса и борьбу с ожирением, регулярную физическую активность, уменьшение потребления алкоголя.
Большинство факторов риска рака молочной железы связано с действием гормонов на ткань молочной железы (раннее менархе, позднее наступление менопаузы, ожирение, применение гормональных препаратов). Считается, что именно женские половые гормоны, стимулируют процессы клеточного роста и повышают риски повреждения ДНК, что может привести к развитию злокачественного новообразования.
Наследственные факторы риска рака молочной железы
Только 5–10% случаев рака молочной железы обусловлены унаследованными мутантными генами BRCA. Но при этом, среди носителей мутаций риск возникновения заболевания может достигать 80%.
Чем младше возраст выявления первичного заболевания рака груди, тем выше вероятность заболеть контралатеральным раком, т.е. противоположной молочной железы.
Семейная история с наличием заболеваний раком молочной железы у кровных родственников, даже без ассоциации с мутациями BRCA, также повышает риск возникновения РМЖ.
Образ жизни
Ожирение
Различными исследованиями доказано существование связи между заболеваемостью первичным РМЖ в постменопаузе и ожирением. Есть подтверждение связи между избыточным весом и низкой выживаемостью при всевозможных видах РМЖ.
Алкоголь
Алкоголь — также установленный фактор риска возникновения первичного РМЖ. Достоверность его отрицательного воздействия на пациентов, перенесших рак молочной железы, убедительна, так как он влияет на увеличение количества циркулирующих эстрогенов.
Симптомы рака молочной железы
Только врач может оценить значимость различных симптомов. Однако каждой женщине необходимо знать, при каких симптомах надо обращаться к маммологу:
Все эти симптомы могут быть проявлениями различных заболеваний (их насчитывается несколько десятков), возможно, не злокачественной природы. Однако, это может решить только специалист по заболеваниям молочной железы.
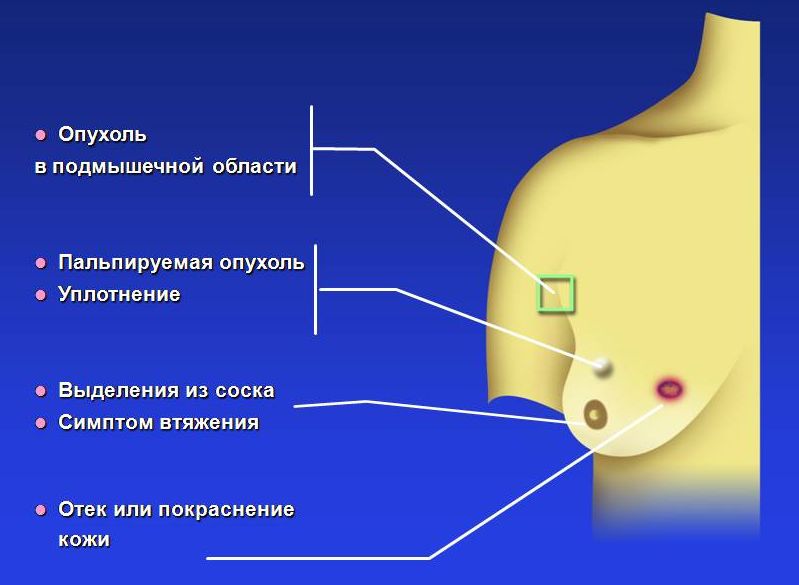
Признаки и симптомы рака молочной железы
Стадии заболевания
0 стадия
Это стадия, когда не выявлена первичная опухоль, или она не может быть оценена, а также в случае неинвазивного рака молочной железы (что означает опухоль не выходит за границы своего появления, так называемый рак in situ).
1 стадия
Раковые клетки в этой стадии инвазируют или прорастают в соседние ткани. Опухолевый узел не более 2 см, лимфоузлы при этой стадии не поражены.
2 стадия
В этой стадии опухолевый узел превышает 2см и может достигать до 5см. При этой стадии могут быть поражены лимфоузлы, но поражение лимфоузлов носит одиночный характер, они не спаяны друг с другом и находятся на той же стороне, что и опухоль. В случае поражения лимфоузлов размер опухоли может быть и менее 2см.
3 стадия
Инвазивный рак, более 5 см или с явным и значительным поражением лимфатических узлов. При этом лимфоузлы могут быть спаяны между собой.
4 стадия
На этой стадии опухоль прорастает в кожу груди, грудную стенку либо во внутренние грудные лимфатические узлы. Она может быть любых размеров.
К 4 стадии рака молочной железы относится воспалительный рак, он встречается до 10 % всех случаев. Симптомы воспалительной формы рака груди это покраснение кожных покровов, железа становится теплой, отмечается увеличение и/или уплотнение части либо всей молочной железы. Кожа приобретает вид апельсиновой корки. Эту форму рака надо дифференцировать с воспалением молочной железы – маститом.
Также при 4 стадии опухоль может распространяться за пределы грудной клетки, в подмышечную область, внутренние грудные лимфатические узлы. Возможны метастазы в надключичные лимфатические узлы, а также в легкие, печень, кости или головной мозг.
Как выглядит рак груди в разных стадиях:
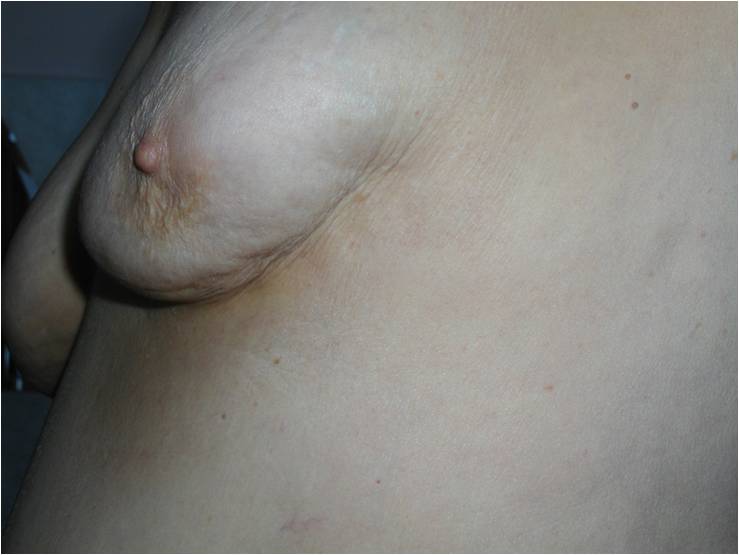
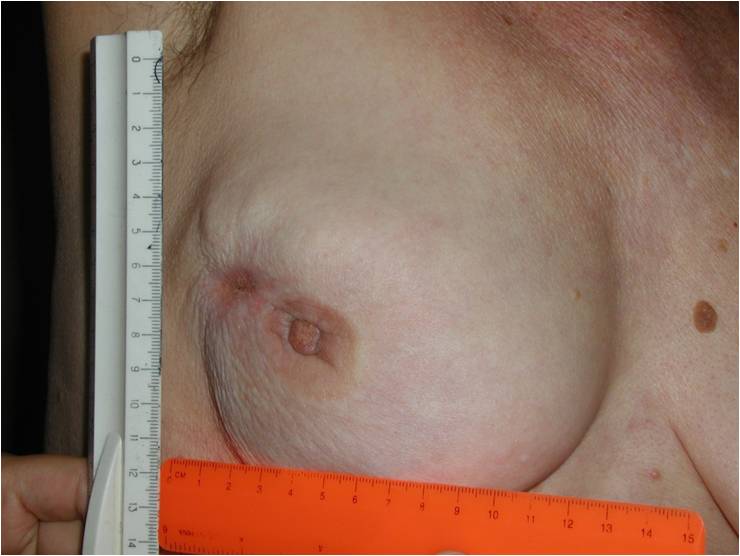

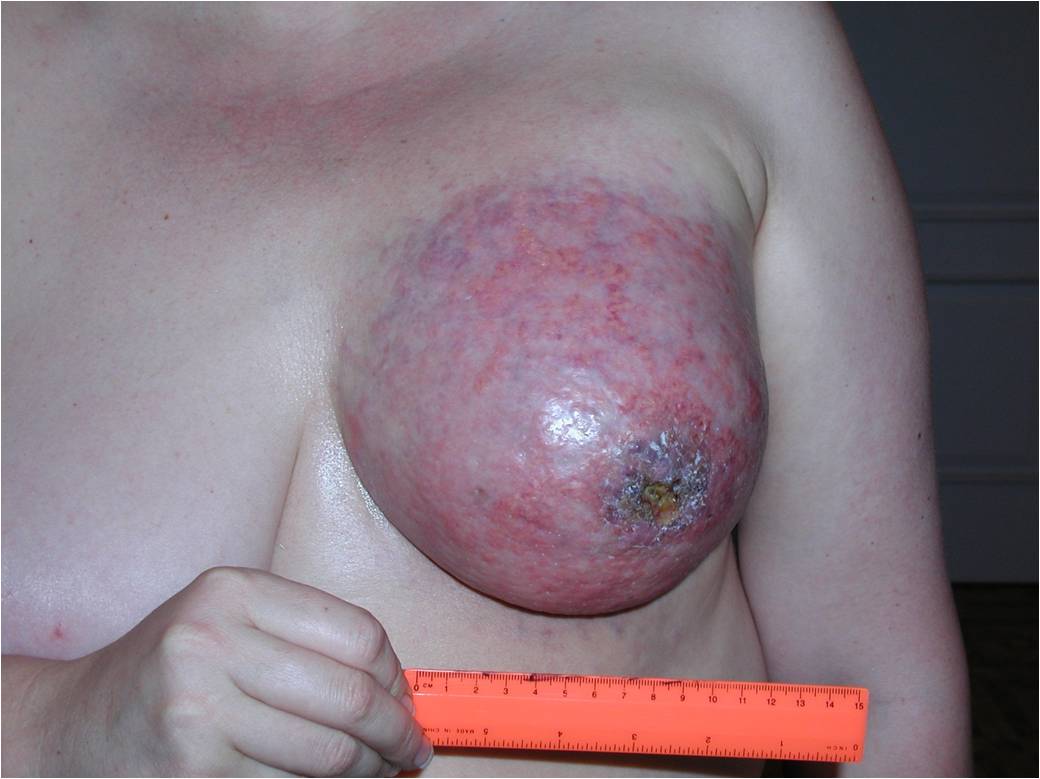
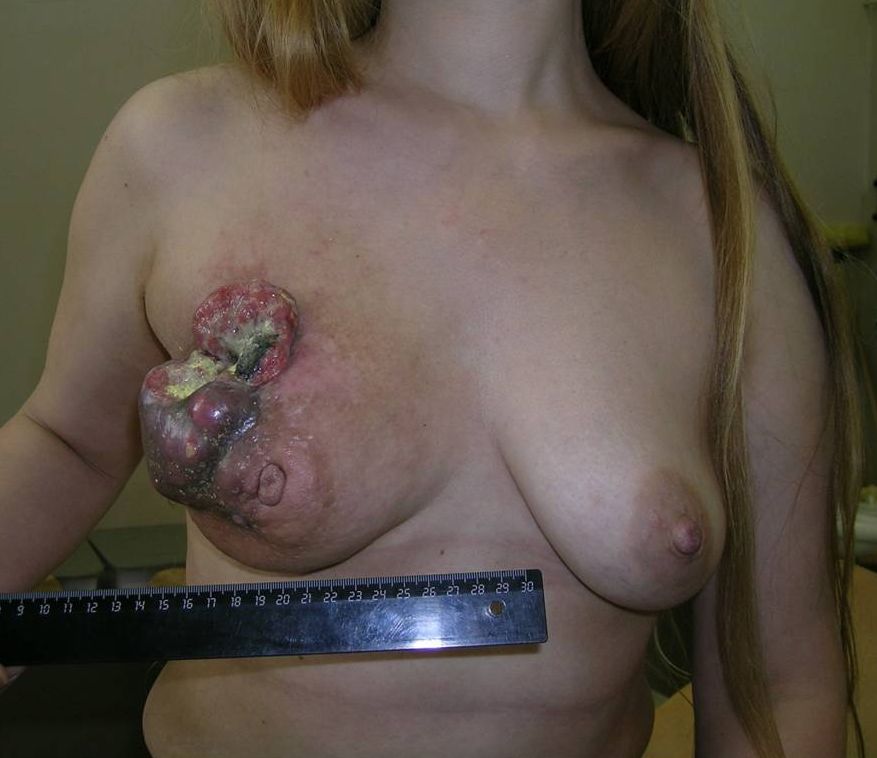
Методы лечения рака молочной железы
Хирургическое лечение
Хирургическая операция — основной метод лечения при опухолях груди, и от качества его проведения во многом зависит исход заболевания. По данным некоторых штатов Индии, в которых по религиозным мотивам не проводится хирургическое лечение, показатели заболеваемости практически равняются показателям смертности. Обычно смертность от РМЖ в два — четыре раза уступает заболеваемости.
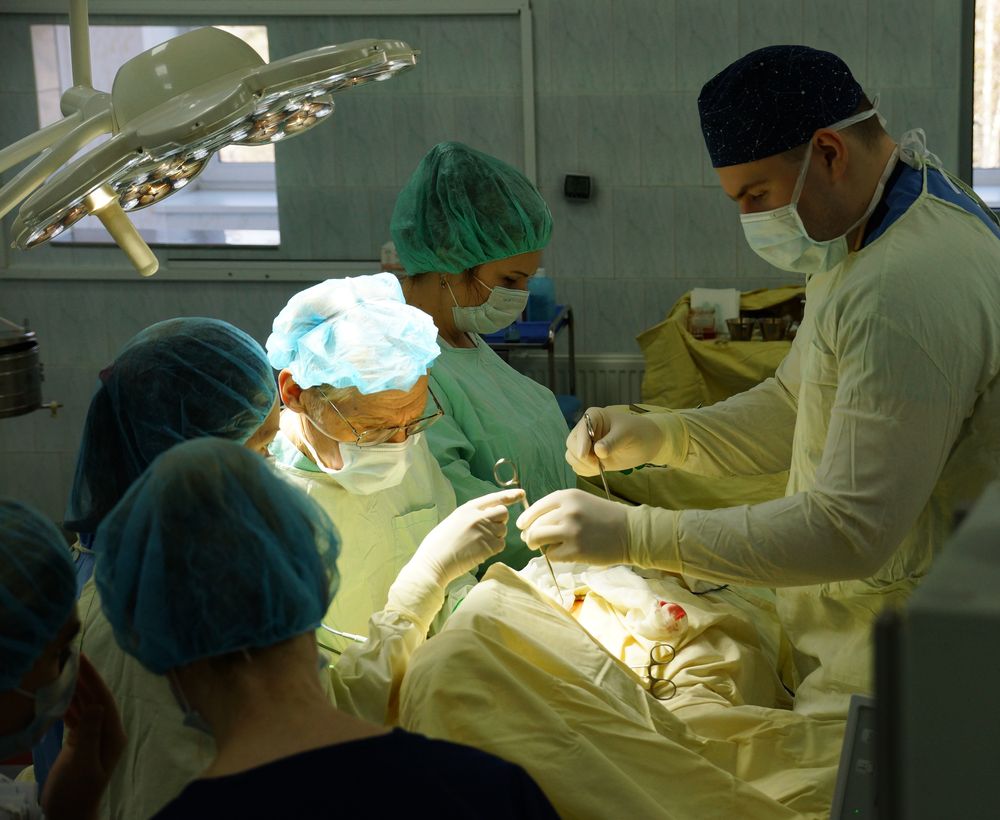
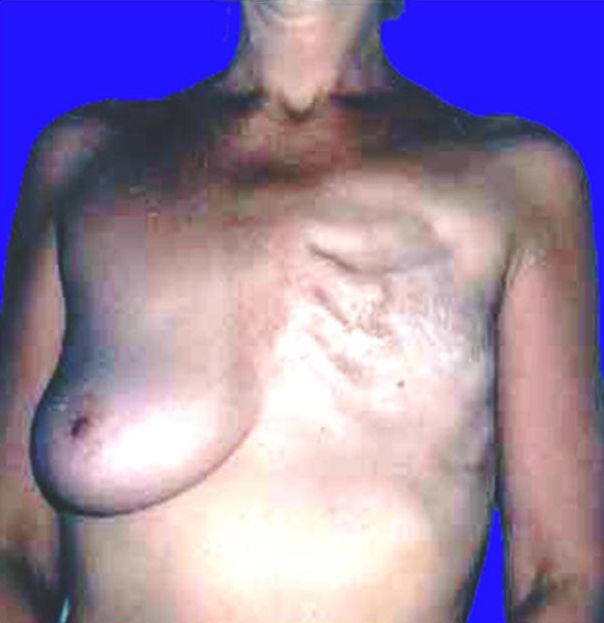

Однако, после хирургического лечения чаще всего следует лучевое. Местное лечение без послеоперационной лучевой терапии часто приводит к локально-регионарным рецидивам заболевания. Дело в том, что после завершения хирургической операции невозможно исключить существования скрытых отдаленных метастазов. Даже у больных с опухолями менее 1 см в диаметре в 10% случаев возможен рецидив заболевания.
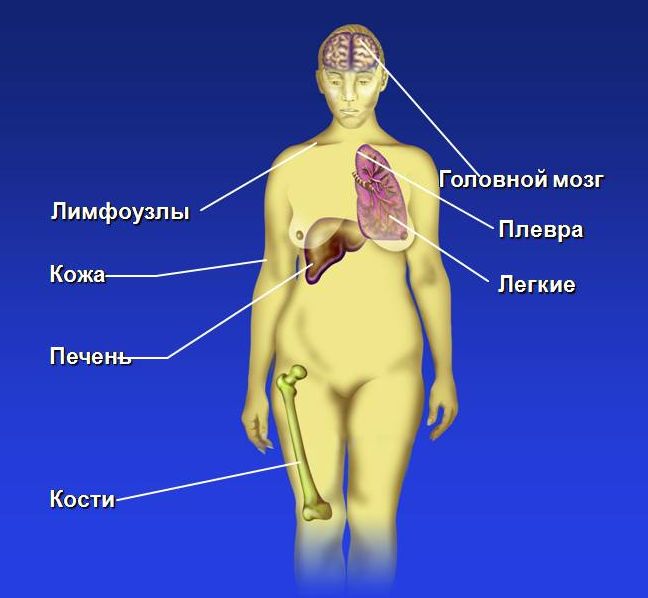
Локализация отдаленных метастазов при РМЖ
Органосохраняющие операции
Сейчас во всем мире наблюдается тенденция к сокращению объема хирургического вмешательства без потери эффективности. Хирургическое и лучевое лечение РМЖ развивается и совершенствуется в направлении органосохранения.
Благодаря этому органосохраняющему методу, тысячи пациенток избежали избыточной полной хирургической диссекции, удаление раковой опухоли не привело к удалению груди.
Последние результаты клинических испытаний, в том числе и при участии НИИ онкологии им. Н.Н. Петрова, подтвердили безопасность отказа от полной подмышечной диссекции. Биопсия сигнальных (сторожевых) лимфатических узлов постепенно вытесняет подмышечную диссекцию как стандартную процедуру стадирования РМЖ.
Концепция биопсии сигнальных лимфатических узлов приобретает все большее признание и введена для многих локализаций опухолей в стандарты хирургического лечения Европейской Организацией по Изучению и Лечению Рака (EORTC).
Химиотерапия
Химиотерапия, наряду с хирургическим вмешательством, является одним из основных методов терапии рака. Послеоперационная химиотерапия улучшает результаты хирургического лечения, как и прогноз заболевания.
Ранее решение о назначении химиотерапии основывалось на двух факторах:
- стадия заболевания
- состояние регионарных лимфоузлов.
Благодаря многочисленным исследованиям ученых изменяются представления о биологии рака молочной железы, и выбор режимов химиотерапии значительно расширяется. И сегодня химиотерапевтическое лечение назначают даже при отсутствии метастазов в лимфоузлах, если небольшие по размеру опухоли обладают агрессивными биологическими характеристиками.
Люминальный А рак
При люминальном А раке избегают назначать проведение химиотерапии, особенно при негативных лимфоузлах, и применяют одну эндокринотерапию.
Люминальный В рак
Люминальные В опухоли характеризуются высокой агрессивностью. В этом случае чаще всего будет назначена химиотерапия, а выбор лечения основывается на оценке риска развития рецидива.
HER2-позитивный рак молочной железы
Лечение HER2-позитивного рака молочной железы основано на применении стандартных схем химиотерапии – трастузумаб и ХТ, основанная на антрациклинах и таксанах. Однако, только небольшой процент пациентов выигрывает от лечения, но все подвержены связанной с этим токсичностью.
Трижды негативный РМЖ
Трижды негативный рак молочной железы обычно ассоциируется с плохим прогнозом. Из-за редкой встречаемости особых типов РМЖ нет достаточных данных о роли адъювантной химиотерапии.
Химиотерапия при РМЖ у очень молодых женщин
Рак молочной железы в молодом возрасте обычно протекает агрессивно, часто встречаются гормонорезистеные и HER2-позитивные опухоли с иными свойствами, чем у более пожилых женщин. Для таких пациенток, моложе 35 лет, адъювантная полихимиотерапия почти всегда является необходимым методом лечения.
Химиотерапия пожилых пациенток
У пожилых пациенток (старше 65 лет) при решении вопроса о назначении адъювантной химиотерапии обязательно учитываются общее состояние организма и наличие сопутствующих хронических заболеваний.
Гормонотерапия
Молодые женщины с гормоноположительным раком молочной железы сохраняют риск рецидива заболевания на протяжении по крайней мере 15 лет после первичного заболевания. Онкологи должны определить, кто из пациентов нуждается в долгосрочной адъювантной терапии тамоксифеном или ингибиторами ароматазы.
Неоадъюватная (предоперационная) терапия
Неоадъюватная терапия занимает ведущую роль в лечении женщин с неоперабельным раком молочной железы, а также имеет важное значение при операбельных опухолях, когда выполняются органосохраняющие операции.
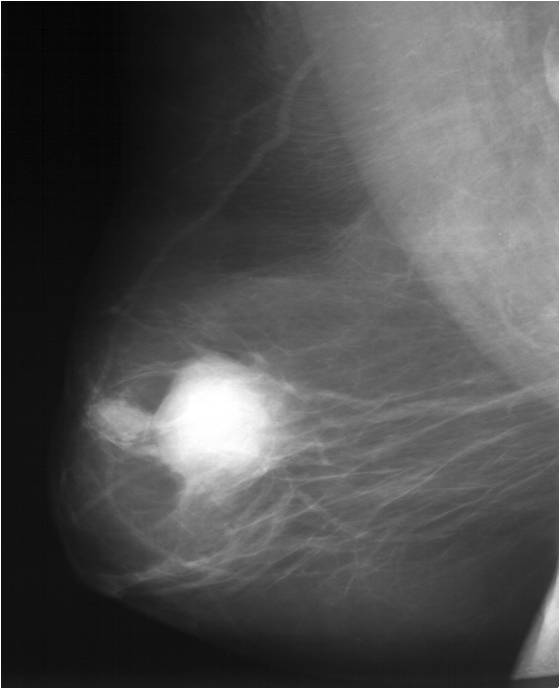
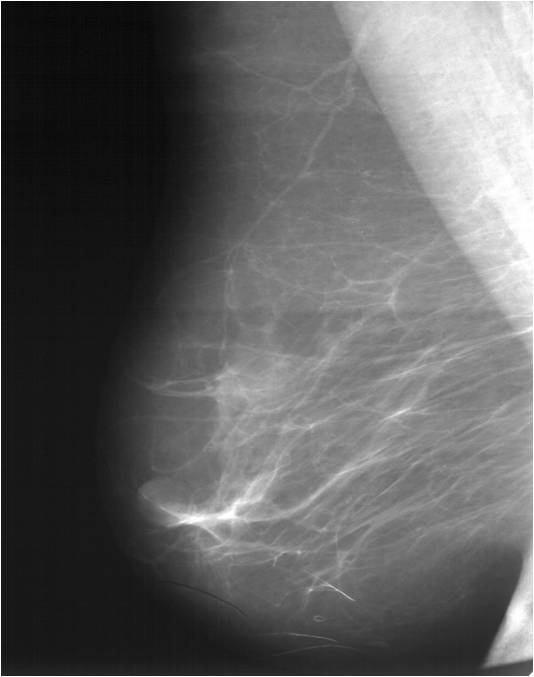
Эффект неоадъювантного лечения ДО (слева) и ПОСЛЕ (справа)
Лучевая терапия
Лучевое лечение после проведенного хирургического вмешательства играет важную роль в терапии рака молочной железы и прогнозе заболевания. В НМИЦ онкологии им. Н.Н. Петрова было проведено исследование роли лучевой терапии после органосохраняющих операций (секторальная резекция с аксиллярной лимфоаденэктомией) у пациенток с минимальным РМЖ.
Анализ десятилетней безрецидивной выживаемости доказал более высокую эффективность лечения в группе больных, где применялась послеоперационная лучевая терапия.
Стратегии профилактики РМЖ
- Химиопрофилактика
- Профилактические хирургические вмешательства
- Коррекция образа жизни
Использование лекарственных препаратов для снижения риска заболевания называется химиопрофилактикой. На сегодняшний день одобренными препаратами для профилактики рака молочной железы являются тамоксифен и ралоксифен.
Тамоксифен может использоваться как пременопаузальными, так и постменопаузальными женщинами. Прием тамоксифена приводит к снижению риска РМЖ на 38% на более чем 10 летний период. Наиболее распространенными нежелательными явлениями на фоне приема препарата являются приливы.
В настоящее время клинические исследования изучают роль другого класса препаратов – ингибиторов ароматазы для оценки эффектов снижения риска РМЖ, которые сегодня используются только для лечения РМЖ. Предварительные результаты оказываются многообещающими. Ингибиторы ароматазы действуют только у женщин с нефункционирующими яичниками.
В НМИЦ онкологии им. Н.Н. Петрова при проведении хирургического лечения женщинам с мутациями BRCA1 предлагается профилактическое удаление и реконструкция молочной железы.
Активный образ жизни идет на пользу и должен поддерживаться среди женщин, перенесших рак молочной железы. К этому единому мнению пришли в своих исследованиях эксперты таких мировых сообществ , как American Cancer Society (Американское онкологическое общество) и American College of Sports Medicine (Американская коллегия спортивной медицины). В дополнение к постоянной физической активности, эксперты рекомендуют женщинам удерживать постоянный вес и ограничивать потребление алкоголя, это также позволит снизить риск развития рака молочной железы.
Видео: вопросы и ответы по раку молочной железы
Вероятно, ни в одной области медицины необходимость удаления тканей единым блоком не подвергалась такому сомнению, как при лечении рака молочной железы (РМЖ). С тех пор как в 1894 г. Halsted предложил данный метод лечения, который заключался в удалении большой грудной мышцы для более полного устранения опухоли, он претерпел множество изменений.
Стал популярным метод модифицированной радикальной мастэктомии, при котором удаляется вся молочная железа, но без большой грудной мышцы; это позволяет избежать деформации передней грудной стенки. Удаление подмышечных лимфоузлов также изменялось: от полного (I, II и III уровня с удалением малой грудной мышцы) до частичного (I и II уровня без удаления малой грудной мышцы).
В ретроспективных исследованиях показано, что продолжительность жизни не зависит от объема операции при сравнении радикальной мастэктомии по Холстеду с любым из модифицированных методов. По этой причине в 1979 г. на согласительной конференции NCI в качестве основного метода лечения был принят модифицированный подход.
Следующим вопросом было профилактическое удаление регионарных лимфоузлов. Учитывая, что при клиническом обследовании не всегда удастся выявить небольшие метастазы, на практике быстро получило распространение удаление подмышечных лимфоузлов, целью которого было не только устранение невыявленных метастазов, но и уничтожение возможного источника последующего метастазирования.
Handley впервые обнаружил, что рецидивы в подмышечных лимфоузлах после простой мастэктомии встречаются реже, чем можно было бы ожидать, учитывая частоту скрытых метастазов в этой области. Это означает, что какие-то метастазы уничтожаются иммунной системой организма.
В 1971 г. в рамках NSABP было начато исследование, которое должно было решить вопрос о необходимости профилактической резекции регионарных лимфоузлов. Больные с опухолями без поражения подмышечных лимфоузлов (1 клиническая стадия) были случайным образом разделены на группы: в одной проводилась радикальная мастэктомия, во второй — тотальная мастэктомия с ЛТ грудной стенки и регионарных лимфоузлов, в третьей — только тотальная мастэктомия.
Пациентки с поражением подмышечных лимфоузлов (II клиническая стадия) были случайным образом разделены на две группы: в одной проводилась радикальная мастэктомия, во второй — тотальная мастэктомия и ЛТ грудной стенки и всех путей лимфооттока от молочной железы. Если не удалены скрытые подмышечные метастазы и продолжается диссеминация, то прогноз при лечении только путем тотальной мастэктомии менее благоприятен.
Напротив, наличие у больных функционирующих лимфоузлов, улучшающих иммунитет, после тотальной мастэктомии должно способствовать более благоприятному прогнозу.

В течение 72 мес. наблюдали 1665 больных. Среди всех трех лечебных групп пациенток с I стадией рака молочной железы (РМЖ) отличий обнаружено не было. В целом у больных со II стадией РМЖ выживаемость была хуже, но отличий между двумя видами лечения выявлено не было. Только 60(16 %) из 365 пациенток, не прошедших профилактическое удаление подмышечных лимфоузлов, в дальнейшем (спустя 30 — 112 мес. после операции) подверглись данной процедуре в связи с прогрессированием заболевания.
При профилактическом удалении лимфоузлов метастазы в них обнаружены у 39 % пациенток. Более чем у половины больных, у которых предполагалось наличие метастазов в лимфоузлах, они не выявлены.
В 1985 г. Fisher и соавт. сообщили о такой же группе из 1665 женщин, период наблюдения за которыми составил в среднем 126 мес. Значимых отличий между группой больных с клиническими признаками метастазов в лимфоузлах, которыхлечили путем радикальной мастэктомии, и группой, в которой была проведена тотальная мастэктомия без удаления подмышечных лимфоузлов, но с регионарной ЛТ, не обнаружено. 10-летняя выживаемость в обеих группах составила около 38 %.
Использование сторожевого лимфоузла для оценки состояния лимфоузлов быстро становится стандартом медицинской помощи. Для определения первого (сторожевого) лимфоузла применяют инъекцию красителя или радиоактивного вещества, что в случае отсутствия в нем опухолевых клеток позволяет избежать полного иссечения подмышечных лимфоузлов.
Очевидно, что такой подход не будет способствовать улучшению выживаемости или сохранению функции молочной железы, но может улучшить косметические результаты. Cancer Institute в Милане было проведено исследование методов лечения с сохранением молочной железы, в котором женщины с опухолями менее 2 см в диаметре и без пальпируемых подмышечных лимфоузлов были разделены на группы радикальной мастэктомии и широкой квадрантэктомии молочной железы с полным удалением подмышечных лимфоузлов с последующей ЛТ (50 Гр) молочной железы (дополнительно 10 Гр на ложе опухоли). Через 7 лет для анализа были доступны данные 701 больной.
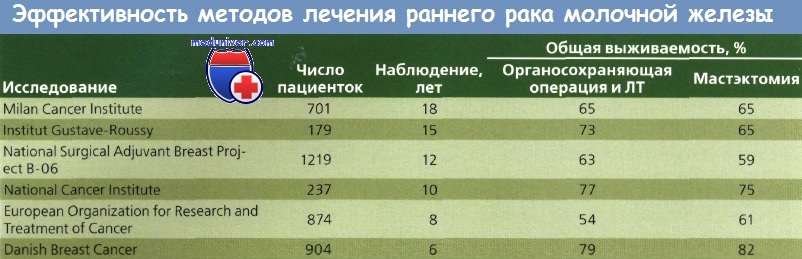
Не было обнаружено значительных различий в показателях распространения опухоли, выживаемости или продолжительности жизни до рецидива. Это исследование показало, что ЛТ высокими дозами способствует сохранению молочной железы у пациенток с локализованным РМЖ небольшого размера. Косметические результаты были удовлетворительными более чем у 70 % больных. В некоторых случаях наблюдалось появление отека руки и лучевого фиброза. До сих пор не определены долговременные канцерогенные эффекты ЛТ молочной железы.
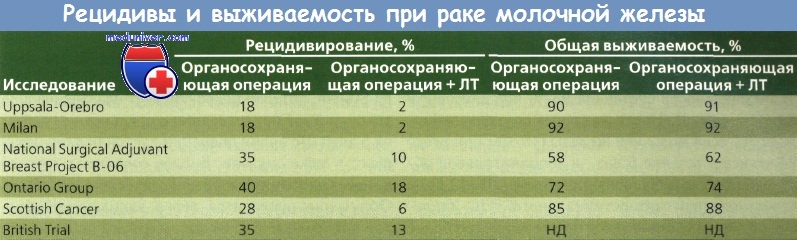
Другое исследование, проведенное Fisher и соавт. и NSABP, представляет результаты рандомизированного исследования, сравнивавшего тотальную мастэктомию и сегментарную мастэктомию с применением ЛТ и без него (I—II стадия РМЖ диаметром не более 4 см). При сегментарной резекции хирург удалял объем ткани, достаточный для уверенности в том, что края удаляемого препарата не содержали опухолевую ткань.
Женщины были путем рандомизации разделены на группы, в которых были проведены тотальная мастэктомия, только сегментарная мастэктомия или сегментарная мастэктомия в сочетании с последующей ЛТ. У всех больных были удалены подмышечные лимфоузлы, а при наличии метастазов в лимфоузлах — проведен курс XT. Расчеты с использованием таблиц дожития и данных 1843 женщин продемонстрировали, что лечение с помощью сегментарной мастэктомии как с применением ЛТ, так и без нее приводило к 5-летней безрецидивной выживаемости, выживаемости без отдаленных метастазов и общей выживаемости, сравнимым с аналогичными показателями при тотальном удалении молочной железы. Безрецидивная выживаемость после сегментарной мастэктомии с ЛТ была даже лучше, чем тот же показатель и общая выживаемость после тотальной мастэктомии.
Рак молочной железы (РМЖ) в течение 5 лет не рецидивировал у 92 % женщин из группы прошедших лучевой терапии (ЛТ) по сравнению с 72 % в группе больных, не получавших ЛТ, что указывает на ценность этого метода лечения для снижения частоты опухолей в ипсилатеральной молочной железе после сегментарной мастэктомии.
Концепция Холстеда о распространении опухоли заключается в том, что рак молочной железы (РМЖ) возникает как местная опухоль, а затем последовательно распространяется к регионарным лимфоузлам, которые служат временным барьером, а затем к таким удаленным органам, как легкие, печень и кости. Холстед считал, что РМЖ всегда излечим хирургическим путем в случае, если молочная железа, грудные мышцы и подмышечные лимфоузлы могут быть удалены до того момента, как опухоль метастазирует за их пределы. Данные NSABP и других авторов дают основание предположить, что распространение РМЖ не полностью соответствует представлениям Холстеда.
Рак может метастазировать в удаленные места до, в течение или после распространения в лимфоузлы. Обоснование для радикальной мастэктомии по Холстеду становится несостоятельным в случае, если рак не может быть остановлен на какой-то определенной точке предположительно последовательного пути. РМЖ часто бывает системным заболеванием даже на ранних стадиях.
Для исследования тактики лечения первичного рака молочной железы (РМЖ) необходимо длительное время, может потребоваться до 10 лет для возможности проведения окончательного анализа. Хотя сведения о частоте ранних рецидивов могут быть полезны при анализе, только данные долговременной выживаемости дадут окончательный ответ. При анализе этих исследований следует рассмотреть неоднородность первичного РМЖ.
Анализ подгрупп требует адекватного отбора больных для получения в результате различных категорий, зависящих от таких важных прогностических переменных, как размер первичной опухоли, клиническое и гистологическое состояние подмышечных лимфоузлов, менопауза и наличие/отсутствие эстрогеновых рецепторов (ЭР). Детальное обсуждение преимуществ и недостатков альтернативных методов первичного лечения у пациенток с излечимым РМЖ находится за рамками данной работы. Более подробную информацию по вопросам, касающимся этой интересной дискуссии, можно найти в публикациях (рекомендуем пользоваться формой поиска на главной странице сайта).
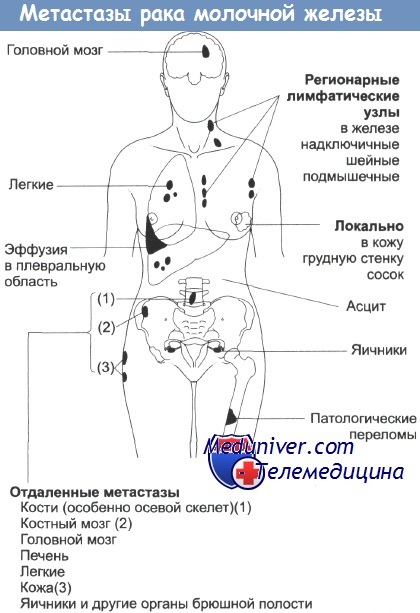
Места локального и отдаленного распространения опухоли молочной железы
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Опухоли молочных желез составляют около 50% всех онкологических заболеваний, регистрируемых у собак. Возникают, как правило, во второй половине жизни животного при наличии функционирующих яичников. У самцов опухоли молочных желез наблюдают весьма редко.
1.Опухоли молочной железы
.1 Доброкачественные опухоли и дисплазии молочных желёз
.2 Злокачественные опухоли молочных желез
. Топографическая анатомия молочной железы
. Подготовка к операции
.1 Стерилизация хирургических инструментов
Нужна помощь в написании курсовой?
Мы - биржа профессиональных авторов (преподавателей и доцентов вузов). Наша система гарантирует сдачу работы к сроку без плагиата. Правки вносим бесплатно.
.2 Стерилизация шовного материала
.3 Правила работы в операционной
.4 Подготовка операционного поля и рук хирурга
.5 Подготовка животного к операции
.6 Фиксация животного
. План и техника операции
. Послеоперационное содержание и уход за животным
Нужна помощь в написании курсовой?
Мы - биржа профессиональных авторов (преподавателей и доцентов вузов). Наша система гарантирует сдачу работы к сроку без плагиата. Правки вносим бесплатно.
операция опухоль дисплазия железа собака
1. Опухоли молочной железы
Опухоли молочных желез составляют около 50% всех онкологических заболеваний, регистрируемых у собак. Возникают, как правило, во второй половине жизни животного при наличии функционирующих яичников. У самцов опухоли молочных желез наблюдают весьма редко.
Этиология и патогенез.
Большую роль в этиологии и патогенезе предопухолевых изменений и рака молочных желез играют дисгормональные расстройства. Под влиянием эндокриннообменных сдвигов в организме нарушаются процессы физиологической эволюции и инволюции в молочных железах, вследствие чего появляются очаги патологической пролиферации эпителия на фоне коллагеноза и гиалиноза стромы и образования кист. Суммируясь на протяжении ряда лет, эти изменения приводят к развитию различных дисплазий и доброкачественных опухолей, которые во многих случаях малигнизируются. Развитию опухолей молочных желез способствуют отсутствие или недостаточность родов, извращение или подавление лактации, частые ложные беременности, связанные с овуляцией, не сопровождающейся оплодотворением, кистозные перерождения яичников, заболевания щитовидной железы. Можно считать установленным, что разнообразные формы дисплазий обусловлены нарушениями нейрогуморальных корреляций в организме животного и в первую очередь дисфункцией нейрогормональной системы гипоталамус — гипофиз — яичник — кора надпочечников — щитовидная железа.
Основным гистогенетическим источником формирования дисплазий, доброкачественных и злокачественных опухолей молочных желез служат долька и ее структурные компоненты: эпителиальная, миоэпителиальная и соединительная ткани.
1.1 Доброкачественные опухоли и дисплазии молочных желёз
Нужна помощь в написании курсовой?
Мы - биржа профессиональных авторов (преподавателей и доцентов вузов). Наша система гарантирует сдачу работы к сроку без плагиата. Правки вносим бесплатно.
Представляют собой пёструю группу заболеваний. Несмотря на многообразии морфологического строения, фактически все они отражают различные формы и стадии единого патолого-дисгормонального процесса.
Симптомы. Доброкачественные поражения проявляются в первую очередь образованием уплотнений или опухолевого узла в ткани молочных желез, как правило, в четвертой и пятой парах (до 70% всех новообразований). Различают две формы процесса: диффузную и узловую. Диффузная форма у собак практически не встречается, что обусловлено анатомическим строением желез. Объем железистой ткани у собак небольшой, несколько нарастающий от первой к пятой паре, в которой любые изменения легко пальпируются как узелковые образования. Диффузная форма может встречаться в виде простой кисты или фиброзно-кистозной болезни, которая клинически проявляется поражением желез с одной или двух сторон большим числом мелких (до 0,5 см) округлых близкорасположенных образований (кист), четко отграниченных друг от друга и окружающих тканей.
Узелковая форма свойственна большинству форм доброкачественных изменений, в основном дисплазиям. Характеризуется образованием одиночных или множественных, нередко двусторонних, подвижных узелков умеренно плотной или плотноэластической консистенции, в течение длительного времени не проявляющих признаков роста и способных к некоторому уменьшению или увеличению, размягчению или уплотнению в зависимости от фазы полового цикла.
Большая киста (простая или папиллярная) молочных желез представляет собой относительно подвижную опухоль плотной консистенции диаметром до 5 сантиметров и более. При этом отмечают молозивные или серозные выделения из соска. Серозно-кровянистые истечения чаще всего бывают при папиллярной кисте или цистаденоме и связаны с отрывом мелких частиц папиллом или некрозом с самопроизвольным отторжением папиллярных сосочков и возникновением кровотечения. проявляется под видом хронического воспаления связанного с задержкой секрета после ложной беременности. представляет собой четко очерченный, подвижный узел тугоэластической консистенции, нередко больших размеров. Может быть множественный; часто развивается на фоне различных форм дисплазий. Характерны длительные существования (в среднем 1…..3 года) и быстрый темп роста. опухоль в отличие от фиброаденомы более плотной или хрящевой консистенции, подвижна по отношению к окружающим тканям. Характерен медленный темп роста. Основан на анамнестических и клинических данных и результатах дополнительных методов обследования: пункционной биопсии с цитологическим исследованием, эксцизионной биопсии и трепанобиопсии с последующим гистологическим анализом. Важное клиническое значение при этом имеют: возраст животного, количество родов, частота ложных беременностей, срок возникновения и размер первичного узла опухоли, темп его роста, консистенция, состояние кожи, подлежащих тканей и регионарных лимфатических узлов. Доброкачественные поражения у собак, как правило, встречаются на два года раньше чем злокачественные, характеризуются четкими границами, гладкой тугоэластический или неоднородной консистенцией, относительно медленным темпом роста. Они могут быть различных размеров, не спаяны с кожей и подлежащими тканями, лимфатические узлы не увеличены. Дифференцирование различных форм доброкачественных поражений и рака молочной железы в ряде случаев бывают крайне затруднительным, так как у многих доброкачественных процессов выражена тенденция к малегнизации, а ранние стадии рака и некоторые его формы остаются долгое время инкапсулированными, напоминая доброкачественный рост. Все внешне доброкачественные узелковые образования, которые нередко трудно с достаточной уверенностью отличить от начинающегося рака, подлежат хирургическому лечению.
Характеризуются многообразием гистологического строения. Из всех форм у собак преобладает рак (составляет около 80% случаев). Саркомы и злокачественные смешанные опухоли встречаются значительно реже (до 20%).
Биологическое проявление рака молочных желез зависит от того, относится ли опухоль к простому или комплексному типу.
Рак комплексного типа включает в себя формы, в строении которых присутствует два типа клеток: секреторные эпителиальные и миоэпителиальные. включает в себя формы , в строении которых обнаруживают только один тип клеток: секреторные эпителиальные или миоэпителиальные. Биологические и анатомические свойства первичной опухоли в клинической практике оценивают, исходя из ее размеров, морфологической структуры, степени злокачественности, пораженности регионарных лимфатических узлов и других органов метастазами рака. В соответствии с классификацией опухолей молочных желез (ВОЗ, 1980) процесс ракового роста разделен по состоянию первичного узла опухоли на следующие стадии:
Т — опухоль в молочной железе не выявляют; с — с фиксацией к мышце); с — с фиксацией к мышце); с — с фиксацией к мышце); — опухоль любого размера, инфильтративная карцинома с прямым распространением на кожу и подлежащие ткани. По состоянию регионарных лимфатических узлов (подмышечных, если узел опухоли выявляют в первых трёх парах молочных желёз, и паховых, если узел опухоли располагается в 4-й и 5-й парах молочных желёз) злокачественные новообразования подразделяют следующим образом:
Нужна помощь в написании курсовой?
Мы - биржа профессиональных авторов (преподавателей и доцентов вузов). Наша система гарантирует сдачу работы к сроку без плагиата. Правки вносим бесплатно.
N — регионарные лимфоузлы не пальпируются; b — фиксированные к окружающим тканям). По наличию или отсутствию отдалённых метастазов:
М — нет признаков отдалённых метастазов; — обнаруживают отдалённые метастазы, включая отдалённые лимфоузлы. Группировка злокачественных новообразований молочных желёз по стадиям.
СтадияТNМ1 (+) — гистологически подтверждённая; (-) — гистологически неподтверждённая. С помощью указанных характеристик с определённой долей уверенности можно предсказать эффективность лечебных мероприятий и обосновать прогноз.
После хирургического удаления опухоли диаметром до 5 сантиметров в течение одного года выживают 90% животных, в течение 2 лет 66%, а после удаления опухоли диаметром до 15 сантиметров в течение 1 года выживают 18% животных, 2 лет — 6%. В то же время у некоторых собак небольшие размеры опухоли (диаметр до 3см) могут сопровождаться метастатическим поражением лимфатических узлов и легких, что свидетельствует об отсутствии абсолютной корреляции между размерами очага и распространенностью опухолевого процесса.
Клинически различают узловую и диффузную анатомические формы роста рака.
Высокодифференцированные аденокарциномы отличаются медленным течением и сравнительно редким метастазированием в отдаленные органы (низкая степень злокачественности). напротив, характеризуются высокой степенью злокачественности. Средняя продолжительность жизни после хирургического удаления солидной, тубулярной и папиллярной аденокарциномы простого типа составляет 12…16 месяцев, а солидной, тубулярной и папиллярной аденокарциномы комплексного типа — 23….36 месяцев. В тех случаях, когда клинические симптомы рака молочных желез достаточно чётко выражены, диагноз не представляет трудностей. Однако при малых размерах опухоли, отсутствии выявляемых метастазов или в начальных стадиях развития рака на фоне доброкачественных поражений, чтобы распознать природу новообразования, необходимо дополнительное обследование. Для этого прибегают к пункции опухоли с цитологическим исследованием или трепанобиопсии с последующим гистологическим анализом. метастазы в лимфатических узлах выявляются методом пальпации. Увеличение, уплотнение, связь с окружающими тканями, образование конгломератов из лимфоузлов считают признаками метастатического поражения. В неясных случаях делают пункцию лимфоузлов. Поражение плевры и лёгких метастазами рака молочной железы устанавливают методом рентгенографии перед мастэктомией. Плевральные формы метастазов наблюдают чаще в поздние сроки после мастэктомии, иногда при наличии местного рецидива опухоли. Поражение плевры метастазами сопровождается выраженной лёгочной недостаточностью и появлением в грудной полости транссудата или экссудата, преимущественно геморрагического характера (скопление выявляют рентгенологически). Саркомы и злокачественные смешанные опухоли отличаются от рака очень быстрым ростом, большими размерами, гиперемией и ранним изъязвлением кожи, частым и повторным рецидивированием в короткие сроки после удаления опухоли. Лечебная тактика при раке сарком и смешанных опухолях молочных желёз одинаковая. Лечение состоит из ряда последовательных мероприятий и поэтому называется комбинированным или комплексным. Оно может включать в себя хирургические, лучевые, гормональные и химиотерапевтические методы. При первой стадии рака ограничиваются радикальной мастэктомией. При второй и третьей — удаляют опухоль и доступные регионарные метастазы, а также проводят профилактические мероприятия, направленные на предупреждение рецидива и возникновения отдалённых метастазов (облучение, послеоперационная химиотерапия). в/в. курс лечения повторяют каждый 21 день. В случае эффективного лечения возможна мастэктомия.
Молочная железа (glandula lactiferai) расположена на вентральной поверхности тела животного. По типу строения является альвеолярно-трубчатой, по функции — мерокриновой железой. У собак молочные железы образуют множественное вымя или вымени, которые состоят из тела и соска. Сама железа состоит из паренхимы и стромы; снаружи она покрыта поверхностной фасцией, укрепляющей железу на туловище, а поверх фасции простирается кожа. У собаки имеется от 4 до 6 парных выменных холмов (молочных пакетов).
Паренхима железы состоит из долек, а дольки — из пузырьков и трубочек, построенных из одного слоя кубического железистого эпителия и миоэпителия. Их альвеолотрубок начинаются отводящие трубочки, образующие при слиянии молочные каналы, а последние соединяются в молочные протоки, которые открываются в сосок сосковыми протоками — 6-12(20) в одном соске.
Нужна помощь в написании курсовой?
Мы - биржа профессиональных авторов (преподавателей и доцентов вузов). Наша система гарантирует сдачу работы к сроку без плагиата. Правки вносим бесплатно.
Рак молочной железы (РМЖ) – наиболее распространенное онкологическое заболевание во всем мире. Основной причиной смерти данной категории больных является прогрессирование процесса, сопровождающееся развитием отдалённых метастазов. Пятилетняя выживаемость таких пациенток не превышает 40 %. Наиболее важной задачей лечения генерализованного РМЖ является продление жизни без потери ее качества. В настоящее время подходы к лечению больных метастатическим РМЖ подверглись значительной коррекции. Лечение данной патологии стало комплексным, включающим все возможности современной онкологической науки. Достижения молекулярной биологии послужили дополнительной точкой приложения в виде таргетного лечения. Применение современных схем и режимов химиотерапии, совершенствование диагностических методов, возможности стереотаксической радиационной терапии, применение малоинвазивных хирургических вмешательств – все это позволяет достаточно долго держать контроль над опухолевым процессом, увеличивает продолжительность жизни пациенток при минимальном неблагоприятном влиянии лечения на качество жизни. Кроме того, терапия таких больных становится сугубо индивидуализированной. Таким образом, несмотря на то, что метастатический РМЖ остается неизлечимым на сегодняшний день, данное состояние надо рассматривать как хронический процесс, требующий постоянного контроля и сугубо индивидуализированного подхода к лечению.

2. Климов Н.А. Возможности хирургического лечения метастатического рака молочной железы: дис. . канд. мед. наук. – Санкт-Петербург, 2015. – 111 с.
3. Weichselbaum R.R., Hellman S. Oligometastases revisited.// Nat. Rev. Clin. Oncol. – 2011. – Vol. 8, № 6. – P. 378–382.
4. Nieto Y., Nawaz S., Jones R.B. et al. Prognostic model for relapse after high-dose chemotherapy with autologous stem-cell transplantation for stage IV oligometastatic breast cancer // J. Clin. Oncol. – 2002. – Vol.20, № 3. – P. 707–718.
5. Georges Vlastos, David L. Smith, S. Eva Singletary, Nadeem Q. Liver metastasis from breast cancer: long term survival after curative resection // Annals of Surgical Oncology. – 2004. – Vol. 11, № 9. Р. 869–874.
6. Chao Y., Wu Q., Shepard C., Wells A. Hepatocyte induced re-expression of E-cadherin in breast and prostate cancer cells increases chemoresistance // Clin. Exp. Metastasis. – 2012. – Vol. 29, № 1. – P. 39–50.
7. Margonis G.A., Buettner S., Sasaki K., Kim Y., Ratti F., Russolillo N., Ferrero A., Berger N., Gamblin T.C., Poultsides G., Tran T., Postlewait L.M., Maithel S., Michaels A.D., Bauer T.W., Marques H., Barroso E., Aldrighetti L., Pawlik T.M. The role of liver-directed surgery in patients with hepatic metastasis from primary breast cancer: a multi-institutional analysis // HPB (Oxford). – 2016. – Vol. 18, № 8. – P. 700–705.
8. Sadot E., Lee S.Y., Sofocleous C.T., Solomon S.B., Gonen M., Peter Kingham T., Allen P. J., DeMatteo R.P., Jarnagin W.R., Hudis C.A., D’Angelica M.I. Hepatic Resection or Ablation for Isolated Breast Cancer Liver Metastasis: A Case-control Study With Comparison to Medically Treated Patients // Ann. Surg. – 2016. – Vol. 264, № 1. – P. 147–154.
9. Charalampoudis P., Mantas D., Sotiropoulos G.C., Dimitroulis D., Kouraklis G., Markopoulos C. Surgery for liver metastases from breast cancer // Future Oncol. – 2015. – Vol. 11, № 10. – P. 1519–1530.
10. Golse N., Rene A. Liver Metastases From Breast Cancer: What Role for Surgery? Indications and Results // Clinical Breast Cancer. – 2017. – Vol. 17, № 4. – P. 256–265.
11. Kiszkaa J., Karczmarek-Borowska B. Radioembolization treatment for liver metastases // Contemp. Oncol. (Pozn). – 2017. – Vol. 21, № 4. – P. 274–278.
12. Ma J., Gimenez J.M., Sandow T., Devun D., Kirsch D., Gulotta P., Gilbert P., Kay D. Intraarterial Liver-Directed Therapies: The Role of Interventional Oncology // Ochsner J. – 2017. – Vol. 17, № 4. – P. 412–416.
13. Gruber-Rouh T., Langenbach M., Naguib N.N.N., Nour-Eldin N.M., Vogl T.J., Zangos S., Beeres M. Trans-arterial chemoperfusion for the treatment of liver metastases of breast cancer and colorectal cancer: Clinical results in palliative care patients // World J. Clin. Oncol. – 2017. – Vol. 8, № 4. – P. 343–350.
14. Sofocleous C.T. et al. Radiofrequency ablation in the management of liver metastasis from breast cancer // La radiologia medica. – 2015. – Vol. 120, № 6. – Р. 536–541.
15. Ho V.K., Gijtenbeek J.M., Brandsma D., Beerepoot L.V., Sonke G.S., van der Heiden-van der Loo M. Survival of breast cancer patients with synchronous or metachronous central nervous system metastases // Eur. J. Cancer. – 2015. – Vol. 51, № 17. – P. 2508–2516.
16. Белов Д.М. Онкологические принципы хирургии церебральных метастазов рака: выбор тактики в зависимости от макроструктуры: автореф. дис. … канд. мед. наук. – Москва, 2011. – 26 с.
17. Никулин М.П. Олигометастазы рака молочной железы и рака предстательной железы: целесообразность хирургического лечения / М.П. Никулин // Практическая онкология. – 2016. – Т. 17. – № 3. – С. 200–211.
18. Brufsky A.M., Mayer M., Rugo H.S., Kaufman P.A., Tan-Chiu E., Tripathy D., Tudor I.C., Wang L.I., Brammer M.G., Shing M., Yood M.U., Yardley D.A. Central nervous system metastases in patients with HER2- positive metastatic breast cancer: incidence, treatment, and survival in patients from regist HER // Clin. Cancer Res. – 2011. – Vol. 17, № 14. – Р. 4834–4843.
19. Niikura N., Liu J., Hayashi N., Mittendorf E.A., Gong Y., Palla S.L., Tokuda Y., Gonzalez-Angulo A.M., Hortobagyi G.N., Ueno N.T. Loss of human epidermal growth factor receptor 2 (HER2) expression in metastatic sites of HER2-overexpressing primary breast tumors // J. Clin. Oncol. – 2012. – Vol. 30, № 6. – Р. 593–599.
20. Lee S.S., Ahn J.-H., Kim M.K. et al. Brain metastases in breast cancer: prognostic factors and management // Breast Cancer Research and Treatment. – 2008. – Vol. 111, № 3. – P. 523–530.
21. Hall M.D., McGee J.L., McGee M.C., Hall K.A., Neils D.M., Klopfenstein J.D., Elwood P.W. Cost-effectiveness of stereotactic radiosurgery with and without whole-brain radiotherapy for the treatment of newly diagnosed brain metastases // Journal of Neurosurgery. – 2014. – Vol. 121. – Р. 84–90.
22. Smith T.R., Lall R.R., Lall R.R., Abecassis I.J., Arnaout O.M., Marymont M.H., Swanson K.R., Chandler J.P. Survival after surgery and stereotactic radiosurgery for patients with multiple intracranial metastases: results of a single-center retrospective study // Journal of Neurosurgery. – 2014. – Vol. 121, № 4. – P. 839–845.
23. Iorio-Morin C., Masson-Cote L., Ezahr Y., Blanchard J., Ebacher A., Mathieu D. Early Gamma Knife stereotactic radiosurgery to the tumor bed of resected brain metastasis for improved local control // Journal of Neurosurgery. – 2014. – Vol. 121. – P. 69–74.
24. Kann B.H., Park H.S., Johnson S.B., Chiang V.L., Yu J.B. Radiosurgery for Brain Metastases: Changing Practice Patterns and Disparities in the United States // J. Natl. Compr. Canc. Netw. – 2017. – Vol. 15, № 12. – P. 1494–1502.
25. Marino N., Woditschka S., Reed L. T., Nakayama J., Mayer M., Wetzel M., Steeg P.S. Breast Cancer Metastasis: Issues for the Personalization of Its Prevention and Treatment // Am. J. Pathol. – 2013. – Vol. 183, № 4. – P. 1084–1095.
Рак молочной железы (РМЖ) – наиболее распространенное онкологическое заболевание у женщин в мире. В структуре заболеваемости женского населения России онкологической патологией РМЖ занимает лидирующую позицию (21,2 %). Стандартизованный показатель заболеваемости РМЖ женского населения России составляет 82,99 на 100000 населения. Прирост данного параметра с 2004 по 2014 гг. составил 29,47 % [1].
Основной причиной гибели больных РМЖ является прогрессирование заболевания, сопровождающееся развитием отдалённых метастазов. Средняя продолжительность жизни больных генерализованным РМЖ 2–3,5 года, пятилетняя выживаемость составляет 40 % и только 10 % пациенток живут свыше 10 лет [2]. К сожалению, необходимо констатировать, что метастатический РМЖ является неизлечимым заболеванием. Вследствие этого основной задачей лечения генерализованного РМЖ является продление жизни пациенток с минимальной потерей ее качества. На сегодняшний день ведущим направлением терапии больных метастатическим РМЖ является системная цитостатическая терапия. В то же время существует категория пациенток, составляющая около 5 % от числа всех пациенток метастатическим РМЖ, у которых выявляются изолированные отдаленные метастазы в границах одного органа или зоны [3]. В настоящее время данная категория больных стала обращать на себя пристальное внимание онкологов. К таким больным применяют индивидуализированный подход, в основе которого лежит комплексное лечение, включающее хирургический, радиологический и лекарственный методы, применяемые как к первичному очагу, так и к отдаленным метастазам. Задачей применяемой терапии является не только замедление роста метастатических очагов РМЖ и регресс местных проявлений заболевания, но и уменьшение общей биологической массы опухоли. Более 25 % пациенток с изолированными отдаленными метастазами РМЖ, в лечении которых использовалась подобная тактика, жили 15 и более лет. Интересно, что лимитирующим фактором для продолжительности жизни данной категории пациенток является метастатическое поражение печени, так как наличие метастазов в других органах (исключением являются метастазы в головной мозг) не влияет на продолжительность жизни, при условии радикального удаления метастазов в печени [4]. Объясняется это медленным ростом метастазов других локализаций.
Метастатическое поражение печени при РМЖ по данным разных авторов, составляет 15–30 %, тогда как при аутопсии метастазы в печени выявляют у 30–50 % больных. Одиночное изолированное метастатическое поражение печени диагностируется только у 3–9 % больных РМЖ. Наличие метастазов в печени сопровождается плохим прогнозом (медиана выживаемости
Читайте также:

