Обратимые и необратимые процессы реферат
Обновлено: 05.07.2024
Первый закон термодинамики – закон сохранения тепловых процессов, устанавливающий связь между количеством теплоты Q и изменением ∆ U внутренней энергии и работой А , совершенной над внешними телами:
Исходя из закона, энергия не может быть создана или уничтожена: производится процесс передачи от одной системы к другой, принимая другую форму. Еще не было получено процессов, нарушающих первый закон термодинамики. Рисунок 3 . 12 . 1 показывает устройства, противоречащие первому закону.
Рисунок 3 . 12 . 1 . Циклически работающие тепловые машины, запрещаемые первым законом термодинамики: 1 – вечный двигатель 1 рода, совершающий работу без потребления энергии извне; 2 – тепловая машина с коэффициентом полезного действия η > 1 .
Обратимый и необратимый процессы
Первый закон термодинамики не устанавливает направления тепловых процессов. Опыты показывают, что большинство тепловых процессов протекают в одном направлении. Их называют необратимыми.
Если имеется тепловой контакт двух тел с разными температурами, тогда направление теплового потока направляется от теплого к холодному. Самопроизвольной передачи тепла от тела с низкой температуры к телу с высокой не наблюдается. Отсюда следует, что теплообмен с конечной разностью температур считается необратимым.
Обратимым процессом называется переход системы из одного равновесного расстояния в другое, которые возможно проводить в обратном направлении в той же последовательности промежуточных равновесных состояний. Она вместе с окружающими телами возвращаются к исходному состоянию.
Если система находится в состоянии равновесия во время процесса, она называется квазистатической.
Когда рабочее тело тепловой машины контактирует с тепловым резервуаром, температура которого неизменна во время всего процесса, то только изотермический квазистатический процесс считается обратимым, так как протекает с бесконечно малой разницей температур рабочего резервуара. Если имеется два резервуара, причем с разными температурами, тогда обратимым путем можно провести процессы на двух изотермических участках.
Так как адиабатический процесс проводится в обоих направлениях (сжатие и расширение), наличие кругового процесса с двумя изотермами и двумя адиабатами (цикл Карно) говорит о том, что это и есть единственный обратимый круговой процесс, где рабочее тело контактируется с двумя тепловыми резервуарами. Остальные при наличии 2 тепловых резервуаров считаются необратимыми.
Превращение механической работы во внутреннюю энергию считаются необратимыми при наличии силы трения, диффузии в газах и жидкостях, а процесс перемешивания по причине начальной разности давлений и так далее. Все реальные процессы считаются необратимыми, даже если значения будут максимально приближены к обратимым. Обратимые рассматриваются как пример реальных процессов.
Первый закон термодинамики не различает их. Правило требует от термодинамического процесса определенного энергетического баланса, но не говорит о том, возможен ли он. Установка направления прохождения процесса определяется вторым законом термодинамики. Его формулировка может звучать как запрет на определенные термодинамические процессы.
Второй закон был трактован У. Кельвином в 1851 .
В циклически действующей тепловой машине невозможно прохождение процесса, единственным результатом которого было бы преобразование в механическую работу всего количества теплоты, полученного от единственного теплового резервуара.
Предположительно, машина с такими процессами могла бы получить название вечного двигателя второго рода.
При земных условиях могла бы быть отбита энергия Мирового океана и полностью превратилась бы в ее работу. Масса воды Мирового океана – 10 21 к г . Для его охлаждения хотя бы на 1 градус потребуется огромное количество энергии ≈ 10 24 Д ж , которое сравнимо с сжиганием 10 17 к г угля. Вырабатываемая энергия на Земле за год в 10 4 раз меньше. Отсюда и вывод о том, что вечный двигатель второго рода мало вероятен, как и двигатель первого, потому как оба они недопустимы, исходя из первого закона термодинамики.
Второй закон термодинамики
Формулировка 2 -го закона термодинамики была дана физиком Р. Клаузиусом.
Невозможно прохождение процесса, единственным результатом которого была бы передача энергии при помощи теплообмена от тела с низкой температуры к телу с более высокой.
Рисунок 3 . 12 . 2 объясняет процессы, которые запрещены вторым законом, но разрешены согласно первому. Они соответствуют трактовкам второго закона термодинамики.
Рисунок 3 . 12 . 2 . Процессы, не противоречащие первому закону термодинамики, но запрещаемые вторым законом: 1 – вечный двигатель второго рода; 2 – самопроизвольный переход тепла от холодного тела к более теплому (идеальная холодильная машина).
Формулировки обоих законов считаются эквивалентными.
Когда тело без помощи внешних сил переходит при теплообмене от холодного к горячему, то возникает мысль о возможности создания вечного двигателя второго рода. Если такая машина получит количество теплоты Q 1 от нагревателя и отдаст холодильнику Q 2 , тогда совершается работа A = Q 1 - Q 2 . Если бы Q 2 самопроизвольно перешло к нагревателю, то конечный результат тепловой машины и идеальной холодильной машины выглядело бы таким образом Q 1 - Q 2 . Причем сам переход происходил бы без изменений холодильника. Отсюда вывод – комбинация тепловой машины и идеальной холодильной машины равноценна двигателю второго рода.
Прослеживается связь между вторым законом термодинамики и необратимостью реальных тепловых процессов. Энергия теплового движения молекул отлична от механической, электрической и так далее. Она способна превратиться в другой вид энергии только частично. Поэтому при наличии энергии теплового движения молекул любой процесс считается необратимым, так как полностью в обратном направлении он не осуществим.
Свойство, относящееся к необратимым процессам, говорит о том, что они проходят в термодинамически неравновесной системе, а результат получается в виде замкнутой системы, приближающейся к состоянию термодинамического равновесия.
Теоремы Карно
Имеются теоремы Карно, которые могут быть доказаны, исходя из второго закона термодинамики.
КПД тепловой машины, работающей при данных значениях температур нагревателя холодильника, не может иметь значение больше, чем КПД действия машины, работающей согласно обратимому циклу Карно с теми же значениями температур нагревателя и холодильника.
КПД действия тепловой машины, работающей по циклу Карно, не зависит от рода рабочего тела, а только от температур нагревателя и холодильника.
Отсюда следует, что КПД действия машины с циклом Карно считается максимальным.
η = 1 - Q 2 Q 1 ≤ η m a x = η К а р н ю = 1 - T 2 T 1 .
Знак равенства данной записи говорит об обратимости процесса. Если машина работает по циклу Карно, тогда:
Q 2 Q 1 = T 2 T 1 или Q 2 T 2 = Q 1 T 1 .
Знаки Q 1 и Q 2 всегда отличаются независимо от направления цикла. Поэтому получаем:
Q 1 T 1 + Q 2 T 2 = 0 .
Рисунок 3 . 12 . 3 говорит о том, что данное соотношение обобщается и представляется в виде последовательности малых изометрических и адиабатических участков.
Рисунок 3 . 12 . 3 . Произвольный обратимый цикл как последовательность малых изотермических и адиабатических участков.
Полный обход замкнутого обратимого цикла имеет вид:
∑ ∆ Q i T i = 0 (обратимый цикл).
Откуда ∆ Q i = ∆ Q 1 i + ∆ Q 2 i – количество теплоты, полученное рабочим телом на двух изотермических участках с температурой T i . Чтобы данный цикл провести наоборот, нужно рабочее тело сконтактировать со многими тепловыми резервуарами с T i .
Энтропия
Отношение Q i T i получило название приведенного тепла. Формула показывает, что полное приведенное тепло на любом обратимом цикле равно нулю. Благодаря ей вводится еще одно понятие – энтропия, обозначаемая S . Ее открыл Р. Клаузиус в 1865 году.
При переходе из одного равновесного состояние в другое изменяется и ее энтропия. Разность энтропий двух состояний равняется приведенному теплу, полученному системой во время обратного перехода состояния.
∆ S = S 2 - S 1 = ∑ ( 1 ) ( 2 ) ∆ Q i о б р T .
Если рассматривается адиабатический процесс ∆ Q i = 0 , тогда энтропия S не изменяется.
Изменение энтропии ∆ S во время перехода в другое состояние фиксируется как формула:
∆ S = ∫ ( 1 ) ( 2 ) d Q о б р T .
Определение энтропии достаточно точное. Разность ∆ S двух состояний системы подразумевает физический смысл. Если имеется необратимый переход, а необходимо найти энтропию, тогда нужно придумать обратимый процесс, который свяжет начальное и конечное состояние. После этого перейти к нахождению приведенного тепла, полученного системой.
Рисунок 3 . 12 . 4 Модель энтропии и фазовых переходов.
Рисунок 3 . 12 . 5 показывает необратимый процесс расширения шага с отсутствием теплообмена. Равновесными считаются начальное и конечное значение, изображаемые на диаграмме p , V . Точки a и b соответствуют состояниям и располагаются на одной изотерме. Чтобы найти ∆ S , следует перейти к рассмотрению обратимого изотермического перехода из a в b . При изопроцессе газ получает определенное количество теплоты окружающих тел Q > 0 , тогда при необратимом расширении энтропия возрастет до ∆ S > 0 .
Еще одним примером необратимого процесса считается теплообмен при конечной разности температур. Рисунок 3 . 12 . 6 и показывает два тела, заключенные в адиабатическую оболочку, где начальные температуры обозначаются как T 1 и T 2 T 1 . Течение процесса теплообмена способствует выравниванию температур. Очевидно, что теплое тело отдает, а холодное принимает. Холодное тело превосходит по модулю приведенное тепло, отдаваемое горячим. Отсюда вывод – изменение энтропии в замкнутой системе необратимого процесса ∆ S > 0 .
Рисунок 3 . 12 . 6 . Теплообмен при конечной разности температур: a – начальное состояние; b – конечное состояние системы. Изменение энтропии Δ S > 0 .
Все самопроизвольно протекающие процессы в изолированных термодинамических процессах характеризуются ростом энтропии.
Обратимые процессы имеют постоянную энтропию ∆ S ≥ 0 . Соотношение называют законом возрастания энтропии.
При любых процессах, протекающих в термодинамических изолированных системах, энтропия либо не меняется, либо возрастает.
Наличие энтропии говорит о самопроизвольно протекающем процессе, а ее рост – приближение всей системы к термодинамическому равновесию, где S принимает максимальное значение. Возрастание энтропии можно трактовать как формулировку второго закона термодинамики.
В 1878 году Л. Больцман дал вероятностное определение понятию энтропии, так как было предложено рассматривать ее в качестве меры статистического беспорядка замкнутой термодинамической системы. Все самопроизвольно протекающие процессы в таких системах приближают ее к равновесному состоянию, так как сопровождаются ростом энтропии, и направляют в сторону увеличения вероятности состояния.
Если состояние макроскопической системы содержит большое число частиц, то его реализация может предусматривать несколько способов.
Термодинамическая вероятность W системы – это количество способов, которыми реализуется данное состояние макроскопической системы, макросостояний, осуществляющих его.
Из определения имеем, что W ≫ 1 .
При наличии 1 м о л ь газа в емкости существует число N способов размещения молекулы по двум половинам емкости: N = 2 N А , где N А - число Авогадро. Каждое из них – это микросостояние.
Одно из них соответствует случаю с молекулами, собранными в одной половине сосуда. Вероятность такого события приравнивается к нулю. Большое количество состояний соответствует такому, где молекулы распределяются равномерно по всей площади емкости.
Тогда равновесное состояние является наиболее вероятным.
Равновесное состояние считается состоянием наибольшего беспорядка в термодинамической системе с максимальной энтропией.
Исходя из трактовок Больцмана, энтропия S и термодинамическая вероятность W связаны:
S = k · ln W , где k = 1 , 38 · 10 - 23 Д ж / К является постоянная Больцмана. Отсюда следует, что определение энтропии определяется логарифмом числа микросостояний. Именно они способствуют реализации данного макросостояния. Тогда энтропия может быть рассмотрена в качестве меры вероятности состояния термодинамической системы.
Вероятностная трактовка второго закона термодинамики допускает самопроизвольное отклонение системы от состояния термодинамического равновесия. Их называют флуктуациями.
В системах с большим числом частиц отклонения от состояния равновесия имеют достаточно малую вероятность на существование.
Функция "чтения" служит для ознакомления с работой. Разметка, таблицы и картинки документа могут отображаться неверно или не в полном объёме!
МИНИСТЕРСТВО ОБЩЕГО И ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КУРГАНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
КАФЕДРА МЕНЕДЖМЕНТА
Курсовая работа
Дисциплина: Теория организации
Студент группы Э-2737 Рудаков М.Ю.
Направление: Менеджмент
Специальность: Менеджмент
Руководитель: кандидат технических наук,
доцент, Угринович В.И.Дата защиты:
Оценка:
Курган 1999
ПОНЯТИЕ ОБРАТИМОГО И НЕОБРАТИМОГО ПРОЦЕССА
ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ПРОЦЕССЫ В ЭКОНОМИКЕ
НАПРАВЛЕННОСТЬ ЭВОЛЮЦИИ СИСТЕМ
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ ВВЕДЕНИЕ
ПОНЯТИЕ ОБРАТИМОГО И НЕОБРАТИМОГО ПРОЦЕССА
Научно целесообразным представляется установить разграничение динамических процессов на эволюционные (иначе неповторимые, или необратимые) и волнообразные (повторимые, или обратимые). Под эволюционными, или необратимыми, процессами мы понимаем те изменения, которые при отсутствии резких посторонних пертурбационных воздействий протекают в определенном и в одном и том же направлении. Как например, можно указать на постоянную тенденцию роста населения, увеличение общего объема производства и др.
Замечу, что, называя некоторые динамические процессы эволюционными, неповторимыми или необратимыми, а другие обратимыми, я совершенно не имею здесь в виду известного противопоставления идиографической и номографической точек зрения. Все построения находятся в плоскости общей теории и не имеют ничего общего с идиографией. Идиографическая точка зрения исключает возможность установления закономерностей. Но когда говорится
Похожие работы
2014-2022 © "РефератКо"
электронная библиотека студента.
Банк рефератов, все рефераты скачать бесплатно и без регистрации.
"РефератКо" - электронная библиотека учебных, творческих и аналитических работ, банк рефератов. Огромная база из более 766 000 рефератов. Кроме рефератов есть ещё много дипломов, курсовых работ, лекций, методичек, резюме, сочинений, учебников и много других учебных и научных работ. На сайте не нужна регистрация или плата за доступ. Всё содержимое библиотеки полностью доступно для скачивания анонимному пользователю

ГОСТ
Обратимый процесс считается в физике процессом, который возможен для проведения в обратном направлении таким образом, что система будет подвержена прохождению тех же состояний, но в обратных направлениях.
Рисунок 1. Обратимые и необратимые процессы. Автор24 — интернет-биржа студенческих работ
Необратимый процесс считается процессом, самопроизвольно протекающим исключительно в одном направлении.
Термодинамический процесс
Рисунок 2. Термодинамические процессы. Автор24 — интернет-биржа студенческих работ
Термодинамический процесс представляет непрерывное изменение состояний системы, которое происходит в итоге ее взаимодействий с окружающей средой. Внешним признаком процесса будет считаться в таком случае изменение хотя бы одного параметра состояния.
Реальные процессы изменения состояния проистекают при условии присутствия значительных скоростей и разностей потенциалов (давлений и температур), существующих между системой и средой. В подобных условиях появится сложное неравномерное распределение параметров и функций состояния, исходя из объема системы, пребывающей в неравновесном состоянии. Термодинамические процессы, предусматривающие прохождение системы через ряд неравновесных состояний, будут называться неравновесными.
Готовые работы на аналогичную тему
Изучение неравновесных процессов считается сложнейшей для ученых задачей, поскольку разработанные в рамках термодинамики методы приспособлены в основном для исследования равновесных состояний. К примеру, неравновесный процесс весьма сложно рассчитывается посредством уравнений состояния газа, применимых для равновесных условий, в то время, как в отношении всего объема системы давление и температура обладают равными значениями.
Возможно было бы выполнять приближенный расчет неравновесного процесса путем подстановки в уравнение средних значений параметров состояния, но в большинстве случаев осреднение параметров по объему системы становится невозможным.
В технической термодинамике в рамках исследования реальных процессов условно принимают распределение параметров состояния равномерным образом. Это, в свою очередь, позволяет воспользоваться уравнениями состояния и иными расчетными формулами, полученными с целью равномерного распределения в системе параметров.
В некоторых конкретных случаях погрешности, обусловленные подобным упрощением, незначительны и при расчете реальных процессов их возможно не учитывать. Если в результате неравномерности процесс ощутимо отличается от идеальной равновесной модели, то в расчет внесут соответствующие поправки.
Условия равномерно распределенных параметров в системе при изменении ее состояния, по существу подразумевают взятие идеализированного процесса в качестве объекта исследования. Подобный процесс при этом состоит из бесконечно большого количества равновесных состояний.
Такой процесс возможно представить в формате протекающего настолько медленно, что в каждый конкретный момент времени в системе установится практически равновесное состояние. Степень приближения такого процесса к равновесному окажется тем большей, чем меньшей будет при этом скорость изменения системы.
В пределе мы приходим к бесконечно медленному процессу, предоставившему непрерывную смену для состояний равновесия. Подобный процесс равновесного изменения состояния будет называться квазистатическим (или как бы статическим). Такому виду процесса будет соответствовать бесконечно малая разность потенциалов между системой и окружающей средой.
При обратном направлении квазистатического процесса система будет проходить через состояния, аналогичные тем, что происходят в прямом процессе. Такое свойство квазистатических процессов называют обратимостью, а сами процессы при этом являются обратимыми.
Обратимый процесс в термодинамике
Рисунок 3. Обратимый процесс в термодинамике. Автор24 — интернет-биржа студенческих работ
Обратимый процесс (равновесный) – представляет термодинамический процесс, способный к прохождению и в прямом, и в обратном направлении (за счет прохождения через одинаковые промежуточные состояния), система при этом возвращается в исходное состояние без энергетических затрат, а в окружающей среде не остается никаких макроскопических изменений.
Обратимый процесс возможно в абсолютно любой момент времени заставить протекать в обратном направлении, за счет изменения какой-либо независимой переменной на бесконечно малую величину. Обратимые процессы могут давать наибольшую работу. Большую работу от системы получить невозможно ни при каких условиях. Это придает теоретическую важность обратимым процессам, реализовать которые на практике также нереально.
Такие процессы протекают бесконечно медленно, и становится возможным лишь приблизиться к ним. Важно отметить существенное отличие термодинамической обратимости процесса от химической. Химическая обратимость будет характеризовать направление процесса, а термодинамическая – способ, при котором он будет проводиться.
Понятия обратимого процесса и равновесного состояния играют очень значимую роль в термодинамике. Так, каждый количественный вывод термодинамики будет применим исключительно в отношении равновесных состояний и обратимых процессов.
Необратимые процессы термодинамики
Необратимый процесс невозможен к проведению в противоположном направлении посредством все тех же самых промежуточных состояний. Все реальные процессы считаются в физике необратимыми. В качестве примеров таких процессов выступают следующие явления:
- диффузия;
- термодиффузия;
- теплопроводность;
- вязкое течение и др.
Переход кинетической энергии (для макроскопического движения) в теплоту через трение (во внутреннюю энергию системы) будет представлять собой необратимый процесс.
Все осуществляемые в природе физические процессы подразделяются на обратимые и необратимые. Пусть изолированная система вследствие некоего процесса осуществит переход из состояния А в состояние В и затем возвратится в свое изначальное состояние.
Процесс, в таком случае, станет обратимым в условиях вероятного осуществления обратного перехода из состояния В в А через аналогичные промежуточные состояния таким путем, чтобы при этом не оставалось совершенно никаких изменений в окружающих телах.
Если осуществление подобного перехода невозможно и при условии сохранения по окончании процесса в окружающих телах или внутри самой системы каких-либо изменений, то процесс окажется необратимым.
Любой процесс, сопровождающийся явлением трения, станет необратимым, поскольку, в условиях трения, часть работы всегда превратится в тепло, оно рассеется, в окружающих телах сохранится след процесса – (нагревание), что превратит процесс (с участием трения) в необратимый.
Идеальный механический процесс, выполняемый в консервативной системе (без сил трения), стал бы обратимым. Примером подобного процесса можно считать колебания на длинном подвесе тяжеловесного маятника. По причине незначительной степени сопротивления среды, амплитуда маятниковых колебаний становится практически неизменной на протяжении продолжительного времени, кинетическая энергия колеблющегося маятника при этом оказывается полностью переходящей в его потенциальную энергию и обратно.
В качестве важнейшей принципиальной особенности всех тепловых явлений (где участвует громаднейшее количество молекул), будет выступать их необратимый характер. Примером процесса такого характера можно считать расширение газа (в частности, идеального) в пустоту.
Итак, в природе наблюдается существование двух видов принципиально различных процессов:
Согласно заявлению М. Планка, сделанного однажды, различия между такими процессами, как необратимые и обратимые, будут лежать значительно глубже, чем, к примеру, между электрическими и механическими разновидностями процессов. По этой причине, его с большим основанием (сравнительно с любым другим признаком) имеет смысл выбирать как первейший принцип в рамках рассмотрения физических явлений.
В дальнейшем модель равновесного термодинамического процесса будет использована для описания квазиравновесных термодинамических процессов. Например, при рассмотрении цикла Карно, мы будет использоваться изотермический процесс, в котором теплообмен происходит при одной и той же температуре нагревателя и теплоносителя. В частности, подобная ситуация наблюдается, если используемый в изотермическом… Читать ещё >
Круговой процесс. Обратимые и необратимые процессы ( реферат , курсовая , диплом , контрольная )
В курсе механики было введено понятие физической системы (системы тел), для описания которой были использованы законы динамики. Такую систему называют механической системой. Когда кроме законов механики требуется применение законов термодинамики, систему называют термодинамической системой. Необходимость использования этого понятия возникает, если число элементов системы весьма велико и движения отдельных её элементов становятся микроскопическими по сравнению с движением самой системы или ее макроскопических составных частей. При этом термодинамика описывает макроскопические движения (изменения макроскопических состояний) термодинамической системы.
Параметры, описывающие такое движение (изменения) термодинамической системы принято разделять на внешние и внутренние, определяемые положениями элементов системы. Это разделение весьма условно и зависит от конкретной задачи. Так, например, воздушный шар в эластичной оболочке в качестве внешнего параметра имеет давление окружающего воздуха, а шар в жёсткой оболочке в качестве внешнего параметра имеет объём, ограниченный этой оболочкой. В термодинамической системе объём и давление могут изменяться независимо друг от друга. Чтобы найти их связь, необходимо введение третьего параметра — температуры.
В большинстве термодинамических задач трёх параметров достаточно для описания термодинамического движения системы. Это движение можно описать в системе трёх термодинамических координат, связанных с соответствующими термодинамическими параметрами.
Равновесным состоянием — состоянием термодинамического равновесия — называется такое состояния термодинамической системы, в котором отсутствуют всякие потоки (энергии, вещества, импульса и т. д. ), а макроскопические параметры системы являются установившимися и не изменяются во времени.
Классическая термодинамика утверждает, что всякая термодинамическая система имеет состояние термодинамического равновесия (нулевое начало), а изолированная система (предоставленная себе самой) стремится к такому состоянию, причём если она его достигает, то самопроизвольно не может из него выйти.
Системы, находящиеся в состоянии термодинамического равновесия обладают свойствами аддитивности и транзитивности. Сформулируем их:
Если какая-либо термодинамическая система находится в термодинамическом равновесии с двумя другими системами, то и эти две системы находятся в термодинамическом равновесии друг с другом.
Далее, если об этом не будет специально оговорено, мы будем рассматривать термодинамические системы, находящиеся в состоянии термодинамического равновесия. Описание систем, находящихся в неравновесном состоянии, то есть в состоянии, когда имеют место макроскопические потоки, занимается неравновесная термодинамика.
Переход из одного термодинамического состояния в другое называется термодинамическим процессом. Ниже, если не будет особо оговорено, мы будем рассматривать квазистатические процессы или, что-то же самое, квазиравновесные процессы. Это процессы, состоящие из непрерывно следующих друг за другом состояний термодинамического равновесия. Реально такой процесс протекать не может, однако если макроскопические изменения в системе происходят достаточно медленно (за промежутки времени, значительно превышающие время релаксации), появляется возможность аппроксимировать реальный процесс квазистатическим (квазиравновесным). Такая аппроксимация позволяет проводить вычисления с достаточно высокой точностью для большого класса практических задач. Предельным случаем квазиравновесного процесса является равновесный процесс, описание которого можно достаточно строго сделать в рамках классической термодинамики. Равновесный процесс является обратимым, т. е. при возвращении к таким значениям параметров, определяющих процесс, которые имели место в предыдущий момент времени, должно получиться предыдущее состояние термодинамической системы.
В дальнейшем модель равновесного термодинамического процесса будет использована для описания квазиравновесных термодинамических процессов. Например, при рассмотрении цикла Карно, мы будет использоваться изотермический процесс, в котором теплообмен происходит при одной и той же температуре нагревателя и теплоносителя. В частности, подобная ситуация наблюдается, если используемый в изотермическом процессе тепловой резервуар очень велик, например мировой океан или атмосфера Земли. Однако, тепловая машина, использующая квазиравновесные процессы, будет работать очень медленно (в пределе — бесконечно медленно), а потому иметь очень малую мощность. Поэтому на практике системы, близкие к равновесным, не реализуются. Тем не менее, равновесная термодинамика может быть применена к реальным системам с достаточно высокой точностью (в этом мы можем убедиться в лабораторном практикуме по физике).
Если в ходе термодинамического процесса система возвращается в исходное состояние, то такой процесс называется круговым или циклом. Круговые процессы, также как и любые другие термодинамические процессы могут быть как равновесными (а, следовательно, обратимыми), так и неравновесными (необратимыми). При обратимом круговом процессе после возвращения термодинамической системы в исходное состояние в окружающих ее телах не возникает никаких термодинамических возмущений, и их состояния остаются равновесными. При необратимом круговом процессе после его завершения окружающие тела приобретают неравновесные состояния. Таким образом, если внешние параметры приобретают в процессе цикла свои исходные значения, в термодинамической системе возможны только равновесные круговые процессы.
Первый закон термодинамики – закон сохранения энергии для тепловых процессов – устанавливает связь между количеством теплоты Q, полученной системой, изменением ΔU ее внутренней энергии и работой A, совершенной над внешними телами:
Количество теплоты, сообщенное системе, идёт на изменение её внутренней энергии и на совершение работы протии внешних сил.
Процессы, нарушающие первый закон термодинамики, никогда не наблюдались. Однако, этот закон не дает никаких сведений о том, в каком направлении развиваются процессы, удовлетворяющие принципу сохранения энергии.
Различают обратимые и необратимые термодинамические процессы.
Обратимым термодинамическим процессом называется процесс, допускающий возможность возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения.
При осуществлении обратимого процесса система переходит из одного равновесного состояния в другое. Процессы, в ходе которых система все время остается в состоянии равновесия, называются квазистатическими. Все квазистатические процессы обратимы. Все обратимые процессы являются квазистатическими.
Если рабочее тело тепловой машины приводится в контакт с тепловым резервуаром, температура которого в процессе теплообмена остается неизменной, то единственным обратимым процессом будет изотермический квазистатический процесс, протекающий при бесконечно малой разнице температур рабочего тела и резервуара. При наличии двух тепловых резервуаров с разными температурами обратимым путем можно провести процессы на двух изотермических участках. Поскольку адиабатический процесс также можно проводить в обоих направлениях (адиабатическое сжатие и адиабатическое расширение), то круговой процесс, состоящий из двух изотерм и двух адиабат (цикл Карно) является единственным обратимым круговым процессом, при котором рабочее тело приводится в тепловой контакт только с двумя тепловыми резервуарами.
Первый закон термодинамики не устанавливает направление тепловых процессов. Однако, как показывает опыт, многие тепловые процессы могут протекать только в одном направлении. Такие процессы называются необратимыми.
Необратимым термодинамическим процессом называется процесс, не допускающий возможности возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения. Такой процесс в прямом направлении протекает самопроизвольно, а для осуществления его в обратном направлении так, чтобы система вернулась в первоначальное состояние, требуется компенсирующий процесс во внешних телах, в результате которого состояние этих тел оказывается отличным от первоначальных.
Например, при тепловом контакте двух тел с разными температурами тепловой поток всегда направлен от более теплого тела к более холодному. Никогда не наблюдается самопроизвольный процесс передачи тепла от тела с низкой температурой к телу с более высокой температурой. Следовательно, процесс теплообмена при конечной разности температур является необратимым.
Все остальные круговые процессы, проводимые с двумя тепловыми резервуарами, необратимы. Необратимыми являются процессы превращения механической работы во внутреннюю энергию тела из-за наличия трения, процессы диффузии в газах и жидкостях, процессы перемешивания газа при наличии начальной разности давлений и т. д.
Все реальные процессы необратимы, но они могут сколь угодно близко приближаться к обратимым процессам. Обратимые процессы являются идеализацией реальных процессов.
Односторонняя направленность макроскопических процессов психологически воспринимается как однонаправленность времени.
Второй закон термодинамики
Опыт показывает, что разные виды энергии неравноценны в отношении способности превращаться в другие виды энергии. Механическую энергию можно целиком превратить во внутреннюю энергию любого тела. Для обратных превращений внутренней энергии в другие виды энергии существуют определенные ограничения: запас внутренней энергии ни при каких условиях не может превратиться целиком в другие виды энергии. С отмеченными особенностями энергетических превращений связано протекание процессов в природе.
Второй закон термодинамики связан непосредственно с необратимостью реальных тепловых процессов. Энергия теплового движения молекул качественно отличается от всех других видов энергии – механической, электрической, химической и т. д. Энергия любого вида, кроме энергии теплового движения молекул, может полностью превратиться в любой другой вид энергии, в том числе и в энергию теплового движения. Последняя может испытать превращение в любой другой вид энергии лишь частично. Поэтому любой физический процесс, в котором происходит превращение какого-либо вида энергии в энергию теплового движения молекул, является необратимым процессом, то есть он не может быть осуществлен полностью в обратном направлении. Общим свойством всех необратимых процессов является то, что они протекают в термодинамически неравновесной системе и в результате этих процессов замкнутая система приближается к состоянию термодинамического равновесия.
Направление самопроизвольно протекающих процессов устанавливает второй закон (начало) термодинамики. Он может быть сформулирован в виде запрета на определенные виды термодинамических процессов.
Этот закон представляет собой результат обобщения огромного числа опытных данных.
Формулировки второго начала термодинамики:
1) по Карно: наибольший КПД тепловой машины не зависит от рода рабочего тела и вполне определяется предельными температурами, между которыми машина работает.
2) по Клаузиусу: невозможен процесс единственным результатом1 которого является передача энергии в форме теплоты от тела, менее нагретого, к телу, более нагретому.
Второе начало термодинамики не запрещает переход теплоты от менее нагретого тела к более нагретому, такой переход осуществляется в холодильной машине, но при этом внешние силы совершают работу над системой, т.е. этот переход не является единственным результатом процесса.
3) по Кельвину: невозможен круговой процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, в эквивалентную ей работу.
На первый взгляд может показаться, что такой формулировке противоречит процесс изотермического расширения идеального газа. Действительно, все полученное идеальным газом от какого-то тела тепло превращается полностью в работу. Однако получение тепла и превращение его в работу не единственный конечный результат процесса; кроме того, в результате процесса происходит изменение объема газа.
4) по Оствальду: осуществление вечного двигателя второго рода невозможно.
Вечным двигателем второго рода называется периодически действующее устройство, которое совершает работу только за счет охлаждения одного источника теплоты.
Примером такого двигателя мог бы служить судовой двигатель, получающий тепло из моря и использующий его для движения судна. Такой двигатель был бы практически вечным, т.к. запас энергии в окружающей среде практически безграничен.
Все формулировки второго закона термодинамики эквивалентны.
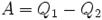
Эквивалентность этих формулировок легко показать. В самом деле, допустим, что постулат Клаузиуса неверен, то есть существует процесс, единственным результатом которого была бы передача тепла от более холодного тела к более горячему. Тогда возьмем два тела с различной температурой (нагреватель и холодильник) и проведем несколько циклов тепловой машины, забрав тепло у нагревателя, отдав холодильнику и совершив при этом работу . После этого воспользуемся процессом Клаузиуса и вернем тепло от холодильника нагревателю. В результате получается, что мы совершили работу только за счет отъёма теплоты от нагревателя, то есть постулат Томсона тоже неверен.
С другой стороны, предположим, что неверен постулат Томсона. Тогда можно отнять часть тепла у более холодного тела и превратить в механическую работу. Эту работу можно превратить в тепло, например, с помощью трения, нагрев более горячее тело. Значит, из неверности постулата Томсона следует неверность постулата Клаузиуса. Таким образом, постулаты Клаузиуса и Томсона эквивалентны.
Второе начало термодинамики является постулатом, не доказываемым в рамках термодинамики. Оно было создано на основе обобщения опытных фактов и получило многочисленные экспериментальные подтверждения.
С точки зрения статистической физики второе начало термодинамики имеет статистический характер: оно справедливо для наиболее вероятного поведения системы. Существование флуктуаций препятствует точному его выполнению, однако вероятность сколь-нибудь значительного нарушения крайне мала.
Энтропия
Энтропия (от греч. entropía — поворот, превращение), понятие, впервые введенное в термодинамику Р. Клаузиусом (1865) для определения меры необратимого рассеяния энергии, позволило строго математически сформулировать второй закон термодинамики. Энтропию можно определить с помощью двух эквивалентных подходов – статистического и термодинамического.
Термодинамический подход
Энтропия, функция состояния S термодинамической системы2, изменение которой dS для бесконечно малого обратимого изменения состояния системы равно отношению количества теплоты полученного системой в этом процессе (или отнятого от системы), к абсолютной температуре Т:
.где dS – приращение энтропии; δQ3 – минимальная теплота, подведенная к системе; T – абсолютная температура процесса.
Величина dS является полным дифференциалом, т.е. ее интегрирование по любому произвольно выбранному пути дает разность между значениями энтропии в начальном (А) и конечном (В) состояниях:
Теплота не является функцией состояния, поэтому интеграл от δQ зависит от выбранного пути перехода между состояниями А и В.
Энтропия измеряется в Дж/(моль·К).
Выражения (1) и (2) справедливы только для обратимых процессов.
Для необратимых процессов выполняется неравенство:
из которого следует возрастания энтропии в этих процессах.
1. Энтропия - величина аддитивная, т.е. энтропия системы из нескольких тел является суммой энтропий каждого тела: S = ∑Si .
2. В равновесных процессах без передачи тепла энтропия не меняется. Поэтому равновесные адиабатические процессы (δQ = 0) называется изоэнтропийным.
3. Энтропия определяется только с точностью до произвольной постоянной.
Действительно, согласно формуле (2) измеренной является лишь разность энтропий в двух состояниях.
Абсолютное значение энтропии можно установить с помощью третьего начала термодинамики (теоремы Нернста): энтропия любого тела стремится к нулю при стремлении к абсолютному нулю его температуры: lim S = 0 при Т → 0К.
Т.о., за начальную точку отсчета энтропии принимают
S0 = 0 при Т→ 0 К.
Энтропия – функция, устанавливающая связь между макро- и микро- состояниями; единственная функция в физике, которая показывает направленность процессов.
Энтропия – в естественных науках мера беспорядка системы, состоящей из многих элементов. В частности, в статистической физике – мера вероятности осуществления какого-либо макроскопического состояния; в теории информации – мера неопределённости какого-либо опыта (испытания), который может иметь разные исходы, а значит, и количество информации; в исторической науке, для экспликации феномена альтернативности истории (инвариантности и вариативности исторического процесса). Энтропия в информатике – степень неполноты, неопределённости знаний.
Понятие энтропии как показал впервые Э. Шрёдингер (1944), существенно и для понимания явлений жизни. Живой организм с точки зрения протекающих в нём физико-химических процессов можно рассматривать как сложную открытую систему, находящуюся в неравновесном, но стационарном состоянии. Для организмов характерна сбалансированность процессов, ведущих к росту энтропии и процессов обмена, уменьшающих её. Однако жизнь не сводится к простой совокупности физико-химических процессов, ей свойственны сложные процессы саморегулирования. Поэтому с помощью понятия энтропии нельзя охарактеризовать жизнедеятельность организмов в целом.
Закон возрастания энтропии
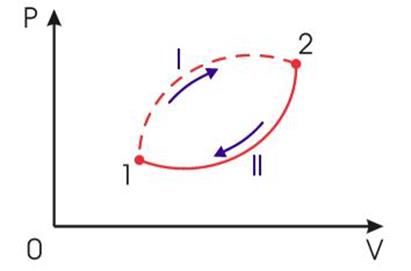
Рис.2.
Необратимый круговой термодинамический процесс
Применим неравенство (3) для описания необратимого кругового термодинамического процесса, изображенного на рис 2.
Пусть процесс будет необратимым, а процесс - обратимым. Тогда неравенство (3) для этого случая примет вид:
Так как процесс является обратимым, для него можно воспользоваться соотношением (2), которое дает:
Подстановка этой формулы в неравенство (4) позволяет получить выражение:
Сравнение выражений (2) и (6) позволяет записать следующее неравенство:
в котором знак равенства имеет место в случае, если процесс является обратимым, а знак больше, если процесс – необратимый.
Неравенство (7) может быть также записано и в дифференциальной форме:
Если рассмотреть адиабатически изолированную термодинамическую систему, для которой , то выражение (8) примет вид: ΔS = S2 – S1 ≥ 0
или в интегральной форме:
Из формулы (9) следует: S2 ≥ S1.
Полученные неравенства выражают собой закон возрастания энтропии, который можно сформулировать следующим образом:
В адиабатически изолированной термодинамической системе энтропия не может убывать: она или сохраняется, если в системе происходят только обратимые процессы, или возрастает, если в системе протекает хотя бы один необратимый процесс.
Записанное утверждение является ещё одной формулировкой второго начала термодинамики.
Таким образом, изолированная термодинамическая система стремится к максимальному значению энтропии, при котором наступает состояние термодинамического равновесия.
Термодинамическому равновесию адиабатической системы соответствует состояние с максимумом энтропии. Энтропия может иметь не один, а несколько максимумов, при этом система будет иметь несколько состояний равновесия. Равновесие, которому соответствует наибольший максимум энтропии называется абсолютно устойчивым (стабильным). Из условия максимальности энтропии адиабатические системы в состоянии равновесия вытекает важное следствие: температура всех частей системы в состоянии равновесия одинакова.
Рост энтропии является общим свойством всех самопроизвольно протекающих необратимых процессов в изолированных термодинамических системах. В состоянии равновесия энтропия принимает максимальное значение. В состоянии с максимальной энтропией макроскопические необратимые процессы невозможны.
При обратимых процессах в изолированных системах энтропия не изменяется.
Необходимо отметить, что если система не является изолированной, то в ней возможно уменьшение энтропии. Примером такой системы может служить, например, обычный холодильник, внутри которого возможно уменьшение энтропии. Но для таких открытых систем это локальное понижение энтропии всегда компенсируется возрастанием энтропии в окружающей среде, которое превосходит локальное ее уменьшение.
Статистический подход
В 1878 году Л. Больцман дал вероятностную трактовку понятия энтропии. Он предложил рассматривать энтропию как меру статистического беспорядкав замкнутой термодинамической системе. При этом Л. Больцман исходил из общего положения: природа стремится от состояний менее вероятных к состояниям более вероятным.
Все самопроизвольно протекающие процессы в замкнутой системе, приближающие систему к состоянию равновесия и сопровождающиеся ростом энтропии, направлены в сторону увеличения вероятности состояния. Всякое состояние макроскопической системы, содержащей большое число частиц, может быть реализовано многими способами.
Термодинамическая вероятность W состояния системы – это число способов, которыми может быть реализовано данное состояние макроскопической системы, или число микросостояний, осуществляющих данное макросостояние.
По определению термодинамическая вероятность W >> 1.
Например, если в сосуде находится 1 моль газа, то возможно огромное число N способов размещения молекулы по двум половинкам сосуда: N = 2 N A где NA – число Авогадро.
Каждый из них является микросостоянием. Только одно из микросостояний соответствует случаю, когда все молекулы соберутся в одной половинке (например, правой) сосуда. Вероятность такого события практически равна нулю. Наибольшее число микросостояний соответствует равновесному состоянию, при котором молекулы равномерно распределены по всему объему. Поэтому равновесное состояние является наиболее вероятным. Равновесное состояние с другой стороны является состоянием наибольшего беспорядка в термодинамической системе и состоянием с максимальной энтропией.
Согласно Больцману, энтропия S системы и термодинамическая вероятность W связаны между собой следующим образом:
S = k lnW,
где k = 1,38·10 –23 Дж/К – постоянная Больцмана.
Таким образом, энтропия определяется логарифмом числа микросостояний, с помощью которых может быть реализовано данное макросостояние. Следовательно, энтропия может рассматриваться как мера вероятности состояния термодинамической системы.
Вероятностная трактовка второго закона термодинамики допускает самопроизвольное отклонение системы от состояния термодинамического равновесия. Такие отклонения называются флуктуациями4. В системах, содержащих большое число частиц, значительные отклонения от состояния равновесия имеют чрезвычайно малую вероятность. Наличие флуктуаций показывает, что закон возрастания энтропии выполняется только статистически: в среднем для большого промежутка времени.
Читайте также:

