Обмен железа в организме реферат
Обновлено: 02.07.2024
Н.Г.Колосова, Г.Н.Баяндина, Н.Г.Машукова, Н.А.Геппе
Кафедра детских болезней Первого МГМУ им.И.М.Сеченова
Уменьшение количества железа в организме (в тканевых депо, в сыворотке крови и костном мозге) приводит к нарушению образования гемоглобина и снижению темпов его синтеза, развитию гипохромной анемии и трофическим расстройствам в органах и тканях. Лечение анемии у детей должно быть комплексным и базироваться на нормализации режима и питания ребенка, возможной коррекции причины железодефицита, назначении препаратов железа, сопутствующей терапии. Современные требования к пероральным препаратам железа, применяемым в детской практике, включают высокую биодоступность, безопасность, хорошие органолептические свойства, возможность выбора наиболее удобной лекарственной формы, комплаентность. В наибольшей степени этим требованиям отвечают препараты железа (III)-гидроксид-полимальтозного комплекса (Мальтофер).
Ключевые слова: анемия, железодефицит, дети, Мальтофер.
Iron exchange in the body and ways of correction of its abnormalities
N.G.Kolosova, G.N.Bayandina, N.G.Mashukova, N.A.Geppe
I.M.Sechenov First Moscow State Medical University, Moscow
Decrease of iron in the body (inside tissue depots, in serum and bone marrow) resulted in disturbances of hemoglobin formation, hypochromic anemia development and trophic disorders in organs and tissues. Treatment of anemia in children should be complex and based on normalization of nutrition, correction of cause of iron deficiency, iron preparation administration and concomitant therapy. Current demands for per oral iron medications for childrens include high bioavailability, safety, good organoleptic properties, possibility to choose most comfortable form of drug as well as appropriate compliance. Iron (III)-hydroxide polymaltose complex drugs such as Maltofer® comply with these criteria best of all.
Key words: anemia, iron deficiency, childrens, Maltofer.
Сведения об авторах:
Колосова Наталья Георгиевна – доцент кафедры детских болезней, к.м.н.
Баяндина Галина Николаевна – доцент кафедры детских болезней, к.м.н.
Машукова Наталья Геннадьевна – ассистент кафедры детских болезней, к.м.н.
Геппе Наталья Анатольевна – д.м.н., профессор, заслуженный врач РФ, зав. кафедрой детских болезней
Железо – очень важный микроэлемент для нормального функционирования биологических систем организма. Биологическая ценность железа определяется многогранностью его функций и незаменимостью другими металлами в сложных биохимических процессах, таких как дыхание, кроветворение, иммунобиологические и окислительно-восстановительные реакции. Железо является незаменимой составной частью гемоглобина и миогемоглобина и входит в состав более 100 ферментов, контролирующих: обмен холестерина, синтез ДНК, качество иммунного ответа на вирусную или бактериальную инфекцию, энергетический обмен клеток, реакции образования свободных радикалов в тканях организма. Суточная потребность ребенка в железе в зависимости от возраста составляет 4-18 мг. Как правило, поступающей пищи хватает, чтобы перекрывать потребность организма в железе, но в некоторых случаях необходимо дополнительное поступление железа. Основными источниками железа служат: крупа, печень, мясо. У детей до 1 года усваивается до 70% железа пищи, у детей до 10 лет – 10%, у взрослых – 3%.
В организме железо содержится в нескольких формах. Клеточное железо составляет значительную часть от общего количества, участвует во внутреннем обмене и входит в состав гемсодержащих соединений (гемоглобина, миоглобина, ферментов, например, цитохромов, каталаз, пероксидазы), негемовых ферментов (например, НАДН-дегидрогеназы), металлопротеидов (например, аконитазы). К внеклеточному железу относят свободное железо плазмы и железосвязывающие сывороточные белки (трансферрин, лактоферрин), участвующие в транспорте железа. Железо запасов находится в организме в виде двух белковых соединений – ферритина и гемосидерина – с преимущественным отложением в печени, селезенке и мышцах и включается в обмен при недостаточности клеточного железа.
Источником железа в организме являются пищевое железо, всосавшееся в кишечнике, и железо из разрушаемых в процессе обновления клеток эритроцитов. Различают гемовое (содержащее протопорфирин) и негемовое железо. Обе формы усваиваются на уровне эпителиоцитов двенадцатиперстной кишки и проксимального отдела тощей. В желудке возможна абсорбция только негемового железа, на долю которого приходится не более 20%. В эпителиоцитах гемовое железо распадается на ионизированное железо, окись углерода и билирубин, причем усвоение его не связано с кислотно-пептической активностью желудочного сока. Негемовое железо, получаемое из пищи, первоначально образует легко растворимые соединения с компонентами пищи и желудочного сока, что благоприятствует его усвоению. Ускоренное усвоение железа происходит под влиянием янтарной, аскорбиновой, пировиноградной, лимонной кислот, а также фруктозы, сорбита, метионина и цистеина. Напротив, фосфаты, а также сок поджелудочной железы, содержащий ингибиторы всасывания железа, ухудшают его абсорбцию.
Транспорт железа осуществляется белком трансферрином, который переносит железо в костный мозг, в места клеточных запасов железа (паренхиматозные органы, мышцы) и во все клетки организма для синтеза ферментов. Железо погибших эритроцитов фагоцитируют макрофаги. Физиологическая потеря железа происходит с калом. Незначительная часть железа теряется с потом и клетками эпидермиса. Общая потеря железа – 1 мг/сут. Также физиологическими считают потери железа с менструальной кровью, с грудным молоком.
Дефицит железа в организме развивается, когда потери его превышают 2 мг/сут. Организм регулирует запасы железа в зависимости от его потребностей путем увеличения его усвоения при прежнем количестве. Кальций, витамины С, В12, кислота желудочного сока, пепсин, медь способствуют усвоению железа, особенно если они поступают из животных источников. Фосфаты, входящие в состав яиц, сыра и молока; оксалаты, фитаты и танины, содержащиеся в черном чае, отрубях, кофе препятствуют усвоению железа. Снижение кислотности желудочного сока в результате продолжительного приема антацидов или препаратов для уменьшения кислотности также сопровождается уменьшением усвоения железа.
Всасываемость железа определяется взаимоотношением трех главных факторов: количеством железа в просвете тонкой кишки, формой катиона железа, функциональным состоянием слизистой оболочки кишечника. В желудке ионное трехвалентное железо переходит в двухвалентную форму. Всасывание железа осуществляется и наиболее эффективно протекает главным образом в двенадцатиперстной и в начальной части тощей кишки. Этот процесс проходит следующие этапы:
• захват клетками слизистой оболочки (ворсинками) тонкого кишечника двухвалентного железа и окисление его в трехвалентное в мембране микроворсинок;
• перенос железа к собственной оболочке, где оно захватывается трансферрином и быстро переходит в плазму.
• факторы органов пищеварения – наиболее важные из них: желудочный сок; термолабильные белки сока поджелудочной железы, препятствующие поглощению органического железа; восстановительные агенты пищи, увеличивающие поглощение железа (аскорбиновая, янтарная и пировиноградная кислота, фруктоза, сорбит, алкоголь) или тормозящие его (бикарбонаты, фосфаты, соли фитовой кислоты, оксалаты, кальций);
• эндогенные факторы – количество железа в запасе влияет на скорость его поглощения; высокая эритропоэтическая активность увеличивает поглощение железа в 1,5-5 раз и наоборот; уменьшение количества гемоглобина в крови увеличивает поглощение железа.
Несмотря на относительную легкость диагностики и лечения дефицит железа остается основной проблемой здравоохранения во всем мире. По данным ВОЗ, дефицит железа встречается, как минимум, у каждого 4-го младенца; у каждого 2-го ребенка в возрасте до 4 лет; у каждого 3-го ребенка в возрасте от 5 до 12 лет.
Особенно чувствительны к недостатку железа маленькие дети. Так как железо участвует в построении некоторых структур головного мозга, недостаток его во внутриутробном периоде и у детей первых двух лет жизни приводит к серьезным нарушениям обучаемости и поведения. Эти нарушения очень стойки, возможно, пожизненны. Дефицит железа у плода, новорожденного, в грудном возрасте может привести к нарушению умственного развития, гипервозбудимости в сочетании с синдромом невнимательности, плохой познавательной функцией и задержке психомоторного развития, вследствие функциональной недостаточности миоцитов и замедления миелинизации нервных волокон.
У новорожденных и детей грудного возраста значительную долю среди всех видов анемий занимает железодефицитная анемия (ЖДА). Известно, что единственным источником железа для плода является кровь матери. Поэтому решающую роль в процессах антенатального поступления железа в организм плода играют состояние маточно-плацентарного кровотока и функциональный статус плаценты, при нарушении которых уменьшается поступление железа в организм плода. Непосредственной причиной развития ЖДА у ребенка является дефицит железа в организме, который зависит от обеспеченности плода железом внутриутробно и новорожденного после рождения (экзогенное поступление железа в составе грудного молока или смесей и утилизация железа из эндогенных запасов).
Так как дети первых месяцев жизни быстро растут, у них очень быстро истощаются запасы железа, полученные во внутриутробном периоде. У доношенных детей это происходит к 4-5-му месяцу жизни, а у недоношенных детей уже к 3-му месяцу жизни.
Известно, что кроветворение недоношенных новорожденных с 2,5-3-месячного возраста вступает в железодефицитную фазу с развитием у большинства из них, без дополнительного введения железа, поздней анемии недоношенных, характеризующейся всеми признаками дефицита этого микроэлемента. Развитие анемии в этой возрастной группе объясняется первоначально небольшим депо железа (в результате недостаточных фетальных запасов железа к моменту рождения), большей потребностью в железе в процессе роста и недостаточным его поступлением с пищей. Частота возникновения поздней анемии недоношенных составляет 50-100% и зависит от степени недоношенности, вредных факторов перинатального периода (гестоз, ЖДА беременных II-III степеней, хронические болезни матери, инфекции, перинатальные кровопотери), характера выхаживания и вскармливания, патологии постнатального периода (дисбактериоз, гипотрофия, рахит), а также от своевременности и качества профилактики анемии препаратами железа.
У детей и подростков с дефицитом железа развивается эпителиопатия с нарушением кишечного всасывания и недостаточностью дериватов кожи (плохой рост волос и ногтей). У подростков дефицит железа приводит к нарушениям памяти и социального поведения, снижению интеллектуальных возможностей. Дефицит железа способен вызвать и другие расстройства в состоянии здоровья детей в связи с избирательными эффектами металлоферментов, содержащих Fe, а их известно более 40.
Причины дефицита железа:
• недостаточное поступление (неадекватное питание, вегетарианская диета, недоедание);
• снижение всасывания железа в кишечнике;
• нарушение регуляции обмена витамина С;
• избыточное поступление в организм фосфатов, оксалатов, кальция, цинка, витамина Е;
• поступление в организм железосвязывающих веществ (комплексонов);
• отравление свинцом, антацидами;
• усиленное расходование железа (в периоды интенсивного роста и беременности);
• потери железа связанные с травмами, кровопотерями при операциях, обильными менструациями, язвенными болезнями, донорством, занятиями спортом;
• гормональные нарушения (дисфункция щитовидной железы);
• гастриты с пониженной кислотообразующей функцией, дисбактериоз;
• различные системные и опухолевые заболевания;
• глистная инвазия.
Основные проявления дефицита железа:
• развитие железодефицитных анемий;
• головные боли и головокружения, слабость, утомляемость, непереносимость холода, снижение памяти и концентрации внимания;
• замедление умственного и физического развития у детей, неадекватное поведение;
• учащенное сердцебиение при незначительной физической нагрузке;
• растрескивание слизистых оболочек в углах рта, покраснение и сглаженность поверхности языка, атрофия вкусовых сосочков;
• ломкость, утончение, деформация ногтей;
• извращение вкуса (тяга к поеданию непищевых веществ), особенно у детей младшего возраста, затрудненное глотание, запоры;
• угнетение клеточного и гуморального иммунитета;
• повышение общей заболеваемости (простудные и инфекционные болезни у детей, гнойничковые поражения кожи, энтеропатии);
• увеличение риска развития опухолевых заболеваний.
Взрослым мужчинам и женщинам требуется только 8 мг /день. Женщины детородного возраста нуждаются в дозе 18 мг/сут, во время беременности потребность возрастает до 27 мг/сут.
Всасывание железа
Железо бывает двух видов: гемовое и негемовое. Гемовое железо содержится только в мясе, птице, рыбе и моллюсках. Негемовое железо содержится в растительных источниках, которые включают сушеную чечевицу, фасоль и горох; изделия из цельнозерновой муки; листовые зеленые овощи; сухофрукты; орехи и семена. Организм усваивает гемовое железо лучше чем негемовое, поэтому у вегетарианцев и тех, кто отказывается от мясной и животной пищи потребность в железе выше и составляет 32 мг/сут.
Необходимо включать богатые железом продукты в каждый прием пищи. Употребляя в пищу продукты с высоким содержанием витамина С, такие, как апельсины, клубника, помидоры, брокколи, цветная капуста, киви и цитрусовые соки — можно увеличить потребление железа. Такой же эффект дает использование посуды из чугуна или нержавеющей стали, железо может проникать из них в приготовленную пищу. Кофе и черный чай тормозят всасывание железа, поэтому лучше отложить их прием хотя бы на час от основного приема пищи.
Если организм не получает достаточного количества микроэлемента может развиться дефицит железа, который в легкой форме проявляется истощением запасов железа, в тяжелой форме — железодефицитной анемией.
- чувство усталости и слабости;
- снижение познавательной способности;
- затруднение поддержания температуры тела;
- снижение иммунной функции;
- восприимчивость к инфекции.
Лабораторные показатели обмена железа:
Трансферрин — это транспортный белок, который осуществляет перенос железа. Трансферрин транспортирует железо, всосавшееся в клетках кишечника, и железо разрушенных эритроцитов для повторного использования. В норме трансферрин насыщается железом только на 33%. При истощении запасов железа, синтез трансферрина активируется, а при увеличении — падает.
Ферритин — основная форма депонирования железа. Клетки печени, костного мозга, тонкого кишечника синтезируют ферритин, который связывает и хранит железо в нетоксичной для организма форме. В первую очередь при возрастающей потребности в железе, железо расходуется из тканей. На начальной стадии дефицита железа (прелатентной) необходимо оценивать уровень ферритина.
ОЖСС — общая железосвязывающая способность сыворотки. Это исследование позволяет определить степень так называемого Fe-голодания сыворотки крови. Второй показатель, после ферритина, который позволяет заподозрить дефицит железа.
Уровень гемоглобина оценивают совместно с уровнем железа сыворотки. Совместная интерпретация обоих результатов помогает провести дифференциальную диагностику анемий.
Все вышеперечисленные анализы необходимо сдавать натощак или спустя 6–8 часов после последнего приема пищи. Накануне сдачи крови желательно избегать чрезмерных физических и эмоциональных нагрузок, прием алкоголя.
Назначение железа как доношенным, так и недоношенным детям является одним из наиболее противоречивых вопросов. Дефицит железа широко распространен, он оказывает долгосрочное влияние на развитие нервной системы и поведенческие функции, нарушение которых может быть необратимым процессом. В то же время известно, что избыток железа токсичен.
Граница между терапевтической и токсической дозами железа весьма условна. Вопросы, которые вызывают противоречивые мнения, касаются адекватных лабораторных методов для оценки содержания железа в организме; времени начала дополнительного введения железа и безопасности такого вмешательства у недоношенных детей с учетом возможного побочного действия избыточного количества железа; времени начала дополнительного введения железа детям, находящимся исключительно на грудном вскармливании.
Железо — важнейший нутриент, участвующий в биологических процессах, включающих репликацию ДНК, экспрессию генов, клеточное дыхание (в т.ч. образование АТФ), а также в транспорте и усвоении кислорода. Железо нужно для эритропоэза (образования гемоглобина). Кроме того, оно является неотъемлемым компонентом многих ферментов, необходимых для развития головного мозга и чрезвычайно важных для работы мышц сердца и скелетных мышц (в частности, миоглобина).
Подобно кальцию и многим другим минералам, 80% железа, имеющегося в организме доношенного ребенка, накапливается плодом на сроке гестации между 24 и 40 нед со скоростью 1,6—2 мг/кг/сут. Общее содержание железа к моменту рождения составляет 75 мг/кг независимо от размеров ребенка; 75% железа находится в эритроцитах, 15% — в печени.
Она может быть подвержена хелированию и преципитации при взаимодействии с другими компонентами пищи, что снижает ее биодоступность. В частности, так действуют фитаты, фосфаты, таннаты, оксалаты и карбонаты. Как показали исследования с применением стабильных изотопов железа, количество неорганического железа, которое всасывается у недоношенных детей, составляет 34—42%. Это превышает количество железа (7-12%), поступающего в организм доношенного ребенка.
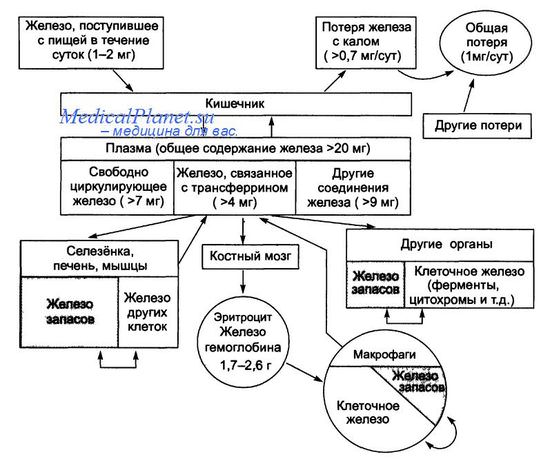
Схема обмена железа в организме взрослого человека
К факторам, усиливающим абсорбцию у недоношенных детей, относят постнатальный возраст, дефицит железа, введение железа (в т.ч. в составе сертифицированных смесей) между приемами пищи, нормальное содержание витамина С в организме. К факторам, уменьшающим абсорбцию железа, относят искусственное вскармливание (такие дети чаще имеют дефицит железа по сравнению с получающими грудное молоко) и гемотрансфузии. Гестационный возраст, постконцептуальный возраст и терапия эритропоэтином оказывают минимальный эффект на усвоение организмом железа.
Всасывание железа у взрослых происходит на апикальной поверхности энтероцитов двенадцатиперстной кишки. Органическое (или гемовое) железо транспортируется в энтероцит через недавно открытый белок-переносчик гема 1. Дальнейший путь железа после проникновения его в энтероцит до конца не изучен, хотя известно, что фермент гемоксигеназа, который высвобождает железо из протопорфиринового кольца, находится в микросомальной части энтероцита.
Гораздо больше известно о всасывании негемового железа. Один из путей заключается в превращении трехвалентного железа в двухвалентное на щеточной кайме энтероцитов при участии фермента дуоденальной редуктазы трехвалентного железа. Затем транспортер бивалентных металлов 1 переносит редуцированную форму железа через апикальную мембрану.
После попадания в кровь железо соединяется с трансферрином и переносится к месту использования или накопления. Предшественники эритроцитов имеют большое количество рецепторов трансферрина 1 (TfR1), что позволяет им иметь преимущества в захвате циркулирующего железа. Стареющие эритроциты поглощаются макрофагами. Макрофаги экспортируют восстановленное железо с помощью ферропортина (того же переносчика, который содержится в дуоденальных энтероцитах). Железо накапливается в печени, которая захватывает его из портальной системы с помощью TfR1.
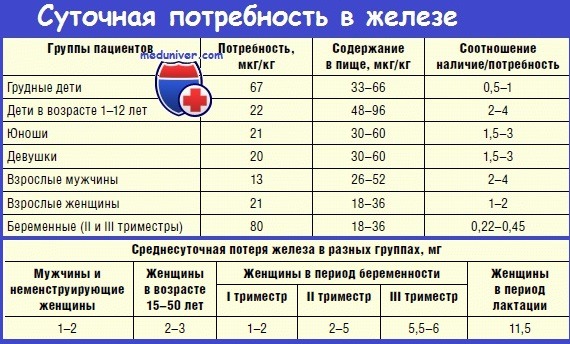
Суточная потребность организма в железе
Организм человека обладает способностью распределять доступное железо между органами, исходя из приоритетной потребности в нем. При дефиците железа в первую очередь расходуются его запасы в печени, затем — в скелетных мышцах и кишечнике. При выраженном дефиците железа сначала истощаются его запасы в сердечной мышце, затем — в головном мозге и, наконец, в эритроцитах. Железодефицитная анемия является тяжелой формой дефицита железа.
Эритроциты имеют большую потребность в железе даже по сравнению с головным мозгом, несмотря на возможные отрицательные неврологические последствия для ребенка, обусловленные дефицитом железа в мозговой ткани. Железо играет важную роль в процессах пролиферации нейронов, миелинизации, метаболизма энергии, нейротрансмиссии и работе различных ферментов в ЦНС. Существует система приоритетов по распределению и расходованию железа в пределах одного органа, что было показано в экспериментах на головном мозге новорожденных детенышей крысы. Наиболее чувствительными к дефициту железа в перинатальном периоде оказались гиппокамп и зона коры головного мозга.
Эритроциты являются приоритетным местом использования железа в организме, очевидна их исключительная функция в транспортировке кислорода в организме. Кислород обратимо присоединяется к гемоглобину в условиях высокого парциального давления кислорода в легких и высвобождается из этой связи при относительно низком парциальном давлении кислорода в тканях. На аффинность кислорода влияет ряд факторов, в т.ч. концентрация 2,3-дифосфоглицерата и рН.
Для осуществления обратимой связи кислорода с гемоглобином железо гемовой части должно находиться в двухвалентной форме. В эритроцитах существует специальный механизм для поддержания железа в редуцированной двухвалентной форме, однако в условиях действия лекарств, обладающих окислительной активностью, или токсинов, а также при генетических нарушениях в эритроцитах или аномалиях самого гемоглобина данные защитные механизмы не работают и гемоглобин не выполняет свою функцию. Высвобождение кислорода в мышцах частично зависит от концентрации миоглобина в тканях. Так же, как и в случае с гемоглобином, дефицит железа тормозит синтез миоглобина.
Низкое содержание миоглобина в мышцах, подобно низкой концентрации гемоглобина в крови, ухудшает высвобождение кислорода.
Наследственный гемохроматоз (НГХ) - тяжёлое многосистемное заболевание, связанное с генетическими дефектами, определяющими повышение всасывания железа в желудочно-кишечном тракте, его накопление в тканях организма, и, как правило, приводящее к нарушению функций печени, поджелудочной железы, сердца, гипофиза.
Первичный (наследственный) гемохроматоз входит в группу нозологических единиц, обозначаемых термином "синдром перегрузки железом" (СПЖ).
Основные клинические проявления этих заболеваний обусловлены общим патогенетическим механизмом - избыточным накоплением железа в органах и тканях. Группы заболеваний, при которых возникает СПЖ, приведены в таблице (табл. 19-5).
Серьёзная проблема дифференциальной диагностики СПЖ - установление первичного характера избыточного накопления железа. Значимость данной проблемы объясняется тем, что, помимо постановки диагноза у конкретного больного, подтверждение первичного (наследственного) характера заболевания определяет необходимость проведения обследования родственников пациента и профилактики развития заболевания у них.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
Преобладание групп признаков поражения определённых органов и систем послужило основанием для выделения четырёх клинических форм болезни.
- НFЕ (классическая форма) — "классическая триада" признаков, часто в сочетании с симптомами поражения сердца и эндокринных желёз, на фоне повышения
- НFЕ 2 (гемохроматоз 2-го типа, ювенильная форма): возникает на фоне перегрузки железом, диагностируют в молодом возрасте. Данная форма встречается редко и наследуется по аутосомно-рецессивному типу. Как правило, первые признаки болезни — упорные боли в животе в сочетании с отставанием полового развития и признаками поражения миокарда (нарушения ритма и проводимости).
- НFЕЗ (гемохроматоз 3-го типа) наследуется по аутосомно-рецессивному типу, клинически мало отличается от классической формы.
- НFЕ4 (аутосомно-доминантный гемохроматоз). При этом типе заболевания железо откладывается преимущественно в ретикулоэндотелиальной системе.
Значительные отложения железа обнаруживают в клетках Купфера, что определяет наличие в клинической картине признаков поражения печени. В литературе описано много семейных случаев (аутосомно-доминантный тип наследования).
Этиология и патогенез
Необходимое количество железа в суточном рационе составляет в среднем 10-20 мг, из которых усваивается лишь 10% (1-1,5 мг). Общее количество железа в организме равно 4-4,5 г. Практически всё железо входит в состав порфириновых соединений, главным образом гемоглобина, а также миоглобина, необходимых для снабжения тканей кислородом. В небольших количествах железо включено в состав железосодержащих ферментов - цитохромов и каталазы. Железо находится в связанной форме с белками, осуществляющими его хранение и транспорт: ферритином, гемосидерином, трансферрином.
Железо в организме реутилизируется на 97%, в основном за счёт повторного использования гема, высвобождаемого из разрушенных эритроцитов. Оставшиеся 3% поступают с пищей. У человека нет специализированного механизма выведения избытка железа. Те 3%, которые поступают с пищей, компенсируют железо, теряющееся при слущивании эпителия желудочно-кишечного тракта. Основная локализация процессов всасывания железа - тонкая кишка. В желудке начинается процесс подготовки железа к всасыванию: кислота желудочного сока восстанавливает негеминовое железо пищи Fe 3+ до Fe 2+ и освобождает его от связывающих веществ. Далее железо попадает в двенадцатиперстную кишку, где муцин захватывает и переносит его из просвета кишки к мембранам дуоденоцитов. Всасывание железа происходит двумя путями в зависимости от того, находится ли оно в составе гема или в свободном ионизированном состоянии. Геминовое железо попадает в клетку через мембрану без дополнительных переносчиков. Свободное железо всасывается с помощью переносчика двухвалентных металлов (DМТ1). В цитоплазме эпителия негеминовое железо связывается с внутриклеточным переносчиком - мобилферрином. Далее геминовое и негеминовое железо объединяются в единый пул, часть которого с помощью другого переносчика (ферропортина) выводится из клетки, вновь окисляется и в связанном с трансферрином виде уходит через кровяное русло к органам и тканям, а другая часть связывается с ферритином и остаётся в энтероците.
Транспорт железа осуществляет трансферрин, связывающий два трёхвалентных иона железа. Трансферрин - главный плазменный белок, осуществляющий транспорт железа, синтезируется в печени. В норме трансферрин насыщен железом на 33%. Сывороточная концентрация трансферрина, равная 3,0 г/л, эквивалентна 3,75 г/л ОЖСС. При гемохроматозе процент насыщения трансферрина железом нередко достигает 100%.
Связанное с трансферрином железо поступает в ткани организма. Здесь трансферрин связывается с рецептором трансферрина что индуцирует рецептор -опосредованный эндоцитоз, при этом в эндосому попадает не только рецептор с трансферрином, но и DМТ1, который обеспечивает перенос железа из эндосомы в цитоплазму. После этого ТfR и DМТ1 снова возвращаются на поверхность клетки, а трансферрин — в кровоток.
Активность всасывания трансферринового железа в криптах двенадцатиперстной кишки пропорциональна степени насыщения трансферрина крови железом. Высокое содержание сывороточного железа приводит к снижению поступления пищевого железа, и таким образом формируется функциональная система регулирования всасывания железа пищи.
Хранится железо преимущественно в виде комплекса с ферритином. Ферритин образуется в клетках ретикулоэндотелиальной системы (РЭС). Нужно помнить, что ферритин - белок острой фазы, и, следовательно, его количество повышается при опухолевых и воспалительных заболеваниях.
Уже было упомянуто, что из энтероцитов железо поступает в кровь с помощью ферропортина. Не менее важную роль он играет и в утилизации железа, получаемого в клетках РЭС при разрушении эритроцитов. Ферропортин имеет множество трансмембранных центров связывания, ответственных за выход железа из клеток. Ген ферропортина экспрессируется в клетках нескольких типов, в том числе в плацентарных синцитиотрофобластах, дуоденальных энтероцитах, гепатоцитах и ретикулоэндотелиальных макрофагах.
Несмотря на то что механизмы накопления железа в организме требуют дальнейшего изучения, можно определённо говорить о повреждающем действии
- усиление перекисного окисления липидов за счёт катализирования железом свободнорадикальных реакций;
- взаимодействие железа с ДНК, приводящее к прямому её повреждению (в частности, к увеличению риска развития гепатоцеллюлярной карциномы).
Эпидемиология
Высокая частота встречаемости НГХ (по зарубежным данным — до 8 случаев на 1000 населения, в среднем - 0,5%) предполагает гетерозиготное носительство патологического гена у 10-13% населения. Несмотря на зарубежный опыт, диагноз НГХ в России ставят крайне редко или не ставят вовсе. Этому, безусловно, способствует значительная фенотипическая гетерогенность заболевания и отсутствие специфических симптомов, а также отсутствие у врачей понимания проблемы.
Клиническая картина
Cимптомы, течение
- Латентная стадия подразумевает наличие генетического дефекта в отсутствие синдрома перегрузки железом. На этом этапе происходит постепенное накопление железа в организме.
- На второй (бессимптомной) стадии в отсутствие клинических проявлений заболевания отмечают лабораторные признаки СПЖ.
- Клиническая картина на третьей стадии (СПЖ с ранними симптомами) малоспецифична и характеризуется слабостью, недомоганием, апатией и другими
- На более поздних стадиях (СПЖ с поражением органов-мишеней) обнаруживают признаки поражения отдельных органов.
Диагностика
На течение НГХ могут влиять различные факторы внешней среды, в частности повышенное употребление железа с пищевыми продуктами, избыточное употребление аскорбиновой кислоты, усиливающей всасывание железа в кишечнике, злоупотребление алкоголем, курение, вирусные гепатиты. Велика роль кровопотерь, связанных с менструальным циклом, беременностью и родами. Этим можно объяснить тот факт, что наследственный гемохроматоз диагностируют у мужчин в 5-10 раз чаще, чем у женщин.
Необходимо отметить, что в последние годы происходит "метаморфоз" клинической картины болезни: всё реже встречаются больные с классической клинической триадой, описанной Dutournier в 1885 г., и всё чаще диагностируют заболевание на доклинических стадиях, когда основные симптомы болезни отсутствуют.
Происходящая при НГХ существенная перегрузка организма железом затрагивает все звенья его метаболизма, что отражается рутинными клиническими тестами и служит основой лабораторной диагностики НГХ.
Насыщение трансферрина железом (НТЖ) — это расчётный коэффициент, определяемый как отношение между количеством сывороточного железа и ОЖСС. Чувствительность данного показателя превышает 90%, однако специфичность метода составляет около 65%, что обусловливает проведение большого количества неоправданных исследований. Высокая чувствительность метода позволяет применять его в скрининг-исследованиях.
Сывороточный ферритин. Связь между концентрацией сывороточного ферритина и запасами железа в печени чётко установлена. Необходимо учитывать, что концентрация ферритина может увеличиваться при хроническом воспалении, опухолях, у больных алкогольной болезнью печени и хроническим гепатитом.
В результате бурного развития молекулярной генетики в 1970-80-х годах и последующего успешного изучения генома человека молекулярно-генетические методы прочно вошли в клиническую практику. Данная группа методов предназначена для обнаружения вариаций в структуре исследуемого участка ДНК (аллеля, гена, региона хромосомы) вплоть до определения первичной последовательности оснований.
Генетическую основу НГХ, связанного с носительством мутантных аллелей гена НFЕ, составляют миссенс-мутации HFE-гена: С282Y, H63D, S65С в различных комбинациях. Большинство больных НГХ, обусловленным мутациями НFЕ-гена, — гомозиготы С282Y/С282Y (от 50 до 100% в различных регионах мира).
Необходимо отметить, что не у всех лиц с наличием двух аллелей гена НFE с мутацией С282Y развивается СПЖ, то есть генетический дефект не всегда проявляется фенотипически. В то же время формирование заболевания в отсутствие мутаций НFЕ-гена указывает на существование других этиологических факторов. Среди больных НГХ, не связанным с носительством гена НFЕ, выделяют несколько клинических вариантов: ювенильный (НFЕ 2), обусловленный мутацией рецептора трансферрина 2-го типа (НFЕ З) или мутацией ферропортина 1-го типа (НFЕ 4), а также африканский вариант перегрузки железом, СПЖ на Исландских островах. После подтверждения диагноза НГХ на основании биопсии печени проводят определение мутации гена НFЕ молекулярно-генетическими методами. Обнаружение гомозиготного состояния по мутациям с282y или компаунд-гетерозиготного состояния с282у/Н6ЗD - показание для обследования родственников пробанда на наличие мутации гена НFЕ и определения риска развития заболевания. Методы генной диагностики более редких мутаций (НFЕ 3, ювенильного и доминантного НГХ) находятся в стадии разработки.
Долгое время биопсию печени считали "золотым стандартом" при постановке диагноза НГХ. В настоящее время в связи с внедрением молекулярно-генетических методов биопсия печени приобретает большее значение в прогнозировании болезни, нежели при постановке диагноза. Биопсия печени с определением содержания железа в её ткани остаётся очень точным методом постановки диагноза.
Исследование содержания железа печени было впервые предпринято Гейлом в 1963 г. В дальнейшем все исследования ткани печени больных НГХ проводили при обязательном определении количества железа в микромолях или граммах в печени может быть повышено не только при НГХ, Бассет в 1986 г. предложил вычислять так называемый печёночный индекс железа (ПИЖ).
Читайте также:

