Никель и его соединения реферат
Обновлено: 28.06.2024
Связывание Никеля в комплексы- важный процесс, для аналитической химии в случае диагностики и определения характерных свойств веществ и самого элемента.
Их известно ограниченное число , при этом большинство неустойчиво, легко выветриваются на воздухе; соединения окрашены преимущественно в красный цвет, получают восстановлением соединений никеля (II) таких как - Оксид никеля(II) NiO, Гидроксид никеля(II) Ni(OH)2, Сульфид никеля (II) NiS). К ним относятся K2[NiCl3] , Na2[Ni(CN)3], K3[Ni(CN)3], K2[Ni(NO)(CN)3] , [Ni(NO)SC2H5] – красный.
2. Комплексные соединения двухвалентного никеля
это Наиболее важные и устойчивые соединения никеля.
Образуемые двухвалентным катионом Ni2+ соли сильных кислот почти все хорошо растворимы в воде, причем растворы их вследствии гидролиза показывают слабокислую реакцию. К труднорастворимым относятся соли сравнительно слабых кислот, в частности производные анионов CO32- и PO43-.Гидратированный ион Ni·· будет окрашен в ярко – зеленый цвет. Та же окраска характерна для образованных им кристаллогидратов солей. Напротив, в безводном состоянии отдельные комплексные соли окрашены различно, причем цвета их не всегда совпадают с собственной окраской Ni2+ (желтый), а зависят также от природы аниона.
Катион с данной валентностью( Ni 2+ ) с аммиаком образует гексаамминовый комплекс [Ni(NH 3 ) 6 ] 2+ и диакватетраамминовый комплекс [Ni(NH 3 ) 4 (Н 2 О) 2 ] 2+ . Эти комплексы с анионами образуют синие или фиолетовые соединения, что сильно упрощает их диагностику.
Водные растворы солей никеля(II) содержат ион гексаакваникеля(II) [Ni(H2O)6] 2+ . При добавлении к раствору, содержащему эти ионы, аммиачного раствора происходит осаждетание гидроксида никеля (II), зелёного желатинообразного вещества. Этот осадок растворяется при добавлении избыточного количества аммиака вследствие образования ионов гексамминникеля(II) [Ni(NH3)6] 2+ .
В некоторых аммиакатах никеля существуют ионы [Ni(NH3)6] 2+ и [Ni(H2O)2(NH3)4] 2+ . Соединения, являющиеся производными этих и других ионов аммиаката никеля, легко растворимы в воде. Образованием этих комплексов объясняется растворимость в водном растворе аммиака многих соединений никеля, нерастворимых в чистой воде, например его гидроокиси и фосфата Никель очень склонен также к образованию внутрикомплексных солей. К ним относятся соли, в которых атом металла, заместившего водород, например никеля, одновременно связан координационной связью с другим кислотным остатком. Внутрикомплексные соли отличаются часто исключительно низкой растворимостью. По этому в последнее время они приобретают все более важное значение в аналитической химии. Одним из наиболее известных представителей этого класса комплексных соединений является никельдиметилглиоксим, широко применяющийся для аналитического определения никеля.
К частным представителям относится Хлорид гексаминнникеля (II).
Хлорид гесаминникеля(II) [Ni(NH3)6]Cl2 – светло – желтый или светло – голубой гигроскопичный порошок, на воздухе частично разлагается. Растворяется уже в холодной воде. Термическая устойчивость образующегося комплексного аммиаката.очень велика . Водой разлагается с выделением гидроокиси
Ni:[Ni(NH3)6]Cl2 =6H2O = Ni(OH)2 + 4NH4OH +2NH4Cl.
На растворы аммиакатов никеля кислород влияния не оказывает
Никель в данной валентности образует комплексы с тетраэдрической и с плоской квадратной структурой. Например, комплекс тетрахлороникелат (II) [NiCl4] 2− имеет тетраэдрическую структуру, а комплекс тетрацианоникелат(II) [Ni(CN)4] 2− имеет плоскую квадратную структуру.
Диметилглиоксим/диметилглиоксимат Никеля.
Характерна реакция ионов Ni 2+ с диметилглиоксимом ( C4H8O2N2) , приводящая к образованию внутрикомплексного соединения розово-красного диметилглиоксимата никеля, что мало растворимо в воде. Диметилглиоксимат никеля Ni(C 4 H 6 N 2 O 2 ) 2 , плохо растворимый в воде хелатный комплекс Ni(II), дополнительно стабилизированный за счёт внутримолекулярных водородных связей , дающий чёткую красную окраску в кислой среде, используется в аналитической химии как качественная реакция на ионы никеля (II).
Диметилглиоксимат никеля Ni(C 4 H 6 N 2 O 2 ) 2 можно получить, прилив к раствору соли Ni(II) диметилглиоксим (реактив Чугаева) и аммиачную воду (нашатырный спирт) .
Уравнение реакции: NiSO4 + 2C4H8O2N2+ 2NH3 => Ni(C4H7O2N2)2 + (NH4)2 SO4.
Эту реакцию используют при количественном определении никеля как ГРАВИМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИ я элемента в присутствии лимонной или винной кислоты.
, а продукт реакции — как пигмент косметических материалов и для других целей , что хорошо используется в настоящее время. Красивая глубокая окраска этого комплексного соединения привлекла внимание и парфюмеров: диметилглиоксимат никеля вводят в состав губной помады. Некоторые из подобных диметилглиоксимату никеля соединений - основа очень светостойких красок.
На этой же реакции основывается и Фотометрический метод определения никеля
Метод основан на образовании никелем окрашенного соединения с
диметилглиоксимом в щелочной среде в присутствии окислителя и измерении оптической плотности окрашенного раствора".
Дибутилдитиокарбамат никеля(Карбамат БНИ ) ([(C4H9)2NCS2]2Ni)
Данное комплексное соединение Представляет собой зеленый кристаллический порошок. Т. плавл. 90°. Плохо растворимый в воде.
Умеренно токсичен. При поступлении в желудок для белых мышей при ЛД50 = 4,1, для крыс 2,35 г/кг. Слегка раздражает кожу животных. В промышленности применяется как противостаритель резины. из-за своих водооталкивающих свойств.
При действии F 2 на смесьдвухвалентного хлорида никеля NiCl 2 , и KCl получаются соединения (Гексафтороникелаты калия) K 3 [NiF 6 ] и K 2 [NiF 6 ]. K 2 [NiF 6 ] является пока единственной фторидной солью которая, обладает специфическими магнитными свойствами. Хотя её свойства до конца не изучены, возможно использование в изготовлении магнитных носителей информации.( дискеты для компьютеров, аудио- и видеокассеты, бобинные ленты, жёсткие диски внутри компьютеров ).
При упаривании растворов содержащих щелочные и некоторые другие роданиды, можно получить хорошо кристаллизующиеся двойные роданиды (роданоникелаты), например Na2[Ni(SCN)4]*8Н20 - светло-зеленые кристаллы и K4[Ni(SCN)6]*4Н2О - синие кристаллы; эти соли можно без разложения перекристаллизовать из спирта, а некоторые и из воды.
3 Комплексные соединения трехвалентного никеля.
Очень малочисленны,т.к неустойчивы. Ппроявляют окислительные свойства и образуются при энергичном окислении некоторых соединений никеля(II). представителем их будет ацетат,(гексаацетоникеля ацетат) [Ni3(CH3COO)6](CH3COO)3, а также некоторые координационные соединения . Me3I[Ni(CH = NO)6].
4. Соединения четырехвалентного никеля
Четырехвалентное состояние не характерно для никеля. Известно очень немного соединений четырехвалентного никеля. Все они имеют окислительный характер и неустойчивы. В качестве примеров никеля (IV) можно привести никелаты K2Ni2+[Ni4+O3]2, Na2Ni2+[Ni4+O3]2, ортопериодаты(т.е неорганические соединения, соли металла меди и иодной кислоты)
Одним из них будет [ Ni ( CO ) 4 ] - . Диамагнитная бесцветная жидкость, очень летучая и очень токсичная. tпл=-19°С [1], tкип=43°С [1], плотность равна 1,356 г/см 3 [2]. Затвердевает при -23°С. разлагается на металлический никель и оксид углерода при нагревании до 180-200°С. Мало растворим в воде, растворяется в эфире, хлороформе, толуоле, бензоле. Не реагирует с разбавленными кислотами и щелочами. С концентрированной серной кислотой реагирует со взрывом. Получают пропусканием оксида углерода над порошкообразным никелем, нагретым до 50-60°С.
Является летучим и чрезвычайно ядовитым соединением, что сильно ограничивает его применение.
. Из растворов, содержащих нитриты щелочных и щелочноземельных металлов, кристаллизуются двойные нитриты типа M4[Ni(NO2)6) (гексанитроникелаты), например устойчивый на воздухе никельнитрит (гексанитроникелат) калия K4[Ni(NO2)6] - коричнево-красные октаэдры, нерастворимые в спирте; их можно перекристализовать из воды. Органические соединения никеля
Связь Ni-C может осуществляться двумя способами: по у- и р-типу, а соответствующие соединения именуются у- и р-комплексами. Так, к у-комплексам относятся соединения вида [Ni(R 2 )L 2 ] и [NiX(R)L 2 ], где R=Alk или Ar, L=PR 3 , амины и др., X - ацидолиганд; к р-комплексам - алкеновые и полиеновые никельорганические соединения, содержащие никель в нулевой степени окисления и имеющие тригональную или тетраэдрическую структуру, например: тригональный комплекс [Ni(cdt)] (cdt - циклододекатриен); тетраэдрический комплекс никеля бис-(1,5-циклооктадиен)никель [Ni(cod) 2 ] - реагент в химии никельорганических соединений и в органическом синтезе.
Из никеля изготавливают коррозионноустойчивые изделия, аппараты для физико – химических измерений, детали машин,
Сплавы
Важной особенностью Никеля будет его способность к образованию спалвов. Это обусловлено тем, что В периодической системе никель по вертикали занимает ряд: Ni - Pd - Pt, что и определяет сходство этих металлов. Вот почему никель во мно гих отношениях сохраняет высокую химическую стойкость, присущую платине и палладию.
В качествее примеров сплавов никеля можно назвать никельсодержащие стали, бронзы, латуни, монетные сплавы, сплавы для электрических сопротивлений (константан - Ni, Cu; никелин –Ni, Cu, Zn; манганин –Ni, Mn, CU), сплавы, используемые для изготовления деталей, устойчивых к корозии и высоким температурам, сплавы для зубильных процессов (тикониум – 68,2% Co +Ni, 30% Cr, 1,8% Be), специальные сплавы, такие, как монель –В технике особое значение имеют сплавы Ni – Cu, легированные железом и марганцем, Ni – Fe, Ni – Cr
(нихром) и Fe – Ni – Cr (ферронихром). Сплавы никеля с хромом, медью и железом не окисляются и проявляют высокую стойкость к коррозионному действию многочисленных химических веществ.
монель-металл (Ni,Cu Mn), жаростойкий до 500 °C, очень коррозионно-устойчив;
белое золото (например золото 585 пробы содержит 58,5 % золота и сплав (лигатуру) из серебра и никеля );
нихром, сплав никеля и хрома ;
пермаллой ( Ni Fe Cu Cr), обладает высокой магнитной восприимчивостью при очень малых потерях на гистерезис;
инвар (Fe Ni), почти не удлиняется при нагревании;
Кроме того, к сплавам никеля относятся никелевые и хромоникелевые стали, нейзильбер и различные сплавы сопротивления типа константана, никелина и манганина
Все нержавеющие стали обязательно содержат никель, т.к. он повышает химическую стойкость сплава. Также сплавы никеля характеризуются высокой вязкостью и используются при изготовлении прочной брони.
При изготовлении важнейших деталей различных приборов используется сплав никеля с железом (36-38% никеля), обладающий низким коэффициентом термического расширения. При изготовлении сердечников электромагнитов широкое применение находят сплавы под общим названием пермаллои. Эти сплавы, кроме железа, содержат от 40 до 80% никеля. Из никелевых сплавов чеканятся монеты. Общее число различных сплавов никеля, находящих практическое применение, достигает нескольких тысяч.
Осуществляется в основном следующими методами:
1) Осаждением в виде диметоиглиоксимата никеля, как уже было сказано.
2) осаждением ввиде никель-альфа-бензилдиоксима.
3)Осаждение ввиде гидроокиси никеля(3) . Эта реакция проводится с помощью едкого кали и бромной воды.
4)Осаждение в виде сульфида. Где будет использован в качестве весовой формы оксид никеля2.
6)Обьёмным методом - т.е титрование цианида калия до образования комплексного цианида(Калий 2 никель це эн четырежды)
7)Колометрический метод, основанный на изменении окраски иона гексаамминаникеля, или красного окрашивания растворимого комплексного соединения, что образуется при реакции ионов никеля 3 с диметилглиоксимом в щёлочном растворе в присутствии окислителя.
тИТРИМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ НИКЕЛЯ
Метод основан на осаждении никеля в аммиачном растворе диметилглиоксимом в виде малорастворимого внутрикомплексного соединения в присутствии лимонной или винной кислоты и определении никеля комплексонометрическим титрованием с эриохром черным Т в качестве индикатора.
АТОМНО-АБСОРБЦИОННЫЙ МЕТОД ОПРЕДЕЛЕНИЯ НИКЕЛЯ
Метод основан на измерении абсорбции света атомами никеля, образующимися при введении анализируемого раствора в пламя ацетилен-воздух.
Применение в промышленности.
Некоторые соли никеля применяются в керамической промышленности в качестве пигментов
Никелирование металлов
Никель в чистом виде находит основное применение в качестве защитных покрытий от коррозии в различных химических средах. Защитные покрытия на железе и других металлах получаются двумя известными способами: плакировкой и гальванопластикой.
Первым методом плаки рованный слой создается путем совместной прокатки в горячем состоя нии тонкой никелевой пластинки с толстым железным листом.
Гальванический же способ создания защитных покрытий никелем , включает в себя некоторую подготовительную работу по очистке поверхности покрываемого металла и подготовке элек тролитической ванны, состоящей из подкисленного раствора сульфата никеля. При электролитическом покрытии като дом служит покрываемый материал, а анодом — никелевая пластинка. В гальванической цепи никель осаждается на катоде с эквивалентным переходом его из анода в раствор. Метод никелирования имеет широкое применение в технике, и для этой цели потребляется большое количество никеля
Аккумуляторы из никеля
Никель широко применяется в качестве аккумуляторных электро дов в щелочных аккумуляторах. В Германии еще в годы войны был раз работан метод изготовления этих электродов из прессованных и спечен ных при определенных условиях порошков чистого никеля. Этот способ стал широко применяться в Германии и других странах.
Функция "чтения" служит для ознакомления с работой. Разметка, таблицы и картинки документа могут отображаться неверно или не в полном объёме!
Физические и химические свойства……………………………………………2
Средние концентрации никеля в городах России……………………………. 5
Токсичное действие никеля и его неорганических соединений……………. 7
Поступление в организм, распределение и выделение………………………15
Индивидуальная защита. Меры предупреждения……………………………15
Общий характер действия……………………………………………………. 17
Поступление в организм и выделение………………………………………. 21
Индивидуальная защита и меры предупреждения…………………………. 21
И ЕГО СОЕДИНЕНИЯ
Никель входит в состав многих сплавов, которые широко используются в сотнях промышленных отраслей. Это один из самых полезных металлов, известных человеку. Но в старину, когда с ним пытались работать химики, он доставлял им немало хлопот. Ведь недаром название "никель" происходит от немецкого слова, означающего "чертенок"!
Физические и химические свойства.
Серебристый металл. Т. плавл. 1453"; кип. 2140°; плоти. 8,90; раств. в воде за сутки 0,15 мг%, за месяц 1 мг%; в 3% растворе НС1 в те же сроки 150 и 200 мг%; в желудочном соке за 1-и 12,5 мг%, за 3 суток—30 мг% . Растворяется в разбавленных минеральных кислотах. В компактном состоянии устойчив. Образует комплексные соединения.
Никель относится к разряду тяжелых металлов.
Тяжелые металлы - это приоритетные загрязняющие вещества, наблюдения за которыми обязательны во всех средах. В различных научных и прикладных работах авторы по-разному трактуют значение этого понятия. В качестве критериев принадлежности к тяжелым металлам используются многочисленные характеристики: атомная масса, плотность, токсичность, распространенность в природной среде, степень вовлеченности в природные и техногенные циклы. В некоторых случаях под определение тяжелых металлов попадают элементы, относящиеся к хрупким (например, висмут) или металлоидам (например, мышьяк).
В работах, посвященных проблемам загрязнения окружающей природной среды и экологического мониторинга, на сегодняшний день к тяжелым металлам относят более 40 металлов периодической системы Д.И. Менделеева с атомной массой свыше 50 атомных единиц: V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Mo, Cd, Sn, Hg, Pb, Bi и др.
При этом немаловажную роль в категорировании тяжелых металлов играют следующие условия: их высокая
Никель входит в состав многих сплавов, которые широко используются в сотнях промышленных отраслей. Это один из самых полезных металлов, известных человеку. Но в старину, когда с ним пытались работать химики, он доставлял им немало хлопот. Ведь недаром название "никель" происходит от немецкого слова, означающего "чертенок"!
Оглавление
Введение . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3
1. Физические и химические свойства Никеля . . . . . . . . . . . . . . . . . . . . . . . . . 4
2. Источники образования . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4
3. Поступление и миграция в окружающую среду . . . . . . . . . . . . . . . . . . . . 5
4. Химические превращения токсикантов в воде, почве и атмосфере . . . . . 6
5. Пути поступления токсикантов в организм, их влияние на животных
и человека. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 8
Вывод . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 13
Список литературы . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 14
Файлы: 1 файл
никель инд.docx
Содержание никеля в почвах составляет 0,004%, в природных поверхностных водах — 0,000 000 34%. В растениях в среднем содержится 0,00005% на живой вес (в зависимости от вида растения, местности, почвы, климата и др.). Растения в районе никелевых месторождений могут накоплять в себе значительные количества никеля. При этом наблюдаются явления эндемического заболевания растений, например уродливые формы астр, что может быть биологическим и видовым индикатором в поисках никелевых месторождений. Морфологически измененные анемоны в обогащенных никелем биогеохимических провинциях концентрируют никель в 30-кратном размере; повышенное содержание никеля в почвенных растворах и в почвах Южного Урала, обогащенных никелем в 50-кратном размере, является причиной появления уродливых форм у сон-травы (семейство лютиковых) и грудницы (семейство сложноцветных).
Критические значения концентрации никеля в питательном растворе—1,5 мг/кг и в сухой массе ячменя, выращенного на такой среде — 26 мг/кг. Токсический уровень этого элемента в листьях растений начинается с превышения 1,0 мг/кг сухой массы.
При усвоении никеля растениями происходит взаимодействие с содержащимися в почве железом, кобальтом, хромом, магнием, медью, цинком, марганцем; при этом ионы марганца и магния не ингибируют, а ионы кобальта, меди, железа и цинка — ингибируют абсорбцию никеля на 25—42%. Существуют указания на то, что растения, произрастающие на серпентиновых почвах, не проявляют признаков токсического повреждающего воздействия никеля, в случаях, если соотношение медь: никель равно или более 1, или соотношение железо: никель равно или более 5. Среди растений существует различие в чувствительности по отношению к воздействию никеля. Токсические уровни никеля в листве растений (млн -1 сухой массы): рис 20—25, ячмень 26, виды твердой древесины 100—150, цитрусовые 55—140, сорняки 154. Типичные симптомы повреждающего токсического действия никеля: хлороз, появление желтого окрашивания с последующим некрозом, остановка роста корней и появления молодых побегов или ростков, деформация частей растения, необычная пятнистость, в некоторых случаях — гибель всего растения.
Никель является одним из чрезвычайно важных металлов; он имеет свою замечательную историю и заманчивые перспективы дальнейшего применения.
Но следует помнить, что избыточное количество соединений никеля оказывают пагубное влияние на живой организм и проявляют токсическое действие. Для веществ в различных средах существуют максимальные концентрации, при которых эти вещества не оказывают неблагоприятного действия на людей ни на производстве, ни в быту. В нашей стране установлены предельно допустимые концентрации (ПДК) вредных веществ в производственных условиях и в окружающей среде.
Для никеля и его солей установлены следующие ПДК.
1. Для водоемов санитарно- бытового водопользования – 0,1 мг/л.
2. Для атмосферного воздуха населенных мест: растворимые соли никеля – 0,0002 мг/м3; никель металлический и окись никеля – 0,001 мг/м3.
3. Для воздуха рабочей зоны: карбонил никеля – 0,0005 мг/м3; соли никеля в виде гидроаэрозоля в пересчете на никель – 0,005 мг/м3; никель металлический, его окиси, сульфид и смеси этих соединений в пересчете на никель – 0,05 мг/м3.
1. “Вредные вещества в промышленности”, том 3.Химия 1977г.
2. Антоньев, А. Гигиена труда / А. А. Антоньев.1964г.
3. Михеев, М. Материалы по токсикологии карбонила никеля / М. И. Михеев. 1970г.

Никель — простое вещество, пластичный, ковкий, переходный металл серебристо-белого цвета, при обычных температурах на воздухе покрывается тонкой плёнкой оксида. Химически малоактивен. Относится к тяжелым цветным металлам, в чистом виде на земле не встречается – обычно входит в состав различных руд, высокой твердостью, хорошо полируется, является ферромагнетиком – притягивается магнитом, в периодической системе Менделеева обозначается символом Ni и имеет 28 порядковый номер.
Смотрите так же:
СТРУКТУРА
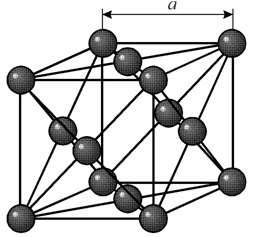
Имеет гранецентрированную кубическую решетку с периодом a = 0,35238 å нм, пространственная группа Fm3m. Эта кристаллическая структура устойчива к давлению, по меньшей мере 70 ГПа. При обычных условиях никель существует в виде b-модификации, имеющей гранецентрированную кубическую решётку ( a = 3,5236 å). Но никель, подвергнутый катодному распылению в атмосфере h 2 , образует a-модификацию, имеющую гексагональную решётку плотнейшей упаковки ( а = 2,65 å, с = 4,32 å), которая при нагревании выше 200 °С переходит в кубическую. Компактный кубический никель имеет плотность 8,9 г/см 3 (20 °С), атомный радиус 1,24 å
СВОЙСТВА

Никель — ковкий и тягучий металл, из него можно изготовлять тончайшие листы и трубки. Предел прочности при растяжении 400—500 Мн/м 2 , предел упругости 80 Мн/м 2 , предел текучести 120 Мн/м 2 ; относительное удлинение 40%; модуль нормальной упругости 205 Гн/м 2 ; твёрдость по Бринеллю 600—800 Мн/м 2 . В температурном интервале от 0 до 631К (верхняя граница соответствует Кюри точке ). Ферромагнетизм никеля обусловлен особенностями строения внешних электронных оболочек его атомов. Никель входит в состав важнейших магнитных материалов и сплавов с минимальным значением коэффициента теплового расширения (пермаллой, монель-металл, инвар и др.).
ЗАПАСЫ И ДОБЫЧА

Никель довольно распространён в природе — его содержание в земной коре составляет около 0,01%(масс.). В земной коре встречается только в связанном виде, в железных метеоритах содержится самородный никель (до 8%). Содержание его в ультраосновных породах примерно в 200 раз выше, чем в кислых (1,2кг/т и 8г/т). В ультраосновных породах преобладающее количество никеля связано с оливинами, содержащими 0,13 — 0,41% Ni.
В растениях в среднем 5·10 −5 весовых процентов никеля, в морских животных — 1,6·10 −4 , в наземных — 1·10 −6 , в человеческом организме — 1…2·10 −6 .
Основную массу никеля получают из гарниерита и магнитного колчедана.
Силикатную руду восстанавливают угольной пылью во вращающихся трубчатых печах до железо-никелевых окатышей (5—8% Ni), которые затем очищают от серы, прокаливают и обрабатывают раствором аммиака. После подкисления раствора из него электролитически получают металл.
Карбонильный способ (метод Монда): Вначале из сульфидной руды получают медно-никелевый штейн, над которым пропускают СО под высоким давлением. Образуется легколетучий тетракарбонилникель [Ni(CO)4], термическим разложением которого выделяют особо чистый металл.
Алюминотермический способ восстановления никеля из оксидной руды: 3NiO + 2Al = 3Ni +Al2O3
ПРОИСХОЖДЕНИЕ

Месторождения сульфидных медно-никелевых руд связаны с лополитоподобными или плитообразными массивами расслоенных габброидов, приуроченных к зонам глубинных разломов на древних щитах и платформах. Характерной особенностью медно-никелевых месторождений всего мира является выдержанный минеральный состав руд: пирротин, пентландит, халькопирит, магнетит; кроме них в рудах встречаются пирит, кубанит, полидимит, никелин, миллерит, виоларит, минералы группы платины, изредка хромит, арсениды никеля и кобальта, галенит, сфалерит, борнит, макинавит, валлерит, графит, самородное золото.
Экзогенные месторождения силикатных никелевых руд повсеместно связаны с тем или иным типом коры выветривания серпентенитов. при выветривании происходит стадийное разложение минералов, а также перенос подвижных элементов, с помощью воды из верхних частей коры в нижние. Там эти элементы выпадают в осадок в виде вторичных минералов.
В месторождениях этого типа заключены запасы никеля в 3 раза превышающие его запасы в сульфидных рудах, а запасы некоторых месторождений достигают 1 млн т. и более никеля. Крупные запасы силикатных руд сосредоточены на Новой Каледонии, Филиппинах, Индонезии, Австралии и др. странах. Среднее содержание в них никеля равно 1.1-2%. Кроме того в рудах часто содержится кобальт.
ПРИМЕНЕНИЕ
Подавляющая часть никеля используется для получения сплавов с другими металлами (fe, cr, cu и др.), отличающихся высокими механическими, антикоррозионными, магнитными или электрическими и термоэлектрическими свойствами. В связи с развитием реактивной техники и созданием газотурбинных установок особенно важны жаропрочные и жаростойкие хромоникелевые сплавы. Сплавы никеля используются в конструкциях атомных реакторов.
Значительное количество никеля расходуется для производства щелочных аккумуляторов и антикоррозионных покрытий. Ковкий никель в чистом виде применяют для изготовления листов, труб и т.д. Он используется также в химической промышленности для изготовления специальной химической аппаратуры и как катализатор многих химических процессов. Никель — весьма дефицитный металл и по возможности должен заменяться другими, более дешёвыми и распространёнными материалами.

Никель — элемент десятой (по устаревшей короткопериодной форме — восьмой) группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 28. Обозначается символом Ni (лат. Niccolum ). Простое вещество никель — это пластичный, ковкий, переходный металл серебристо-белого цвета, при обычных температурах на воздухе покрывается тонкой плёнкой оксида. Химически малоактивен.

Серебристо-белый металл

Содержание
- 1 Происхождение названия
- 2 История
- 3 Физические свойства
- 4 Химические свойства
- 5 Нахождение в природе
- 5.1 Месторождения никелевых руд
- 5.2 Природные изотопы никеля
- 7.1 Сплавы
- 7.2 Никелирование
- 7.3 Производство аккумуляторов
- 7.4 Химическая технология
- 7.5 Радиационные технологии
- 7.6 Медицина
- 7.7 Монетное дело
- 7.8 Музыкальная промышленность
- 7.9 Цены на никель
Происхождение названия
Элемент получил своё название от имени злого духа гор немецкой мифологии, который подбрасывал искателям меди минерал мышьяково-никелевый блеск, похожий на медную руду (ср. нем. Nickel — озорник); при выплавлении руд никеля выделялись мышьяковые газы, из-за чего ему и приписали дурную славу.
История
Физические свойства
Никель — серебристо-белый металл, не тускнеет на воздухе. Имеет гранецентрированную кубическую решетку с периодом a = 0,35238 нм, пространственная группа Fm3m. В чистом виде весьма пластичен и поддается обработке давлением. Является ферромагнетиком с точкой Кюри 358 °C.
- Удельное электрическое сопротивление 0,0684 мкОм∙м.
- Коэффициент линейного теплового расширения α=13,5∙10 −6 K −1 при 0 °C
- Коэффициент объёмного теплового расширения β=38—39∙10 −6 K −1
- Модуль упругости 196—210 ГПа.
Химические свойства
![никель хлористый]()
Атомы никеля имеют внешнюю электронную конфигурацию 3d 8 4s 2 . Наиболее устойчивым для никеля является состояние окисления Ni(II).
Никель образует соединения со степенью окисления +1, +2, +3 и +4. При этом соединения никеля со степенью окисления +4 редкие и неустойчивые. Оксид никеля Ni2O3 является сильным окислителем.
Никель характеризуется высокой коррозионной стойкостью — устойчив на воздухе, в воде, в щелочах, в ряде кислот. Химическая стойкость обусловлена его склонностью к пассивированию — образованию на его поверхности плотной оксидной плёнки, обладающей защитным действием. Никель активно растворяется в разбавленной азотной кислоте:
и в горячей концентрированной серной:
С соляной и с разбавленной серной кислотами реакция протекает медленно. Концентрированная азотная кислота пассивирует никель, однако при нагревании реакция всё же протекает (основной продукт восстановления азота — NO2).
С оксидом углерода CO никель легко образует летучий и очень ядовитый карбонил Ni(CO)4.
Тонкодисперсный порошок никеля пирофорный (самовоспламеняется на воздухе).
Никель горит только в виде порошка. Образует два оксида NiO и Ni2O3 и соответственно два гидроксида Ni(OH)2 и Ni(OH)3. Важнейшие растворимые соли никеля — ацетат, хлорид, нитрат и сульфат. Водные растворы солей окрашены обычно в зелёный цвет, а безводные соли — жёлтые или коричнево-жёлтые. К нерастворимым солям относятся оксалат и фосфат (зелёные), три сульфида: NiS (черный), Ni3S2 (желтовато-бронзовый) и Ni3S4 (серебристо-белый). Никель также образует многочисленные координационные и комплексные соединения. Например, диметилглиоксимат никеля Ni(C4H6N2O2)2, дающий чёткую красную окраску в кислой среде, широко используется в качественном анализе для обнаружения никеля.
![никель сернокислый]()
![никель сернокислый на паллетах]()
Водные растворы солей никеля(II) содержат ион гексаакваникеля(II) [Ni(H2O)6] 2+ . При добавлении к раствору, содержащему эти ионы, аммиачного раствора происходит осаждение гидроксида никеля (II), зелёного желатинообразного вещества. Этот осадок растворяется при добавлении избыточного количества аммиака вследствие образования ионов гексааминникеля(II) [Ni(NH3)6] 2+ .
Никель образует комплексы с тетраэдрической и с плоской квадратной структурой. Например, комплекс тетрахлороникелат (II) [NiCl4] 2− имеет тетраэдрическую структуру, а комплекс тетрацианоникелат(II) [Ni(CN)4] 2− имеет плоскую квадратную структуру.
В качественном и количественном анализе для обнаружения ионов никеля (II) используется щелочной раствор бутандиондиоксима, известного также под названиями диметилглиоксим и реактив Чугаева. То, что это вещество является реактивом на никель, установил в 1905 году Л. А. Чугаев. При его взаимодействии с ионами никеля (II) образуется красное координационное соединение бис(бутандиондиоксимато)никель(II). Это — хелатное соединение, и бутандиондиоксимато-лиганд является бидентатным.
Нахождение в природе
Никель довольно распространён в природе — его содержание в земной коре составляет ок. 0,01 %(масс.). В земной коре встречается только в связанном виде, в железных метеоритах содержится самородный никель (от 5 до 25 %). Содержание его в ультраосновных породах примерно в 200 раз выше, чем в кислых (1,2 кг/т и 8г/т). В ультраосновных породах преобладающее количество никеля связано с оливинами, содержащими 0,13—0,41 % Ni. Он изоморфно замещает железо и магний. Небольшая часть никеля присутствует в виде сульфидов. Никель проявляет сидерофильные и халькофильные свойства. При повышенном содержании в магме серы возникают сульфиды никеля вместе с медью, кобальтом, железом и платиноидами. В гидротермальном процессе совместно с кобальтом, мышьяком и серой и иногда с висмутом, ураном и серебром, никель образует повышенные концентрации в виде арсенидов и сульфидов никеля. Никель обычно содержится в сульфидных и мышьяк-содержащих медно-никелевых рудах.
- никелин (красный никелевый колчедан, купферникель) NiAs
- хлоантит (белый никелевый колчедан) (Ni, Co, Fe)As2
- гарниерит (Mg, Ni)6(Si4O11)(OH)6·H2O и другие силикаты
- магнитный колчедан (Fe, Ni, Cu)S
- мышьяково-никелевый блеск (герсдорфит) NiAsS,
- пентландит (Fe,Ni)9S8
Месторождения никелевых руд
Основные месторождения никелевых руд находятся в Канаде, России (Мурманская область, Норильский район, Урал, Воронежская область), Кубе, ЮАР, Албании, Греции, а также на Новой Каледонии и Украине.
Природные изотопы никеля
Природный никель содержит 5 стабильных изотопов: 58 Ni (68,27 %), 60 Ni (26,10 %), 61 Ni (1,13 %), 62 Ni (3,59 %), 64 Ni (0,91 %). Существуют также искусственно созданные изотопы никеля, самые стабильные из которых — 59 Ni (период полураспада 100 тысяч лет), 63 Ni (100 лет) и 56 Ni (6 суток).
Получение
Тугоплавкие магнезиальные руды, как правило, подвергают электроплавке на ферроникель (5—50 % Ni+Co, в зависимости от состава сырья и технологических особенностей).
Наиболее железистые — латеритовые руды перерабатывают гидрометаллургическими методами с применением аммиачно-карбонатного выщелачивания или сернокислотного автоклавного выщелачивания. В зависимости от состава сырья и применяемых технологических схем конечными продуктами этих технологий являются: закись никеля (76-90 % Ni), синтер (89 % Ni), сульфидные концентраты различного состава, а также металлические никель электролитный, никелевые порошки и кобальт.
Менее железистые — нонтронитовые руды плавят на штейн. На предприятиях, работающих по полному циклу, дальнейшая схема переработки включает конвертирование, обжиг файнштейна, электроплавку закиси никеля с получением металлического никеля. Попутно извлекаемый кобальт выпускают в виде металла и/или солей. Ещё один источник никеля: в золе углей Южного Уэльса в Англии — до 78 кг никеля на тонну. Повышенное содержание никеля в некоторых каменных углях, пефтях, сланцах говорит о возможности концентрации никеля ископаемым органическим веществом. Причины этого явления пока не выяснены.
Основную массу никеля получают из гарниерита и магнитного колчедана.
- Силикатную руду восстанавливают угольной пылью во вращающихся трубчатых печах до железо-никелевых окатышей (5—8 % Ni), которые затем очищают от серы, прокаливают и обрабатывают раствором аммиака. После подкисления раствора из него электролитически получают металл.
- Карбонильный способ (метод Монда). Вначале из сульфидной руды получают медно-никелевый штейн, над которым пропускают СО под высоким давлением. Образуется легколетучий тетракарбонилникель [Ni(CO)4], термическим разложением которого выделяют особо чистый металл.
- Алюминотермический способ восстановления никеля из оксидной руды: 3NiO + 2Al = 3Ni +Al2O3
![никель слитки]()
Применение
В 2015 году 67 % потребления никеля пришлось на производство нержавеющей стали, 17 % на сплавы без железа, 7 % на никелирование и 9 % на прочие применения, такие как аккумуляторы, порошковая металлургия и химические реактивы.
Сплавы
Никель является основой большинства суперсплавов — жаропрочных материалов, применяемых в аэрокосмической промышленности для деталей силовых установок.
- монель-металл (65—67 % Ni + 30—32 % Cu + 1 % Mn), жаростойкий до 500 °C, очень коррозионно-устойчив;
- белое золото (например, 585 пробы содержит 58,5 % золота и сплав (лигатуру) из серебра и никеля (или палладия));
- нихром, сплав никеля и хрома (60 % Ni + 40 % Cr);
- пермаллой (76 % Ni + 17 %Fe + 5 % Cu + 2 % Cr), обладает высокой магнитной восприимчивостью при очень малых потерях на гистерезис;
- инвар (65 % Fe + 35 % Ni), почти не удлиняется при нагревании;
- Кроме того, к сплавам никеля относятся никелевые и хромоникелевые стали, нейзильбер и различные сплавы сопротивления типа константана, никелина и манганина.
- Никель присутствует в качестве компонента ряда нержавеющих сталей.
Никелирование
Никелирование — создание никелевого покрытия на поверхности другого металла с целью предохранения его от коррозии. Проводится гальваническим способом с использованием электролитов, содержащих сульфат никеля(II), хлорид натрия, гидроксид бора, поверхностно-активные и глянцующие вещества, и растворимых никелевых анодов. Толщина получаемого никелевого слоя составляет 12—36 мкм. Устойчивость блеска поверхности может быть обеспечена последующим хромированием (толщина слоя хрома — 0,3 мкм).
Бестоковое никелирование проводится в растворе смеси хлорида никеля(II) и гипофосфита натрия в присутствии цитрата натрия:
Процесс проводят при рН 4—6 и 95 °C.
Производство аккумуляторов
Производство железо-никелевых, никель-кадмиевых, никель-цинковых, никель-водородных аккумуляторов.
Химическая технология
Во многих химико-технологических процессах в качестве катализатора используется никель Ренея.
Радиационные технологии
Нуклид 63 Ni, излучающий β - -частицы, имеет период полураспада 100,1 года и применяется в крайтронах, а также детекторах электронного захвата (ЭЗД) в газовой хроматографии.
Медицина
- Применяется при изготовлении брекет-систем (никелид титана).
- Протезирование.
Монетное дело
Музыкальная промышленность
Также никель используется для производства обмотки струн музыкальных инструментов.
Цены на никель
В течение 2012 года цены на никель колебались в пределах от $15 500 до $17 600 за тонну.
Биологическая роль
Никель относится к числу микроэлементов, необходимых для нормального развития живых организмов. Однако о его роли в живых организмах известно немного. Известно, что никель принимает участие в ферментативных реакциях у животных и растений. В организме животных он накапливается в ороговевших тканях, особенно в перьях. Повышенное содержание никеля в почвах приводят к эндемическим заболеваниям — у растений появляются уродливые формы, у животных — заболевания глаз, связанные с накоплением никеля в роговице. Токсическая доза (для крыс) — 50 мг. Особенно вредны летучие соединения никеля, в частности, его тетракарбонил Ni(CO)4. ПДК соединений никеля в воздухе составляет от 0,0002 до 0,001 мг/м 3 (для различных соединений).
Физиологическое действие
Никель и его соединения токсичны и канцерогены.
В XX веке было установлено, что поджелудочная железа очень богата никелем. При введении вслед за инсулином никеля продлевается действие инсулина и тем самым повышается гипогликемическая активность. Никель оказывает влияние на ферментативные процессы, окисление аскорбиновой кислоты, ускоряет переход сульфгидрильных групп в дисульфидные. Никель может угнетать действие адреналина и снижать артериальное давление. Избыточное поступление никеля в организм вызывает витилиго. Депонируется никель в поджелудочной и околощитовидной железах.
Читайте также:





