Нарушения обмена нуклеотидов реферат
Обновлено: 02.07.2024
Нуклеотиды присутствуют во всех без исключения живых клетках, выполняя целый ряд ключевых функций. В их числе построение нуклеиновых кислот из рибозо и дезоксирибозонуклеозидмонофосфатных звеньев(рнк и днк соответственно); перенос энергии (АТР); образование коферментов(АМР), участие в роли акцепторов в окислительном фосфорилировании (АDP), а также в качестве аллосторических регуляторов активности ряда ферментов и вторичных посредников.
Прикрепленные файлы: 1 файл
ФГАОУ ВПО.docx
Гетероциклические основания (пурины и пиримидины) являются исходными структурными элементами молекул нуклеозидов и нуклеотидов.
Нуклеотиды присутствуют во всех без исключения живых клетках, выполняя целый ряд ключевых функций. В их числе построение нуклеиновых кислот из рибозо и дезоксирибозонуклеозидмонофосф атных звеньев(рнк и днк соответственно); перенос энергии (АТР); образование коферментов(АМР), участие в роли акцепторов в окислительном фосфорилировании (АDP), а также в качестве аллосторических регуляторов активности ряда ферментов и вторичных посредников.
Синтетические аналоги пуриновых и пиримидиновых оснований, нуклеозидов и нуклеотидов широко применяются в научных исследованиях и клинической медицине. Их использование основано на роли нуклеотидов как компонентов нуклеиновых кислот, определяющие такие жизненно важные функции клетки, как ее рост и деление. Для деления необходим этап репликации ДНК. Это означает, что предшественники нуклеиновых кислот – нормальные пуриновые и пиримидиновые дезоксирибонуклеотиды - должны быть легко доступны.
2. Нуклеиновые кислоты
В состав нуклеиновых кислот входят азотистые основания двух типов: пуриновые - аденин (А), гуанин (G) и пиримидиновые - цитозин (С), тимин (Т) и урацил (U).
Пурин— органическое азотсодержащее соединение. Производные Пурина широко распространены в природе и играют важную роль в различных биологических процессах. Ядро Пурина входит в состав многих алкалоидов, витаминов, антибиотиков, нуклеотидов. Формула пурина:
Пиримидин (C4N2H4, м-диазин, миазин) — гетероциклическое соединение, имеющее плоскую молекулу, простейший представитель 1,3-диазинов. Бесцветные кристаллы с характерным запахом. Пиримидин проявляет свойства слабого двукислотного основания, так как атомы азота могут присоединять протоны за счет донорно-акцепторной связи, приобретая при этом положительный заряд.
Реакционная способность в реакциях электрофильного замещения у пиримидина снижена из-за снижения электронной плотности в положениях 2,4,6, вызванного наличием двух атомов азота в цикле. Так, пиримидин не нитруется и не сульфируется, однако в виде соли бромируется в положение 5. Пиримидин получают восстановлением галогенизированых пиримидиновых производных. Или из 2,4,6-трихлор пиримидина, получаемого обработкой барбитуровой кислоты хлороксидом фосфора. Производные пиримидина широко распространены в живой природе, где участвуют во многих важных биологических процессах. В частности, такие производные как цитозин, тимин,урацил вход ят в состав нуклеотидов, являющихся структурными единицами нуклеиновых кислот, пиримидиновое ядро входит в состав некоторых витаминов группы B, в частности B1, коферментов и антибиотиков.
3. Обмен пурина и пиримидина
Обмен пуринов и пиримидинов в организме состоит из трех основных путей – синтеза, катаболизма и взаимопревращений нуклеозидов и нуклеотидов.
Синтез. Центральными промежуточными продуктами биосинтеза, предшественников нуклеиновых кислот, являются мононуклеотид уридинмонофосат для пиримидинового ряда и инозинмонофосфат основание: гипоксантин для пуринов. Путь синтеза различен для пиримидиновых и пуриновых оснований. В первом случае строится, прежде всего, пиримидиновое кольцо и затем к нуклеотиду присоединяется рибозо-5'-фосфат. Синтез пуриновых нуклеотидов, напротив, начинается с рибозо-5'-фосфата и исходя из него шаг за шагом формируется кольцо. Непосредственными предшественниками в синтезе пиримидинового кольца являются карбамоилфосфат, который образуется из глутамина и НСО3 и аспартат. После образования N-карбамоиласпартата происходит замыкание кольца с образованием дигидрооротата. У млекопитающих стадии от 1а до 1в проходят в цитоплазме и катализируются одним полифункциональным ферментом. На следующей стадии дигидрооротат окисляется флавинмо-нонуклеотидзависимой дегидрогеназой в оротат, который связывается с фосфорибозилдифосфатом с образованием нуклеотида оротидин-5'-монофосфата декарбоксилирование которого приводит к уридин-5'-монофосфату. Пуриновый биосинтез начинается с фосфорибозилдифосфата. Сначала присоединяется аминогруппа, которая впоследствии в кольце становится N-9. Глицин и формильная группа N10-формилтетрагидрофолата поставляют недостающие атомы пятичленного кольца. Прежде чем это кольцо замкнется, присоединяются атомы N-3 и N-6 шестичленного кольца. Затем построение кольца продолжается путем присоединения N-1 и С-2. На последней стадии шестичленное кольцо замыкается с образованием инозин-5'-монофосфата, который, однако, не накапливается, а быстро превращается в АМФ и ГМФ.
Катаболизм. Катаболизм пиримидиновых оснований.
Возможны несколько вариантов катаболизма. Разберем более простой вариант.
Аминогруппа может отщепляться, когда азотистое основание еще находится в составе нуклеозида, мононуклеотида и даже в составе нуклеиновой кислоты. Но поскольку в организме урацил не входит в состав ДНК, то дезаминирование цитозина и превращение его в урацил воспринимается клеткой как ошибка и исправляется.
Бета-аланин обычно разрушается до CO2, H2O и NH3, но частично может использоваться для синтеза пептидов карнозина и ансерина в мышечной ткани и для синтеза КоА. Конечным продуктов распада пиримидиновых азотистых оснований можно считать и мочевину, которая образуется из аммиака по известному механизму, изложенному в лекциях по обмену белков. Тимин распадается подобно урацилу, но вместо бета-аланина образуется бета-аминоизобутират (альфа-метил-бета-аланин).
Бета-аминоизобутират выводится из организма и определение его количества в моче может использоваться для оценки катаболизма ДНК.
Катаболизм пуриновых оснований.
Распад начинается с отщепления аминогруппы (ее отщепление также возможно в составе ДНК). Такой путь распада характерен для человека. Мочевая кислота образуется еще у обезьян, ящериц, змей и долматской собаки. При наследственном дефиците фермента аденозиндезаминазы наблюдается синдром врожденного иммунодефицита.Мочевая кислота выводится из организма с мочой - это обычный ее компонент, но в почках организма человека происходит ее интенсивная реабсорбция и концентрация мочевой кислоты в крови поддерживается на постоянном уровне 0.12-0.30 ммоль/л.
Взаимопревращения нуклеозидов и нуклеотидов.
Этапы взаимопревращений экзогенных пуриновых и пиримидиновых производных:
азотистое основание превращается обратимо в нуклеозид, который превращается обратимо в нуклеотид (моно превращается обратимо в ди и затем превращается обратимо в трифосфат).
4. Нарушения обмена, наследственные заболевания
Пуриновые и пиримидиновые основания являются фрагментами нуклеиновых кислот, участвуют в кодировании и передаче наследственной информации. Производные пуринов и пиримидинов входят в состав многих биологически активных веществ – алкалоидов, коферментов, витамина B1 и др.
Наследственные дефекты обмена пуринов и пиримидинов встречаются редко и обусловлены врожденной недостаточностью ферментов. При патологии обмена нуклеотидов в первые же месяцы жизни у ребенка отмечается задержка развития двигательных навыков, а также непроизвольные движения мышц, повышенный тонус мышц стоп, спазмы конечностей; болезнь сопровождается олигофренией.
К типу наследственных болезней пуринового и пиримидинового обмена прежде всего следует отнести подагру. В распространении подагры имеют большое значение социальные факторы, неполноценное питание, частое употребление алкоголя и курение.
Подагра - заболевание, связанное с нарушением пуринового обмена, характеризующееся повышением содержания мочевой кислоты в крови (гиперурикемией) и отложением уратов в суставных или околосуставных тканях. Частота:1/1000 населения. Большинство больных(80-90%)-среднего или старшего возраста с предшествующей в течение 20-30 лет асимптоматичсекой гиперурикемией. Чаще болеют мужчины(20:1).Преобладающий возраст-45 лет.
Синдром Леша – Найхана - обусловлен недостаточностью фермента гипоксантинфосфорибозилтрансфе разы (ГФРТ), который регулирует скорость присоединения свободных пуриновых оснований к нуклеотидам.
При недостаточности фермента ГФРТ конечным продуктом превращения пуриновых оснований является мочевая кислота. Высокое содержание мочевой кислоты и ее солей, несмотря на усиленное выделение их с мочой, приводит к формированию камней в мочевыводящих путях, отложению солей мочевой кислоты в суставах.
В первые же месяцы жизни отмечается задержка развития двигательных навыков, а также непроизвольные движения мышц, повышение сегментарных рефлексов, быстро следующие одно за другим сокращения мышц или групп мышц стоп, спазмы конечностей.
Болезнь сопровождается олигофренией, склонностью ребенка к самоповреждениям.
Встречается достаточно редко, лишь 1 случай на 300 тыс. рождений. Тип наследования Х-сцепленный рецессивный.
Наследственные дефекты обмена пуринов и пиримидинов встречаются редко и обусловлена врожденной недостаточностью ферментов. Лечение заболеваний должно основываться на синтетических аналогах природных нуклеотидов, способные замещать их в структуре нуклеиновых кислот и оказывать ингибирующее действие на синтез рнк и днк.
Таким образом, пиримидиновые и пуриновые основания входят в состав нуклеиновых кислот, играющие чрезвычайно важную роль в жизнедеятельности организма.
Гетероциклические азотистые основания – пурины и пиримидины - являются исходными структурными элементами молекул нуклеозидов и нуклеотидов. Нуклеотиды принимают участие во множестве биохимических процессов. Наиболее известна роль пуриновых и пиримидиновых нуклеотидов в качестве мономеров-предшественников при биосинтезе РНК и ДНК. Рибонуклеотиды выполняют в организме целый ряд важных функций: являются универсальными источниками энергии (например, АТФ), регуляторными сигналами, входят в состав коферментов (ФАД, НАД, НАДФ), служат переносчиками метильных групп (S-аденозилметионин), являются макроэргическими посредниками в углеводном обмене и в синтезе липидов. Обмен пуринов и пиримидинов в организме состоит из трех основных путей – синтеза, катаболизма и взаимопревращений нуклеозидов и нуклеотидов. Генетически обусловленные дефекты ферментов, принимающих участие в этих процессах, могут приводить к развитию заболеваний.
Наследственные нарушения обмена пуринов и пиримидинов - группа генетически обусловленных нарушений метаболизма, до сих пор мало изучавшаяся в Российской Федерации, несмотря на то, что некоторые заболевания поддаются лечению. Во многом причиной тому служили трудности биохимической лабораторной диагностики этих заболеваний. С внедрением в клиническую практику метода высокоэффективной жидкостной хроматографии-хроматомасс-спектрометрии (ВЭЖХ-МС) стала возможной диагностика большинства наследственных нарушений обмена.
Клиническая симптоматика наследственной патологии пуринового и пиримидинового обмена широко варьирует по степени тяжести даже среди родственников из одной семьи. Наиболее часто при данном нарушении метаболизма страдают центральная нервная система, почки и система крови (Simmonds H.A. et al., 1997). Основным биохимическим признаком этих заболеваний является изменение содержания пуриновых и пиримидиновых азотистых оснований, нуклеозидов и их производных в биологических жидкостях (Hartmann S. etal., 2006) и в лизатах клеток.

Нуклеотиды являются вездесущими компонентами жизни, участвуя в большинстве биохимических реакций. АТФ является энергетической валютой клетки, производные аденина служат коферментами, циклические нуклеотиды цAMФ и цГМФ играют роль вторичных мессенджеров. Наконец, нуклеотиды — это мономерные звенья РНК и ДНК.
Пути биосинтеза нуклеотидов служат мишенью для противоопухолевых и некоторых антибактериальных препаратов, а нарушения в путях их катаболизма ловят ступни в капкан.
Строение нуклеотидов
Нуклеотиды состоят из трех компонентов: азотистого основания, пентозы и фосфата. Нуклеотид без фосфата называется нуклеозидом. Азотистые основания — это производные пурина и пиримидина (рис. 1).
Рисунок 1. | Главные азотистые основания. Некоторые названия отражают историю открытия этих соединений. Гуанин был выделен из перуанского гуано (птичьего помета), тимин — из тимуса быка, аденин — из поджелудочной железы. Урацил получил свое название от мочевой кислоты, из которой его пытались синтезировать. Б. Структурная формула нуклеотидов. В дезоксирибонуклеотидах OH-группа при 2’-углероде замещена на H.
Биосинтез пуринов
Синтез пуринов de novo сложен и энергозатратен, поэтому в физиологических условиях пул пуринов поддерживается в основном за счет путей их реутилизации (исключение составляют быстроделящиеся клетки). Всасывание нуклеотидов из пищи мало, так как почти все остатки нуклеиновых кислот катаболизируются эпителием тонкой кишки.
Аденин и гуанин образуются из общего предшественника — инозината (IMP). Пуриновое ядро постепенно собирается на остатке 5-Фосфорибозил-1-пирофосфата (PRPP). Все четыре атома азота происходят из аминокислот: два из глутамина, один из аспартата и один из глицина (рис. 2–4).
Рисунок 2. | Синтез пуриновых нуклеотидов de novo: часть 1, образование пуринового кольца инозината. После стадии ③ R обозначает 5-фосфо-D-рибозильную группу. Снизу изображено происхождение атомов пуринового кольца.
Зависимость синтеза пуринов от фолатов на стадиях 3 и 9 означает, что ингибиторы метаболизма фолиевой кислоты являются непрямыми ингибиторами синтеза пуринов, а значит, и ингибиторами деления клетки.
Рисунок 3. | Биосинтез AMP и GMP из IMP.
Регуляция этого пути сложна и мало изучена. Известно, что AMP, GMP и IMP ингибируют его по механизму отрицательной обратной связи. В недавних исследованиях [1] было показано, что шесть ферментов биосинтеза пуринов собираются в пуриносому, являющую собой новый уровень организации ферментов.
Рисунок 4. | Обзорная схема синтеза пуриновых нуклеотидов.
Реутилизация пуринов
Свободные пуриновые основания постоянно высвобождаются в клетке в процессе катаболизма нуклеотидов, и их большая часть повторно используется для синтеза нуклеотидов в более простом пути, нежели синтез de novo.
Один из таких путей настолько прост, что состоит из одной реакции, катализируемой аденозинфосфорибозилтрансферазой: Аденин + PRPP → AMP + PPi
Свободный гуанин и гипоксантин реутилизируются в похожем пути под действием гипоксантин-гуанин-фосфорибозилтрансферазы. Мутация гена вышеназванного фермента вызывает синдром Лёша — Нихена. Это сцепленное с мужским полом заболевание, манифестирующее в раннем возрасте и характеризующееся деформирующим артритом и неврологическими нарушениями. Мальчики с синдромом Лёша — Нихена плохо ориентируются в пространстве, очень враждебны и склонны к саморазрушению вплоть до откусывания себе пальцев.
Биосинтез пиримидинов
Если при синтезе пуриновых нуклеотидов азотистое основание кусочек за кусочком собирается на остатке рибозилфосфата, то при синтезе пиримидинов к рибозе оно присоединяется уже в готовом виде (рис. 5).
Рисунок 5. | Синтез пиримидиновых нуклеотидов. Стадия 1: Синтез карбамоилфосфата. 2: Конденсация аспартата и карбамоилфосфата с образованием N-карбамоиласпартата. 3: Внутримолекулярная конденсация, катализируемая дигидрооротазой с образованием шестичленного гетероцикла (дигидрооротата). 4: Окисление дигидрооротата до оротата. 5: присоединение к оротату рибозо-5-фосфата (PRPP). 6: Декарбоксилирование оротодилата до уридилата. Ферменты 5 и 6 стадий образуют комплекс и называются УМФ-синтазой.
Источник: Campbell M. K., Farell S. O. Biochemistry
Мутации гена UMPS, кодирующего УМФ-синтазу вызывают оротацидурию — редкое (описано лишь 20 случаев) аутосомно-рецессивное заболевание, проявляющееся тяжелой мегалобластной анемией, задержкой развития вследствие дефицита пиримидиновых нуклеотидов и повышенным содержанием оротовой кислоты в моче.
Нуклеозидмонофосфаты превращаются в нуклеозидтрифосфаты под действием нуклеозидмонофосфаткиназ и нуклеозиддифосфаткиназ. Последние необычны тем, что являются неспецифичными ни по основанию, ни по пентозе.
Цитидилатсинтетаза образует цитидилат из UTP.
Прежде чем описать синтез тимидилата, необходимо упомянуть об образовании дезоксирибонуклеотидов, так как его синтез de novo возможен только из дезоксирибонуклеотидного предшественника.
Образование дезоксирибонуклеотидов
Строительные блоки ДНК образуются из соответствующих рибонуклеотидов непосредственным восстановлением 2’-углеродного атома рибозы с образованием 2’-дезоксипроизводного. Реакция катализируется рибонуклеотидредуктазой, ее субстраты — нуклеозиддифосфаты, в ней также участвуют тиоредоксин и тиоредоксинредуктаза.
Рисунок 6. | Восстановление рибонуклеотидов до дезоксирибунклеотидов.
Регуляция рибонуклеотидредуктазы весьма необычна и служит для поддержания баланса четырех нуклеотидов, необходимых для синтеза ДНК. Каждая субъединица имеет 2 типа регуляторных центров: один центр регулирует активность (ATP +, dATP-), второй влияет на субстратную специфичность. Например, если со вторым центром связывается ATP или dATP, фермент начинает отдавать предпочтение восстановлению UDP или CDP, а когда UTP и СTP становится слишком много, возвращается к ADP. ATP выступает главным стимулятором восстановления всех рибонуклеотидов, а dATP в больших концентрациях выключает фермент.
Биосинтез тимидилата
Непосредственный предшественник тимидилата — dUMP. Превращение катализируется тимидилатсинтазой и сопряжено с окислением метилентетрагидрофолата до дигидрофолата (рис. 7).
Рисунок 7. | Синтез тимидилата.
Источник: Campbell M. K., Farell S. O. Biochemistry
Синтез тимидилата является мишенью некоторых противоопухолевых препаратов. Так, в химиотерапии используется ингибитор тимидилатсинтазы — фторурацил (вернее, его метаболит FdUMP), ингибитор дигидрофолатредуктазы — аминоптерин и структурный аналог фолата — метотрексат. Потребность раковых клеток в нуклеотидах гораздо выше, чем у нормальных клеток, поэтому они более чувствительны к ингибиторам биосинтеза тимидилата.
Катаболизм нуклеотидов
Катаболизм пиримидинов
С помощью нуклеотидазы и фосфорилазы от пиримидиновых нуклеотидов отщепляются фосфаты и рибоза, а оставшиеся свободные азотистые основания подвергаются дезаминированию и гидрированию (рис. 8).
Рисунок 8. | Катаболизм пиримидинов. Источник: Campbell M. K., Farell S. O. Biochemistry
Пути распада пиримидинов ведут главным образом к NH4+ и далее к мочевине.
Катаболизм пуринов
Пуриновые нуклеотиды теряют свои фосфаты под действием 5’-нуклеотидазы.
Аденилат превращается в аденозин, который дезаминируется аденозиндезаминазой (ADA) с образованием инозина, который гидролизуется нуклеозидазой до гипоксантина и рибозы. Ксантиноксидаза окисляет гипоксантин до ксантина и затем до мочевой кислоты. (рис. 9)
Рисунок 9. | Катаболизм пуриновых нуклеотидов. Общий метаболит катаболизма пуринов — ксантин. Превращение ксантина в мочевую кислоту катализирует ксантиноксидаза. В правом верхнем углу изображена аденозиндезаминаза (ADA)
У большинства млекопитающих мочевая кислота окисляется до более растворимого соединения — аллантоина, однако у человека, далматинов, приматов и птиц она является конечным экскретируемым продуктом катаболизма пуринов, и здесь время поговорить о подагре.
Заболевания, связанные с катаболизмом пуринов
1. Гиперурикемия и подагра.
Повышенное содержание мочевой кислоты в крови называется гиперурикемией (> 360 мкмоль/л для женщин и > 400 мкмоль/л для мужчин). У этого состояния может быть множество причин: дефект генов, отвечающих за экскрецию уратов почками и кишечником, богатая пуринами и/или фруктозой диета, низкоуглеводная диета, голодание, синдром лизиса опухоли, прием препаратов (диуретиков, аспирина, никотиновой кислоты и др.), синдром Лёша-Нихена, большие дозы алкоголя и другие, но всех их можно поделить на два типа: гиперпродукция уратов и снижение их экскреции. Гиперурикемия далеко не всегда сопровождается подагрой, но подагра гиперурикемией — всегда. Подагра — это метаболическое заболевание, характеризующееся отложением кристаллов уратов натрия преимущественно в плюснефаланговых суставах, поражением почек и приступами острого подагрического артрита.
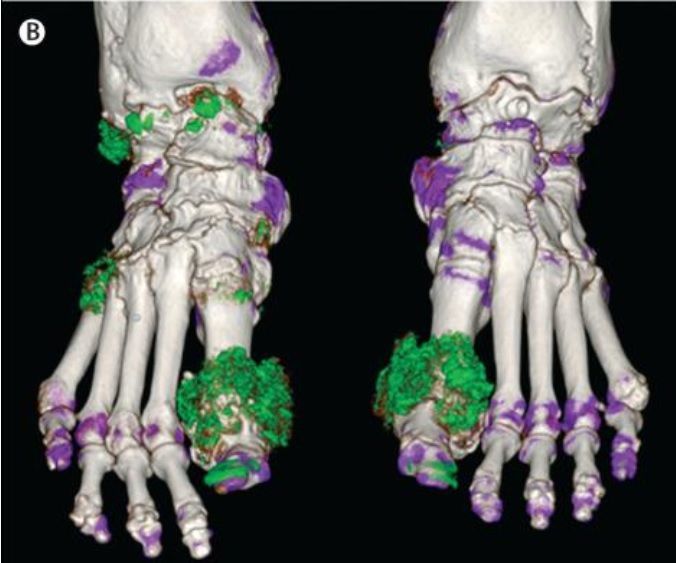
Рисунок 10. | Двухэнергетическая КТ стоп пациента с тофусной подагрой. Депозиты урата показаны зеленым цветом ( на ногтях – артефакт)
Этиология, патогенез и терапия подагры заслуживают отдельной статьи. Здесь я упомяну только о препаратах, влияющих на катаболизм пуриновых нуклеотидов, — ингибиторах ксантиноксидазы (фермента, превращающего ксантин в мочевую кислоту, см. рис. 9). Один из них — аллопуринол, структурный аналог гипоксантина, конкурентный ингибитор ксантиноксидазы. К неконкурентным ингибиторам относится фебуксостат. Оба препарата снижают уровень мочевой кислоты в крови и используются для предотвращения приступов подагры.
2. Дефицит аденозиндезаминазы ведет к одному из типов тяжёлого комбинированного иммунодефицита (SCID, синдром Глянцмана — Риникера, в 30 % случаев вызывается дефицитом ADA), характеризующемуся неспособностью T- и B- лимфоцитов к пролиферации и продукции антител.
Отсутствие аденозиндезаминазы ведет к значительному накоплению dATP, который ингибирует нуклеотидредуктазу, в результате чего возникает дефицит всех дезоксирибонуклеотидов (рис. 11). ADA является Zn-зависимым ферментом, поэтому нарушения в делении лимфоцитов возможны и при дефиците в организме цинка.
Рисунок 11. | Недостаточность аденозиндезаминазы приводит к нарушениям репликации ДНК
Целью данной работы является обобщение информации о метаболизме пуринов и пиримидинов и нарушении их метаболизма.
Изучить литературу по данной теме;
Дать характеристику метаболизма пуриновых и пиримидиновых нуклеотидов;
Рассмотреть нарушения метаболизма и связанные с этим болезни, а также привести способы лечения или компенсации данных заболеваний;
Привести классификацию заболеваний, связанных с нарушением метаболизма пуриновых и пиримидиновых нуклеотидов.
Основная часть
Метаболизм большинства нуклеотидов начинается с синтеза, так как большая часть нуклеотидов (до 90%) синтезируется denovo. Синтез как пуриновых, так и пиримидиновых нуклеотидов начинается с образования 5-фосфорибозил-1-дифосфата (ФРДФ или ФРПФ). Реакция катализируется ферментом ФРДФ-синтетазы. Далее, в синтезе пуриновых оснований следуют несколько реакция с участием Асп, Гли, Глн, СО2 и двух одноуглеродных производных тетрагидрофалата: метенил-H4-фолат и формил-H4-фолат. В результате образуется ИМФ, которая вступает в дальнейшие реакции образования АМФ и ГМФ (рис. 1.1).
Рис. 1.1 Синтез АМФ (АMP) и ГМФ (GMP).
Синтез пиримидиновых оснований же начинается с образования оротовой кислоты (Рис. 1.2). Оротовая кислота, при взаимодействии с ФРПФ и, следующим, декарбоксилированием, образует УМФ (Рис. 1.2)
Рис. 1.2 Синтез оротовой кислоты и УМФ с соответствующими ферментами.
Далее УМФ под действием УМФ-киназы и УДФ-киназы превращается в УТФ, а затем, при помощи ЦТФ-синтазы, в сам ЦТФ.
Таким образом в клетке синтезируются основные НТФ, которые вступают в дальнейшие реакции метаболизма клетки.
Касаемо нарушений метаболизма пуриновых и пиримидиновых нуклеотидов – большинство дефектов связано с системой распада нуклеотидов. Поэтому следующей мы рассмотри именно эту систему.
Распад пуриновых нуклеотидов происходит до конечного продукта, которым является мочевая кислота. Полная схема распада пуриновых нуклеотидов представлена на Рисунке 1.3.
Рис. 1.3 Распад пуриновых нуклеотидов и ферменты, катализирующие данные реакции.
Распад Пиримидиновых нуклеотидов осуществляется до нескольких конченых продуктов, которыми можно считать β-аланин и β-аминоизобутират, которые включаются в дальнейший метаболизм (с образованием ацетил-КоА и пропионил-КоА). Полная схема распада пиримидиновых нуклеотидов представлена на Рисунке 1.4.
Рис. 1.4 Распад пиримидиновых нуклеотидов и ферменты, катализирующие данные реакции.
Читайте также:

