Нарушение генетической программы клетки реферат
Обновлено: 05.07.2024
• Многоклеточный организм состоит из различных типов клеток, которые выполняют специализированные функции
• Многие дифференцированные клетки утратили способность к делению и/или к образованию клеток других типов
• Стволовые клетки способны к делению с образованием различных типов клеток, которые необходимы для построения тканей организма
Когда выше мы давали определение клетки, то в качестве одного из ее свойств мы называли способность к делению с образованием копии себе подобной. Хотя это остается справедливым для клеток одноклеточных организмов, уровень специализации, которого достигли клетки у многоклеточных, требует расширения базовых понятий.
Термин дифференцировка описывает процесс, посредством которого клетка приобретает новый фенотип, или же дает начало предшественникам клеток, которые по фенотипу отличаются от родительской.
Под развитием организма подразумевают процесс, в результате которого исходная клетка (оплодотворенный ооцит в случае млекопитающих) путем последовательных делений превращается в организм, состоящий из клеток различных типов. Оплодотворенная зигота обладает тотипотентностью, т. е. из нее способны образовываться все клетки организма.
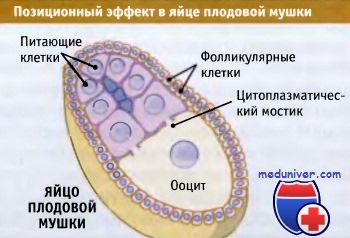
Питающие клетки окружают ооцит и участвуют в переносе веществ,
что создает асимметричность в распределении белков.
Процесс развития можно рассматривать как наложение неких дополнительных ограничений на свойства образующихся клеток. В результате этих ограничений клетки могут развиваться, образуя лишь определенный тип клеток.
Поскольку существуют многоклеточные организмы, состоящие из специализированных тканей, необходимо различать два типа клеток. К соматическим относятся все клетки организма, за исключением герминативных. Соматические клетки предназначены для выполнения в организме определенных функций и не участвуют в процессе воспроизводства организма. У млекопитающих они являются диплоидными клетками (т. е. содержат один материнский и один отцовский набор генетического материала).
Следующее поколение организма формируется при участии специализированных герминативных клеток. Эти клетки существуют для каждого пола отдельно и являются гаплоидными: сперматозоиды и ооциты содержат по одному набору генетического материала.
В период развития и существования взрослого организма некоторые клетки сохраняют способность к воспроизводству любых клеток различных тканей, в то время как другие образуют лишь родственные клетки или не образуют никаких. Клетки, обладающие широкими возможностями к регенерации, называются стволовыми. Например, клетки иммунной системы произошли от иммунных стволовых клеток. Основной вопрос биологии состоит в том, существуют стволовые клетки только при развитии организма или же они сохраняются и в зрелом возрасте.
При развитии ткани происходит серия процессов дифференцировки клеток, при которых они продолжают изменять свой фенотип до тех пор, пока не образуются все необходимые типы. По завершении этого процесса некоторые клетки могут утратить способность к делению и превратиться в терминально дифференцированные. Клетки также могут стареть и умирать. Многие соматические клетки являются терминально дифференцированными. К их числу относятся и половые клетки, хотя они обладают уникальной способностью образовывать зиготу, которая способна к делению.
Терминально дифференцированные клетки могут проявлять настолько необычные свойства, что возникает вопрос, применимо ли к ним определение самого понятия клетка. У млекопитающих дифференцировка эритроцитов приводит к потере ядра. Клетка представляет собой не более чем мембрану, которая внутри содержит раствор гемоглобина и форма которой поддерживается сетью волокон актина и спектрина. Поскольку эритроцит произошел из полностью функциональной клетки, мы рассматриваем его как клетку, хотя и утратившую почти все характерные признаки.
Широко обсуждается вопрос, происходят ли при дифференцировке клеток постоянные изменения их генетической программы или же ограничения на развитие фенотипа носят исключительно эпигенетическую природу? Возможность клонирования организмов при помещении ядра соматической клетки в ооцит дает однозначный ответ на этот вопрос: почти каждая клетка организма сохраняет генетическую информацию, необходимую для поддержания процесса развития. (Исключение составляют клетки с измененным генетическим материалом, например клетки, продуцирующие антитела, или утратившие генетическую информацию (эритроциты).)
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
• Многоклеточный организм состоит из различных типов клеток, которые выполняют специализированные функции
• Многие дифференцированные клетки утратили способность к делению и/или к образованию клеток других типов
• Стволовые клетки способны к делению с образованием различных типов клеток, которые необходимы для построения тканей организма
Когда выше мы давали определение клетки, то в качестве одного из ее свойств мы называли способность к делению с образованием копии себе подобной. Хотя это остается справедливым для клеток одноклеточных организмов, уровень специализации, которого достигли клетки у многоклеточных, требует расширения базовых понятий.
Термин дифференцировка описывает процесс, посредством которого клетка приобретает новый фенотип, или же дает начало предшественникам клеток, которые по фенотипу отличаются от родительской.
Под развитием организма подразумевают процесс, в результате которого исходная клетка (оплодотворенный ооцит в случае млекопитающих) путем последовательных делений превращается в организм, состоящий из клеток различных типов. Оплодотворенная зигота обладает тотипотентностью, т. е. из нее способны образовываться все клетки организма.

Питающие клетки окружают ооцит и участвуют в переносе веществ,
что создает асимметричность в распределении белков.
Процесс развития можно рассматривать как наложение неких дополнительных ограничений на свойства образующихся клеток. В результате этих ограничений клетки могут развиваться, образуя лишь определенный тип клеток.
Поскольку существуют многоклеточные организмы, состоящие из специализированных тканей, необходимо различать два типа клеток. К соматическим относятся все клетки организма, за исключением герминативных. Соматические клетки предназначены для выполнения в организме определенных функций и не участвуют в процессе воспроизводства организма. У млекопитающих они являются диплоидными клетками (т. е. содержат один материнский и один отцовский набор генетического материала).
Следующее поколение организма формируется при участии специализированных герминативных клеток. Эти клетки существуют для каждого пола отдельно и являются гаплоидными: сперматозоиды и ооциты содержат по одному набору генетического материала.
В период развития и существования взрослого организма некоторые клетки сохраняют способность к воспроизводству любых клеток различных тканей, в то время как другие образуют лишь родственные клетки или не образуют никаких. Клетки, обладающие широкими возможностями к регенерации, называются стволовыми. Например, клетки иммунной системы произошли от иммунных стволовых клеток. Основной вопрос биологии состоит в том, существуют стволовые клетки только при развитии организма или же они сохраняются и в зрелом возрасте.
При развитии ткани происходит серия процессов дифференцировки клеток, при которых они продолжают изменять свой фенотип до тех пор, пока не образуются все необходимые типы. По завершении этого процесса некоторые клетки могут утратить способность к делению и превратиться в терминально дифференцированные. Клетки также могут стареть и умирать. Многие соматические клетки являются терминально дифференцированными. К их числу относятся и половые клетки, хотя они обладают уникальной способностью образовывать зиготу, которая способна к делению.
Терминально дифференцированные клетки могут проявлять настолько необычные свойства, что возникает вопрос, применимо ли к ним определение самого понятия клетка. У млекопитающих дифференцировка эритроцитов приводит к потере ядра. Клетка представляет собой не более чем мембрану, которая внутри содержит раствор гемоглобина и форма которой поддерживается сетью волокон актина и спектрина. Поскольку эритроцит произошел из полностью функциональной клетки, мы рассматриваем его как клетку, хотя и утратившую почти все характерные признаки.
Широко обсуждается вопрос, происходят ли при дифференцировке клеток постоянные изменения их генетической программы или же ограничения на развитие фенотипа носят исключительно эпигенетическую природу? Возможность клонирования организмов при помещении ядра соматической клетки в ооцит дает однозначный ответ на этот вопрос: почти каждая клетка организма сохраняет генетическую информацию, необходимую для поддержания процесса развития. (Исключение составляют клетки с измененным генетическим материалом, например клетки, продуцирующие антитела, или утратившие генетическую информацию (эритроциты).)
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

ДНК находится в клетке внутри ядра. Она особым образом организована в виде хромосом – эти нитеподобные структуры можно рассмотреть в микроскоп с достаточно большим увеличением. Внутри хромосомы ДНК намотана на белки – гистоны. Когда гены неактивны, они расположены очень компактно, а во время считывания генетического материала молекула ДНК расплетается.
- 22 пары аутосом одинаковы у мужчин и женщин. В каждой паре хромосомы имеют одинаковую длину и содержат одинаковые наборы генов.
- Одна пара половых хромосом. У женщин это две X-хромосомы. Одна из них неактивна и плотно свернута – ее называют тельцем Барра. У мужчин одна половая хромосома представлена X-хромосомой, а вторая – Y-хромосомой, она меньше по размерам.
Методы исследования хромосом
Для исследования кариотипа применяют специальный метод – световую микроскопию дифференциально окрашенных метафазных хромосом культивированных лимфоцитов периферической крови.
Этот анализ применяется для диагностики различных хромосомных заболеваний. Он позволяет выявлять такие нарушения, как:
- Грубые изменения в кариотипе – изменение количества хромосом. Например, при синдроме Дауна в клетках ребенка присутствует лишняя хромосома №21.
- Присутствие в организме клеток с разными кариотипами. Это явление называется мозаицизмом.
- Хромосомные аберрации – нарушение структуры хромосом, внутрихромосомные и межхромосомные перестройки. Сюда относятся делеции (утрата участка хромосомы), дупликации (удвоение участка хромосомы), инверсии (поворот участка хромосомы на 180 градусов), транслокации (перенос участка одной хромосомы в другую).

Однако с помощью исследования кариотипа можно выявить не все генетические нарушения. Оно не способно обнаружить такие изменения, как:

Для получения дополнительной информации, не видимой в световой микроскоп, используют хромосомный микроматричный анализ (ХМА). С его помощью можно изучить все клинически значимые участки генома и выявить изменения в количестве и структуре хромосом, а именно микрополомки (микроделеции и микродупликации).
Во время хромосомного микроматричного анализа применяют технологию полногеномной амплификации и гибридизации фрагментов опытной ДНК с олигонуклеотидами, нанесенными на микроматрицу. Если объяснять простыми словами, то сначала ДНК, которую необходимо изучить, копируют, чтобы увеличить ее количество, а затем смешивают ее со специальными ДНК-микрочипами, которые помогают выявлять различные нарушения.
С помощью ХМА можно выявлять:
- изменения числа хромосом;
- дупликации и делеции, в том числе микродупликации и микроделеции;
- отсутствие гетерозиготности – утрату одной из двух копий гена. Это явление имеет важное значение в онкологии, при болезнях импринтинга (когда активность гена зависит от того, от какого из родителей он получен), аутосомно-рецессивных заболеваниях (связанных с рецессивными генами – о них мы поговорим ниже), близкородственных браках;
- однородительские дисомии, когда в геноме ребенка присутствуют две хромосомы от одного родителя.
Однако, как и предыдущий метод, хромосомный микроматричный анализ имеет некоторые ограничения. Он не позволяет выявлять или ограничен в выявлении таких аномалий, как:
Мутации в генах и заболевания, к которым они способны приводить
Все внешние признаки и особенности работы организма, которые человек получает от родителей, передаются с помощью генов. Это важнейшее свойство всех живых организмов называется наследственностью. В зависимости от того, как проявляются гены в тех или иных признаках, их делят на две большие группы.
Как выявляют рецессивные мутации?
Для выявления мутаций, которые передаются рецессивно, используют целый ряд исследований.
Если неизвестно, какую нужно выявить мутацию, то используют специальные панели.
Не в каждой семье можно отследить все возможные рецессивные заболевания. Тогда на помощь приходит секвенирование экзома – тест для определения генетических повреждений (мутаций) в ДНК путем исследования в одном тесте практически всех областей генома, кодирующих белки, изменения которых являются причиной наследственных болезней.
Секвенирование следующего поколения-NGS – определение последовательности нуклеотидов в геномной ДНК или в совокупности информационных РНК (транскриптоме) путем амплификации (копирования) множества коротких участков генов. Это разнообразие генных фрагментов в итоге покрывает всю совокупность целевых генов или, при необходимости, весь геном.

Анализ позволяет выявить точечные мутации, вставки, делеции, инверсии и перестановки в экзоме. Анализ не позволяет выявить большие перестройки; мутации с изменением числа копий (CNV); мутации, вовлеченные в трехаллельное наследование; мутации митохондриального генома; эпигенетические эффекты; большие тринуклеотидные повторы; рецессивные мутации, связанные с Х-хромосомой, у женщин при заболеваниях, связанных с неравномерной Х-деактивацией, фенокопии и однородительские дисомии, и гены, имеющие близкие по структуре псевдогены, могут не распознаваться.
Что делать, если в семье есть наследственное заболевание?
Существуют два способа выявить наследственные генетические мутации у эмбриона:
Предимплантационное генетическое тестирование (ПГТ) в цикле ЭКО. Это диагностика генетических заболеваний у эмбриона человека перед имплантацией в слизистую оболочку матки, то есть до начала беременности. Обычно для анализа проводится биопсия одного бластомера (клетки зародыша) у эмбриона на стадии дробления (4–10 бластомеров). Существует несколько видов ПГТ: на хромосомные отклонения, на моногенные заболевания и на структурные хромосомные перестройки. Данные Simon с соавторами (2018) говорят о том, что в случае проведения ЭКО с ПГТ у пациентки 38–40 лет результативность ЭКО составляет 60%. Но при исследовании эмбриона есть ряд ограничений. Так, из-за ограниченного числа клеток можно не определить мозаицизм.
Если нет возможности провести ЭКО с ПГТ, то используют второй вариант – исследование плодного материала во время беременности.
Для забора плодного материала используют инвазивные методы:
- биопсия хориона – когда берут клетки из плаценты;
- амниоцентез – когда берут клетки амниотической жидкости.
Далее эти клетки исследуют при помощи одного или нескольких генетических тестов (которые имеют свои ограничения). Проведение инвазивных методов может быть связано с риском для беременности порядка 1%.
Таким образом, проведя дополнительные исследования, можно значительно снизить риск рождения ребенка с генетическим заболеванием в конкретной семье. Но привести этот риск к нулю на сегодняшний день, к сожалению, невозможно, так как любой генетический тест имеет ряд ограничений, что делает невозможным исключить абсолютно все генетические болезни.

Автор статьи
Пелина Ангелина Георгиевна
Ведёт генетическое обследование доноров Репробанка, осуществляет подбор доноров для пар, имеющих ранее рождённых детей с установленной генетической патологией.

Обзор
Автор
Редакторы

Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Младшая сестра генетики
Со времени первых открытий в области генетики и до недавних пор в науке прочно укоренилось представление о том, что структура ДНК — это единственный носитель наследственной информации. Благодаря крупномасштабным расшифровкам геномов, в том числе человеческого [2], была раскрыта природа гена и мутаций — нарушений генетической записи, — поняты принципы организации ДНК, изучены последовательности нуклеотидов, обусловливающие наследственные патологии. Было установлено, что генетическая информация человека хранится в 23 парах хромосом, содержащих 20–25 тысяч генов (оказалось, что точно определить их количество тоже не очень-то просто [3]), или три миллиарда пар нуклеотидов, несущих азотистые основания преимущественно четырех типов: аденин, тимин, гуанин, цитозин (сокращенно — А, Т, Г, Ц). Однако роль внешних факторов в механизмах реализации генетической информации была сведена к минимуму. Проще говоря, ученые считали: что записано в генόм, того не вырубишь топором [4].
Со временем ученые пришли к выводу, что активность многих генов непостоянна: они включаются (экспрессируются) и выключаются (репрессируются) в зависимости от воздействия внешних факторов. Это изменение активности генов, не затрагивающее первичную структуру ДНК, но влияющее на проявление тех или иных свойств и признаков, и составило предмет изучения эпигенетики.
Эпигенетика — сравнительно молодое направление науки. Впервые этот термин в 1942 году употребил английский ученый Конрад Уоддингтон. Изучая ряд закономерностей, научное сообщество пришло к выводу, что функции живого организма не обусловлены одной только закодированной в генах информацией, а во многом служат ответом на сигналы из окружающей среды. То, как происходит эпигенетически обусловленное включение и выключение определенных генов, стало одним из важных открытий современности, за что в 2006 году американским исследователям присудили Нобелевскую премию [10].
Рассмотрим самую известную и самую важную модификацию — метилирование ДНК. Это единственная химическая модификация ДНК, задействованная во многих генетических процессах у эукариот. Метилирование — добавление СН3-группы к цитозину ферментами ДНК-метилтрансферазами (рис. 1), что приводит к инактивации целого гена, в состав которого входит этот модифицированный нуклеотид.

Рисунок 1. Модификация цитозина в 5-метилцитозин с участием ДНК-метилаз и S-аденозилметионина
Что же происходит, когда к цитозину, входящему в состав того или иного гена, присоединяется метильная группа? Оказывается, такая модификация провоцирует присоединение белков, изменяющих состояние хроматина. Чаще всего эпигенетическая регуляция осуществляется именно путем дифференциального метилирования цитозина в специфических участках генома. Формально ген никуда не девается, он продолжает находиться на своем месте, но никак себя не проявляет. Ген словно выключен, он не может производить продукт. В таком выключенном состоянии ген способен наследоваться. Передача потомству признаков, приобретенных организмами в течение жизни, в том числе посредством метилирования, называется эпигенетической наследственностью. Это наследование сохраняется у нескольких клеточных поколений или нескольких поколений живых существ.
Но всегда ли плохо то, что гены выключаются? Если представить, к примеру, что путем такой нехитрой модификации происходит выключение каких-либо вредоносных генов, вызывающих развитие патологий, наследственных аномалий или онкотрансформацию клеток, это же будет хорошо. Однако эпигеном может и навредить организму, инактивируя нужные гены. Еще до конца не изучено, как поддерживаются и воспроизводятся те или иные эпигенетические состояния [1].
Как уже упоминалось, метилирование ДНК влияет на многие генетические процессы у эукариот. Оно контролирует экспрессию генов, задействовано в пререкомбинационных событиях (предшествующих рекомбинации — процессу перераспределения генов между участками хромосом), выполняет функцию защиты от встраивания экзогенных нуклеотидных последовательностей, ограничивает перемещение транспозонов (особых участков ДНК, способных передвигаться по геному). Метилирование связано в основном с репрессией генов, инактивацией чужеродных последовательностей, регулировкой развития и организации генома. Регуляторные эпигенетические механизмы могут вызывать перемены в генетической активности. Метилирование цитозина в ДНК эукариот относится к ключевым факторам их развития. Оно оказывает влияние на структурно-функциональную организацию генома, принимая участие в регуляции конформационных изменений хроматина, что способствует изменениям в соответствующих локусах (местах локализации гена на хромосоме). ДНК в разных типах клеток организма метилирована по-разному. Это связано с расхождениями в выполняемых функциях, степени дифференцировки клеток и свойственной им экспрессии генов [13–15].
На страже спокойствия генома. Метилирование как защитный механизм
Метилирование как функция защиты генетического материала от встраивания вирусных и других чужеродных нуклеотидных последовательностей встречается даже у таких примитивных живых организмов, как бактерии. Осуществляется это за счет системы рестрикции-модификации. Чужеродная ДНК, попав в бактерию, расщепляется рестриктазами (специальными ферментами, разрезающими ДНК в определенных участках). Однако те же самые последовательности собственной ДНК бактерии защищены от расщепления метильными метками [17].

Рисунок 2. Метильные группы в регуляторной области гена препятствуют транскрипции. Механизм — прямое ингибирование.
Старость — не радость, а эпигенетическая программа
Эпигеном — пластичная система, функционирующая в соответствии с программой развития и реагирующая на воздействие внешних факторов. Считается, что существует эпигенетически обусловленный каскад изменений, охватывающих процессы старения и реакции на стрессовые факторы [26–28]. Поэтому одним из важных направлений современных исследований является выяснение роли метилирования цитозина в регуляции экспрессии генов в механизмах стрессового ответа и возрастной деградации. Понимание аспектов эпигенетического контроля старения поможет прояснить, что служит отправной точкой этого процесса.

С возрастом снижается экспрессия генов поддержания клеточного равновесия, в результате чего начинается свойственная старению деградация тканей и органов. Происходит увеличение числа разрывов в ДНК и сшивок ДНК с белком, снижаются активности ферментов поддержания структуры хромосом и количество 5-метилцитозина, накапливаются структурные дефекты. Процесс старения сопровождается транскрипцией определенных генов и синтезом ряда белков. Этот каскад сурово скоординированных событий подчинен некой программе. Переход к каждой новой стадии онтогенеза (индивидуального развития) характеризуется изменениями эпигенетического статуса, который обеспечивает активацию или репрессию специфического набора генов. С помощью воздействия на эпигеном можно некоторым образом корректировать генетическую программу развития живых организмов [36], [39–41].
Все перечисленные процессы действуют в направлении ухудшения состояния и функционирования генетического аппарата. А реализуются они под действием внешних и внутренних факторов. Старение — это результат изменения надгеномных процессов, которые на определенном этапе онтогенеза запускают деструктивные механизмы по двум направлениям. С одной стороны, происходит индукция генетической программы деградации структур и функций, которая репрессирует гены поддержки клеточного гомеостаза и активирует гены, отвечающие за реакции распада. С другой стороны, запускается механизм ослабления деятельности защитных систем, что делает клетку восприимчивой к повреждающему действию стрессовых факторов. Несмотря на эффективную репарационную машину, в структуре ДНК с возрастом накапливаются разрывы и другие дефекты, всё меньше и меньше индуцируются защитные белки теплового шока, в делящихся клетках сильно сокращается длина теломер (защитных концевых участков хромосом). Всё это — элементы единого многосложного процесса надгеномной регуляции процессов старения. Согласно некоторым гипотезам, множественность механизмов старения эукариот может быть обусловлена тем, что природа страхуется от появления долгоживущих видов и особей [42], [43].
Молекулярные механизмы старения сегодня интенсивно изучаются, тем не менее предложенные концепции не позволяют создать общую картину, объяснить многочисленные противоречия, закономерности индукции этого процесса и причины, обусловливающие тождественность старения у различных организмов . Однако можно сделать несколько гипотетических выводов: почти все многоклеточные организмы подвержены старению, но принцип функционального обеспечения этого процесса неизвестен; старение необратимо и затрагивает все системы, что в какой-то мере затрудняет поиск программ, отвечающих за его развитие; старение не может быть обусловлено одним специальным механизмом, иначе спонтанное нарушение его работы приводило бы к преодолению видового лимита продолжительности жизни; молекулярная природа старения основывается на взаимодействии генетических и эпигенетических путей регуляции, что делает процесс старения надежным, стабильно развивающимся и невосприимчивым к радикальной коррекции извне. Одна из задач эпигенетики — исследование того, как изменение образа жизни человека может повлиять на гены и способствовать продлению жизни индивида [1], [29], [31].
Метки смерти на генах. Метилирование и онкогенез
Недостаточное метилирование (гипометилирование) генома было одним из первых выявленных эпигенетических маркеров онкозаболеваний. Гипометилирование ведет к активации генов, которые в норме должны молчать. В случае опухолей это индивидуальные онкогены, пребывающие в здоровой клетке в метилированном (неактивном) состоянии. Понижение тотального уровня метилирования генома выражается в снятии естественных репрессивных меток с онкогенов, что вызывает каскад разрушительных событий. Попутно гипометилирование больших участков генома активирует транспозоны, за счет чего увеличивается хромосомная нестабильность и растет число аномалий. Эти два процесса ставят клетку на путь онкологической трансформации. Во многих лабораториях именно тотальное гипометилирование ДНК диагностируется как основной признак раковых клеток [15], [47], [48].

Рисунок 4. CpG-островок промоторной области гена. а — Транскрипционно активный (неметилированный) островок. б — Сайленсированный (метилированный) островок.
Как видим, рак не обходится без эпигенетических событий. Как недостаток метилирования, так и его избыток в равной мере способствуют раковому перерождению здоровой клетки. Нарушенное метилирование ведет к аномалиям развития и опухолеобразованию. Как тут не вспомнить о том, что всё хорошо в меру. Онкогенез — это многофакторный и многоэтапный процесс, включающий в себя как активацию онкогенов, так и молчание генов-онкосупрессоров. Каждое из этих нарушений эпигенома для опухолевой прогрессии имеет не меньшее значение, чем генетические нарушения, то есть служит эпигенетическим эквивалентом генетической мутации [50]. Изменение нормальных паттернов (шаблонов) метилирования ДНК неизбежно ведет к отрицательным последствиям. А сохранение здорового статуса метилирования генома является основным условием нормального развития организма.
Выходит, что рак — это не только генетически обусловленное заболевание, как считалось раньше, а заболевание, в основе которого лежит ряд еще во многом не изученных эпигенетических изменений. При этом нельзя считать, что неправильное метилирование — всего лишь маркер онкозаболевания; зачастую оно выступает причиной последнего. Так, например:
- Гиперметилирование промоторов, обусловливающее инактивацию генов-онкосупрессоров, в 70% случаев способствует развитию таких онкопатологий, как гепатокарцинома и аденокарцинома поджелудочной железы.
- Гиперметилирование CpG-островков гена рецептора эстрогена (ER) обнаруживается в опухолях толстой кишки и молочной железы.
- Ген транскрипционного фактора MyoD, специфичного для мышечной ткани, гиперметилируется при раке мочевого пузыря и толстой кишки.
- Ген кальцитонина гиперметилирован по CpG-островку, что наблюдается при лимфомах и раке легкого.
- Опухоли молочной железы вызываются инактивацией генов BRCA1, MYOD и ER посредством их метилирования.
- Аберрантное метилирование промотора гена тканевого ингибитора металлопротеиназы характерно для разных опухолей: немелкоклеточного рака легкого — в 19% случаев, рака молочной железы и толстой кишки — в 27%, карциномы почки — в 78%, глиобластомы — в 26% [51], [52].
- Гиперметилирование промоторной области играет ключевую роль в инактивации гена-онкосупрессора HIC1, что вызывает развитие опухолевых процессов в различных органах. Замечено, что обработка клеток опухоли деметилирующими агентами вызывает восстановление экспрессии этого гена, вследствие чего опухоль претерпевает обратное развитие [52], [53].
Здесь стоит отметить, что активация гена, наступающая вследствие деметилирования определенных сайтов, может происходить только в том случае, если в клетке присутствует специфический транскрипционный фактор. Этим объясняется ограниченное количество генов, активированных в опухолях посредством гипометилирования [50].
Однако нельзя забывать, что недостаток метилирования ДНК так же опасен, как и его избыток, и так же служит причиной ряда онкопатологий. К примеру, при хроническом лимфолейкозе наблюдается тотальное деметилирование ДНК в раковых клетках на фоне высокой ДНК-метилтрансферазной активности. Тотальное снятие метильных меток оказывает значительное дестабилизирующее действие на геном эукариот, меняет структуру хроматина, степень его конденсации, время репликации, что может вызывать нарушения экспрессии различных генов [15], [54].
Вместе с тем не менее опасна и спонтанная потеря сайтов метилирования. Спонтанное дезаминирование (потеря аминогрупп) 5-метилцитозина приводит к возникновению остатка тимина и образованию неканонической пары оснований Г:Т, которая становится мишенью для системы репарации. Репаративные ферменты удаляют тимин из этой пары и восстанавливают исходную последовательность Г:Ц, однако иногда возникают мутации, выражающиеся в замене пары Г:Ц на А:Т. Именно нестабильность 5-метилцитозина и спонтанные замены Г:Ц на А:Т привели в ходе эволюции к низкому уровню CpG-динуклеотидов в геноме млекопитающих. Таким образом, спонтанный мутагенез, происходящий в животной клетке при отсутствии экзогенных и эндогенных агентов, нарушает структуру многих генов, в том числе и онкосупрессоров. Этот механизм играет не последнюю роль в процессах онкологической трансформации [55].
Помимо аберрантного метилирования промоторов генов-онкосупрессоров, в опухолевых клетках обнаруживается и нестабильность микросателлитов (коротких тандемных повторов ДНК), при которой микросателлитные маркеры представлены одновременно многими разными аллелями, дополнительными к двум родительским [52], [56]. Сателлитные ДНК в геноме человека в норме высоко метилированы. В процессе опухолеобразования наблюдается микросателлитная нестабильность, резкое гипер- или гипометилирование (в зависимости от вида опухоли). В качестве примера здесь можно упомянуть ген MLH1, продукт которого участвует в репарации ошибок спаривания нуклеотидов. Гиперметилирование промотора этого гена и микросателлитная нестабильность ассоциированы с опухолями желудочно-кишечного тракта и некоторых других органов [52].Изменчивость микросателлитных последовательностей по-разному проявляется на разных стадиях развития и зависит от состояния дифференцировки и типа ткани [57].
Однако не все гены задействованы в эпигенетических событиях канцерогенеза. Ген белка р53 не содержит в своей промоторной области CpG-островков и не поддается метилированию. Нарушение функций р53 наблюдаются во многих случаях рака, но инактивация его гена обусловлена не эпигенетическими, а генетическими механизмами. В кодирующей части гена присутствуют одиночные метилированные CpG-динуклеотиды, которые в силу спонтанного дезаминирования 5-метилцитозина мутируют с заменой комплементарных пар [50], [52].
Перспективы изучения эпигенома
Общая черта, присущая как метилированию, так и мутациям — это наследуемость, хотя в отличие от большинства мутаций метилирование — процесс обратимый. Контроль модификации ДНК интересен прежде всего для биотехнологической отрасли. Воздействуя на эпигеном, можно не только вылечить ряд заболеваний, но и добиться промышленной выгоды. К примеру, направленная регуляция экспрессии генов у растений способна увеличить их продуктивность. Замечено, что в результате обработки 5-азацитидином наблюдается увеличение белка в зерновках пшеницы за счет активации генов запасных белков. Причем индуцированные химическим агентом признаки сохраняются в течение трех поколений. Какие механизмы отвечают за возвращение к исходному паттерну метилирования, соответственно, и к исходному фенотипу — пока неизвестно [60], [61].
Как отмечалось выше, эпигеном — система пластичная, что позволяет в перспективе подобраться к рычагам управления эпигенетическими модификациями, минимизировать действие неблагоприятных факторов и обеспечить оптимальные условия для существования клетки. Ключ к разгадке наследственных патологий, продлению жизни, управлению полезными свойствами живых организмов — всё это сулит эпигенетика. Уже сегодня можно без преувеличения сказать, что открытия в области эпигенетики в скором времени поднимут биологическую науку на качественно новый уровень развития, и это кардинальным образом изменит саму человеческую цивилизацию.
Читайте также:

