Метод комплексонометрического титрования реферат
Обновлено: 07.07.2024
Фиксирование момента эквивалентности В методе комплексиметрического титрования вещества, участвующие в реакции и их продукты, ничем внешне себя не проявляют. Следовательно, для определения момента эквивалентности необходимо воспользоваться каким-либо из существующих способов фиксирования точки эквивалентности. К ним от-носятся индикаторные способы. В комплексиметрии фиксирование эквивалент-ного… Читать ещё >
Комплексиметрическое титрование (комплексиметрия или комплексонометрия) ( реферат , курсовая , диплом , контрольная )
История метода
Первые работы, посвященные комплексонометрическому определению ионов относятся к 1834 г. Они были проведены Либихом (1803−1873).
Он описал комплексонометрическое определение цианидов раствором нитрата серебра.
Однако годом открытия комплексиметрического титрования можно считать 1945 г. Это произошло после того, как предложенные в 1944 г. Г. Х. Шварценбахом (1904;1978) аминополикарбоновые кислоты стали широко применять в качестве комплексообразующих органических соединений. С 1950 г. этот метод получил международное признание для определения жёсткости воды, а к 1955 г. его стали применять для определения большинства известных катионов металлов.
Теория метода
Основу комплексиметрического метода анализа составляют реакции образования устойчивых внутрикомплексных солей при взаимодействии ионов металлов с комплексообразующими органическими соединениями.
Схематически данные реакции можно представить уравнением:
Ме 2+ + Н2Y 2- МеY 2- + 2Н + .
Рабочие вещества Рабочими веществами в методе служат органические вещества, способные образовывать комплексные соединения. К их числу относятся аминополикарбоновые кислоты и их производные, названные комплексонами. От этого термина и пошло название метода.

Принята краткая запись этой формулы: Na2H2Y.
Молярную массу эквивалентов ЭДТА рассчитывают по формуле:

Кроме ЭДТА на практике нашли применение и такие комплексоны:
уксусная кислота (ЭДТУ)).
Некоторые особенности взаимодействия комплексонов с металлами Из графической записи формул комплексонов видно, что молекулы их содержат карбоксильные группы (-СООН) и амидный азот (N). Таким образом, процесс образования внутрикомплексных солей при взаимодействии комплексонов с ионами металлов идет за счет:
- 1) замещения активных атомов водорода в карбоксильных группах (образования ионных связей);
- 2) взаимодействия ионов металла с аминным азотом с образованием донорно-акцепторной (координационной) связи.
Это хорошо видно на примере схемы реакции ЭДТА с ионом металла.


В различных условиях почти со всеми катионами металлов комплексон III образует комплексные соединения в соотношении 1:1. При этом схемы протекающих реакций можно представить уравнениями:
Следует отметить, что образующиеся соединения комплексонов с ионами металлов являются бесцветными и в большинстве растворимыми в воде.
Определяемые вещества В разделе 2.4 отмечено, что реакции в титриметрическом анализе должны протекать до конца. Следовательно, в комплексиметрии в точке эквивалентности определяемые ионы практически полностью должны быть связаны в устойчивый комплекс. Устойчивость комплекса определяется константой устойчивости (образования) комплекса или константой нестойкости. Константу устойчивости, например, для реакции:
рассчитывают по формуле:

Чтобы реакция комплексообразования прошла с достаточной полнотой (99,99%) и могла быть применена в титриметрическом анализе константа устойчивости должна быть больше 10 8 , а константа нестойкости — меньше 10 -8 .
Условия образования комплексов Условия образования комплексов следующие:
- 1. Устойчивость соединений металлов с комплексонами определяется зарядностью и электронной конфигурацией иона металла. Наиболее устойчивые комплексы ЭДТА образует с многозарядными ионами ри d-элементов (Bi 3+ , Fe 3+ , Cr 3+ и т. д. ) и менее устойчивые — с ионами s-элементов (Ba 2+ , Mg 2+ , Ca 2+ и т. д. ). В связи с этим определение первых ведут как в щелочной, так и в кислой среде, а вторых — только в щелочной.
- 2. Большое влияние на устойчивость комплексов оказывает рН раствора.
Это связано с тем, что комплексоны — это многоосновные кислоты, диссоциирующие по ступеням, как электролиты разной силы. Константы разных ступеней диссоциации различаются на несколько порядков. Например, для ЭДТА рК1 = 2,07; рК2 = 2,75; рК3 = 6,24; рК4 = 10,34. Следовательно, наличие ионов Н + в растворе в сильной степени влияет на сдвиг равновесия при диссоциации и на возможность образования комплексного соединения с ионами металла. Реакция комплексообразования идет обычно с участием полностью ионизированной формы комплексона.
Кроме того, при образовании комплекса определяемого металла с комплексоном высвобождаются ионы водорода, что ведет к снижению рН раствора. Это снижение может достигнуть нескольких единиц рН, и требуемые комплексные соединения не образуются. Чтобы избежать подобных явлений, титрование ведут с добавлением буферных растворов, позволяющих поддержать рН раствора на заданном уровне или при сильном подщелачивании растворов.
Применение комплексиметрического титрования на пищевых предприятиях Комплексиметрическое титрование используют для контроля показателей качества сырья, полуфабрикатов и готовой продукции.
Этим методом определяют содержание кальция и магния в молоке и молочных продуктах, жирах, мясе, мясных продуктах.

В виноделии, при производстве пива и безалкогольных напитков важную роль играет качество используемой воды. Особенно важен такой ее показатель, как жёсткость ().
Жёсткость указывает на количество присутствующих в воде солей кальция и магния, и вода в зависимости от их содержания делится:
- 1) на очень мягкую (0−1,5 ммоль экв/дм 3 );
- 2) мягкую (1,5−3 ммоль экв/дм 3 );
- 3) средней жёсткости (3−6 ммоль экв/дм 3 );
- 4) жёсткую (6−9 ммоль экв/дм 3 );
- 5) очень жёсткую (> 9 ммоль экв/дм 3 ).
В перечисленных выше производствах (вина, пива, безалкогольных напитков) жёсткость воды не должна превышать определенной величины. Например, в производстве различных видов пива может быть использована вода с жёсткостью не более 6 ммоль экв/дм 3 . Жёсткость воды легко и надежно определяется комплексиметрическим титрованием.
Способы титрования В методе комплексиметрического титрования при определении катионов применяются способы прямого, обратного и заместительного титрования.
Прямое титрование. Анализируемый раствор, содержащий ионы определяемого металла, непосредственно титруют рабочим раствором комплексона III, фиксирование точки эквивалентности осуществляют в присутствии металл-индикаторов. Способом прямого титрования можно определять Cu 2+ , Cd 2+ , Pb 2+ , Ni 2+ , Co 2+ , Fe 3+ , Zn 2+ , Mg 2+ , Ca 2+ , Ba 2+ и другие катионы.
Обратное титрование. К анализируемому раствору прибавляют, заведомо в избытке, точно измеренный объем рабочего раствора комплексона. Для завершения реакции комплексообразования раствор нагревают, а затем охлаждают. Избыток комплексона, находящийся в охлажденном растворе, оттитровывают раствором MgSO4 или ZnSO4. Момент эквивалентности устанавливают с помощью металл-индикатора, реагирующего на ионы Mg 2+ или Zn 2+ . Способом обратного титрования определяют содержание катионов в нерастворимых в воде осадках (Ca 2+ в CaC2O4; Mg 2+ в MgNH4PO4; Pb 2+ в PbSO4 и т. д. ), а также Al 3+ .
Заместительное титрование. К анализируемому раствору, содержащему определяемые ионы металла, добавляют магниевый комплекс MgY 2- Т.к. он менее устойчив, чем комплекс определяемого иона металла с комплексоном, то идет реакция замещения и выделяется ион Mg 2+ .


Затем ион Mg 2+ оттитровывают комплексоном III в присутствии эриохрома черного Т.


По объему ЭДТА, затраченному на титрование, рассчитывают массу определяемого иона металла. Такой способ титрования возможен только в случае, если комплексные соединения определяемых металлов устойчивее магниевого комплекса.
Фиксирование момента эквивалентности В методе комплексиметрического титрования вещества, участвующие в реакции и их продукты, ничем внешне себя не проявляют. Следовательно, для определения момента эквивалентности необходимо воспользоваться каким-либо из существующих способов фиксирования точки эквивалентности. К ним от-носятся индикаторные способы. В комплексиметрии фиксирование эквивалент-ного объема осуществляется с помощью индикаторов, различных по своей природе и механизму действия, а именно: кислотно-основных, окислительно-вос-становительных (редокс), металлохромных, флуоресцирующих. Рассмотрим металлохромные индикаторы (металлиндикаторы), т.к. они получили самое широкое применение в комплексиметрии.
Природа и механизм действия металлохромных индикаторов Металлохромные индикаторы по своей природе являются органическими красителями, чаще всего кислотами, способными образовывать комплексные соединения. При взаимодействии с ионами металлов они образуют комплексы менее устойчивые, чем комплексы металлов с комплексонами, что позволяет применять их для фиксирования точки эквивалентности.
Представим схематически (без учета зарядов) реакции, протекающие при комплексиметрическом титровании. Обычно к анализируемому раствору соли металла прибавляют сухой индикатор Ind, имеющий свою персональную окраску, который вступает в реакцию с ионами металла Ме 2+ , образуя комплексное соединение [MeInd] с окраской I.


Затем раствор титруют комплексоном, в результате этого идет образование устойчивого соединения металла с комплексоном. Каждая последующая порция титранта разрушает менее устойчивый комплекс металла с индикатором. Вблизи точки эквивалентности последние порции ЭДТА разрушают комплекс [MeInd] и образуют более устойчивый комплекс [МеY] 2- .


При этом высвобождается индикатор, и соответственно изменяется окраска раствора. Раствор приобретает цвет ионной формы индикатора Ind - , т.к. титрование ведётся в щелочной среде. Этот переход вблизи момента эквивалентности должен произойти достаточно быстро, что возможно только при условии, если константа устойчивости комплекса [MeY 2- ] будет в 10−100 раз больше константы устойчивости комплекса [MeInd].
Основные характеристики металлохромных индикаторов Механизм действия металлохромных индикаторов связан с величиной константы устойчивости комплекса, образованного индикатором с ионом определяемого металла.

Металлохромные индикаторы характеризуются точкой перехода и интервалом перехода цвета индикатора. Эти величины связаны с концентрацией ионов металла в растворе. Точка перехода цвета индикатора (точка конца титрования) характеризуется заметным изменением цвета раствора при переходе индикатора из комплекса в свободное состояние. Наблюдается это при равенстве концентраций комплекса индикатора и свободного индикатора.

Следовательно, в точке перехода цвета индикатора рМе равен логарифму константы устойчивости индикаторного комплекса.
Интервал перехода цвета индикатора (ИП) устанавливают для изменений соотношения [MeInd] / [Ind] от 1/10 до 10/1, т. е. в интервале.

На состояние индикаторов в растворе и устойчивость образованных ими комплексов влияет величина рН среды. Так, индикатор эриохром чёрный Т представляет собой трехпротонную кислоту Н3Ind, которая:
- а) при рН - (красного цвета);
- б) в пределах 6,3 2 — (синего цвета);
- в) при рН>11,6 — в виде Ind 3 — (желтого цвета).
Каждая из этих форм индикатора способна реагировать с ионами металла, образуя комплексные соединения, характеризующиеся своей константой устойчивости.
Кривые титрования В комплексиметрии кривые титрования представляют собой графическую зависимость изменения рМе раствора от прилитого объема титранта. Общий вид кривой титрования представлен на рис. 10.
Вид кривой комплексонометрического титрования аналогичен общему виду кривых титрования. На кривой титрования также есть скачок. Величина его зависит:
- 1) от концентрации растворов веществ, участвующих в реакции; чем больше концентрация, тем больше скачок на кривой титрования;
- 2) величины константы устойчивости комплекса; чем больше величина константы, тем больше скачок титрования;
- 3) рН раствора; чем больше значение рН раствора, тем больше устойчивость комплекса, следовательно, больше и величина скачка на кривой титрования.
Выбор индикатора Чтобы подобрать индикатор, необходимо:

- 1. Константу устойчивости комплекса, образованного индикатором с определяемым ионом металла, сравнить с константой устойчивости комплекса металла с комплексоном. Если в 10−100 раз, то данный индикатор может быть использован для фиксирования точки эквивалентности.
- 2. Чтобы металлохромный индикатор образовал комплекс с металлом при его концентрации в пределах скачка титрования.
- 3. Чтобы интервал перехода окраски индикатора находился в пределах скачка титрования.
Ошибки комплексиметрического титрования При применении индикаторов для фиксирования конца титрования могут возникать индикаторные ошибки. Их появление обусловлено несовпадением точки конца титрования и точки эквивалентности. Индикация точки конца титрования наступает до достижения точки эквивалентности. Это обусловлено взаимодействием титранта с комплексом [MeInd], в котором связаны последние порции определяемого иона металла. Если комплекс [MeInd] непрочен и разрушается полностью под воздействием комплексона при достаточно высокой концентрации свободных ионов металла, то изменение цвета раствора наступит раньше достижения т.э. При этом раствор будет недотитрован.
Комплексонометрическое титрование - метод титриметрического анализа, основанный на реакциях взаимодействия определяемых ионов металла с органическими реагентами (комплексонами) с образованием растворимых, бесцветных прочных внутрикомплексных соединений.
Содержание
ВВЕДЕНИЕ 2
1. КОМПЛЕКСОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ 3
1.1Обоснование комплексонометрического метода. 3
1.2Теоретические основы комплексонометрического метода. 5
1.3 Приготовление стандартного раствора трилона Б. 8
1.4 Способы фиксирования конечной точки титрования. 8
1.5 Условия комплексонометрическоro титрования: 10
1.6 Способы комплексонометрического титрования. 11
1.6.1 Прямое титрование. 11
1.6.2 Обратное титрование. 11
1.6.3 Заместительное титрование. 12
2. Жесткость воды. 13
2.1 жесткости воды – это… 13
2.2 Методы определения жесткости. 16
2.2.1 Колориметрический метод 16
2.2.2 Олеатный метод 16
2.2.3 Метод кислотно-основного титрования 17
2.3. 2 типа жесткости воды: 18
2.4 Методы устранения. 18
2.4.1 Термоумягчение. 18
2.4.2 Реагентное умягчение. 18
2.4.3 Катионирование. 19
2.4.4 19
2.4.5 Электродиализ. 20
3. Методика определения жесткости воды комплексонометрическим методом. 21
3.1 Сущность метода 21
3.2 Отбор проб 21
3.3 Реактивы и оборудование 22
3.4 Проведение анализа 23
3.5 Обработка результатов 25
Заключение 27
Литература 28
Работа содержит 1 файл
химия.docx
1. КОМПЛЕКСОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ 3
1.1Обоснование комплексонометрического метода. 3
1.2Теоретические основы комплексонометрического метода. 5
1.3 Приготовление стандартного раствора трилона Б. 8
1.4 Способы фиксирования конечной точки титрования. 8
1.5 Условия комплексонометрическоro титрования: 10
1.6 Способы комплексонометрического титрования. 11
1.6.1 Прямое титрование. 11
1.6.2 Обратное титрование. 11
1.6.3 Заместительное титрование. 12
2. Жесткость воды. 13
2.1 жесткости воды – это… 13
2.2 Методы определения жесткости. 16
2.2.1 Колориметрический метод 16
2.2.2 Олеатный метод 16
2.2.3 Метод кислотно-основного титрования 17
2.3. 2 типа жесткости воды: 18
2.4 Методы устранения. 18
2.4.1 Термоумягчение. 18
2.4.2 Реагентное умягчение. 18
2.4.3 Катионирование. 19
2.4.5 Электродиализ. 20
3. Методика определения жесткости воды комплексонометрическим методом. 21
3.1 Сущность метода 21
3.2 Отбор проб 21
3.3 Реактивы и оборудование 22
3.4 Проведение анализа 23
3.5 Обработка результатов 25
Комплексонометрическое титрование - метод титриметрического анализа, основанный на реакциях взаимодействия определяемых ионов металла с органическими реагентами (комплексонами) с образованием растворимых, бесцветных прочных внутрикомплексных соединений.
Чаще всего комплексонометрическое титрование применяют для определения ионов металлов с использованием ЭДТА в качестве титранта (например, при определении жесткости воды). Образец воды подщелачивают аммиачным буферным раствором, добавляют индикатор эриохром черный и полученный раствор титруют ЭДТА.
В нашей работе рассматривается жесткость воды комплексонометрическим титрованием. Присутствие в воде значительного количества солей жесткости, делает воду непригодной для многих технических целей, так и для использования человеком.
Наиболее широко комплексоны используют в качестве титранта. Эта область анализа получила название комплексонометрии. Различают несколько способов титрования: прямое, обратное, вытеснительное, косвенное. Конечную точку титрования устанавливают с помощью индикаторов: кислотно-основных, окислительно- восстановительных и металлохромных. Последние имеют наибольшее применение; к ним относятся реагенты класса оксиазосоединений, в том числе гетероциклических. По селективности взаимодействия с ионами металлов различают универсальные (неспецифические) индикаторы — пирокатехиновый фиолетовый, ксиленоловый оранжевый, мурексид, эриохром черный Т и специфические индикаторы— тайрон, сульфосалициловая кислота для определения железа (III), роданид для определения железа(III) и кобальта, тиомочевина для определения висмута.
1.1Обоснование комплексонометрического метода.
Введение комплексонов в аналитическую практику расширило возможности химического анализа вообще и объемного метода в частности.
Наиболее ценным свойством комплексонов, широко используемым в анализе, является их способность давать внутрикомплексные соли с ионами щелочноземельных металлов: магнием, кальцием и барием, которые, как известно, трудно или невозможно перевести в комплексные соединения другими средствами.
Комплексы, образуемые комплексонами с большинством катионов металлов, весьма устойчивы, что вполне обеспечивает практически полное связывание определяемого металла в комплекс.
Объемно – аналитические методы анализа отличаются простотой, скоростью, что имеет решающее значение в практике промышленных лабораторий. Но до введения комплексонов объемно-аналитическими методами можно было определять лишь ограниченное число металлов. Комплексоны же позволяют определять объемными методами почти все металлы. Только ЭДТА образует комплексы с 44 катионами, из которых только Ag + , Нg 2+ , Ва 2+ и катионы щелочных металлов обычно комплексонометрически не определяются.
Большим достоинством комплексонов является то, что в ряде случаев представляется возможность титровать одни катионы в присутствии других, не прибегая к предварительному их разделению.
Комплексоны, являясь кислотами или их кислыми солями, при взаимодействии с катионами независимо от их степени окисления образуют ионы водорода, например:
Са 2+ + Н2Y 2- → СаY 2- + 2Н +
Поэтому титрование комплексонами можно проводить по методу нейтрализации, пользуясь кислотно-основными индикаторами.
Комплексонометрически можно определять не только катионы, но и анионы. Например, фосфат-ион в анализируемом растворе можно осадить солью магния, отделить осадок, растворить и в полученном растворе оттитровать магний рабочим раствором комплексона.
Комплексонометрия предъявляет высокие требования к чистоте применяемых реактивов и дистиллированной воды, в качестве которой лучше применять бидистиллят, полученный в аппарате из химически стойкого стекла.
Аналитические свойства комплексонов не исчерпываются применением их в объемном анализе. Они позволяют облегчить выполнение многих определений и в гравиметрическом анализе, так как могут связывать мешающие ионы в практически недиссоциированные комплексы, освобождая аналитика от отделения их осаждением.
В заключение обзора аналитических свойств комплексонов следует отметить их применимость и в физико-химических методах анализа – в фотометрии, потенциометрии, полярографии и др.
1.2Теоретические основы комплексонометрического метода.
В основе метода комплексонометрии лежит образование комплексных соединений анализируемых катионов с органическими реагентами – комплексонами.
В комплексонометрическом анализе в качестве рабочего вещества чаще всего используют трилон Б.
Трилоном Б называется двузамещенная натриевая соль органической этилендиаминотетрауксусной кислоты.
Трилон Б – это фирменное название вещества; его называют также хелатон, версен, комплексон III.
Сокращенное обозначение молекулы трилона Б: Na2Н2Тр.
Это соединение легко образует прочные внутрикомплексные соли со многими катионами. Соли образуются, с одной стороны, за счет замещения металлом водорода карбоксильных групп, с другой – за счет образования координационных связей между ионами металла и атомами азота.
При комплексонометрическом титровании к раствору, содержащему определяемые ионы, добавляют постепенно титрованный раствор комплексона. По мере титрования определяемые ионы связываются в комплекс, и в точке эквивалентности они практически отсутствуют в растворе. Реакцию в общем виде можно записать так:
Чтобы реакция комплексообразования шла до конца, нужно связать выделяющиеся ионы водорода. Поэтому при титровании к анализируемому раствору добавляют смесь хлорида и гидроксида аммония – аммиачно-буферный раствор.
Для определения момента окончания титрования служат индикаторы – вещества, образующие окрашенные соединения с ионами кальция и магния или с одним из этих катионов. Такими индикаторами являются кислотный хром синий К, дающий переход от розовой к серо–голубой окраске при рН=10-11; магнезон и эриохром черный Т, называемый также хромом черным специальным ЕТ00, изменяющие окраску от вино–красной к синей; мурексид и др.
Индикаторы обладают различной чувствительностью, т.е. их окрашенные соединения с ионами кальция и магния возникают при различных, но определенных для данного индикатора и для выбранных условий концентрациях этих ионов (табл.1.1). Например, эриохром черный Т образует окрашенное соединение с кальцием при концентрации этого иона около 7 мкг – экв/л; по отношению к ионам магния этот индикатор более чувствителен, и окраска возникает уже при 4 – 5 мкг-экв/л.

Титратор для комплексонометрического титрования. GT-200
Чтобы унифицировать получаемые результаты анализа и избежать индикаторной ошибки рекомендуется применять автоматизированные установки. Они позволят выполнять анализ в строго контролируемых одинаковых условиях, фотометрически детектируя смену окраса раствора.
Основной блок – потенциометрический титратор GT-200 – управляется либо встроенным программным обеспечением, либо с помощью WINDOWS-совместимого ПО. Он производит все расчетные операции и сохраняет необходимые данные (концентрации, объемы, статистику и пр.) в памяти.
Бюретка для титрования GT-200BRT – предназначена для дозирования и титрования растворов. Можно задавать шаг, скорость, последовательность дозирования.
Фотометрический датчик GT-LDII – имеет встроенный детектор, вырабатывающий фототок при определенной длине волны. При смене окраса раствора длина волны меняется, изменяя фототок. В процессе подачи титранта объем поданного раствора можно зафиксировать до смены окраса индикатора и после.
Мешалка GT-200STR – позволяет производить контролируемое и повторяемое перемешивание пробы.
Это основные элементы автоматической системы для фотометрического титрования на базе потенциометрического титратора GT-200. Дополнительно к ним можно добавить устройства для автоматической подачи образцов, принтер для распечатки результатов, весы с возможностью передачи веса образца сразу в прибор и другие полезные модули.
Сущность комплексонометрического титрования
Комплексонометрическое титрование – это титриметрический метод анализа, основанный на взаимодействии определяемых ионов металла с комплексонами. Чаще всего в роли комплексообразователя выступает динатриевая соль этилендиаминтетрауксусной кислоты (другие названия: Трилон Б, ЭДТА), которая в большинстве случаев образует комплексы с катионами металлов в молярном соотношении 1:1, что упрощает расчет концентраций определяемых элементов.
Устойчивые комплексы с ЭДТА большинство металлов образуют в щелочной среде, для этого к раствору с анализируемым образцом добавляют аммиачный буфер, но некоторые элементы, например, железо (Fe III), можно титровать и в кислой среде.
Основные требования к комплексообразующему реагенту:
Образования устойчивых комплексов с катионами металлов в известном молярном соотношении.
Хорошая растворимость образуемых комплексов в воде.
Образующиеся комплексы не должны быть окрашены.
Взаимодействие комплексона с противоионом должно происходить быстро и количественно
Всем этим требованиям, в большинстве случаев, удовлетворяет Трилон Б.
Индикатор подбирают в зависимости от титруемого элемента и исходя из типа титрования.
Как уже упоминалось ранее, pH среды существенно влияет на устойчивость образующихся комплексов, что видно при построении кривой комплексонометрического титрования ионов кальция, представленной ниже:
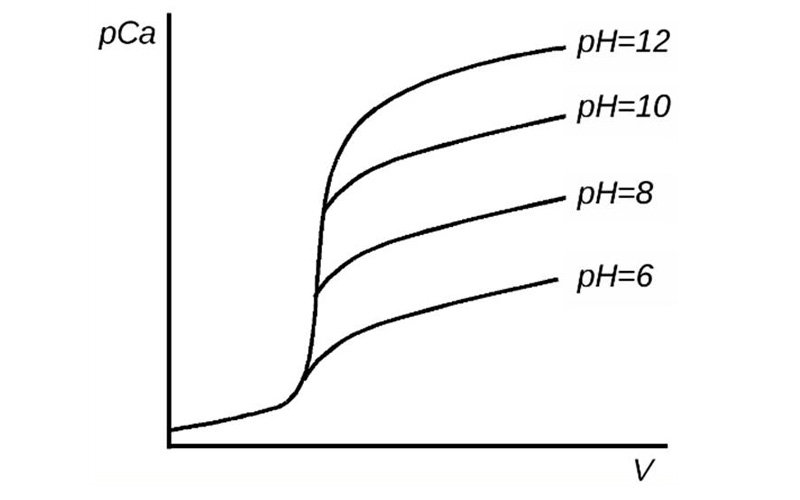
Рис.1 Кривая титрования [Ca 2+ ] трилоном Б при различных значениях pH.
Из кривых титрования видно, что при более высоком pH величина ΔpCa больше (высокий скачок), что позволяет точней идентифицировать точку эквивалентности.
Классификация методов комплексонометрического титрования
Как и большинство титриметрических методов, комплексонометрию можно проводить прямым, обратным или заместительным титрованием.
В случае прямого титрования первоначальное окрашивание раствора вызвано взаимодействием индикатора с металлом. В дальнейшем сильный комплексообразователь трилон Б вытесняет индикатор, образуя с металлом более устойчивый комплекс. В ходе этого взаимодействия наблюдается смена цветности раствора. Титрант добавляется до получения устойчивого окраса, что говорит о присутствии в растворе свободного Трилона Б.
Обратный метод титрования подразумевает добавление избытка комплексона к раствору. Непрореагировавшую часть ЭДТА оттитровывают солью цинка или магния. Зная первоначально добавленный объем ЭДТА и вычтя из него количество оттитрованного избытка, можно вычислить содержание металла, вступившего во взаимодействие с комплексоном. Этот способ предпочтителен для элементов, которые медленно взаимодействуют с Трилоном Б, для которых сложно подобрать индикатор. Металлы в нерастворимых в воде солях тоже определяют обратным титрованием. Кроме того, если индикатор образует более прочный комплекс с металлом, чем титрант, то обратное комплексонометрическое титрование поможет определить его содержание.
При заместительном титровании к образцу добавляют комплексы металлов, которые легко вытесняются определяемыми металлами в образце. Избыток добавленного раствора оттитровывается стандартным раствором ЭДТА.
Комбинированные методы комплексонометрического титрования
Комбинацией упомянутых методов можно определять не только катионы, но и анионы, такие как SO4 2- ; PO4 3- ; CrO4 2- . Для этого их сначала осаждают, фильтруют, растворяют в известном количестве ЭДТА. Избыток ЭДТА оттитровывают сульфатом цинка.
Виды комплексонометрического титрования
Различают комплексонометрические методы в зависимости от используемого хелата:
Трилон Б – трилонометрия. Обычно применяется для определения катионов металлов.
Соединения ртути – меркуриметрия. Применяется для анализа анионов (галогенов, цианидов и пр.).
Фосфорорганические комплексоны. Применяются относительно недавно и позволяют специфично определять катионы металлов даже в смесях.
Можно классифицировать методы комплексонометрического титрования в зависимости от используемого индикатора.
Индикаторы для комплексонометрического титрования
Выбор индикатора в первую очередь зависит от условий титрования. Для анализа катионов металлов наиболее универсален индикатор Эриохром черный Т, который применяется для определения Mg + ; Са 2+ ; Zn 2+ ; Cd 2+ ; Pb 2+ ; Мn 2+ .
Широкий спектр элементов можно определять с помощью Ксиленолового оранжевого, в том числе редкоземельные элементы, висмут и Fe 3+ .
Также в комплексонометрическом титровании используют такие индикаторы, как: Пирокатехиновый фиолетовый, Мурексид, кальцес, Хромовый темно¬синий, Бериллон II, Кальцион, Кальцеин и пр.
При индикаторном титровании необходимо четко фиксировать смену окраса индикатора для определения конечной точки титрования. Учитывая особенности индивидуального цветовосприятия, момент перехода окраса у разных лаборантов может отличаться, что влияет на точность получаемых результатов, повторяемость.
Применение комплексонометрического титрования
Читайте также:

