Металлолигандный гомеостаз и причины его нарушения реферат
Обновлено: 02.07.2024
Комплексы – соед, содержащие в своем сост сложные частицы-комплексы, способные к самостоятельному существованию в узнахкристалич решетки или в р-ре и образованные из реально существующих более простых частиц.
Нормальноефункционир-е многих систем орг-ма чел-ка определяется Металло-лигандным гомеостазом (МЛГ), т.е. постоянством конц-иибиометаллов и биополимеров, их взаимодействием и равновесием.
Нарушение МЛГ приводит к развитию различ. Заболеваний. Регуляция МЛГ осуществляется с помощью нерв-ой, эндокринной, иммунной сист-ой.
I. Причина нарушения МЛГ: Дефицит эссенциальных(необходимых) МЭ (микроэлементов) . к эссенц-ым МЭ орг чел относятся: Cr, Mn, Fe, Co, Zn, Mo. Их дефицит приводит к заболеванию. Пример: недостаток Fe приводит к железодефицитной анемии, при этом нарушается синтез гемоглобина и его ф-ций (буферной и транспортной).
Причины дефицита эссенц МЭ в орг:
1.их недостаток в пище
2.особенности биогеохимич. провинций, некоторые регионы хар-сяпониженнымсодерж МЭ в почве и воде
3. антогонизм ионов металлов :Zn-Fe избыток цинка снижает активность железосодер-х ферментов
4. в-ванаходящ-ся в пище: чай и кофе содержат полифенольные соед, образующие прочные комплексы с ионами железа, тормозя тем самым всасывания этого МЭ
Коррекция при дефиците МЭ: добавление в пищу соед-нийсодержащих необходимые МЭ (на промышленном или на бытовом уровне)
II. Причина нарушения МЛГ: Избыток эссенциальных МЭ приводит к металлотоксикозам.
Причины избыткааэссенц МЭ в орг:
1.Особенности биохим провинции. (болезнь Ковальского- эндемические молибденовые подагры)
2.условия производства на предприятиях с получение, переработкой и применением цвет и черн металлов и сплавов (заболевания: сидерозы легких и глаз, медные лихорадки)
3. использование несовременных технологий : МЭ сразу поступают в большом кол-ве в пищу и напитки или сначала в окр. Среду, а затем с водой в орг (болезнь любителей пива – тяжелая сердеч недостаточность, особенно когда в пиво для улучшения пенообразования добавляют CoCl2)
4. прием лекарств средств содержащих МЭ
Коррекция при избытке МЭ: выведения избытка ионов из орг в том числе с помощью хелатообразующих лигандов (L) и уменьшение дозы лекарств или их отмена.
III. Причина нарушения МЛГ: избыток L-ов, конкурирующих с биолигандами
Наличие этих L приводит к процессу – конкуренции за комплекса-образователь (М)
M_Б L_Б + L_T M_Б L_T + L_Б
L_T-токсичный лиганд; M_Б L_Б – биологически важное комплексное соед, состоящие из биоМе и ибио L. Если Кн〖(M〗_Б L_T) 0 к р-ля
b(x)моляльная концентрация . моль/кг =n/m(р-ля) =m/M*m(р-ля) в кг !
Kэ- коэффициент пропорциональности =1. 86
2) Понижение температуры замерзания растворов неэлектролитов прямо пропорциональнамоляльности вещества в растворе.
К производным пиридина относятся ЛС природного и синтетического происхождения с разным фармакологическим действием. В основе химической структуры ЛС рассматриваемой группы находится пиридин — шестичленный гетероцикл с одним атомом азота, который участвует в образовании единой замкнутой системы из 6 я-электронов. Из-за отрицательного индукционного эффекта атома азота электронная плотность у атомов углерода, особенно в положениях 2, 4 и 6, понижена (я-дефицитныйгетероцикл). Атом азота с таким электронным строением образует основный центр (рКа = 5,20) и называется пиридиновым. По сравнению с алифатическими аминами основные свойства пиридина выражены значительно слабее.
Основные свойства пиридина и его производных проявляются при взаимодействии с соединениями, способными принимать свободную пару электронов пиридинового азота на свою незаполненную орбиталь. Так, при взаимодействии с протоном в водных растворах кислот они образуют пиридиниевый катион RC5H4NH+. С кислотами Льюиса образуются координационные соединения, с алкилгалогенидами — алкилпиридиниевые соли.
По химическому строению ЛВ рассматриваемой группы можно разделить на следующие группы (табл. 11.4):
производные пиридин-3-карбоновой (никотиновой) кислоты. К ним относятся кислота никотиновая, никотинамид, кордиамин, пикамилон;
производные пиридин-4-карбоновой (изоникотиновой) кислоты. В эту группу входят изониазид, фтивазид, ниаламид;
производные пиридинметанола. К ним относятся пиридоксина гидрохлорид (В6), пиридоксаль фосфат, пиридитол, пармидин, эмоксипин;

4) производные дигидропиридина. К ним относится нифедипин (коринфар).Рассмотрим структурные элементы ЛС, производных пиридина: Производные пиридина и пиперидина
Наименование (русское, английское, латинское). Химическая формула. Молекулярная масса. Применение в разных странах
Фармакологическая группа. Лекарственная форма. Условия хранения
1. Изонназид:Гидразид 4-пиридинкарбоновой кислоты
Применяют для лечения всех форм и локализаций активного туберкулеза у взрослых и детей. Таблетки по 0,1; 0,2 или 0,3 г; порошок; 10 % раствор в ампулах по 5 мл.
Хранение: по списку Б. Порошок в хорошо укупоренных банках оранжевого стекла; таблетки — в защищенном от света месте; при температуре не выше 10 °С
Бесцветные кристаллы или белый кристаллический порошок без запаха слабогорького вкуса. 7/™= 170-174 "С. Мало растворим в воде, хорошо — в хлороформе, этилацетате, метаноле. Водные растворы для инъекций имеют рН 6,0— 7,5
2. Фтивазид — Phthivazide — Phtivazidum
4-Пиридинкарбоновой кислоты [(4-гид-рокси-3-метоксифенил)метилен]гидразид
C14H13N303 289,29 ГФ, РЛС
Применяют для лечения всех форм и локализаций активного туберкулеза у взрослых и детей. Порошок; таблетки по 0,1; 0,3 или 0,5 г в упаковке по 100 штук.
Хранение: по списку Б в хорошо укупоренной таре
Светло-желтый или желтый мелкокристаллический порошок, со слабым запахом ванилина, без вкуса. Плохо растворим в воде и спирте, легко — в неорганических кислотах и щелочах.
3. Ниаламид — Nialamide — Nialomidum
2-[3-оксо-3-[(фенилметил)амино]пропил] гидразид 4-пиридинкарбоновой кислоты
1 ^NH-NH-CH2-CH2— C-NH-CH,
C16H19N402 299,18 ГФ, РЛС
Применяют в психиатрической практике при депрессивных состояниях различных нозологических форм, сочетающихся с вялостью, заторможенностью, безынициативностью.
Таблетки (драже) по 0,025 (25 мг). Хранение: по списку Б в сухом, прохладном, защищенном от света месте
Белый или белый со слабым желтоватым оттенком мелкокристаллический порошок. Мало растворим в воде, тр
3.Укажите вид и знак электронных эффектов в этиламине (этанамине) и п-аминобензойной (4-аминобензойной) кислоте.
Обозначьте эффекты графически.
Объясните, почему только в одном случае аминогруппа проявляет мезомерный эффект.
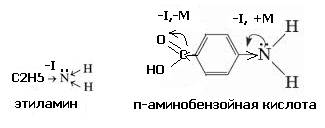
В случае этиламина наблюдается смещение электронной плотности посигма связи С-N от радикала к аминогруппе, поскольку азот – более электроотрицателен, чем углерод. Вид и знак эффекта – I (отрицательный индукционный эффект).
У п-аминобензойной кислоты имеется лве функциональные группы (аминогруппа и карбоксильная группа), проявляющие разные виды электронных эффектов:
Для аминогруппы характерно сочетание отрицательного индукционного и положительного дмезомерного эффектов (-I,+M); для карбоксильной группы - отрицательного индукционного и отрицательного мезомерного эффектов (-I,-M).
Аминогруппа проявляет мезомерный эффект (р-π сопряжение 2рэлектронов азота с π –электронной плотностью бензольного кольца) только в п-аминобензойной кислоте, поскольку в этиламине нет π-связей.
БИЛЕТ 10( начни с 3 и 2, потом 1)
© 2014-2022 — Студопедия.Нет — Информационный студенческий ресурс. Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав (0.008)


Важнейшим классом бионеорганических комплексов металлов являются транспортные комплексы, в которых один или несколько атомов металла связаны с атомами азота, кислорода или серы белковых молекул, выступающие в роли полидентатных лигандов. Одним из основных переносчиков ионов металлов в человеческом организме является низкомолекулярный белок металлотионеин (Мr=6500), содержащий большое число цистеиновых фрагментов. Один моль металлотионеина способен перенести 7-12 моль таких жизненно необходимых элементов, как Zn, Cu и Se. При отравлениях тяжелыми металлами (Сd, Hg, Pb, Ag, As) данный белок выполняет защитную функцию, связывая их в прочные и относительно малотоксичные комплексы. Железосодержащий белок трансферрин выполняет преимущественно транспортные функции. Несмотря на сравнительно низкое содержание железа (2 моль ионов Fe3+ на одну молекулу белка), трансферриновые комплексы обеспечивают высокую скорость тканевого обмена данного элемента и являются важными переносчиками железа.
Изучение бионеорганических комплексов дает важную информацию об особенностях их метаболизма и позволяет разрабатывать эффективные способы коррекции заболеваний, связанных с недостатком (или, наоборот, с избытком) тех или иных элементов в человеческом организме.
Применение комплексных соединений в медицине и фармации связано также с их использованием в методах качественного и количественного анализа – в комплексонометрии. Широкое распространение получила комплексонометрия в медико-биологических исследованиях. Этот метод необходим для определения в живых организмах кальция, магния и многих микроэлементов. Комплексонометрия применяется в анализе лекарственного сырья, питьевых, минеральных и сточных вод. В биологии и медицине комплексоны используются не только в аналитических целях, но и в качестве стабилизаторов при хранении крови, так как комплексоны связывают ионы металлов, катализирующих реакции окисления. Комплексоны применяются также для выведения из организма ионов токсичных металлов (Рb2+, Cd2+ , Hg2+ и др.), радиоактивных изотопов и продуктов их распада.
При нормальных условиях функционирования организма концентрация биотиков, в том числе, металлов и лигандов, поддерживается на определенном уровне, оптимальном для выполнения специфических биологических функций. Это объясняют механизмом авторегуляции живых организмов, обеспечивающим поддержание стационарных условий, который называют гомеостазом.
Причем в живых системах непрерывно происходит образование и разрушение биокомплексов, которые состоят из катионов различных биометаллов и биолигандов — аминокислот, пептидов, порфиринов, нуклеотидов и т.д.
Постоянный обмен веществ с окружающей средой дает возможность организму поддерживать на определенном уровне концентрации веществ, которые участвуют в равновесных процессах комплексообразования, обеспечивая состояние так называемого металло-лигандного гомеостаза.
Роль металло-лигандного гомеостаза
Для каждого биометалла характерна своя совокупность равновесных процессов металл-биолиганд, которая определяется устойчивостью образованных комплексов и концентрацией во внутренней среде как ионов этого металла, так и биолигандов.
Подробно изученной является металло-лигандное равновесие катионов железа, которые находятся в связанном состоянии (в составе таких биокомплексов, как миоглобин, гемоглобин, цитохромы, ферритин, трансферрин, ферредоксин), а также металлоферментов, в частности каталазы и пероксидазы.
Каждое из этих биологически активных веществ выполняет в организме специфическую функцию, но в целом их объединяет наличие в молекулах ионов Fe(II) и Fe(III). Следовательно, условием нормального функционирования многих биокомплексов железа является определенная концентрация этих ионов в крови.
Нарушение суммарного равновесия приводит к патологическим явлениям — железоизбыточных или железодефицитных состояний, то есть сидерозу, в первом случае, или анемии — во втором. Описано много патологий, связанных с нехваткой или избытком того или иного биоэлемента в организме. Например, дефицит ионов Cu(I), Cu(II) вызывает синдром Марфана, синдром Менкеса, болезнь Вильсона-Коновалова, цирроз печени, энфизему легких, анемию.
Избыточное поступление этих ионов в организм приводит к заболеванию различных органов (суставов, почек, легких, печени), которые называют гиперкупремия, или гиперкупреоз (медная лихорадка). Повышенное содержание калия в крови (гиперкалиемия) наносит вред сердечно-сосудистой системе, а его дефицит (гипокалиемия) приводит к изменению проводимости миокарда, повреждению мышц. Избыток ионов Кальция (гиперкальциемия) способствует возникновению катаракты и атеросклероза, а недостаток (гипокальциемия) может вызвать приступы общих или местных судорог (тетания).
Причины нарушения металло-лигандного гомеостаза
Нарушение металло-лигандного гомеостаза возможно из разных причин.
- дефицит или избыток биоэлементов;
- поступление катионов токсических металлов;
- поступление или образование посторонних лигандов;
- поступление ксенобиотиков.
Катионы токсичных металлов (Pb, Hg, Cd, Be, Sr, TI) и и некоторых неметаллов (As, Sb), токсичные лиганды (CO, CN -, S2-), ксенобиотики (пестициды, канцерогены) поступают в окружающую среду вследствие антропогенной деятельности человека — выбросы металлургической, электрохимической, горной промышленности,отходы электростанций, котельных установок, автотранспорта и пр.
В следствии попадания токсичных металлов или лигандов в организм человека с воздухом, водой или продуктами питания к естественным природным равновесиям приобщаются новые, неестественные для организма, равновесия. Это приводит к образованию чуждых для организма комплексов, не способных к выполнению определенных биологических функций.
Следовательно, избыток или недостаток в организме необходимых металлов, попадание в организм тяжелых металлов и их соединений, ядовитых лигандов, ксенобиотиков, вирусов нарушают состояние металло-лигандного гомеостаза, что приводит к возникновению патологических процессов в организме человека и животных.
Изоморфизм - свойство химически и геометрически близких атомов, ионов и их сочетаний замещать друг друга в кристаллической решетке , образуя кристаллы переменного состава; т.е. изоморфизм – это изменение химического состава минерала при сохранении его кристаллической структуры.
Изоморфны, например, кристаллы дигидрофосфатов и арсенатов щелочных металлов: KH2PO4 (KDP), NH4H2PO4 (ADP), RbH2PO4, CsH2PO4, KH2AsO4, PbH2AsO4 и др. Все они при комнатной температуре кристаллизуются в одном классе с сходной внешней формой и близкими параметрами решетки, все имеют сегнето- и параэлектрические фазы, Этот изоморфный ряд интересен тем, что здесь ни замена катиона (например, K + на NH4 + ), ни замена аниона (например, PO4 - на AsO4 - ) не меняет морфологию кристалла.
Ураты - соли мочевой кислоты, накапливаются в крови при некоторых болезнях, например при подагре, нефритах, лейкемиях; могут откладываться в тканях.
Оксалаты (от греч. oxalís — щавель), кислые и средние соли щавелевой кислоты , например HOOC—COOK, NaOOC—COONa.
Карбонаты - соли и эфиры угольной кислоты Н2СО3. Различают нормальные (средние) соли с анионом CO32- (напр., К2СО3) и кислые (гидрокарбонаты) с анионом НСО3- (напр., КНСО3).
№ 7.3 Лигандообменные равновесия и процессы. Конкуренция за лиганд или за комплексообразователь: изолированное и совмещенное лигандообменные равновесия. Константа нестойкости комплекса. Инертные и лабильные комплексы. Представления о строении металлоферментов и других биокомплексных соединений (гемоглобин, цитохромы, кобаламины). Физико-химические принципы транспорта кислорода гемоглобином. Металло-лигандный гомеостаз и причины его нарушения. Механизм токсического действия тяжелых металлов и мышьяка на основе теории жестких и мягких кислот и оснований (ЖМКО). Термодинамические принципы хелатотерапии. Механизм цито-токсического действия соединении платины.
Если в системе несколько лигандов с одним ионом металла или несколько ионов металла с одним лигандом способных к образованию комплексных соединений, то наблюдаются конкурирующие процессы: в первом случае лигандообменное равновесие - конкуренция между лигандами за ион металла, во втором случае металлообменное равновесие - конкуренция между ионами металла за лиганд. Преобладающим будет процесс образования наиболее прочного комплекса.
Нарушения металлолигандного гомеостаза вызывают нарушения процесса обмена веществ, ингибируют активность ферментов, разрушают важные метаболиты, такие как АТФ, клеточные мембраны, нарушают градиент концентрации ионов в клетках. Поэтому создаются искусственные системы защиты. Должное место в этом методе занимает хелатотерапия (комплексонотерапия).
Хелатотерапия – это выведение токсичных частиц из организма, основанное на хелатировании их комплексонатами s–элементов.
С практическими целями часто пользуются величиной, обратной константе устойчивости - константой нестойкости Кн:

где β- константа устойчивости.
Чем меньше константа нестойкости, тем прочнее комплекс. Константы нестойкости позволяют прогнозировать направление процессов комплексообразования.
Основные термодинамические принципы хелатотерапии можно сформулировать в двух положениях.
1. Детоксикант (Lg): должен эффективно связывать ионы токсиканты (Мт, Lт), вновь образующиеся соединения (МтLg),должны быть прочнее, чем те, которые существовали в организме. Ку(МтLg) > Ку (МбLт), Ку(МбLтLg) > Ку (МбLт), где Ку – константа устойчивости;
2. Детоксикант не должен разрушать жизненно необходимые комплексные соединения (МбLб); соединения, которые могут образовываться при взаимодействии детоксиканта и ионов биометаллов (MбLq), должны быть менее прочными, чем существующие в организме.
Гемоглобин - дыхательный пигмент, придающий крови красный цвет. Гемоглобин состоит из белка и железопорфирина и переносит кислород от органов дыхания к тканям тела и углекислый газ от них к дыхательным органам.
Цитохромы - сложные белки (гемопротеиды), осуществляющие в живых клетках ступенчатый перенос электронов и/или водорода от окисляемых органических веществ к молекулярному кислороду. При этом образуется богатое энергией соединение АТФ.
Кобаламины - природные биологически активные кобальторганические соединения. Структурной основой К. является корриновое кольцо, состоящее из 4 пиррольных ядер, у которых атомы азота связаны с центральным атомом кобальта.
Физико-химические принципы транспорта кислорода гемоглобином - Атом (Fe (II)) (один из компонентов гемоглобина) способен образовывать 6 координационных связей. Из них четыре используются для закрепления самого атома Fe(II) в геме, пятая связь - для связывания гема с белковой субъединицей, а с помощью шестой связи происходит связывание молекулы О2 или СО2.
Реакция, лежащая в основе переноса кислорода гемоглобином.
HHb+ + O2 HbO2 + H+

Токсичность солей тяжелых металлов. Хорошо известно, что загрязнение окружающей среды соединениями токсичных элементов — тяжелых металлов: ртути, свинца, кадмия, хрома, никеля — может приводить к отравлениям. Ядовитость или токсичность таких соединений во многих случаях объясняется взаимодействием катионов тяжелых металлов Мт с бионеорганическими комплексами. Реакция, описывающая это взаимодействие, может быть записана в виде
№ 7.4 Редокс-равновесия и процессы. Механизм возникновения электродного и редокс-потенциалов. Уравнения Нернста - Петерса. Сравнительная сила окислителей и восстановителей. Прогнозирование направления редокс-процессов по величинам редокс-потенциалов. Влияние лигандообменного окружения центрального атома на величину редокс - потенциала. Физико-химические принципы транспорта электронов в электронотранспортной цепи митохондрий. Общие представления о механизме действия редокс-буферных систем. Токсическое действие окислителей (нитраты; нитриты, оксиды азота). Обезвреживание кислорода, пероксида водорода и супероксид-иона. Применение редокс-реакций для детоксикации.
Окислителями называются вещества или частицы, принимающие электроны от других веществ или частиц — восстановителей. Окисленную и восстановленную форму одного и того же вещества называют редокс-системой (редокс-парой). Для протекания окислительно-восстановительной реакции (редокс-реакции) необходимо наличие как минимум двух веществ, относящихся к разным редокс-системам. В общем виде реакции такого типа можно представить уравнением:

В ходе окислительно-восстановительной реакции окислитель (Ох1) превращается в сопряженный восстановитель (Red1), а восстановитель (Red2) - в сопряженный окислитель (Ох2).

Потенциал , возникающий на границе раздела металл — раствор соли этого металла, называют электродным. Его величина φ определяется уравнением Нернста:где φ° — стандартный потенциал электродной реакции (при Т = 298 К и активности иона металла а,= 1); z— число электронов, теряемых атомом металла при образовании катиона; R— универсальная газовая постоянная; F — постоянная Фарадея (96500 Кл/моль). Величина потенциала в единицах СИ измеряется в вольтах (В).

Количественной характеристикой редокс-систем, в которых и окислитель, и восстановитель находятся в растворенном состоянии, является редокс-потенциал. Для его вычисления используется следующая форма уравнения Нернста:где а(Ох) и a(Red) — активности окисленной и восстановленной форм соответственно; n —число электронов, принимающих участие в элементарном редокс-процессе; φ° — стандартный редокс-потен-циал (т.е. потенциал, измеренный при условии а(Ох) = a(Red) = 1 и данной температуре).
Чем больше величина редокс-потенциала , тем сильнее окислитель и слабее сопряженный ему восстановитель. Сильный окислитель вступает в реакции с большим числом восстановителей, чем слабый, и/или вызывает более глубокое окисление восстановителей.
Токсическое действие оксидов азота связано с их высокой окислительно-восстановительной способностью.
Токсическое действие нитратов связано с восстановлением их до нитритов, аммиака, гидроксиламина под влиянием микрофлоры пищеварительного тракта и тканевых ферментов. Если в организм человека поступают высокие дозы нитратов, через 4–6 ч появляются тошнота, одышка, посинение кожных покровов, диарея.
В зависимости от дозы нитратов , поступающих в организм, отмечают
патоморфологические изменения разной степени: некроз или зернистая
дистрофия в сильной степени в печени, почках, миокарде.
Биологическое окисление протекает по сложным механизмам при участии большого числа ферментов. В митохондриях окисление происходит в результате переноса электронов от органических субстратов-
интермедиатов на элементный кислород, который при этом восстанавливается до воды:

№ 7.5 Совмещенные равновесия и конкурирующие процессы разных типов. Константа совмещенного равновесия. Совмещенные равновесия и конкурирующие процессы разных типов, протекающие в организме в норме, при патологии и при корреции патологических состояний.
Одним из видов совмещения разнотипных равновесий является протолитическое — гетерогенное — равновесие. В лабораторной практике с ним встречаются, изучая растворимость осадков при разных значениях рН. Растворимость труднорастворимых солей, образованных анионами слабых кислот, значительно зависит от рН раствора, т.е. от кислотности. Объясняется это возникающими конкурирующими процессами за анион слабой кислоты между ионом металла и протоном:
В этом совмещенном равновесии объектом конкуренции является анион слабой кислоты (В"), а конкурирующими частицами - ион металла (М + ) и протон (Н + ). Выигрывает конкуренцию ион металла — образуется осадок, выигрывает протон — осадок растворяется. Преобладание того или иного процесса определяется общей константой совмещенного равновесия, которая определяется через частные константы равновесия, чаще всего диссоциативного типа (константы кислотности для протолитических равновесий, константы растворимости для гетерогенных, константы нестойкости для лиган-дообменных).
Адсорбция и абсорбция — поглощение в объёме тела, объединяются общим термином сорбция . Явление А. тесно связано с особыми свойствами вещества в поверхностном слое. Например, молекулы, лежащие на поверхности раздела фаз жидкость — пар, втягиваются внутрь жидкости, т. к. испытывают большее притяжение со стороны молекул, находящихся в объёме жидкости, чем со стороны молекул пара, концентрация которых во много раз меньше концентрации жидкости. Это внутреннее притяжение заставляет поверхность сокращаться и количественно характеризуется поверхностным натяжением . По той же причине молекулы какого-либо другого вещества, оказавшиеся вблизи поверхности, притянутся к ней и произойдёт А. После А. внутреннее притяжение частично компенсируется притяжением со стороны адсорбционного слоя и поверхностное натяжение уменьшается. Гиббс вывел формулу, связывающую значение А. с изменением поверхностного натяжения. Те вещества, А. которых сильно уменьшает поверхностное натяжение, принято называть поверхностно-активными (дифильные и ассиметричные, одноатомные спирты, одноосновные карбоновые кислоты, амины, эфиры).
Изотерма адсорбции - зависимость адсорбции от равновесной концентрации растворенного вещества при постоянной температуре.

Поверхностно-неактивные вещ- ва (адсорбирующие отрицательно) либо не изменяют коэффициент поверхностного натяжения водной фазы, либо незначительно его увеличивают.(большинство неорганический вещ-в: кислоты, щелочи, соли) Мера адсорбции-Г(гамма)ед. изм.-моль\м2.
Уравнение Гиббса: Г=-Сср/RT Х ср.ро/ср.С
При малых концентрациях пав углеводородные радикалы лежат на поверхности полярной жидкости, а полярные группировки погружены в нее. С увеличением конц. Пав в растворе число молекул, находящихся в поверхностном слое, возрастает. Это приводит в пределе к образованию на граничной поверхности насыщенного мономолекулярного адсорбционного слоя, а котором молекулы пав предельно ориентированы.-это слой Ленгмюра.
Биологическая мембрана (Даниэли и Давсон): основной элемент мембранных структур клетки явл. Биомолекулярный слой из молекул липидов, полярные(взаимодействуют с белками) группировки направлены наружу, а неполярные углеводородные радикалы – внутрь. Белки образуют симметричные и ассиметричные распределия белков в клеточных мембранах. Среди мембранных есть способные взаимодействовать с гидрофобными радикалами и проникать вглубь мембраны(интегральные белки) наиболее принятая – мозаичная модель.поры- ионные каналы(облад. Избирательной проницаемостью)

Система гемостаза является сложной, многокомпонентной и выполняет массу функций, важнейшими из которых являются остановка кровотечения, поддержание крови в жидком состоянии, участие в заживлении повреждений органов и тканей.
Она включает в себя факторы свертывания крови, биологические молекулы, тромбоциты, стенки сосудов, а также нейрогуморальные механизмы, которые регулируют работу этих факторов. Нарушение системы гемостаза может возникать при выходе из строя одного или нескольких компонентов. В итоге нарушается баланс между свертывающими и противосвертывающими механизмами с развитием определенных последствий для организма.
Причины нарушений системы гемостаза
Выделяют приобретенные и врожденные. К приобретенным состояниям относятся:
- вмешательство в антигенную структуру тромбоцитов за счет вирусных агентов, определенных лекарственных препаратов, аутоимунных процессов;
- поражение красного костного мозга ионизирующим излучением, опухолевым процессом, химическими веществами;
- нарушение проницаемости сосудистой стенки за счет снижения синтеза коллагена;
- заболевания печени, которые приводят к снижению продукции различных факторов свертывания крови;
- недостаток витамина К.
К врожденным причинам нарушений системы гемостаза относят тромбоцитопению, болезнь Виллебранда, изменения в генах, которые кодируют синтез факторов свертывания крови, наследственные гипофибринемии.
Симптомы нарушений системы гемостаза во многом зависят от того, какой именно компонент пострадал. Если перевес оказывается на стороне свертывающих факторов, то ярко выраженная клиническая картина зачастую отсутствует. Обычно пациентов беспокоит общее недомогание (головная боль, слабость, быстрая утомляемость), что не всегда является для них поводом обратиться за медицинской помощью. Характерные симптомы нарушений системы гемостаза появляются при тромбозе сосудов. В таких случаях могут развиваться инфаркт, инсульт, тромбоэмболия легочной артерии, ДВС-синдром. Данные состояния оборачиваются тяжелыми последствиями для организма и часто становятся причиной летального исхода.
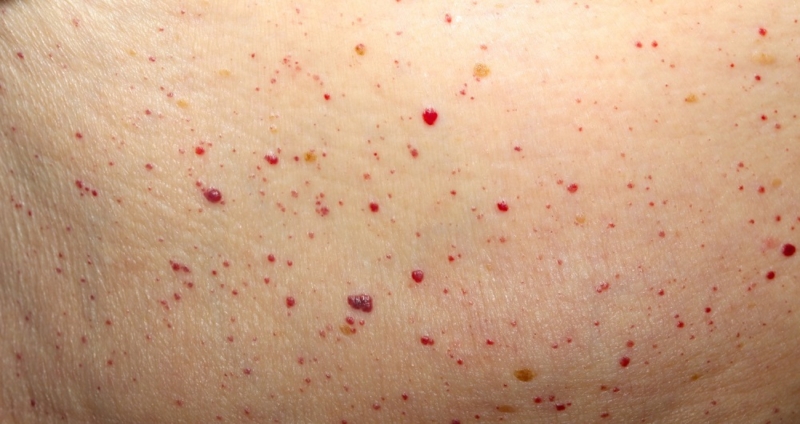
При нарушениях системы гемостаза, которые привели к активации противосвертывающих компонентов, развиваются следующие признаки:
- повышенная кровоточивость десен;
- точечные кровоизлияния на коже (петехии);
- появление синяков без видимых на то причин;
- при нарушении целостности кожных покровов кровь долго не останавливается.
Кровотечения могут быть не только наружными, но и внутренними. Их не всегда удается заблаговременно распознать, что также может обернуться тяжелыми последствиями для организма.
Методы диагностики нарушений системы гемостаза
Для выявления патологии могут применяться следующие методы:
- определение времени кровотечения (по Дюке, по Айви, по Ли — Уайту);
- общий анализ крови с формулой;
- определение агрегации тромбоцитов;
- протромбиновое время (ПТВ) и протромбиновый индекс (ПТИ);
- активированное частичное тромбопластиновое время (АЧТВ) и др.
В зависимости от конкретных нарушений системы гемостаза врач может назначать как отдельные показатели, так и комплексное исследование — коагулограмму. В нее входят такие показатели, как ПТВ, ПТИ, АЧТВ, определение уровня фибриногена и D-димеров и т. д.
Читайте также:

