Метаболический синдром реферат по терапии
Обновлено: 08.07.2024
В 1948 г. известный клиницист Е. М. Тареев писал: «Представление о гипертонике наиболее часто ассоциируется с ожирелым гиперстеником, с возможным нарушением белкового обмена, с засорением крови продуктами неполного метаморфоза — холестерином, мочевой кис
ИР — полигенная патология, в развитии которой могут иметь значение мутации генов субстрата инсулинового рецептора (IRS-1 и IRS-2), β3-адренорецепторов, разобщающего протеина (UCP-1), а также молекулярные дефекты белков сигнального пути инсулина (глюкозные транспортеры). Особую роль играет снижение чувствительности к инсулину в мышечной, жировой и печеночной тканях, а также в надпочечниках. В миоцитах нарушаются поступление и утилизация глюкозы, в жировой ткани развивается резистентность к антилиполитическому действию инсулина. Интенсивный липолиз в висцеральных адипоцитах приводит к выделению большого количества свободных жирных кислот (СЖК) и глицерина в портальный кровоток. Поступая в печень, СЖК, с одной стороны, становятся субстратом для формирования атерогенных липопротеидов, а с другой — препятствуют связыванию инсулина с гепатоцитом, потенциируя ИР. ИР гепатоцитов ведет к снижению синтеза гликогена, активации гликогенолиза и глюконеогенеза. Долгое время ИР компенсируется избыточной продукцией инсулина, поэтому нарушение гликемического контроля манифестирует не сразу. Но, по мере истощения функции β-клеток поджелудочной железы, наступает декомпенсация углеводного обмена, сначала в виде нарушенных гликемии натощак и толерантности к глюкозе (НТГ), а затем и сахарного диабета 2 типа (Т2СД). Дополнительное снижение секреции инсулина при МС вызывается длительным воздействием высоких концентраций СЖК на β-клетки (так называемый липотоксический эффект). При имеющихся генетически обусловленных дефектах секреции инсулина развитие Т2СД значительно ускоряется.
Согласно другой гипотезе, ведущую роль в развитии и прогрессировании инсулинорезистентности играет жировая ткань абдоминальной области. Особенность висцеральных адипоцитов — высокая чувствительность к липолитическому действию катехоламинов и низкая к антилиполитическому действию инсулина.
Следует особо остановиться на механизмах развития артериальной гипертонии (АГ) при МС, некоторые из них до недавнего времени были неизвестны, ввиду чего патогенетический подход к лечению МС был не до конца разработан.
Существуют многочисленные исследования, посвященные изучению тонких механизмов влияния инсулинорезистентности и гиперинсулинемии на уровень АД.
В норме инсулин обладает сосудистым протективным эффектом за счет активации фосфатидил-3-киназы в эндотелиальных клетках и микрососудах, что приводит к экспрессии гена эндотелиальной NO-синтазы, высвобождению NO эндотелиальными клетками и инсулин-обусловленной вазодилатации.
В настоящее время установлены следующие механизмы воздействия хронической гиперинсулинемии на АД:
- стимуляция симпатоадреналовой системы (САС);
- стимуляция ренин-ангиотензин-альдостероновой системы (РААС);
- блокада трансмембранных ионообменных механизмов с повышением содержания внутриклеточного Na+ и Са++, уменьшением К+ (увеличение чувствительности сосудистой стенки к прессорным воздействиям);
- повышение реабсорбции Na+ в проксимальных и дистальных канальцах нефрона (задержка жидкости с развитием гиперволемии), задержка Na+ и Са++ в стенках сосудов с повышением их чувствительности к прессорным воздействиям;
- стимуляция пролиферации гладкомышечных клеток сосудистой стенки (сужение артериол и увеличение сосудистого сопротивления).
Инсулин принимает участие в регуляции активности симпатической нервной системы в ответ на прием пищи. В экспериментальных работах установлено, что при голодании активность САС снижается, а при потреблении пищи повышается (особенно жиров и углеводов).
Предполагается, что инсулин, проходя через гематоэнцефалический барьер, стимулирует захват глюкозы в регуляторных клетках, связанных с вентромедиальными ядрами гипоталамуса. Это уменьшает их тормозящее воздействие на центры симпатической нервной системы ствола мозга и повышает активность центральной симпатической нервной системы.
В физиологических условиях этот механизм явлется регуляторным, при гиперинсулинемии же приводит к стойкой активации САС и стабилизации АГ.
Повышение активности центральных отделов САС приводит к периферической гиперсимпатикотонии. В почках активация β-рецепторов ЮГА сопровождается выработкой ренина, усиливается задержка натрия и жидкости. Постоянная гиперсимпатикотония на периферии в скелетных мышцах влечет нарушение микроциркуляторного русла, вначале с физиологической разреженностью микрососудов, а затем и к морфологическим изменениям, таким, как снижение количества функционирующих капилляров. Уменьшение числа адекватно кровоснабжаемых миоцитов, которые являются главным потребителем глюкозы в организме, ведет к нарастанию инсулинорезистентности и гиперинсулинемии. Таким образом, порочный круг замыкается.
Инсулин через митоген-активированную протеинкиназу усиливает повреждающие сосудистые эффекты за счет стимуляции различных факторов роста (тромбоцитарный фактор роста, инсулиноподобный фактор роста, трансформирующий фактор роста Р, фактор роста фибробластов и др.), что ведет к пролиферации и миграции гладкомышечных клеток, пролиферации фибробластов сосудистой стенки, накоплению внеклеточного матрикса. Эти процессы вызывают ремоделирование сердечно-сосудистой системы, приводя к потере эластичности сосудистой стенки, нарушению микроциркуляции, прогрессированию атерогенеза и, в конечном счете, к росту сосудистого сопротивления и стабилизации АГ.
Некоторые авторы полагают, что нарушение функции эндотелия играет основную роль в патогенезе АГ, связанной с метаболическими нарушениями. У лиц с инсулинорезистентностью и гиперинсулинемией наблюдается снижение реакции на вазодилатационное и усиление на вазоконстрикторное воздействие, что ведет к кардиоваскулярным осложнениям.
Для метаболического синдрома характерна гиперурикемия (встречается, по разным данным, у 22—60% больных с МС).
В настоящее время показано, что концентрация мочевой кислоты в крови коррелирует с триглицеридемией и степенью выраженности абдоминального ожирения; в основе этого явления лежит тот факт, что усиление синтеза жирных кислот активирует пентозный путь окисления глюкозы, способствуя образованию рибозо-5-фосфата, из которого происходит синтез пуринового ядра.
С учетом всех рассмотренных выше аспектов проблемы и должен формироваться терапевтический алгоритм патогенетического подхода к лечению метаболического синдрома.
Лечение метаболического синдрома
Комплекс лечения метаболического синдрома включает в себя следующие равнозначные позиции: изменение образа жизни, лечение ожирения, лечение нарушений углеводного обмена, лечение артериальной гипертонии, лечение дислипидемии.
Изменение образа жизни
Этот аспект лежит в основе успешного лечения метаболического синдрома.
Пищевой соли — не более 6 г в день (одна чайная ложка).
Пациентам рекомендуется ведение пищевого дневника, где они записывают, что, в каком количестве и в какое время было съедено и выпито.
Необходим отказ от табакокурения, это значительно снижает риск сердечно-сосудистых и онкологических осложнений.
Физическая активность. По оценкам G. Reaven, у 25% лиц, ведущих малоподвижный образ жизни, можно обнаружить инсулинорезистентность. Сама по себе регулярная мышечная активность приводит к метаболическим изменениям, снижающим инсулинорезистентность. Для достижения терапевтического эффекта достаточно ежедневно практиковать 30-минутную интенсивную ходьбу или три-четыре раза в неделю проводить 20—30-минутные пробежки.
Лечение ожирения
При лечении метаболического синдрома удовлетворительным результатом может считаться снижение массы на 10—15% в первый год лечения, на 5—7% на второй год и отсутствие рецидивов прибавки массы тела в дальнейшем.
Соблюдение низкокалорийной диеты и режима физической активности не всегда выполнимо для пациентов. В этих случаях показана лекарственная терапия ожирения.
Лечение нарушений углеводного обмена
Степень выраженности нарушений углеводного обмена при метаболическом синдроме колеблется от минимальной (нарушенные гликемия натощак и толерантность к глюкозе (НТГ)) до развития сахарного диабета 2 типа.
Лекарственные препараты, влияющие на углеводный обмен, в случае метаболического синдрома должны назначаться не только при наличии Т2СД, но и при менее тяжелых (обратимых!) нарушениях углеводного обмена. Гиперинсулинемия требует агрессивной терапевтической тактики. Имеются данные о наличии осложнений, характерных для сахарного диабета, уже на стадии нарушенной толерантности к глюкозе. Полагают, что это связано с частыми эпизодами постпрандиальной гипергликемии.
Мощный арсенал современных сахароснижающих средств позволяет выбрать в каждом конкретном случае оптимальную терапию.
1. Препараты, снижающие инсулинорезистентность
При метаболическом синдроме — препараты выбора.
В настоящее время единственным бигуанидом, снижающим инсулинорезистентность, является метформин. По результатам UKPDS, лечение метформином при Т2СД снижает риск смерти от сахарного диабета на 42%, инфаркта миокарда — на 39%, инсульта — на 41%.
Может считаться препаратом первого ряда в лечении метаболического синдрома.
Механизм действия: повышение чувствительности тканей к инсулину; подавление глюконеогенеза в печени; изменение фармакодинамики инсулина за счет снижения соотношения связанного инсулина к свободному и повышения соотношения инсулина к проинсулину; подавление окисления жиров и образования свободных жирных кислот, снижение уровня триглицеридов и ЛПНП, повышение ЛПВП; по некоторым данным — гипотензивный эффект; стабилизация или снижение массы тела. Снижает гипергликемию натощак и постпрандиальную гипергликемию. Гипогликемий не вызывает.
Может назначаться при НТГ, что особенно важно с точки зрения профилактики развития Т2СД.
К клиническому применению разрешены пиоглитазон и розиглитазон.
В России — малоприменяемая группа препаратов, вероятно, из-за относительной новизны, известного риска острой печеночной недостаточности и высокой стоимости.
Механизм действия: повышают захват глюкозы периферическими тканями (активируют GLUT-1 и GLUT-4, подавляют экспрессию фактора некроза опухолей, усиливающего инсулинорезистентность); уменьшают продукцию глюкозы печенью; снижают концентрацию свободных жирных кислот и триглицеридов в плазме за счет подавления липолиза (через повышение активности фосфодиэстеразы и липопротеинлипазы). Действуют только в присутствии эндогенного инсулина.
2. Ингибриторы α-глюкозидаз
Механизм действия: конкурентно ингибирует интестинальные α-глюкозидазы (сахаразу, мальтазу, глюкоамилазу) — ферменты, расщепляющие сложные сахара. Препятствует всасыванию простых углеводов в тонком кишечнике, что приводит к снижению постпрандиальной гипергликемии. Снижает массу тела и, как следствие, оказывает гипотензивное действие.
3. Секрeтогены инсулина
Препараты этого класса назначаются при метаболическом синдроме в случаях, когда не удается добиться удовлетворительного гликемического контроля с помощью средств, снижающих инсулинорезистентность, и/или акарбозы, а также при наличии противопоказаний к ним. Риск развития гипогликемий и увеличения массы тела при длительном применении требует строго дифференцированного подхода при выборе препарата. Назначение при НТГ не практикуется. Весьма эффективно сочетание секретогенов инсулина с бигуанидами.
А. Препараты сульфонилмочевины
Клинический опыт показывает, что монотерапия некоторыми секретогенами инсулина (в частности, глибенкламидом) у больных с метаболическим синдромом обычно оказывается неэффективной даже в максимальных дозах из-за нарастающей инсулинорезистентности — наступает истощение секреторной способности β-клеток и формируется инсулинопотребный вариант Т2СД. Предпочтение следует отдавать высокоселективным лекарственным формам, не вызывающим гипогликемий. Желательно, чтобы препарат можно было принимать один раз в день — для повышения комплаентности лечения.
Этим требованиям удовлетворяют препарат второй генерации гликлазид в фармакологической форме МВ (модифицированного высвобождения) и препарат третьей генерации глимепирид.
Гликлазид — высокоселективный препарат (специфичный к SUR1 субъединице АТФ-чувствительных калиевых каналов β-клетки), восстанавливает физиологический профиль секреции инсулина; повышает чувствительность периферических тканей к инсулину, вызывая посттранскрипционные изменения GLUT-4 и активируя действие инсулина на мышечную гликоген-синтетазу; снижает риск развития тромбозов, ингибируя агрегацию и адгезию тромбоцитов и повышая активность тканевого плазминогена; снижает уровень липидных пероксидов в плазме.
Глимепирид комплексируется с SURX рецептора сульфонилмочевины. Обладает выраженным периферическим действием: увеличивает синтез гликогена и жира за счет активации транслокации GLUT-1 и GLUT-4; снижает скорость глюконеогенеза в печени, повышая содержание фруктозо-6-бифосфата. Обладает более низкой, чем другие препараты сульфонилмочевины, глюкагонотропной активностью. Обеспечивает низкий риск гипогликемий — вызывает при минимальной секреции инсулина максимальное снижение глюкозы в крови. Обладает антиагрегационным и антиатерогенным эффектами, избирательно ингибируя циклооксигеназу и снижая превращение арахидоновой кислоты в тромбоксан А2. Комплексируется с кавеолином жировых клеток, что, вероятно, обусловливает специфичность влияния глимепирида на активизацию утилизации глюкозы в жировой ткани.
Б. Прандиальные регуляторы гликемии (секретогены короткого действия)
Быстродействующие гипогликемические препараты, производные аминокислот. В России представлены репаглинидом и натеглинидом.
Механизм действия — быстрая, кратковременная стимуляция секреции инсулина β-клеткой за счет быстрого обратимого взаимодействия со специфическими рецепторами АТФ-чувствительных калиевых каналов.
Считается, что натеглинид безопаснее в отношении развития гипогликемий: секреция инсулина, вызванная натеглинидом, зависит от уровня гликемии и снижается по мере уменьшения уровня глюкозы в крови. Исследуется возможность применения низких дозировок натеглинида при НТГ у больных с высоким риском сердечно-сосудистых осложнений (NAVIGATOR).
4. Инсулинотерапия
Раннее начало инсулинотерапии при метаболическом синдроме (за исключением случаев декомпенсации диабета) представляется нежелательным, так как, скорее всего, будет усугублять клинические проявления гиперинсулинизма. Однако следует отметить, что, во избежание осложнений сахарного диабета, компенсация углеводного обмена должна быть достигнута любой ценой. При неудовлетворительном эффекте от ранее перечисленных видов лечения должна быть назначена инсулинотерапия, возможно, в допустимых комбинациях с пероральными сахароснижающими препаратами. В отсутствии противопоказаний предпочтительна комбинация с бигуанидами.
Опасности висцерального ожирения. Определение массы абдоминального жира методом компьютерной томографии. Диагностика метаболического синдрома в поликлиниках и стационарах. Выявление нарушений углеводного обмена. Терапевтические приёмы снижения веса.
| Рубрика | Медицина |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 15.02.2014 |
| Размер файла | 1,0 M |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Министерства здравоохранения и социального развития Российской Федерации
Кафедра терапии, общей врачебной практики, эндокринологии и гастроэнтерологии
Реферат на тему:
Метаболический синдром
Выполнил: клинический интерн по
Содержание
1. Определение метаболического синдрома МС и факторы риска
2.1 Критерии диагноза
2.2 Формулировка диагноза
2.3 Диагностика МС на уровне первичного звена здравоохранения
2.4 Диагностика МС на уровне специализированной клиники
2.5 Методы диагностики
3. Дифференциальный диагноз МС
4.1 Общие принципы лечения
4.2 Немедикаментозые методы лечения
4.3 Лечение больных с ожирением и нарушением дыхания во время сна
4.4 Медикаментозное лечение
4.4.1 Препараты, влияющие на инсулинорезистентность
4.4.2 Гиполипидемическая терапия
4.4.3 Антигипертензивная терапия
5. Программы лечения больных с МС
Ожирение по признанию Всемирной организации здравоохранения (ВОЗ) рассматривают как неинфекционную эпидемию настоящего времени в связи с его широким распространением среди населения, высоким риском развития сердечно-сосудистых заболеваний (ССЗ), ранней инвалидизацией больных и преждевременной смертностью.
По данным ВОЗ ~ 30% жителей планеты страдают избыточным весом, из них 16,8% -- женщины и 14,9% -- мужчины. Численность людей, страдающих ожирением, прогрессивно увеличивается каждые 10 лет на 10%.
У лиц с ожирением вероятность развития артериальной гипертонии (АГ) на 50% выше, чем у лиц с нормальной массой тела (МТ). Согласно Фремингеймскому исследованию, на каждые лишние 4,5 кг веса систолическое артериальное давление (САД) повышается на 4,4 мм рт.ст. у мужчин и на 4,2 мм рт.ст. у женщин. В ряде работ была выявлена прямая пропорциональная зависимость между МТ и общей смертностью. Ожирение 1 ст. увеличивает риск развития СД-2 в 3 раза, II ст. -- в 5 раз и III ст. -- в 10 раз.
Особую опасность представляет центральный тип ожирения с преимущественным отложением жира в абдоминальной области. Частое сочетание висцерального ожирения, нарушений углеводного, липидного обменов, расстройств дыхания во время сна,
АГ и наличие тесной патогенетической связи между ними послужило основанием для выделения их в самостоятельный синдром -- метаболический.
Эксперты ВОЗ следующим образом оценили ситуацию по распространенности МС: ?Мы сталкиваемся с новой пандемией XXI века, охватывающей индустриально развитые страны. Это может оказаться демографической катастрофой для развивающихся стран. Распространенность метаболического синдрома (МС) в 2 раза превышает распространенность сахарного диабета (СД), и в ближайшие 25 лет ожидается увеличение темпов его роста на 50% .
Мета-анализ широкомасштабных исследований показал, что в популяции взрослого населения МС диагностируется от 10% в Китае до 24% в США. В большинстве исследований были определены общие закономерности, играющие важную роль в развитии МС, такие как возраст, постменопаузальный статус у женщин, поведенческие факторы -- малоподвижный образ жизни и преобладание углеводной диеты, социально-экономический статус. Недавно были получены результаты I российского исследования, проведенного на случайной выборке взрослого населения (п.=1800) в городе Чебоксары (Чувашская Республика, Приволжский федеральный округ). Оказалось, что 20,6% лиц в возрасте 30-69 лет имеют МС; у женщин он встречается в 2,4 раза чаще; с возрастом число больных увеличивается. В возрастном диапазоне 30-39 лет МС обнаружен у 1%, в 40-49 лет у 3,6%, в 50-59 лет у 9%, 60-69 лет у 7% респондентов.
Выделение МС имеет большое клиническое значение, поскольку с одной стороны это состояние является обратимым; при соответствующем своевременном лечении можно добиться исчезновения или, по крайней мере, уменьшения выраженности основных его проявлений, а с другой стороны, оно предшествует возникновению таких болезней как сахарный диабет 2 типа (СД-2) и атеросклероз -- болезней, которые в настоящее время служат основными причинами повышенной смертности населения.
Впервые в России предложены алгоритм и критерии диагностики МС для учреждений различного уровня: от первичного звена (поликлиники, амбулатории) до специали-зированных клиник в научно-исследовательских институтах и центров с высоким материально-техническим оснащением, а также алгоритм комплексного лечения МС.
1. Определение метаболического синдрома и факторы риска
МС характеризуется увеличением массы висцерального жира, снижением чувствительности периферических тканей к инсулину и ГИ, которые вызывают нарушения углеводного, липидного, пуринового обменов и АГ.
Факторы, влияющие на развитие МС:
Генетическая предрасположенность: Формирование МС генетически детерминировано. Известен ген к инсулиновым рецепторам, который локализуется на 19-й хромосоме. Описано более 50 мутаций этого гена. Существует множество исследований семей, обширных родословных и близнецов, родственники которых страдали СД-2. Результаты этих работ позволили прийти к твердому убеждению, что инсулинорезистентность (ИР) может быть генетически обусловлена. Гиперинсулинемия (ГИ) и инсулинорезистентность (ИР) находили у потомков родственников с анамнезом СД-2.
Избыточное питание: Наиболее важными факторами внешней среды, способствующими развитию МС, являются избыточное употребление жирной пищи и низкая физическая активность (НФА). В основе накопления жировых масс в организме лежит переедание животных жиров, содержащих насыщенные жирные кислоты (ЖК). Если масса потребляемого жира превосходит возможности организма по его окислению, то развивается и прогрессирует ожирение. Насыщенные ЖК, в избытке поступающие с пищей, вызывают структурные изменения фосфолипидов клеточных мембран и нарушение экспрессии генов, контролирующих проведение сигнала инсулина в клетку. Жиры более калорийны, чем белки и углеводы, 1 г жира содержит 9 ккал, тогда как белки и углеводы -- по 4 ккал. Поэтому при употреблении жиров организм при одинаковом объеме пищи получает в 2 раза больше калорий, чем при употреблении белков и углеводов.
Синдром обструктивного апноэ во сне (СОАС): СОАС часто сопутствует МС, и в настоящее время сочетание этих состояний принято обозначать как синдром Z. Ожирение -- основной фактор риска (ФР) развития СОАС, которым страдают 50% тучных людей.
С другой стороны, если СОАС развивается в связи с наличием других ФР (любые причины, приводящие к рассройству нормального носового дыхания), МС может быть следствием нарушений дыхания во время сна. В результате хронической гипоксии во время сна отсутствуют ночные пики выделения соматотропного гормона, что способствует развитию ИР.
Эффект изменения веса на течение СОАС был широко изучен в клинических исследованиях. Уровень глюкозы натощак и после нагрузки возрастал в зависимости от тяжести СОАС. ИР уменьшалась с увеличением тяжести апноэ. Отношение между СОАС и НТГ -- не зависело от ожирения и возраста.
Гиподинамия: Снижение физической активности (ФА) -- второй по значимости после переедания фактор внешней среды, способствующий развитию ожирения и ИР. При гиподинамии замедляются липолиз и утилизация ТГ в мышечной и жировой тканях и снижается транслокация транспортеров глюкозы в мышцах, что приводит к развитию ИР.
Артериальная гипертония (БГ): БГ является одним из основных симптомов, объединенных в понятие МС. В ряде случаев АГ может быть первичным звеном в патогенезе МС. АГ без лечения вызывает ухудшение периферического кровообращения, что приводит к снижению чувствительности тканей к инсулину и, как следствие, к относительным ГИ и ИР.
2. Диагностика
2.1 Критерии диагностики МС
Основной критерий признак центральное ожирение (ЦО) абдоминальное ожирение (АО), при котором окружность талии (ОТ) >80 см у женщин и > 94 см у мужчин.
Дополнительные критерии:
* АГ - АД (артериальное давление) > 140/90 мм рт.ст.
* повышение уровня триглицеридов (ТГ) > 1,7 ммоль/л
* снижение концентрации холестерина липопротеидов высокой плотности (ХС ЛВП) 3,0 ммоль/л
* гипергликемия натощак -- глюкоза в плазме крови натощак > 6,1 ммоль/л
* Нарушение толерантности к глюкозе (НТГ) -- глюкоза в плазме крови через 2 часа после теста на толерантность к глюкозе (ТТГ) в пределах >7,8 и 6 мес.) нарушение ночного сна; дневная сонливость; ожирение и АГ, особенно в ночные и утренние часы.
При наличии у пациента АО необходимо подробно выяснить анамнез заболевания, жизни, наследственности и провести дополнительные исследования. Это может иметь значение не только для диагностики МС, оценки прогноза, но и при определении тактики лечения.
Рекомендуемые исследования:
* Взвешивание пациента и измерение роста для вычисления ИМТ.
* Наиболее простой метод косвенного определения АО -- антропометрическое измерении ОТ.
* Для выявления нарушений углеводного обмена применяется определение глюкозы в крови натощак и через 2 часа после перорального приема 75 г глюкозы -- ПТТГ.
* Определение в крови параметров липидного обмена (общий холестерин (ОХС) и триглицеридов (ТГ)).
* Оценка уровня мочевой кислоты.
* Измерение АД методом Короткова.
* Опрос больного для определения скрытых нарушений дыхания во время сна (опросник).
2.4 Диагностика МС в условиях стационаров и специализированных клиник
Возможности специализированных стационаров и клиник позволяют расширить рамки диагностики МС за счет определения более полного липидного спектра (ЛС) и суточного мониторирования артериального давления (СМАД). В таких лечебных учреждениях существует возможность определения содержания инсулина в крови по показателям иммунореактивного инсулина и С-пептида, на основании изучения которых можно определить ГИ и оценить чувствительность периферических тканей к инсулину. Эти показатели позволят наиболее точно и корректно судить о наличии у больного МС и вы работать тактику лечения.
Рекомендуемые исследования:
* Определение ст. ожирения путем вычисления индекса массы тела (ИМТ).
* Измерение ОТ для установления типа ожирения.
* Определение массы абдоминального жира методом компьютерной томографии (КТ) или магнитно - резонансной томографии (МРТ) -- только для научных исследований.
* Для выявления нарушений углеводного обмена определяется уровень глюкозы в крови натощак и через 2 часа после перорального приема 75 г глюкозы -- пероральный тест толерантности к глюкозе (ПТТГ).
- Непрямыми методами с оценкой эффектов эндогенного инсулина:
* ПТТГ с определением инсулина
* В/в ТТГ (тест толерантности к глюкозе)
- Прямые методы, оценивающие эффект инсулина на метаболизм глюкозы (для научных исследований):
* Инсулиновый тест толерантности (ИТТ)
* Эугликемический гиперинсулинемический КЛЭМП -тест (ЭГК тест)
* Диагностика артерианой гипертонии (АГ):
- Офисное измерение артериального давления (АД); Суточное мониторирование артериального давления (СМАД)
* Выявление Синдрома обструктивного ночного апноэ (СОАС):
* Определение лабораторных показателей: общего холестерина ( ОХС), ТГ, ХС ЛВП, ХС ЛНП в сыворотке крови, мочевой кислоты в сыворотке крови; наличие микроальбуминурии (МАУ); определение показателей гемостаза: ингибитор активатора плазминогена-1, фибриноген, фактор VII, фактор Виллебранда и др.
* При необходимости дифференциальной диагностики МС с болезнью Иценко-Кушинга, акромегалией, феохромоцитомой, гипотиреозом и другими эндокринными болезнями, сопровождающимися АГ, ожирением и ИР необходимы дополнительные методы обследования: КТ или МРТ гипофиза и надпочечников; Ультразвуковое исследование (УЗИ) щитовидной железы; определение содержания в крови гормонов -- кортизола, альдостерона, ренина, адренокортикотропного гормона ( АКТГ), пролактина, гормона роста, тиреотропного гормона (ТТГ), трийодтиронина, тироксина и др.
Что такое метаболический синдром? Причины возникновения, диагностику и методы лечения разберем в статье доктора Чернышев А. В., кардиолога со стажем в 33 года.
Над статьей доктора Чернышев А. В. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Метаболический синдром (синдром Reaven) представляет собой симптомокомплекс, сочетающий в себе абдоминальное ожирение, инсулинорезистентность, гипергликемию (повышенное содержание глюкозы в крови), дислипидемию и артериальную гипертензию. Все эти нарушения связаны в одну патогенетическую цепь. Кроме того, такой синдром часто сочетается с гиперурикемией (избытком мочевой кислоты в крови), нарушением гемостаза (свёртываемости крови), субклиническим воспалением, синдромом обструктивного апноэ-гипопноэ сна (остановкой дыхания во сне). [4]
Метаболический синдром – хроническое, распространённое (до 35% в российской популяции), полиэтиологическое заболевание (возникающее по многим причинам), в котором главная роль принадлежит поведенческим факторам (гиподинамия, нерациональное питание, стресс). Имеет значение также наследственная предрасположенность к артериальной гипертензии, атеросклероззависимым заболеваниям и сахарному диабету второго типа. [5]
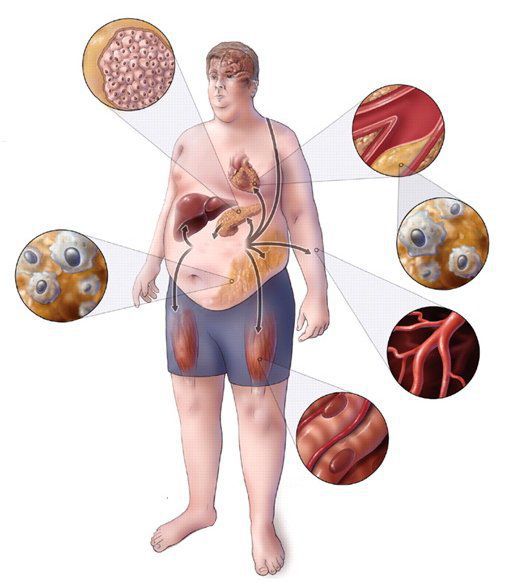
Практикующим врачам важно выделять группу риска метаболического синдрома. К данной группе относятся пациенты с начальными признаками заболевания и его осложнениями: артериальная гипертензия, углеводные изменения, ожирение и повышенное питание, ишемическая болезнь сердца, атеросклеротические заболевания периферических и мозговых артерий, нарушение пуринового обмена, жировая болезнь печени; синдром поликистозных яичников; постменопаузальный период у женщин и эректильная дисфункция у мужчин; гиподинамия, злоупотребление алкоголем, табакокурение, наследственная отягощенность по сердечно-сосудистым и обменным заболеваниям. [3] [7]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы метаболического синдрома
Клинические проявления метаболического синдрома соответствуют симптомам его составляющих:
- абдоминального ожирения;
- артериальной гипертензии;
- изменениям углеводного, липидного и пуринового обмена.
Если изменения составляющих синдрома Reaven носят субклинический характер (что встречается довольно часто), то и течение заболевания носит асимптомный характер.
Патогенез метаболического синдрома
Классификация и стадии развития метаболического синдрома
Чёткой классификации и стадийности метаболического синдрома не существует. Его деление некоторыми авторами на полный, включающий все составляющие синдрома, и неполный представляется необоснованным. Несмотря на это, выраженность симптомов, количество компонентов синдрома Reaven и наличие осложнений оказывают влияние на стратификацию риска и выбор тактики лечения у конкретного пациента. Для этого следует учитывать:
- степень ожирения и артериальной гипертензии;
- выраженность метаболических изменений;
- наличие или отсутствие сахарного диабета и заболеваний, связанных с атеросклерозом.
В зависимости от индекса массы тела (ИМТ), который рассчитывается делением веса (кг) на рост (м 2 ), классифицируются следующие типы массы тела (МТ):
-
нормальная МТ — ИМТ ≥18,5
Второй тип ожирения является более патогенным в плане риска возникновения сердечно-сосудистых заболеваний и сахарного диабета. Это связано с ожирением внутренних органов, в том числе печени (висцеральное ожирение, неалкогольная жировая болезнь печени), снижением сатурации крови кислородом из-за перехода дыхания на грудной, поверхностный тип и эндокринной активностью висцеральной жировой ткани с патологическим изменением выработки адипокинов (лептин, грелин, адипонектин). Выявлена чёткая корреляция между увеличением абдоминальной жировой ткани и индекса массы тела с риском сопутствующих заболеваний. Считается, что риски начинают нарастать при увеличении окружности талии (ОТ) >80 см у женщин и 94 см у мужчин, а при ОТ >88 см и 102 см соответственно риск возрастает значительно.
Осложнения метаболического синдрома
Так как метаболический синдром является сочетанием факторов риска сердечно-сосудистых и обменных заболеваний, именно эти патологии и являются его осложнениями. Речь идёт, в первую очередь, о сахарном диабете, ишемической болезни сердца и их осложнениях: диабетическая ангио-, нейро- и нефропатия, острая коронарная недостаточность, сердечная недостаточность, нарушение сердечного ритма и проводимости, внезапная сердечная смерть, цереброваскулярные заболевания и болезни периферических артерий. [17] Прогрессирование артериальной гипертензии также приводит к поражению органов-мишеней и ассоциированным клиническим состояниям.
Диагностика метаболического синдрома
Для диагностики метаболического синдрома необходимо выявить у пациента основной признак — абдоминальное ожирение по измерению ОТ (>80 см у женщин и >94 см у мужчин) и хотя бы два дополнительных критерия, которые включают в себя:
- артериальную гипертензию (артериальное давление ≥140/90 мм рт.ст.);
- липидные показатели (ммоль/л) — повышение концентрации в крови триглицеридов ≥1,7; снижение ХС ЛПВП 3,0;
- углеводные показатели (ммоль/л) — гипергликемия натощак ≥6,1 и НТГ 7,8 – [8]
В клинических условиях нужно дифференцировать метаболический синдром от механического сочетания факторов риска, например артериальной гипертензии, избыточной массы тела без признаков абдоминального ожирения и повышения уровня ОХ крови, что встречается довольно часто (до 30%). В сомнительных случаях рекомендовано дополнительное определение инсулинорезистентности по следующим методикам:
- оценка базальной гиперинсулинемии в крови натощак (гиперинсулинемия — >18 мкед/мл);
- показатель HOMA-IR — произведение значения инсулина натощак (мкед/мл) на величину глюкозы (ммоль/л), разделить на 22,5 (значение большее, чем 2,27, считается инсулинорезистентностью);
- индекс Caro — соотношение тощаковой глюкозы (в ммоль/л) к инсулину (в мкед/мл) (инсулинорезистентность – значение [12]
Лечение метаболического синдрома
Лечение метаболического синдрома следует разделить на немедикаментозное и медикаментозное.
Немедикаментозное лечение синдрома Reaven — это ведение здорового образа жизни, отказ от курения и злоупотребления алкоголем, оптимальная двигательная активность [14] , рациональное питание, а также разумное использование природных и преформированных физических лечебных факторов (массаж, подводный душ-массаж, гипокситерапия и гиперкапния, водолечение, талассотерапия, бальнео- и термотерапия, внутренний прём минеральных вод, общие магнитотерапевтические воздействия) [15] , психотерапевтических методик и обучающих программ. [13]
Медикаментозное лечение метаболического синдрома, в зависимости от наличия тех или иных его компонентов, может включать гиполипидемические, антигипертензивные препараты, медикаменты для снижения инсулинорезистентности, постпрандиальной гипергликемии и веса.
Основными препаратами, которые используют при лечении артериальной гипертензии у больных синдромом Reaven и сахарным диабетом, являются ингибиторы ангиотензинпревращающего фермента, сартаны и агонисты имидазолиновых рецепторов. Однако для достижения целевого уровня артериального давления часто необходимо сочетание различных классов медикаментов, таких как пролонгированных блокаторов медленных кальциевых каналов, высокоселективных бета-адреноблокаторов и тиазидоподобных диуретиков (индапамид) в сочетании с медикаментами первой линии. [10]
Для коррекции нарушений липидного обмена при метаболическом синдроме первоначально используются статины, возможно их сочетание с эзетролом и фибратами. Основной механизм действия статинов — снижение внутриклеточного синтеза ОХ за счёт обратимого блокирования фермента 3-гидрокси-3-метилглютарил-кофермент А редуктазы. Оно ведёт к увеличению количества рецепторов к ХС-ЛПНП на поверхности гепатоцита и снижению концентрации ХС-ЛПНП в крови. Помимо этого, статины имеют плейотропные эффекты, такие как антитромбогенный, противовоспалительный, улучшение функции эндотелия, что приводит к стабилизации атеросклеротической бляшки. Современные статины способны вместе со снижением ХС-ЛПНП до 55% уменьшать триглицериды до 30% и повышать ХС-ЛПВП до 12%. В то же время, ключевое достоинство статинотерапии — снижение сердечно-сосудистых осложнений и общей смертности [1] . Эффективней всего использовать аторвастатин (10-80 мг/сут) или розувастатин (5-40 мг/сут). [11]
При неэффективности монотерапии статинами целесообразно присоединение эзетрола в дозе 10 мг/сут, который препятствует всасыванию ОХ в кишечнике и может усиливать снижение ХС-ЛПНП на 15-20%.
Фибраты — ещё один класс липидснижающих препаратов. Они расщепляют богатые триглицеридами жировые частицы, снижают синтез свободных жирных кислот и повышают ХС-ЛПВП путём увеличения распада ЛНП. Это приводит к значительному уменьшению триглицеридов (до 50%), ХС-ЛПНП (до 20%) и увеличению ХС-ЛПВП (до 30%). Фибраты также имеют плейотропные эффекты: снижают концентрацию мочевой кислоты, фибриногена и улучшают инсулиночувствительность, однако их положительное влияние на прогноз пациентов не доказано. Наиболее эффективный и безопасный препарат этой группы — фенофибрат 145 мг/сут.
Для снижения инсулинорезистентности препаратом выбора является метформин, который обладает доказанным положительным эффектом на тканевую инсулинорезистентность через усиление поглощения глюкозы тканями-мишенями. Метформин уменьшает скорость всасывания углеводов в тонкой кишке, оказывает периферическое анорексигенное действие, уменьшает продукцию глюкозы печенью, улучшает транспорт глюкозы внутри клеток. Положительное воздействие метформина (1500-3000 мг/сутки) на конечные точки обусловлено снижением инсулинорезистентности, системными метаболическими эффектами (снижение веса, липидных нарушений, факторов свёртываемости крови и т.д.). [9]
Для снижения постпрандиальной гипергликемии используют акарбозу, которая обратимо блокирует глюкоамилазы, сахарозы и мальтазы в верхнем отделе тонкой кишки. В итоге непереваренные углеводы достигают нижние отделы кишечника, и абсорбция углеводов пролонгируется. Вместе с тем, у акарбозы выявлены дополнительные эффекты. В исследовании STOP-NIDDM (2002 год) у больных метаболическим синдромом, принимающих акарбозу дозировкой 300 мг/сут, продемонстрировано снижение развития сахарного диабета на 36%, новых случаев артериальной гипертензии на 34% и суммарного показателя сердечно-сосудистых событий на 46% [6] .
При наличии у пациента с синдромом Reaven сахарного диабета второго типа могут применяться современные классы сахароснижающих препаратов, такие как аналог глюкагоноподобного пептида-1, ингибитор дипептидилпептидазы-4 и ингибитор натрийзависимого переносчика глюкозы второго типа. Представитель последнего класса эмпаглифлозин (Джардинс) в исследовании EMPA-REG OUTCOME (2016 год) снизил сердечно-сосудистую смертность у больных сахарным диабетом второго типа на 36%.
Медикаментозная коррекция морбидного ожирения показана, если немедикаментозное лечение не приводит к снижению массы тела более чем на 5% от исходного. Препараты для лечения ожирения делятся на аноретики центрального действия (сибутрамин), и средства, воздействующие на желудочно-кишечный тракт, например орлистат (Ксеникал).
Препарат для снижения аппетита сибутрамин в меньшей степени воздействует на дофаминовые и холинергические процессы, но уменьшает потребление жиров и углеводов, что приводит к похудению и улучшает жировой и углеводный метаболизм. Артериальное давление и частота сердечных сокращений при этом повышается только на 5%.
Орлистат является ингибитором желудочной и панкреатической липаз, вследствие чего треть пищевых триглицеридов не всасывается и снижается их концентрация в крови, что приводит к уменьшению калоража пищи и веса. Кроме того, снижается артериальное давление, уровень глюкозы и инсулинорезистентности.
В медицинской практике лечение метаболического синдрома зависит от наличия и выраженности его компонентов. В таблице ниже показана тактика подбора терапии при вариантах синдрома Reaven, которые встречаются наиболее часто.
Постменопаузальный метаболический синдром (ПМС), включающий тканевую инсулинорезистентность, дислипопротеинемию, абдоминальное ожирение, артериальную гипертензию и ряд других нарушений, относится к поздним заболеваниям климактерического периода. Приводятся результаты исследования клинической эффективности бигуанида метформина (Формин-Плива) при ПМС у 30 женщин. Установлено, что Формин-Плива оказывает выраженное позитивное действие на клинико-метаболические и гемодинамические показатели, улучшает ближайший и отдаленный прогноз при ПМС. Препарат хорошо переносится больными, при его применении не отмечались серьезные побочные эффекты. Полученные данные свидетельствуют о целесообразности использования метформина (Формин-Плива) при ПМС.
ПМС – это полисимптомное состояние. При обследовании женщин с этим синдромом чаще всего выявляются нарушение толерантности к углеводам или сахарный диабет (СД) 2 типа, дислипидемия, сердечно-сосудистые заболевания и абдоминальное ожирение. Поэтому при выборе лекарственных средств для проведения долгосрочной терапии ПМС крайне важно тщательно анализировать не только наличие и степень метаболических нарушений, но наличие различной сопутствующей патологии.
Заместительная гормональная терапия (ЗГТ) является наиболее эффективным и экономически выгодным фармакологическим методом профилактики и лечения ПМС. Однако очень многие женщины имеют абсолютные противопоказания к использованию ЗГТ, а некоторые гестагены, входящие в состав гормональных препаратов, используемых при ее проведении, оказывают негативное влияние на показатели углеводного и липидного обмена.
В последние годы в качестве антигипрегликемических средств для лечения СД 2 типа в сочетании с ожирением и сопутствующими кардиоваскулярными расстройствами активно изучаются и используются бигуаниды. В 1956–1957 гг. для клинического применения были предложены несколько препаратов этого ряда – фенформин (фенэтилбигуанид), метформин (N,N-диметилбигуанид) и буформин (L-бутилбигуанид), обладающие выраженным сахароснижающим действием.
В России, как и во всех других странах мира, из группы бигуанидов применяется только метформин. Поскольку этот препарат не метаболизируется в организме и экскретируется почками в неизмененном виде, его прием не ассоциируется с серьезными побочными эффектами, характерными для других представителей этой группы. Помимо антигипергликемического действия, метформин оказывает ряд дополнительных положительных эффектов: на фоне его приема отмечается снижение массы тела и гемостатического потенциала крови, улучшаются нарушенные показатели кальциевого и липидного обмена (в первую очередь триглицеридов), которые являются предикторами и факторами риска развития кардиоваскулярной патологии.
Целью настоящего исследования явилось изучение клинической эффективности и переносимости метформина (Формин-Плива) при ПМС.
Методы исследования
Обследование проводилось согласно протоколу. При верификации диагноза ИБС учитывали данные опроса, характер болей в области сердца, ишемический ответ при ЭКГ с нагрузкой, асинергию миокарда при эхокардиографии, документированное подтверждение перенесенного инфаркта миокарда. Оценку когнитивных функций и церебральной недостаточности проводили на основании шкалы DSM-III-R (Сандоз) в пределах от 3 до 5 по 11 из 17 пунктов.
Формин-Плива назначался в дозе 850 мг вечером вместе с приемом пищи в течение 4 недель. Если уровень глюкозы в крови натощак не изменялся по сравнению с исходным, доза препарата могла быть увеличены до 850 мг 2 раза в день (первый прием утром с завтраком, второй прием вечером с ужином). Всем пациентам была рекомендована программа рационального питания для больных СД 2 типом.
Результаты исследования
Показатели гликемии, гликированного гемоглобина, ИМТ, индекса ОТ/ОБ у получавших Формин-Плива женщин представлены в таблице 1.
Таблица 1.
Динамика уровней глюкозы, HbA1c, ИМТ, соотношения ОТ/ОБ на фоне лечения Формином-Плива
Длительность терапии
Глюкоза, ммоль/л
HbA1c, %
ИМТ, кг/м 2
ОТ/ОБ
ОТ/ОБ – отношение объема талии к объему бедер
*р 2 и ОТ/ОБ ³ 0,96).
Различные нарушения липидного спектра крови отмечались у всех обследуемых женщин (табл. 2).
Таблица 2.
Изменения уровня липидов и липопротеидов на фоне применения Формина-Плива

Немедикаментозные методы коррекции относятся:
Диетотерапия
Диетотерапия является одним из важнейших звеньев профилактики и лечения метаболического синдрома. При этом лечение должно быть направлено не только на оптимальную компенсацию имеющихся метаболических нарушений, но и, в первую очередь, на снижение инсулинрезистентности. Диеты, применяемые у больных МС с целью профилактики сердечно-сосудистых заболеваний и сахарного диабета 2-го типа, основаны на общих принципах диетотерапии:
1. Общее снижение калорийности рациона до около 1700 ккал/с у т.
Данная величина является усредненной; для индивидуального расчета желательной калорийности питания следует рассчитать суточную потребность в энергии, а затем вычесть из полученной величины 300-600 ккал. Расчет исходной калорийности суточного рациона производится по формулам:
для женщин 31-60 лет:(0,0342*вес (кг) + 3,5377)* 240 (ккал)
для женщин старше 60 лет: (0,0377*вес (кг) + 2,7545)* 240 (ккал)
Для учета физической нагрузки полученный показатель умножают на 1,0 при низкой физической активности; на 1,3 при умеренной; на 1,5 при высокой. Режим питания должен быть дробным, не менее 4-х раз в день.
2. Ограничение в рационе соли до 3-8 г/сут (в зависимости от АД).
3.Снижение потребления продуктов, богатых холестерином. По рекомендациям ВОЗ, потребление холестерина при наличии ги-перхолестеринемии не должно превышать 300мг/сут.
4. Достаточное потребление белка (около 80-90г/сут или 15-20% от общей калорийности рациона). На долю жиров должно приходиться не более 30% от общего числа калорий (1-% - животные, 20% - растительные). Доля углеводов должна составлять 50% (для пациенток с СД 2 типа расчет калорий проводиться индивидуально).
5. Увеличение содержания в рационе пищевых волокон (до 30-50г/сут) и продуктов, богатых клетчаткой.
6. Употребление омега-3-кислот в составе оливкового и рапсового масел (частично заменив подсолнечное и, особенно, сливочное). Оптимальная доля в общей калорийности рациона - 1-2%.
7. Достаточное потребление витаминов и минералов.
8. Ограничение потребление алкоголя (до 50г/сут крепких напитков или 150 - сухих вин).
9. Обязательное сочетание с физической нагрузкой.
Поскольку в генезе ожирения существенную роль играют нарушения пищевого поведения, врач должен активно выявлять их признаки и при необходимости мотивировать пациента на работу с психотерапевтом. Ни в коем случае нельзя допускать выраженного чувства голода; при работе с пациентами, привыкшими к перееданию, целесообразно снижать калорийность рациона постепенно.
Голодание, а также очень низкокалорийные диеты (ниже 1200 ккал/сут) не должны использоваться у больных МС, так как приводят к развитию ряда неблагоприятных последствий: гипогликемические состояния, плохая переносимость, увеличение веса после отмены диеты, усугубление стеатогепатита, при значительном снижении калорийности - увеличение ИР.
Учитывая, что неправильное пищевое поведение у пациентки с ожирением формируется в течение длительного времени, меняются они постепенно. Оптимальным в лечении ожирения считается снижение веса на 2-4 кг в месяц. Ведение дневника питания, в котором она регистрирует режим и качество пищи, помогает пациентки изменить пищевое поведение, а врачу оценить пищевые привычки и количество реально потребляемой пиши. Следует подчеркнуть, что резкое уменьшение массы тела является крайне нежелательным: начальная цель - снижение на 10% от исходного веса за 2-3 месяца.
Препараты для коррекции нарушений углеводного обмена:
- бигуаниды;
- препараты сульфонилмочевины (глибенкламид, гликла-зид, глимепирид, глипизид);
- сенсетайзеры (пиоглитазон, розиглитазон);
- прандиальные регуляторы гликемии (репаглинид, нате-глинид);
- ингибиторы альфа-глюкозидазы (акарбоза)
Метформин - препарат, относящийся к группе бигуани-дов, повышает печеночную и периферическую чувствительность к эндогенному инсулину, не влияя на его секрецию. Основные механизмы действия: снижение периферической инсулинорези-стентности; улучшение утилизации глюкозы в печени, мышцах, жировой ткани; подавление глюконеогененза в печени; торможение всасывания глюкозы в тонком кишечнике (табл.17).
Таблица 17. Кардиопротективные эффекты метформина
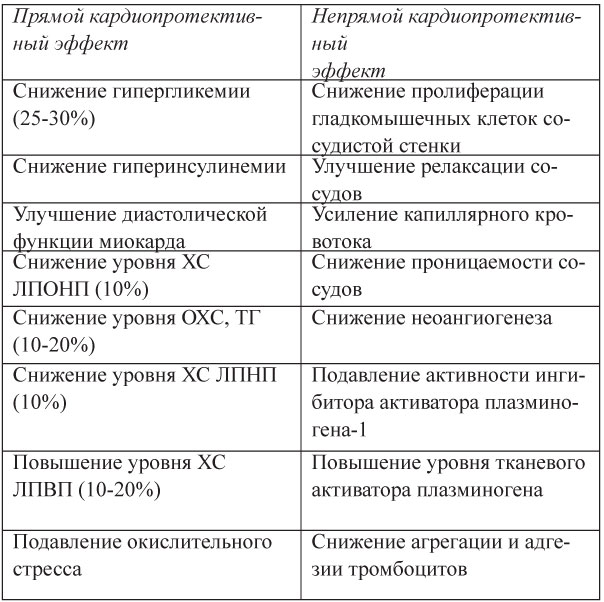
Оптимальная дозировка метформина: 850 мг 2 раза в день в течение 12 недель и более. Побочные эффекты: диспепсия, снижение всасывания витамина В12 и фолиевой кислоты в желудочно-кишечном тракте, лактоацидоз, кожные реакции.
Противопоказания к назначению: тяжелые нарушения функции почек (креатинин более 140 мкг/л у женщин), клинически выраженные проявления острых и хронических заболеваний, связанных с гипоксией (острая сердечная и дыхательная недостаточность, инфаркт миокарда и ацидоз, анемия), нарушение функции печени, применение контрастных веществ, серьезные хирургические операции, лактоацидоз в анамнезе, хронический алкоголизм, беременность и лактация.
Группы препаратов для лечения ожирения.
В настоящее время для регуляции веса и метаболических нарушений разрешено только 2 лекарственных препарата: периферического действия - аналог лептина (орлистат) и центрального действия - серотонинергического - сибутрамин.
Поскольку метаболические нарушения генетически де-термированы, то у 90% женщин возникают рецидивы ожирения, поэтому в качестве ингибитора липазы рекомендуется применение орлистата (Ксеникал). Оказывая тормозящее влияние на липазы желудочно-кишечного тракта, препарат препятствует расщеплению и последующему всасыванию пищевых жиров. На фоне терапии 30% триглицеридов пищи не перевариваются и не всасываются, что позволяет создать дополнительный дефицит калорий по сравнению с применением гипокалорийной диеты. Орлистат применяется у пациенток, которые предпочитают жирную пищу, т.к. при употреблении большого количества углеводов он неэффективен. Показано также, что на фоне применения препарата (в дозе 120 мг 3 раза в сутки в течение 24 недель) уменьшается масса висцерально-абдоминального жира, улучшается чувствительность тканей к инсулину, уменьшается гиперинсулинемия.
Для коррекции дислипидемии применяются следующие препараты:
- статины;
- фибраты;
- секвестранты желчных кислот (пробукол).
Фибраты (фенофибрат, клофибрат, безафибрат, гемифи-бразил) показаны при III-IV типах дислипидемии. По механизму действия вызывают повышение активности липопротеиновой липазы, усиливают катаболизм ХС ЛПОНП без изменения скорости их синтеза и ускоряют переход холестерина в ХС ЛПВП, повышая их уровень на 10-15%. Из побочных эффектов следует отметить стимуляцию образования желчных камней, развитие миозита с мышечными болями в бедрах и икроножных мышцах, редко - тошнота. Часто применяются: ципрофибрат (Липанор) 100-200 мг/сут, фенофибрат (Липантил 200М) 145-200 мг/сут
Препараты никотиновой кислоты (ниаспан, ниацин) снижают уровень холестерина, ТАГ на 20-50%, снижают скорость синтеза ХС ЛПОНП в ХС ЛПНП, увеличивая на 10-15% уровень ХС ЛПВП. Подобный спектр делает эти препараты очень перспективными для лечения больных с метаболическим синдромом. Из побочных эффектов следует отметить гиперемию кожи, гиперурикемию, желудочно-кишечные расстройства, гипергликемию.
Препараты на основе рыбьего жира (максепа, эйконол). Показаны при дислипидемии V типа. Содержат в своем составе большое количество полиненасыщенных жирных кислот, применяется с целью снижения агрегации тромбоцитов за счет уменьшения содержания арахидоновой кислоты в фосфолипидах клеточных мембран.
К секвестрантам желчных кислот (холестирамин, коле-стипол), которые по механизму действия обеспечивают связывание жирных кислот в просвете кишечника с предотвращением их реабсорбции, что приводит к усилению утилизации холестерина печенью. Эти препараты чаще используются для коррекции изолированной гиперхолестеринемии(снижение на 20-30%). Так как эти препараты могут индуцировать гипертриглицеридемию за счет компенсаторного усиления синтеза ХС ЛПОНП, то они не применяются при IIБ, III, IV, V типах дислипидемий. Из побочных эффектов отмечаются нарушение всасывания железа и фоли-евой кислоты, запоры, противопоказаны при фенилкетонурии.
Пробукол - препарат, обладающий умеренной активностью в отношении снижения содержания холестерина, оказывает незначительное влияние на уровень триглицеридов. Показан
пациенткам со IIА типом дислипидемии. Но препарат вызывает активную регрессию ксантолазм, удлиняет интервал Q-T на ЭКГ, что исключает его одновременное назначение с антагонистами кальция.
Статины (ловастатин, симвастатин, правастатин) - ингибиторы бетагидроксибетаметилглутарил КоА редуктазы, направлены на блокирование синтеза холестерина на уровне мевалоной кислоты. За счет этого происходит нарушение синтеза желчных кислот, для которых холестерин является субстратом. Дефицит холестерина гепатоциты компенсируют за счет увеличения синтеза рецепторов для ХС ЛПНП, тем самым, увеличивая величину плазменного клиренса ХС ЛПНП. Статины обеспечивают гипо-холестеринемический эффекта счет усиления элиминации ХС ЛПНП на 24-40% и уменьшения синтеза ХС ЛПОНП. Побочные эффекты развиваются значительно редко - в 1-3 % случаев и проявляются в виде кишечных расстройств (запоры, тошнота, метеоризм), кожной сыпи, головокружения, головной боли, бессонницы.
Наиболее часто применяются: розувастатин (Крестор) 5-40 мг/сут, аторвастатин (Липримар, Липтонорм) 10-80 мг/сут, симвастатин (Симгал, Вазилип) 10-80 мг/сут.
Лечение артериальной гипертензии.
Артериальная гипертензия при МС является не только симптомом заболевания, но и одним из важнейших звеньев его патогенеза наряду с ГИ. Особенности патогенеза АГ при МС определяют показания и противопоказания к назначению тех или иных классов антигипертензивных препаратов или их отдельных представителей. При определении тактики терапии особое внимание следует уделять метаболическим эффектам различных классов антигипертензивных лекарственных средств.
Таблица 18. Метаболические эффекты антигипертензивных препаратов
Читайте также:

