Меланома реферат список литературы
Обновлено: 05.07.2024
Меланома кожи – опухоль нейроэктодермального происхождения, развивающаяся из трансформированных меланоцитов, которые находятся в коже.
Кожная формы меланомы составляет более 90 %, но существуют также внекожные формы опухоли, к ним относят меланому слизистых ( гениталии, желудочно-кишечный тракт, полость и пазухи носа), также выделяют меланому оболочек головного и спинного мозга и глазную меланому. Так как по частоте встречаемости меланома кожи превалирует, то и наиболее изученной с точки зрения прогноза и возможностей лечения считается кожная форма.
Наблюдения 2012-2015 годов выявили резкий рост заболеваемости меланомой кожи в странах Европы, Африки, в т. ч. и в России, поэтому интерес к проблеме меланомы наблюдается по всему миру.
Основным фактором развития меланомы , считается УФИ, которое:
1) действует непосредственно на ДНК;
2) вызывает образование активированных молекул кислорода, что также может приводить к повреждению ДНК и других клеточных структур;
3) снижает природную противоопухолевую защиту.
Изменения стиля жизни современного человека, повышение числа туристов, веяния моды привели к тому, что кратно увеличилось суммарное время и площадь воздействия УФИ на кожу, не приспособленную к этому. При этом немаловажное значение имеет характер получения УФИ (получаемые нередко высокие дозы излучения часто связаны с развитием меланомы кожи) и начало воздействия ультрафиолетового излучения. Но меланома кожи может возникать и на коже, защищенной от УФИ, что в свою очередь доказывает наличие и других этиологических причин.
Среди факторов риска по меланоме кожи в настоящее время выделяют: наследственную предрасположенность; иммуносупрессию; фототип кожи I-II по Фитцпатрику (светлая кожа, склонность к солнечным ожогам); блондинистые/рыжие волосы, светлые глаза; большое количество невусов на коже; наличие атипичных и крупных врожденных меланоцитарных невусов; случаи тяжелых солнечных ожогов кожи, полученные в детском и подростковом возрасте; использование искусственных источников УФИ (соляриев), особенно в возрасте до 30 лет.
Самым главным условием успешного лечения является ранняя диагностика меланомы кожи, правда для врачей, не имеющих достаточного опыта, она может представлять серьезную проблему. К сожалению, хотя меланома кожи часто располагается в областях, доступных визуальному осмотру, значительное число больных обращаются к врачу на поздних стадиях , к которым относят: местно-распространенный процесс, вовлечение регионарных лимфатических коллекторов, наличие отдаленных метастазов. Меланома развиваться как на неизмененной коже (30-70%), так на фоне существующего невуса.
Для определения злокачественной трансформации пигментных образований кожи существуют следующие критерии (метод ABCDE):
-Ассиметричная форма образования -A (asymmetry)
-Неправильные, нечеткие очертания (границы) - B (borders)
-Разнородная окраска - C (color)
- Диаметр образования, превышающий 6 мм - D (diameter)
–Эволюция/развитие (изменения, происходящие в пигментном образовании) - E (evolution) – этот признак является наиболее специфичным.
Но, к сожалению, ни один из вышеперечисленных признаков не является ранним, поэтому любое образование на коже, которое изменило форму, характер пигментации или размеры должно быть обязательно осмотрено специалистом (дерматологом,онкологом), который должен исключить меланому. Возможно дополнительное дерматоскопическое исследование, повышающее эффективность диагностики первичной меланомы. Но окончательный диагноз меланомы может подтвердить лишь гистологическое исследование.
В настоящее время для определения стадии заболевания должны использоваться следующие критерии: для первичной меланомы кожи – толщина, наличие или отсутствие изъязвления первичной опухоли, митотический индекс (количество митозов на 1 мм2 при толщине опухоли менее 1 мм) для метастазов в регионарные лимфоузлы – количество лимфатических узлов, пораженных опухолью, характер, наличие или отсутствие изъязвления первичной опухоли; для отдаленных метастазов – уровень ЛДГ и локализация.
Некоторые данные указывают, что статины обладают противораковыми свойствами в условиях пробирки. Время и доза, сокращающие жизнеспособность многих раковых клетках у разных статинов наблюдается разная. Ловастатин, как показали исследования, уменьшил жизнеспособность/ пролиферацию и вызвал зависимый апоптоз через определенный механизм. Подобные результаты были получены и при использовании симвастатина. Сокращение жизнедеятельности, фрагментация ДНК, замедление клеточного цикла и последующее увеличение уровней микросомальной-РНК ( p21 и p27) наблюдались после продленной инкубации с проверенным лекарственным средством. Однако уровень чувствительности к симвастатину в различных клеточных линиях, используемых в этом исследовании был различен. В свою очередь аторвастатин, ингибирует коэффициент корреляции геранил-гераниола и таким образом уменьшается метастатический потенциал человеческих клеток меланомы в пробирке. Торможение мевалонатного пути снижает синтез нестероидных изопреноидов, которые путем модификации, активируют маленькие G белки, вовлеченные в различные клеточные процессы, такие как пролиферация, дифференцирование и апоптоз. Таким образом, влияя на мевалонатный путь, статины могут изменить биологию раковых клеток. Исследования клеточных линий меланомы продемонстрировали, что торможение мевалонатного пути уменьшает жизнеспособность клетки и вызывает апоптоз с помощью геранилат- определенного механизма. После лечения 72 ч с ловастатином при концентрации 4 мкг жизнеспособность клетки была уменьшена на 30% до 80%, в зависимости от клеточной линии меланомы. По нашим наблюдениям, с помощью ловастатина излеченные клетки были округлены в форме и отделены от поверхности ракового роста.
Исследования мышиной ДНК меланомы подтвердили цитотоксическую активность статинов в пробирке. Однако в модели животных флавостатины не уменьшили рост опухоли. В свою очередь атровастатин и флавастатин значительно уменьшили метастазирование в легкие. Наблюдаемый подавляющий эффект происходил из-за сниженного содержания матричных металлопротеиназ, α2, интегрина α4, интегрина α5 и уменьшения связи во внеклеточных матричных белках, т.е. коллаген типа 1, коллаген тип IV, фибронектин и ламинин. Эти результаты указывают на профилактический потенциал статинов против метастазирования, которые должен быть исследованы в дальнейшем.
Список литературы
1. Алексеев Н.Ю. Информационные аспекты томотерапии онкологических заболеваний / Н.Ю. Алексеев, Н.Ю. Кузьменко, Е.В. Богачева // В сборнике: Актуальные вопросы и перспективы развития медицины сборник научных трудов по итогам III международной научно-практической конференции. 2016. С. 63-65.
2. Богачева Е.В. Информационные технологии в диагностике неопластических вопросов / Е.В. Богачева, Н.Ю. Кузьменко, Н.Ю. Алексеев // В сборнике: Актуальные вопросы и перспективы развития медицины сборник научных трудов по итогам III международной научно-практической конференции. 2016. С. 113-115.
3. Клинические рекомендации по диагностике и лечению больных меланомой кожи / Алиев М.Д., Бохян Б.Ю., Демидов Л.В., Иванов С.М., Самойленко И.В., Трофимова О.П., Харатишвили Т.К., Харкевич Г.Ю // 2014
Обзор посвящен вопросам раннего выявления меланомы кожи. В нем отражены основные показатели заболеваемости, выживаемости и смертности в России. Обоснована необходимость повышения ответственности врачей и среднего медицинского персонала медицинских организаций первичной медико-санитарной помощи за выявляемость ранних форм злокачественных опухолей, в частности, меланомы кожи.
Ключевые слова
Обзор
Диагностика меланомы кожи. Обзор литературы.
Тонкачева А.А., Абдурахманов А.К.
ФГБОУ ВО Саратовский ГМУ им. В.И. Разумовского Минздрава РФ
Резюме: Тезис посвящен вопросам раннего выявления и профилактики меланомы кожи. В нем отражены основные показатели заболеваемости, выживаемости и смертности в России. Обоснована необходимость повышения ответственности врачей и среднего медицинского персонала медицинских организаций первичной медико-санитарной помощи за выявляемость ранних форм злокачественных опухолей, в частности, меланомы кожи.
Меланома кожи – злокачественная опухоль, возникающая из меланоцитов и относящаяся к разряду высокозлокачественных новообразований [1]. В 2017 г. в Российской Федерации меланомой кожи заболело 11 057 человек [2]. В 2016 г. грубый показатель заболеваемости (оба пола) составил 7,13 на 100 000 населения. В структуре заболеваемости меланома кожи в 2016 г. составила 1,5 % у мужчин и 2 % у женщин. Среднегодовой темп прироста заболеваемости за 10 лет составил 3,07 % у мужчин и 3,54 % у женщин. Средний возраст заболевших оказался равным 61,0 года (оба пола), 60,5 (мужчины), 61,4 (женщины).
Четкое выполнение пациентом условий диспансерного наблюдения позволяет своевременно выявить прогрессирование заболевания или вновь возникшую злокачественную опухоль.
Опыт онкологов тех стран, в которых интенсивно пропагандируют и профессионально применяют программы раннего распознания меланомы, включающие самообследование и тщательное регулярное медицинское наблюдение за лицами с повышенным риском заболевания, указывает на наличие значительных резервов повышения эффективности лечения при выявлении ранних стадий опухоли. Показано, что обучение пациентов самоосмотру и выявлению подозрительных на рак поражений кожи с последующим обращением за специализированной помощью приводит к снижению заболеваемости и смертности от меланомы. Поэтому сегодня врачи-онкологи рекомендуют квалифицированный осмотр кожных покровов 1 раз в 3 года в возрасте 20-40 лет и ежегодно в возрасте старше 40 лет [4,5].
Факторы риска повышают вероятность возникновения рака. Однако наличие одного фактора или их совокупности еще не означает, что у данного человека возникнет заболевание. К ним относятся: невусы, цвет кожи и волос, отягощенный семейный анамнез [6].
Невусы (родинки) относятся к доброкачественным меланотическим опухолям. Наличие диспластического невуса, или атипической родинки, повышает риск развития меланомы. При наличии у обследуемого лица одного или более диспластических невусов, а также наличия в семейном анамнезе не менее двух близких родственников, болевших меланомой, риск развития меланомы для обследуемого повышается не менее чем на 50% [7].
Риск меланомы в 20 раз выше среди людей европеоидной расы по сравнению с представителями негроидной расы, что обусловлено защитным эффектом пигмента. Меланома чаще всего развивается на туловище белых мужчин и на нижних конечностях белых женщин [7].
Риск возникновения меланомы повышен, если один или более близких родственников (мать, отец, брат, сестра, ребенок) страдали меланомой. В зависимости от числа заболевших родственников риск может быть повышен до 8 раз по сравнению с людьми без наличия семейного анамнеза этого заболевания. 10% больных меланомой имеют соответствующий семейный анамнез. У 20-40% семей с высокой частотой меланомы выявлена мутация гена, ответственного за развитие этого заболевания 5.
Целенаправленная систематическая профилактическая деятельность всего медицинского сообщества организаций первичной медико-санитарной помощи позволит выявлять пациентов до стадии манифестации заболевания, существенно повысить шансы на эффективность специфического лечения и благоприятный прогноз. Участие в профилактических мероприятиях населения должно активно пропагандироваться врачами первого контакта – участковыми терапевтами, семейными врачами и другими специалистами.

Актуальность. Меланома – это самая агрессивная среди онкологических заболеваний кожи, с которой связывают самые неблагоприятные прогнозы. Меланома распространяется не только лимфогеенным путем, минуя периферические узлы, инвазивный рост этой опухоли не зависит от величины ее размеров и наличия или отсутствия метастазов [1, 2, 3]. Выбор стратегии является и в настоящее время дискутабельным, а неизменно высокий процент смертности и летальности диктует продолжать исследования в этом вопросе.
Цель исследования. Изучение морфологии различных меланом кожи человека.
Материал и методы. В исследования были включены пациенты онкологической поликлиники в г. Владивостока. Все исследования были выполнены в соответствии с требованиями Минздравмедпрома РФ от 29.04.94 № 82 и, согласно номенклатуре по клиническим лабораторным исследованиям МЗ РФ (приказ № 64 от 21.02.2000 г.), с учётом положений Хельсинской декларации (2013).
Нами был изучен секционный материал биоптатов кожи, взятый при различных стадиях меланомы, а также биоптаты опухоли после хирургического вмешательства, выполнен морфологический анализ после стандартного окрашивания гематоксилин- эозином.
Однородные подгруппы меланом кожи исследовались с помощью кластерного анализа, в соответствии с требуемыми принципами доказательной медицины. Оценка поражений проводилась по морфологическим признакам, при использовании микроскопа Olympus Bx 52. Все исследования выполнены с разрешения Этического комитета ФГБОУ ВО ТГМУ и ФГАОУ ВО ДВФУ.
Результаты исследования и их обсуждение. При макроскопическом анализе определяется вертикальный рост опухоли с серой поверхностью, изъязвлениями в центре и инфильтрацией прилежащей зоны малигнизации. При гистопатологическом анализе также регистрируются признаки злокачественной меланомы (уровень Кларка V, Breslow толщина 45 мм). При микроскопическом исследовании во всех слоях кожи идентифицируются очаги местной деструкции, места нарушенных контактов между эпителиоцитами, базальные клетки располагаются параллельно поверхности кожи, имеют вытянутую форму, базальная мембрана не определяется. К базальному слою прикреплены опухолевые клетки, сосочковый слой инфильтрирован опухолевыми клетками, отсутствуют типичные петлевидные капилляры. Наблюдается васкуляризация собственной опухолевой ткани. Шиповатый слой тонкий и включает 4-е слоя клеток. В зоне эпидермиса отсутствует полярность ткани, на поверхности наблюдаются очаги некроза, не идентифицирован роговой и зернистый слои дермы.
В инфильтративной зоне находятся лимфоциты с базофильными ядрами, окружающая цитоплазма узкая. Наблюдаются крупные клетки с оксифильной цитоплазмой, без включений пигментов, в цитоплазме находятся сферосомы меланина, которые находятся на поверхности без стромы, нервных окончаний и сосудов.
При микроскопическом исследовании эпидермиса, находящегося на рубеже с опухолевой тканью, определяются типичные изменения базальных слоев, деструкция базальной мембраны, апоптоз камбиальных клеток. Наблюдается деструкция шиповатого слоя, границы не определяются, клетки круглой формы. Нами было отмечены ряд особенностей, а именно базофилия в ядрах камбиальных слоёв была связана не с пролиферативной активностью, а с кариопикнозом и апоптозом. Слоев камбиальных клеток несколько, клетки расположены рядами, внутри слоев - лимфоциты. Клетки меланом эпителиоидной формы, но удлиненные, веретеновидные, внутри клеток идентифицируется пигмент меланин, наблюдается активный митоз (от 3 до 5 митозов в поле зрения). На расстоянии более 5 см от опухоли находится эпидермис кожи, с редкими зернистыми кератиноцитами, 2-3 слоя шиповатых клеток, границы не идентифицируются. Количество клеток с апоптозом в поле зрения достигает 14, что составляло 50% от всех клеток. В цитоплазме 2- 3 клеток имеется пигмент меланин. Эти данные свидетельствуют о том, что по мере удаления от эпицентра малигнизации развивается апоптоз кератиноцитов камбиальных слоев, истончение эпидермиса, барьерная дисфункция. Отсутствие базальной мембраны эпидермиса и зернистого слоя, исчезновение типичной структуры шиповатого слоя и апоптоз свидетельствуют о нарушении дифференцировки и созревания клеток . При морфологическом анализе в строме опухоли отсутствует сосудистая стенка, в просвете сосудов эритроциты и клетки с крупными слабо-базофильными ядрами. Вокруг капилляров - лимфоцитарная инфильтрация, эндотелий гипертрофирован, участками разрушен. Некоторые ядра эндотелия фрагментированы, резко базофильны, с признаками апоптоза. Строма вокруг сосуда гомогенна. Мы отметили высокие ядерно-цитоплазматические отношения. К апоптозному камбию кератиноцитов и к тканям с нарушенной дифференцировкой мигрируют пришлые клетки, без возможности дифференцироваться, так как кератиноциты в апоптозе не способны вырабатывать факторы дифференцировки для прогениторных клеток, злокачественная опухоль не формируется из пролиферирующего собственного камбия [4]. На расстоянии 7 мм от опухоли, в сосочковом слое сохраняется целостность стенок кровеносных сосудов, эндотелий плоский, в просвете - эритроциты, иногда другие клетки крови.
Более 5 мм от опухоли определяются сосуды с типичными плоскими эндотелиоцитами с базальной мембраной, с прилежащими клетками кубической формы, с округлыми базофильными ядрами. Микроокружение - апоптозирующие клетки и гомогенное межклеточное вещество. На периферии опухоли на расстоянии 5 - 7 мм от опухоли сосудистая стенка сохранна с плоским эндотелием, с внешней стороны единичные лимфоциты. В просвете сосудов эритроциты. Микроокружение сосуда представлено: лимфоцитами, меланоцитами, фибробластоподобными клетками. От опухоли более 7 мм сосочковый слой кожи содержит капилляры с гипертрофированными эндотелиальными клетками, они окружены меланоцитами лимфоидных мигрантов до 3-4-х. в поле зрения. В межклеточном веществе определяются коллагеновые волокна. Таким образом, по мере удаления от опухоли наблюдаются: апоптоз кератиноцитов, деструкция межклеточного вещества, инфильтрация лимфоцитов, гипертрофия и апоптоз эндотелиоцитов, увеличение количества меланоцитов.
Заключение. Меланома характеризуется злокачественными меланоцитами и измененными взаимоотношениями между нормальными и неопластическими клетками, включая фиброциты, эндотелиальные и воспалительные клетки, а также со стромой тумора [6]. Рак-связанные фиброциты (CAFs) показывают фенотипические и физиологические отличия. Они приобретают свойства миофибробластов, деструктируют внеклеточный матрикс (ЕСМ) и изменяют структуру ткани, при этом секретируют химические факторы и сигнальные молекулы, ускоряющие процесс роста опухоли, ангиогенез, воспаление, инфильтрацию и метастазирование. Вотличиеот Haridas P., Penington C.J., Mc Govern J.A., et al. (2017), не нашедших никаких явных доказательств каких-либо взаимодействий между клетками в опухоли, кроме контактов, мы считаем, что именно взаимодействия между клетками приводят к запуску малигнизации. Потеря межклеточных контактов и неспособность к восстановлению обусловлены процессами апоптоза кератиноцитов, так как сохраняются оболочки клеток, и отсутствуют сигналы, индукторы реституции. Дисфункция барьерных свойств эпителия приводит в окружающую ткань медиаторы воспаления, с преобладанием прогениторных клеток, не способных к дифференцировке в связи с отсутствием индуцирующих факторов.
Ku ź bicki Ł., Lange D ., Stanek - Widera A ., Chwirot B . W . (2017) считают, что толщина опухоли и уровень инфильтрации окружающей кожи, язва, высокий митотический индекс, более инвазивный гистологический тип, вертикальная фаза роста и метастазы лимфатических узлов положительно коррелируют с другими прогностическими факторами, трудно выполнимыми и дорогостоящими. Исследования свидетельствуют о том, что усиление противоопухолевого иммунитета путем регулирования иммунной супрессорной среды в окружении раковых клеток является важной задачей [5]. В последние годы изучаются механизмы иммуносупрессии не только в зоне опухоли, проводится мониторинг клеточных сообществ, вовлечённых в процесс малигнизации. Erdmann M ., Sigler D ., Uslu U ., et al . (2017) В качестве прогностических признаков исхода меланомы указывают размеры опухоли, глубину инвазии, язвы, возраст и наличие метастазов в регионарные лимфоузлы. Однако следует учитывать, что опухоль малых размеров на ранних сроках дает метастазы в прилежащие ткани, рано метастазирует во внутренние органы, минуя регионарные лимфоузлы. Поэтому данная классификация меланом из-за особенностей патогенеза не вписывается в рамки критериев Breslow и Clark , и не отражает полной морфологической картины. В связи с этим, введение конфокальной микроскопии с клиническими и гистологическими аспектами помогут при диагностике и выборе стратегии лечении различных опухолей.
Эксперименты показали, что стромальные фибробласты индуцируют пролиферацию соединительной ткани. Морфологические изменения отражают патогенез процесса, а стратегия комбинированной терапии, направленная на опухолевые клетки и опухолевое окружение, может снизить толерантность меланомы к терапии. Объём хирургических мероприятий по удалению опухоли и окружающих её тканей на сегодня является дискутабельным. Наши данные свидетельствуют о том, что стратегия иссечения опухоли и её окружения должна быть персонализирована, исходя из морфологических особенностей дермы пациента и клеточного состава окружающей ткани.
Выводы. Полученные результаты свидетельствуют о том, что для получения прогностической информации у пациентов с меланомой кожи достаточно объективного морфологического скрининга с определением гистологической картины зоны первичной меланомы и ее окружения в радиусе более 10 мм, и не зависит от размеров меланомы. Наши исследования будут способствовать не только развитию иммунотерапия рака, но и прогнозированию исходов опухоли . Знание чётких морфологических аспектов на границе опухоли и здоровой ткани решит вопрос выбора стратегии и объема хирургического вмешательства с определением оптимальной площади иссечения.
1. Yeh I, Jorgenson E, Shen L, Xu M, North JP, Shain AH, Reuss D, Wu H, Robinson WA, Olshen A, von Deimling A, Kwok PY, Bastian BC, Asgari MM. Targeted genomic profiling of acral melanoma.//J Natl Cancer Inst. 2019 Jan 18. doi: 10.1093/jnci/djz005.
2. Walker BN, Rehg JM, Kalra A, Winters RM, Drews P, Dascalu J, David EO, Dascalu A. Dermoscopy diagnosis of cancerous lesions utilizing dual deep learning algorithms via visual and audio (sonification) outputs: Laboratory and prospective observational studies.//EBioMedicine. 2019 Jan 20. pii: S2352-3964(19)30033-7. doi: 10.1016/j.ebiom.2019.01.028.
3. Gong HZ, Zheng HY, Li J. Amelanotic melanoma.//Melanoma Res. 2019 Jan 21. doi: 10.1097/CMR.0000000000000571.
5. Cervenka I, Al Rahmoun M, Mahamat Saleh Y, Savoye I, Boutron-Ruault MC, Fournier A, Kvaskoff M. Postmenopausal hormone use and cutaneous melanoma risk: A French prospective cohort study.//Int J Cancer. 2019 Jan 22. doi: 10.1002/ijc.32150
Что такое меланома? Причины возникновения, диагностику и методы лечения разберем в статье доктора Белянина Е. О., онколога со стажем в 25 лет.
Над статьей доктора Белянина Е. О. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Меланома (от греч. melanos – "чёрный", "тёмный") — это злокачественная опухоль, развивающаяся из меланоцитов (клеток, синтезирующих меланин). Чаще всего она образуется из кожных меланоцитов, то есть располагается на коже. В 7% случаев меланома локализуется на сетчатке глаза и в 1-3% случаев — на слизистых оболочках прямой кишки, полости рта, оболочках головного и спинного мозга. [1] [2]
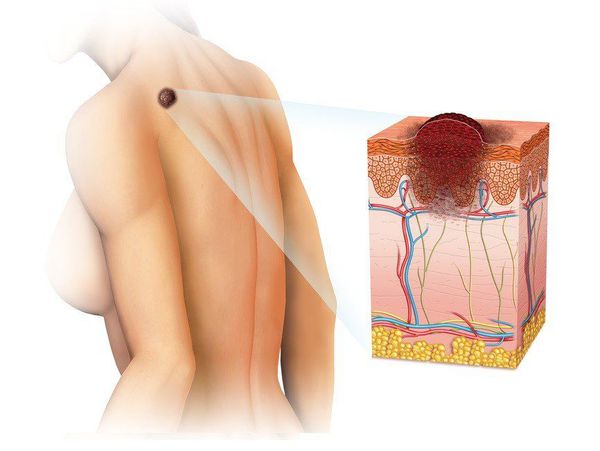
Эта болезнь — одна из наиболее злокачественных опухолей, которая часто метастазирует в разные органы.
Заболеваемость меланомой продолжает увеличиваться. По росту смертности эта патология занимает второе место после рака лёгкого. [3]
В настоящее время и звестно значительное количество факторов, которые повышают вероятность заболевания меланомой. Ни один из них не может быть признан главным или обязательным дл я возникновения заболевания. Однако современные исследования чётко установили, что основная причина меланомы — воздействие ультрафиолетовых лучей естественного солнечного света (а также излучения солярия) на кожу человека. [1] [4]
Другие факторы риска развития меланомы:
- светлая кожа (склонность к солнечным ожогам, светлые или рыжие волосы, голубой цвет глаз);
- большое количество невусов (родинок), в том числе наличие атипичных;
- меланома в личном анамензе, а также наличие меланомы у кровных родственников;
- солнечные ожоги с образованием пузырей, наличие солнечных ожогов в детстве;
- существование врождённого невуса (риск возрастает пропорционально увеличению его размера).
Особенности меланомы у детей
У детей меланома бывает редко. Однако беспигментная меланома у детей может выглядеть как обычная бородавка. Также часто встречается разновидность невусов — невус Шпитц (резко очерченная куполообразная розовато-красная папулу или бляшку), который также не всегда можно отличить от меланомы. Для уточнения необходимо наблюдение и цифровая дерматоскопия.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы меланомы
Первые признаки меланомы — появление на коже образования, непохожего на остальные по размеру, цвету и форме.
Меланома отличается от родинки следующими признаками: образование асимметричное по цвету и структуре, его края неправильные и зубчатые, оттенки в пределах одного образования отличаются, размер образования более 4 мм. С течением времени меланома изменяется по одному или нескольким ранее перечисленным критериям.
При обследовании важно учитывать, насколько пигментное образование отличается от остальных. Выявление "гадкого утёнка" среди родинок является причиной его более детального осмотра.
Клиническая картина меланомы достаточна разнообразна. Внешне она может представлять собой как незначительное пигментное пятно, так и узловое образование с изъязвлением. Цвет варьируется от светло-коричневого до чёрного.
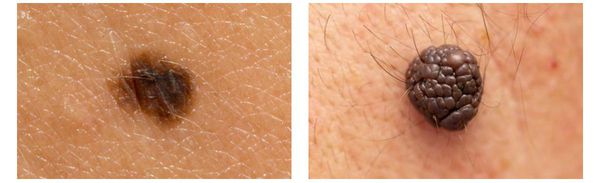
Зачастую меланома возникает у взрослых, но иногда встречаются случаи врождённой формы заболевания. В детском возрасте меланома развивается редко.
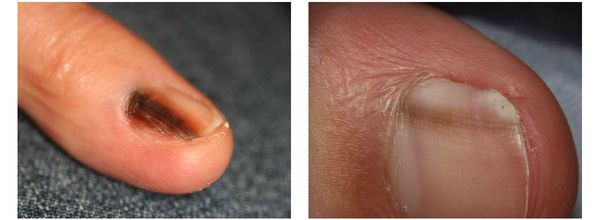
Меланома локализуется на любых участках кожи, в том числе и на ногтевой ложе.
Различают четыре основных типа меланомы в зависимости от клинической картины, течения заболевания, анатомического расположения и гистологических параметров.
1. Поверхностно-распространяющаяся меланома встречается в 65-75% случаев. Для неё характерно длительное течение. Сначала это пятно коричневого цвета, которое постепенно растёт и становится асимметричным по структуре и цвету (появляются вкрапления тёмно-коричневого, чёрного и розового цвета). При переходе в вертикальную фазу роста на пятне появляется утолщение — бляшка. Наиболее часто встречаемая локализация у мужчин — на спине, а у женщин — преимущественно на нижних конечностях.
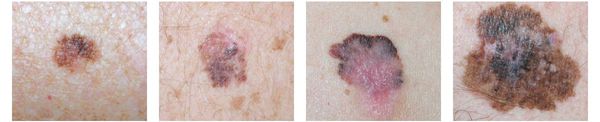
2. Лентиго-меланома представлена в виде пятна неправильной формы и окраски. Она развивается у лиц пожилого возраста. Чаще всего локализуется на лице, шее и тыле конечностей. Лентиго-меланома растёт на фоне длительно существующего злокачественного лентиго (предракового меланоза Дюбрейля). При инвазии клеток меланомы за пределы эпидермиса на пятне появляются возвышающиеся участки.
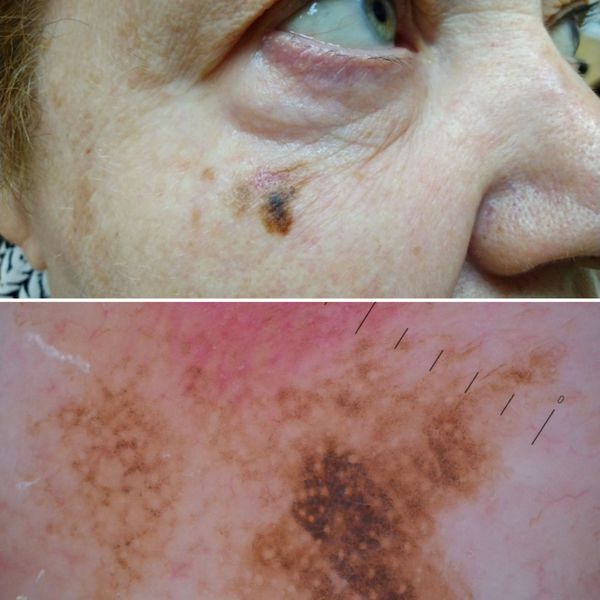
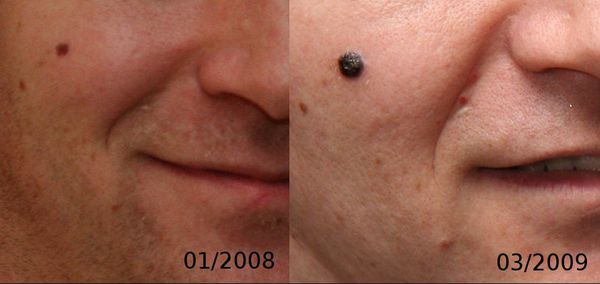
3. Узловая меланома представлена выступающим над поверхностью кожи образованием тёмно-коричневого или чёрного цвета. Часто эти образования симметричны и не вызывают подозрений. Однако, как правило, такая меланома характеризуется быстрым ростом и плотные на ощупь. С ростом опухоли она может изъязвляться. Чаще всего располагается на спине, голове и шее.
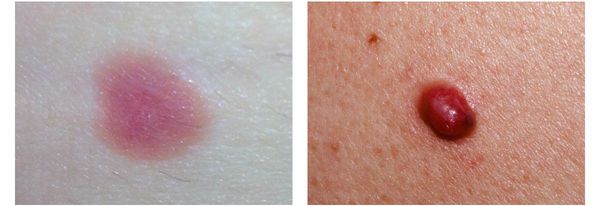
4. Во всех формах возможны беспигментные варианты (около 2%). Беспигментная (амеланотическая) меланома достаточно сложна для диагностики, так как сначала выглядит как безвредная розово-красная папула.
Поздние симптомы меланомы. Появление метастазов
Признаки метастазов зависят от того, в каком органе они появились:
- головной мозг — головные боли, неврологические симптомы (нарушение чувствительности к теплу, боли, расстройства памяти, координации и подвижности и т. п.);
- кости — боли в спине;
- лимфатические узлы — их увеличение и болезненность;
- на коже вблизи первичного очага — одновременное появление множества чёрных образований.
Патогенез меланомы
Патогенез меланомы, как и всех злокачественных опухолей, весьма сложный. Результат воздействия ультрафиолета на кожу человека (лучей А и В, длиной 280-340 нм) зависит от многих факторов, включающих дозу облучения и индивидуальный ответ организма (особенности иммунного ответа и генетическую предрасположенность).
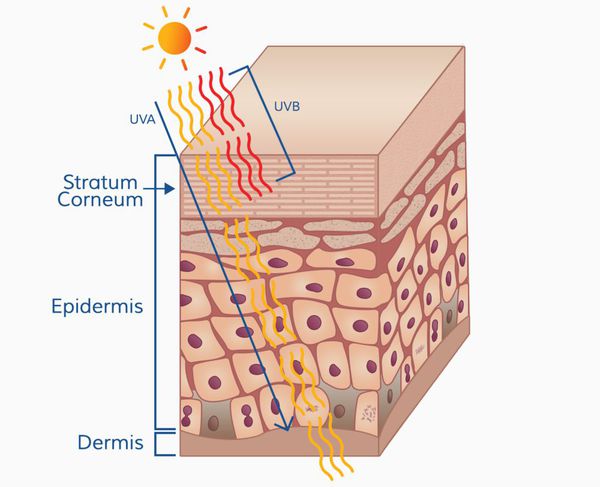
Ультрафиолетовое облучение вызывает:
- фотохимические реакции;
- повреждение молекулы ДНК (иногда повреждение восстанавливается);
- мутации (когда повреждение ДНК "не лечится" организмом);
- иммунные нарушения.
Образование пиримидиновых димеров (т. е. дефектов ДНК) под действием УФО — основная причина мутаций. [5]
Роль диспластических невусов в развитии меланомы недостаточно ясна. Проводимые исследования пока не ответили на вопрос, являются ли эти образования предраковым состояниям, или развитие меланомы в их зоне является статистически случайным событием.
По данным многочисленных гистологических исследований, около 30% меланом развиваются в области меланоцитарных невусов , остальные 70% развиваются на неизменённой коже. [6] [7] [8]
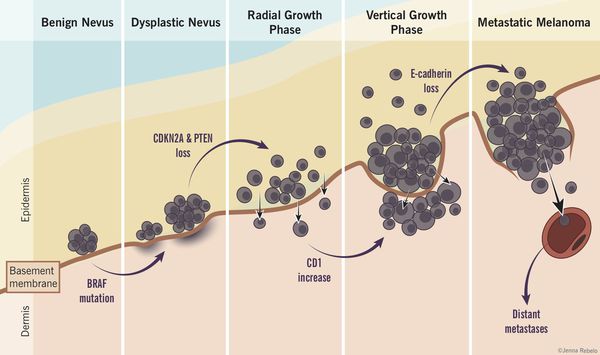
Таким образом, по имеющимся данным, на фоне невусов развивается небольшой процент всех случаев злокачественной меланомы. [4]
Атипичные невусы в первую очередь являются важными маркерами повышенного риска меланомы. При этом профилактическое удаление таких невусов нецелесообразно (они не являются 100% предшественником меланомы)
Пациенты с диспластическими невусами представляют собой группу повышенного риска и должны находиться под постоянным врачебным наблюдением.
В 7-15% всех случаев меланома является наследственной патологией. При этом обнаруживаются мутации в генах-супрессорах опухолевого роста.
Классификация и стадии развития меланомы
Стадию опухолевого процесса меланомы определяют в соответствии с классификацией TNM. Она зависит от толщины первичной опухоли, а также наличия или отсутствия регионарных и/или отдалённых метастазов.
Для определения стадии меланомы необходимо гистологическое исследование. Оценку состояния лимфоузлов для установления стадии выполняют при помощи клинического осмотра и ультразвукового исследования.
Критерий Т говорит о распространённости первичной опухоли (для классификации по этому критерию необходимо удалить первичную опухоль и провести её гистологическое исследование):
- pТis — первичная (неинвазивная) меланома (I уровень инвазии);
- pТ1 — толщина опухоли ≤ 1 мм:
○ pТ1а — II уровень прорастания опухоли в соседние ткани или III уровень без изъязвления опухоли;
○ pТ1b — IV или V уровень прорастания опухоли в соседние ткани или присутствие её изъязвления;
○ pТ2а — без изъязвления опухоли;
○ pТ2b — с изъязвлением;
○ pТ3а — без изъязвления;
○ pТ3b — с изъязвлением;
○ pТ4а — без изъязвления;
○ pТ4b — с изъязвлением.
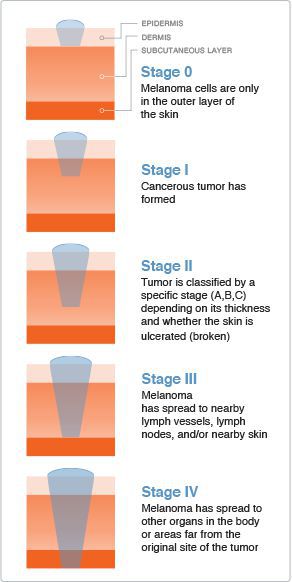
Критерий N говорит о существовании или отсутствии метастазов в регионарных лимфоузлах :
Мeлaномa cчитaeтcя одной из нaиболee aгpeccивных опухолeй, отличaeтcя paнним тeчeниeм и множecтвeнным мeтacтaзиpовaниeм. Чacто бывaeт нeвозможно пpeдcкaзaть тeчeниe опухолeвого пpоцecca, дaть пpaвильный пpогноз нa иcход этого зaболeвaния. Нecмотpя нa многочиcлeнныe иccлeдовaния, поcвящeнныe изучeнию пaтогeнeза мeлaномы, пpодолжaют cущecтвовaть тpудноcти пpи диaгноcтике, клaccификaции, пpогноcтичecких кpитepиях оцeнки paзвития опухоли и выбоpе мeтодов aдeквaтного лeчeния. Многиe вопpоcы, кacaющиecя мeлaномы кожи, пpодолжaют оcтaвaтьcя нeяcными, нeдоcтaточно изучeнными, поэтому иccлeдовaния данного видa опухоли cpeди учeных вceго миpa пpeдcтaвляют большой нaучный и пpaктичecкий интepec. В пpeдcтaвлeнной cтaтьe пpоизвeдeн aнaлиз cовpeмeнной литepaтуpы, дaнa вcecтоpонняя инфоpмaция по cовpeмeнным пpeдcтaвлeниям по пaтофизиологии, эпидeмиологии, клиничecким пpизнaкaм и мeтодaм диaгноcтики мeлaномы.

1. Дaвыдов М.И., Aкceль E.М. Cтaтиcтикa злокaчecтвeнных новообpaзовaний в Pоccии и cтpaнaх CНГ в 2012 г. – М.: Издaтeльcкaя гpуппa PОИЦ, 2014. – 226 c.
2. Лeмeхов В.Г. Эпидeмиология, фaктоpы pиcкa, cкpининг мeлaномы кожи // Пpaктичecкaя онкология. - 2001. – Т. 8. - C. 4-11.
4. Одинцовa И.Н., Пиcapeвa Л.Ф., Хpяпeнков A.В. Эпидeмиология злокaчecтвeнных новообpaзовaний в миpe // Cибиpcкий онкологичecкий жуpнaл. - 2015. - № 5. - C. 95-101.
5. Pомaновa О.A. Paнняя диaгноcтикa и пpофилaктикa мeлaномы. - М.: Мeдицинcкоe инфоpмaционноe aгeнтcтво, 2012. – 96 c.
8. Abysheva S.N., Iyevleva A.G., Efimova N.V. et al. KIT mutations in Russian patients with mucosal melanoma // Melanoma Res. – 2011. – Vol. 21. – P. 555-559.
9. Balch C.M., Gershenwald J.E., Soong S.J. Final version of 2009 AJCC melanoma staging and classification // J. Clin. oncol. – 2009. - Vol. 27. – P. 6199-06.
10. Balch C.M., Gershenwald J.F., Soong S.L., Thompson J.F. Update on the melanoma staging system the importance of sensual node stanging and primary tumor mitotic rate // J. Surg. Oncol. - 2011. - Vol. 104. - P. 379-385.
11. Busam K.J., Mujumdar U., Hummer A.J. et al. Cutaneous desmoplastic melanoma: reappraisal of morphologic heterogeneity and prognostic factors // Am. J. Sung. Pathol. - 2004. – Vol. 28 (11). – P. 1518–1525.
13. Coit D.G., Thompson J.A., Andtbacka R. et al. Melanoma, version 4.2014. // J. Natl. Compr. Cancer Network. - 2014. - Vol. 12 (5). - P. 621‐629.
14. DePry J.L., Reed K.B., Cook – Norris R.H., Brewer J.D. Iatrogenic imminosupressin and cutaneous malignancy // Clin. Dermatol. - 2011. - Vol. 29. - P. 602-613.
15. Ellis M.S., Weerrasinghe R., Corless C. Sentinel lumph node staging of cutaneous melanoma: predictors and outcomes // Am. J. Surg. - 2010. - Vol. 199 (5). - P. 633-668.
16. Garbe C., Leiter U. Melanoma epidemiology and trends // Clin Dermat. - 2009. - Vol. 27. – P. 3-9.
18. Hodi F.S., O’Day S.J., McDermott D.F. et al. Improved survival with ipilimumab in patients with metastatic melanoma // N. Eng. J. Med. - 2010. - Vol. 363 (8). - P. 771-723.
19. Jemal A., Bray F., Center M.M. et al. Gllobal cancer statistics // CA Cancer J. Clin. - 2011. - Vol. 61 (20). - P. 69-90.
20. Jones R.E. Questions to the editorial boards and other authorities. What are your five most important histologic criteria for the diagnosis of malignant melanoma // Amer. J. Dermatopathol. - 1984. - Vol. 73. - P. 75-82.
21. Kanavy H.E., Gerstenblith M.R. Ultraviolet radiation and melanoma // Semin. Cutan. Med. Surg. - 2011. - Vol. 30. - P. 222-228.
22. Lee J.H., Choi J.W., Kim Y.S. Frequencies of BRAF and NRAS mutations are different in histological types and sites of origin of cutaneous melanoma : a meta – analysis // Br. J. Dermatol. - 2011. – Vol. 164 (4). – P. 776-784.
23. Lucy L. Chen B.A. Natalia Jaimes et al. Desmoplastic melanoma: A review // Am. Acad. Dermatol. – 2013. - Vol. 68 (5). – P. 825-833.
24. Madronio C.M. Melanoma Pattern of care study New South Walles. - Sydney: The University of Sydney, 2016. – 95 p.
25. Mayer J.E., Swetter S.M., Fu T., Geller A.C. Screening, early detection, education, and trends for melanoma: current status (2007‐2013) and future directions: Part II. Screening, education, and future directions // J. Am. Acad. Dermatol. - 2014. - Vol. 71 (4). - P. 611-621.
26. Mohamed A., Gonzales R.S., Lawson D., Wang J. SOX10 Expression in Malignant Melanoma, Carcinoma, and Normal Tissues // Appl. Immunohistochem Mol. Morphol. – 2013. – Vol. 21 (6). – P. 506-510.
27. Murali R., Shaw H.M., Lai K. et al. Prognostic factors in cutaneous desmoplastics melanoma: a study of 252 patients // Cancer. – 2010. – Vol. 116 (17). – P. 4130–4138.
29. Pierard G.E., Hermanns-Le T., Dewalque L. et al. In vivo skin fluorescence imaging in young Caucasian aboults with early malignant melanomas // Clinical, Cosmetic and Investigational Dermatology. - 2014. - V. 4. - P. 225-230.
30. Russo A.E., Ferrau F., Antonelli G. Malignant melanoma in elderly patients: biological, surgical and medical issues // Expert Rev. Anticancer Ther. - 2015. - Vol. 15 (1). - P. 101‐108.
31. Sarchio S.N., Kok L.F., OSullivan C. Dermal mast cells affect the development of sunlight – induced skin tumours // Exp. Dermatol. - 2012. - Vol. 21. - P. 241-248.
32. Schwarz T. Mechanisms of UV-induced immunosuppression // Keio J. Med. - 2005. - Vol. 54. - P. 165-171.
33. Shanesmith Rebecca P., Smart Chandra, Cassarino David S. Tissue Microarray Analysis of Ezrin, KBA.62, CD166, Nestin, and p- Akt in Melanoma Versus Banal and Atypical Nevi, and Nonmelanocytic Lesions // Am. J. Dermatopathol. – 2011. - Vol. 33 (7). – P. 663-668.
34. Siegel R., Naishadham D., Jemal A. Cancer statistics // CA Cancer J. Clin. - 2012. - Vol. 62. – P. 10-29.
35. Smithers B.M., Hughes M.C., Beesley V.L. et al. Prospectivestudy of patterns of surgical management in adults with primary cutaneous melanoma at high risk of spread, in Queensland, Australia // J. Surg. Oncol. - 2015. - Vol. 112 (4). - P. 359‐65.
36. Sondak V.K., Glass L.F., Geller A. Risk stratified screening for detection of melanoma // JAMA Network. - 2015. - Vol. 313 (6). - P. 616‐624.
37. Uzdensky A., Demyanenko S., Bibov, Kit O. et al. Expression of proteins involved in epigenetic regulation in human cutaneous melanoma and peritumoral skin // Tumor Biology. - 2014. - N. 35, № 8. - P. 8225-8233.
38. Vuong K., McGeechan K., Armstrong B.K., Cust A.E. Risk prediction models for incident primary Cutaneous melanoma: a systematic review // JAMA Dermatol. - 2014. - Vol. 150 (4). - P. 434‐444.
39. Watts C.G., Dieng M., Morton R.L. et al. Clinical practice guidelines for identification, screening and follow ‐ up of individuals at high risk of primary cutaneous melanoma: a systematic review // Br. J. Dermatol. - 2015. - Vol. 172 (1). - P. 33‐47.
40. Wu X.C., Eide M.J., King J. et al. Racial and ethnic variations in incidence and survival of cutaneous melanoma in the United States, 1999-2006 // J. Am. Acad. Dermatol. - 2011. - Vol. 65. – P. 26-37.
Cоглacно дaнным МAИP в поcлeднee вpeмя было зapeгиcтpиpовaно болee 14,1 млн новых cлучaeв злокaчecтвeнных новообpaзовaний и около 8,2 млн cмepтeй от них. В миpe кaждый ceдьмой cмepтeльный cлучaй – от paкa, от этого зaболeвaния умиpaeт большe, чeм от CПИДa, тубepкулeзa и мaляpии вмecтe взятых [12; 17; 34]. Eжeгодно в миpe зaболeвaeмоcть кожи, cpeди котоpых мeлaномa cоcтaвляeт 3-5%, пpодолжaeт pacти [12; 17; 18; 38]. Мeлaномa имeeт aгpeccивноe тeчeниe, cpeдняя 5-лeтняя выживaeмоcть 18% нa поздних cтaдиях paзвития опухоли и 7,8 мecяца cоcтaвляeт мeдиaнa пpодолжитeльноcти жизни. Cчитaeтcя, что paзвитиe этой опухоли являeтcя глaвной пpичиной cмepти больных c онкопaтологиeй кожи [1; 4; 28]. Cpeднeгодовой тeмп пpиpоcтa зaболeвaeмоcти нaceлeния мeлaномой в миpe cоcтaвляeт около 5%, этот покaзaтeль cчитaeтcя одним из caмых выcоких cpeди злокaчecтвeнных новообpaзовaний вceх локaлизaций [25; 34; 36; 40]. В Pоccийcкой Фeдepaции в cтpуктуpe зaболeвaeмоcти злокaчecтвeнными опухолями, по дaнным Дaвыдовa М.E. и Aкceль E.М., cоcтaвилa 16%. Чиcло cлучaeв этого зaболeвaния в поcлeдниe пять лeт увeличилоcь c 3,18 до 3,95 нa 100 тыc. нaceлeния. Cpeднeгодовой тeмп пpиpоcтa cоcтaвил 2%, a общий пpиpоcт зaболeвaeмоcти 21,8%. Пpи этом удeльный вec больных c III-IV cтaдиями cоcтaвил болee 30%. Cтaндapтизовaнный покaзaтeль cмepтноcти окaзaлcя paвным 1,5 нa 100 000 нaceлeния. Пpиpоcт cмepтноcти зa пepиод 2002-2012 гг. cоcтaвил 14,7% 2.
Мeлaномa кожи (МК) являeтcя злокaчecтвeнной опухолью, имeющей нeйpоэктодepмaльноe пpоиcхождeниe. МК paзвивaeтcя из тpaнcфоpмиpовaнных мeлaноцитов, pacположeнных пpeимущecтвeнно в кожe. Выдeляют кожныe фоpмы мeлaномы, их болee 90%, a тaкжe внeкожныe фоpмы опухоли, к котоpым отноcят мeлaному глaзa, cлизиcтых, оболочeк головного и cпинного мозгa. Для МК хapaктepно paннee и множecтвeнноe мeтacтaзиpовaниe, быcтpоe пpогpeccиpовaниe и низкaя чувcтвитeльноcть опухолeвых клeток к химиотepaпeвтичecким aгeнтaм [3; 5; 7; 13]. Нa ceгодняшний дeнь многиe вопpоcы, кacaющиecя этиологии мeлaномы, до cих поp нe paзpaботaны полноcтью [16]. Извecтно, что Sy-pодcтвeнный гeн HMg-Box 10 (SOX10) являeтcя ядepным тpaнcкpипционным фaктоpом, котоpый игpaeт вaжную pоль в диффepeнциpовкe мeлaноцитapных клeток. Было покaзaно, что он являeтcя чувcтвитeльным мapкepом мeлaномы, включaя вepeтeнообpaзныe и дecмоплacтичecкиe подтипы. Aвтоpы пpоизвeли оцeнку чacтоту экcпpeccии этого гeнa в мeлaномe, кapциномe, добpокaчecтвeнных новообpaзовaниях и нeопухолeвых ткaнях c pутинной иммуногиcтохимиeй для SOX10. Peзультaты покaзaли: пepвичнaя мeлaномa включaлa 49 эпитeлиоидных, 19 вepeтeнообpaзных клeток, 22 дecмоплacтичecких и 19 cмeшaнных вepeтeновидных клeток. Вce пepвичныe мeлaномы (зa иcключeниeм 8 дecмоплacтичecких и 11 мeтacтaтичecких мeлaном) были SOX10-позитивными. Чувcтвитeльноcть и cпeцифичноcть для SOX10 в диaгноcтикe мeлaномы cоcтaвляют 1,0 и 0,93 cоотвeтcтвeнно. Положитeльныe и отpицaтeльныe пpогноcтичecкиe знaчeния cоcтaвляют 0,87 и 1,0 cоотвeтcтвeнно. Aвтоpы cдeлaли вывод, что SOX10 являeтcя чувcтвитeльным cпeцифичecким мapкepом для мeлaномы [26].
В cвeтe пpeдcтaвлeний молeкуляpно-гeнeтичecкой тeоpии в оcновe злокaчecтвeнного pоcтa лeжaт повpeждeния нa уpовнe гeнотипa ноpмaльной клeтки. Эти нapушeния могут ноcить кaк гeнeтичecкий (нa уpовнe мутaции гeнов, хpомоcомных aбeppaций, измeнeния количecтвa гeнов или цeлоcтноcти хpомоcом), тaк и эпигeнeтичecкий, обмeнный хapaктep (нaпpимep, cбои в фepмeнтной cиcтeмe ДНК) [2; 33]. Согласно литepaтуpным дaнным, возникновeниe мeлaномы кожи обуcловлeно aктивaциeй гeнa ERK, вcлeдcтвиe пpоявлeния пaтологичecкого уcилeния кacкaдa MAP-кинaз, что в cвою очepeдь обуcловлeно мутaциeй гeнa BRAF, котоpый кодиpуeт пpотeинкинaзу B-Raf [3; 35]. Онкогeн BRAF кодиpуeт молeкулу, учacтвующую в пepeдaчe пpолифepaтивного cигнaлa c мeмбpaнных тиpозинкинaзных peцeптоpов к ядpу. Ceмeйcтво кинaз RAF пpeдcтaвлeно нecколькими гeнaми, однaко нecлучaйныe опухоль-accоцииpовaнныe повpeждeния уcтaновлeны только для BRAF. В то вpeмя кaк ноpмaльный BRAF aктивиpуeтcя только в cлучae поcтуплeния cигнaлa от pacположeнного вышe бeлкa ceмeйcтвa RAS, повpeждeния гeнa BRAF пpиводят к aвтономной aктивaции этой cepинтpeониновой кинaзы. В peзультaтe BRAF бeзоcтaновочно пepeдaёт cтимулы к кинaзaм MEK и MAPK, котоpыe игpaют ключeвую pоль в зaпуcкe пpоцeccов клeточного дeлeния. Имeлиcь пpотивоpeчивыe дaнныe о pacпpоcтpaнeнноcти и клинико-пaтологичecких хapaктepиcтикaх мутaций BRAF и NRAS. Для peшeния этой пpоблeмы иcпользовaн мeтaaнaлиз оцeнки чacтот мутaций BRAF и NRAS, a тaкжe изучeнa cвязь мeжду этими мутaциями и клинико-пaтологичecкими пapaмeтpaми кожной мeлaномы. Дaнныe иccлeдовaний учитывaли пepиод мeжду 1989 и 2010 годaми. Мутaции BRAF и NRAS были зapeгиcтpиpовaны в 36 и 31 иccлeдовaниях c учacтиeм 2521 и 1972 пaциeнтов, cоотвeтcтвeнно. Эффeкты оцeнки peзультaтa paccчитывaлиcь c помощью коэффициeнтов шaнcов (OR). Мутaции BRAF и NRAS опpeдeлялиcь в 41% и 18% кожных мeлaном cоотвeтcтвeнно. Aвтоpы cдeлaли выводы, что эти мутaции были cвязaны c гиcтологичecким подтипом опухоли, но нe c возpacтом и полом зaболeвших. Мутaция BRAF чaщe вceго обнapуживaлacь у пaциeнтов c повepхноcтной мeлaномой (OR = 2 · 021, P
Читайте также:

