Лучевая терапия при раке прямой кишки реферат
Обновлено: 02.07.2024
За последние 20 лет достигнуты определенные успехи в лечении рака прямой кишки. Признание того факта, что после чисто хирургического лечения II-й и III-й стадий частота неудач в местном контроле опухоли составляет 15-50%, привело к использованию дополнительной (адъювантной) лучевой терапии. Многочисленные проспективные рандомизированные исследования, проведенные многоцентровыми кооперативными группами, имели результатом практическое применение сочетанной адъювантной терапии, включающей лучевую терапию и использование химиопрепарата 5-фторурацила. В некоторых исследованиях были тщательно подобраны последовательность применения и дозы лучевой терапии и химиотерапии для достижения максимальной эффективности и для минимизации токсичности. Появление точных методов стадирования - эдоректальной сонографии и магнитно-резонансной томографии - позволило применять предоперационную терапию без излишнего облучения при ранней стадии болезни. Это привело к повышению частоты сохранения сфинктера и к меньшей частоте осложнений. Еще предстоит выяснить оптимальный порядок проведения дополнительной терапии.
В 1999 г. у 34 700 человек в Соединенных Штатах выявлен рак прямой кишки, что составляет приблизительно 37% всех случаев рака толстой кишки. Эта болезнь в тот год унесла жизни 8700 человек [1].
Хирургическая резекция является главным методом лечения данного злокачественного заболевания. Хирургическое удаление опухолей нижних отделов прямой кишки с адекватным отступом, особенно с радиальным отступом (вокруг опухоли), часто приводит к результатам, которые нельзя считать оптимальными, если опухоль прорастает всю толщу стенки [2, 3]. В отличие от верхних отделов прямой кишки и сигмы, откуда лимфа оттекает, главным образом, в нижние мезентериальные сосуды, которые легко поддаются хирургическим манипуляциям, дренаж от нижних отделов прямой кишки может идти и во внутренние подвздошные коллекторы, обычно не удаляемые при резекции. По этим причинам частота неудач местного контроля опухоли при ее локализации в средних и нижних отделах прямой кишки обычно выше, чем при локализациях в других отделах толстой кишки.
Частота местного рецидива после одной лишь хирургической резекции составляет 5-15% для стадии 1,15-30% для стадии II, и 30-50% для 111-й стадии аденокарциномы прямой кишки 4. Некоторые хирурги настаивают на применении более радикальной операции - тотальной мезоректальной эксцизии, что позволило бы уменьшить частоту местного контроля [7, 8]. Эта операция связана с более тяжелым послеоперационным периодом, и ее можно выполнять лишь при большом опыте в колоректальной хирургии. В Соединенных Штатах мезоректальная эксцизия редко применяется на уровне местных больниц.
С целью снижения частоты местных рецидивов и, в конечном итоге, увеличения выживаемости, в 1970-х - начале 1980-х гг. была разработана адъювантная лучевая терапия. В последние 20 лет споры велись вокруг проблемы: какую применять лучевую терапию - предоперационную (адъювантную) или постоперационную (нео-адъювантную). В Европе были склонны использовать предоперационное облучение, часто с таким фракционированием, которое в Соединенных Штатах считается неприемлемым. В США постоперационная лучевая терапия, часто сочетаемая с 5-фторурацилом (5-FU), стала золотым стандартом при лечении аденокарциномы нижних отделов прямой кишки II и III стадий.
Постоперационная (адъювантная) терапия
Главным преимуществом постоперационной адъювантной терапии - это знание о полном хирургическом стадировании. Такое лечение планируется для тех, кто может выиграть от адъювантной терапии (а именно, больные с II или III стадиями аденокарциномы). До появления сонографического метода, было довольно много ошибок при стадировании, что, кстати, представляет существенный минус предоперационной терапии. Другое преимущество постоперационной терапии состоит в том, что не происходит задержки с проведением хирургического вмешательства, которое является главным методом лечения.
Частота рецидивов в пределах таза после чисто хирургического лечения II или III стадии рака прямой кишки колеблется от 15 до 50%, в зависимости от конкретной стадии. В начале 1970-х годов характер развития рецидивов после резекции рака прямой кишки изучался в исследовании повторных операций, проведенном Университетом штата Миннесота [9]. В ходе этого исследования выявлено, что большинство локорегионарных рецидивов возникало в пресакральном пространстве, за которым по частоте рецидивов следовали зона анастомоза и задние отделы органов мочеполового тракта. Эти данные позволили разработать оптимальные поля облучения, которые стали стандартом для адъювантного лечения рака прямой кишки.
Постоперационная лучевая терапия получила широкое распространение в конце 1970-х - начале 1980-х гг. Ретроспективные обзорные исследования постоперационной лучевой терапии показали уменьшение частоты местных неудач, по сравнению с группами чисто хирургического лечения [10, II]. В последующие годы в ходе ряда проспективных рандомизированных исследований была определена роль системной химиотерапии в сочетании с лучевой терапией (табл. 1). Эти многоцентровые исследования утвердили применение методик с использованием 5FU и прояснили вопрос о дозировках, особенно при параллельном применении облучения и 5FU.
Таблица 1. Проспективные рандомизированные исследования постоперационной адъювантной терапии рака прямой кишки.
Исследование
Лечение
Рецидивы и рост
локорегиональиых mts (%)
Выживаемость без
признаков болезни (%)
Общая
выживаемость (%)
Только операция
ЛТ
XT
ЛТ и ХТ
ЛТ
Knook с соавт. (NCCTG) [13]
ЛТ - лучевая терапия; XT - химиотерапия.
Первое из этих исследований было проведено Группой изучения гастроинтестинальных опухолей (GTSG) [12]. Больных со стадиями II и III, по рандомизации распределяли в одну из групп лечения: с применением чисто хирургического метода, с постоперационным облучением (40 Грей или 48 Грей), с постоперационной химиотерапией (болюс 5FU и метил-ломустин), с сочетанием химиотерапии и лучевой терапии. В этом исследовании было обнаружено статистически существенное повышение выживания без признаков болезни и местного контроля при сравнении сочетанной химиолучевой терапии с чисто хирургическим методом. При всех других сравнениях между 4-мя группами не выявлено статистически достоверных отличий. В другом исследовании, проведенном Северо-центральной группой противораковой терапии (NCCTG), больные со II или III стадиями заболевания, по рандомизации получали либо постоперационную лучевую терапию (45-50,4 Грей), либо сочетание химиотерапии (болюс 5FU и метил-ломустин) с лучевой терапией [13]. В этом исследовании продемонстрировано повышение частоты местного контроля (86,5% против 75%, Р=0,036), частоты выживания без признаков болезни (58% против 38%, Р=0,0016) и 5-летней общей выживаемости (58% против 48%, Р=0,025) в группе сочетанной терапии, по сравнению с группой с чисто лучевым постоперационным лечением.
В результате этих рандомизированных многоцентровых исследований конференция Национального ракового института (National Cancer Institute -NCI), по консенсусу в заявлении, опубликованном в 1990 г., рекомендовала рассматривать методику сочетанной терапии как стандарт пост-операционного адъювантного лечение больных II и III стадий рака прямой кишки [14].
В последующем исследования с кооперацией нескольких групп попытались определить оптимальные химиотерапевтические препараты и наилучшие способы введения этих препаратов. NCCTG провела рандомизированное исследование 4-х групп, поставив задачу оценить полезность лейкозогенного препарата метил-ломустина и сравнить применение длительных инфузий низких доз 5FU с болюсным введением 5FU [15]. Прибавление метил-ломустина к 5 FU не улучшало выживаемость или частоту местного контроля. Кроме того, статистически достоверно отмечалось снижение частоты рецидивов опухоли и увеличение выживаемости, когда 5FU вводился в виде длительных инфузий на протяжении курса лучевой терапии, по сравнению с болюсной инфузией, проводимой в три конкретных дня 1-й и 5-й недель лучевой терапии. Вопрос о полезности метил-ломустина ставился и в рандомизированном исследовании GTSG [16]. Как и в исследовании NCCTG прибавление метил-ломустина к постоперационному лечению рака прямой кишки не принесло какой-либо пользы.
Указанные два кооперативные исследования стимулировали проведение 2 последовательных межгрупповых работ, в ходе которых решался вопрос об оптимальной схеме химиотерапии, применяемой вместе с постоперационным облучением. Первой из этих 2-х работ было межгрупповое исследование INT-0114, в котором сравнивались схемы лечения с применением 5FU как монохимиотерапии, 5FU вместе с лейковорином, 5FU вместе с левамизолом и 5FU вместе с лейковорином и левамизолом [17]. Медианное значение срока динамического наблюдения составило 48 мес, и, по сравнению с применением 5 FU как монотерапии, не обнаружено преимуществ ни у одной из других схем лечения. Второй работой было исследование INT-0144, в ходе которого сравнивались, с одной стороны, длительные инфузии 5 FU в фазы до и после лучевой терапии в сочетании с дозой, вводимой одновременно с лучевой терапией, и, с другой стороны - болюсное введение 5FU в периоды без облучения. Это исследование недавно было завершено, и результаты вот-вот увидят свет.
Национальный проект хирургического лечения рака молочной железы с адъювантной терапией (NSABP) генерировал несколько другой подход к адъювантному лечению стадий II и III рака прямой кишки. В первом рандомизированном исследовании, проведенном соавторами этого проекта (NSABP R-01), изучались 3 группы, а именно - с постоперационное применение метил-ломустина вместе с онковином и 5FU (схема MOF) в сравнении с чисто лучевой терапией и отсутствием постоперационного лечения [18]. При этом обнаружено, что постоперационная химиотерапия MOF существенно улучшает 5-летние показатели — как выживаемость без признаков болезни, так и общую выживаемость. Однако, при анализе в подгруппах преимущество в выживаемости сохранялось за химиотерапией только в подгруппе мужчин моложе 65 лет (44% против 26%). Наоборот, у женщин отмечалось снижение выживаемости, если им применялась адъювантная химиотерапия (37% против 54%).
Предоперационная (неоадъювантная) терапия
Имеется несколько преимуществ такой терапии, которая может девитализировать клетки опухоли в параректальной ткани, тем самым понижая вероятность диссеминации жизнеспособных клеток во время резекции. Кроме того, до операции клетки опухоли, скорее всего, более оксигенированы, и, значит, более чувствительны к облучению, чем после операции. Другим преимуществом является достижение регрессии опухолей дистальных отделов прямой кишки, для которых отступ весьма ограничен, - тем самым, становится возможным выполнять больше сфинктер-сохраняющих операций.
Наконец, предоперационная лучевая терапия проводится до операции на брюшной полости, тем самым, уменьшается вероятность спаечной фиксации толстой кишки в полости таза, а, значит, понижается вероятность и тяжесть лучевого повреждения толстой кишки. До появления более точных визуализирующих методик, таких как эндоректальная сонография и МР-томография, существенным недостатком предоперационной терапии была опасность излишнего облучения при неадекватном стадировании. Но сейчас у нас есть возможность лучше, чем прежде, выявлять тех больных, которые могут получить пользу от дополнительного лечения, и предоперационная терапия постепенно получает признание в Соединенных Штатах.
В то время, как в Соединенных Штатах изучалась постоперационная терапия, в Европе исследования фокусировались на применении предоперационной лучевой терапии, обычно без применения системной терапии. Основное отличие между этими исследованиями и американским подходом к адъювантной терапии рака прямой кишки, - это включение опухолей I стадии в европейские исследования по адъювантной терапии. Кроме того, европейские схемы лучевой терапии отличаются от американских меньшей длительностью и большей интенсивностью облучения.
В серии европейских рандомизированных исследований сравнивалось предоперационное применение лучевой терапии с чисто хирургическим лечением (табл. 2). Европейская организация по изучению и терапии рака (EORTC) сравнила 34,5 Грей облучения за 15 фракций с чисто хирургическим лечением. Хотя при этом не отмечено влияния на выживаемость, но местный контроль был существенно лучше в группе неоадъювантной терапии (86% против 72%, Р=0,003) [20]. В 2-х шведских рандомизированных исследованиях изучались интенсивные короткие курсы предоперационного облучения [6, 21]. При этом, как и в исследовании EORTC, выявлено статистически достоверное улучшение местного контроля, и, к тому же, определялось повышение выживаемости без признаков болезни, а в одном из этих шведских исследований зафиксировано и повышение общей выживаемости. Сходные результаты дала работа Рабочего объединения по раку прямой кишки MRC, в которой, на основании данных, собранных в Британии, предоперационная лучевая терапия сравнивалась с отсутствием нео-адъювантной терапии. Особенностями этого исследования было включение только местно-распространенных опухолей и облучение в дозе 40 Грей за 20 фракций, причем такое облучение приближено к вариантам фракционирования, применяемым в Соединенных Штатах. В данной работе в группе предоперационной терапии обнаружена высокая степень местного контроля, а также увеличение выживаемости без признаков болезни и уменьшение отдаленного метастазирования [22].
Таблица 2. Проспективные рандомизированные исследования предоперационной неоадъювантной терапии рака прямой кишки.
Лучевая терапия является неотъемлемой частью нескольких стандартных режимов лечения при аноректальных/тазовых или некоторых внетазовых новообразованиях, вовлекающих ограниченный объем тканей. В области колоректальной хирургии лучевая терапия наиболее часто применяется как часть мультимодального лечения.
Облучение вызывает прямое или непрямое (через радикалы) ионизационное повреждение биологических молекул (ДНК, РНК), что приводит к разрыву одной или двух цепей ДНК: клетка, подвергнутая облучению, реагирует репарацией ДНК, погибает или теряет способность к репродукции.
Радиочувствительность различных тканей зависит от: типа ткани, скорости деления клеток, оксигенации, анемии (потеря транспорта кислорода) и радиосенсибилизаторов (химиотерапии).
Эффекты облучения тканей:
• Ранние эффекты (в течение недели, ткани с высокой степенью скорости деления клеток): уменьшение опухоли, повреждение кожи, острый энтерит и т.д.
• Поздние эффекты (через месяцы/годы): облитерирующая микроангиопатия с неоваскуляризацией, интерстициальный фиброз, разрушение эпителия => повреждение нервов, почечная недостаточность, обструкция или перфорация толстой кишки и фиброз.
а) Альтернативы:
• Только химиотерапия или в комбинации с оперативным вмешательством.
• Только оперативное вмешательство.
• Альтернативные методики лучевой терапии: лучевая терапия с модулируемой интенсивностью (IMRT), интраоперационная лучевая терапия, брахитерапия.
б) Показания для лучевой терапии:
• Первичный рак прямой кишки в стадии II и III, в отобранных случаях при IV стадии: адъювантный или неоадъювантный курс.
• Рецидив рака прямой кишки у ранее не облучавшихся больных.
• Рак анального канала.
• Выборочно при раке толстой кишки Т4.
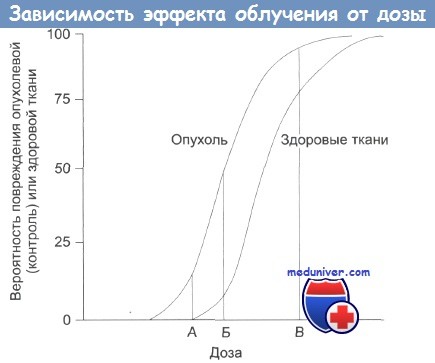
Зависимость терапевтического эффекта от дозы облучения.
А — нижняя безопасная доза;
Б — увеличение дозы: растет поражение здоровых тканей;
В — наивысшая вероятность успешного лечения, но и высокая вероятность поражения здоровых тканей, многочисленные побочные эффекты, некоторые из которых могут проявиться в отдаленном будущем
г) Схемы лучевой терапии
Рак прямой кишки:
• Стандартный курс: доза облучения 50,4 Гр (6 недель) в комбинации с химиотерапией (см. отдельное обуждение).
• Короткий курс: доза облучения 25 Гр (5 дней) с оперативным вмешательством на следующей неделе.
Рак анального канала:
• Лучевая терапия (45-59 Гр) в комбинации с 5-FU и митомицином С (схема Nigro) или химиотерапией на основе препаратов платины.
Токсичность и побочные эффекты:
• Со стороны ЖКТ (в частности тонкая кишка) - острый или хронический энтерит, мочевая токсичность, некроз головки бедренной кости, увеличение частоты венозной тромбоэмболии.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

В лечении рака прямой кишки лучевая терапия играет несколько ролей. Как до, так и после операции облучение может проводиться и выполнять различные задачи. Основная цель – уменьшение опухоли и предотвращение рецидивов. При облучении рака кишечника рентгеновские лучи целенаправленно ориентируются на опухоль, что ингибирует деление раковых клеток.
Особенности лучевой терапии при раке кишечника:
Для сохранения здоровой ткани вся доза лучей распределяется на несколько сеансов, чтобы поврежденные клетки могли восстановиться. Тем не менее, в краткосрочной и долгосрочной перспективе могут возникать серьезные побочные эффекты.
Рак кишечника может быть не чувствителен к лучевой терапии. То есть при лечении не наблюдается сокращения опухоли или даже продолжается дальнейший локальный рост. В этих случаях облучение должно быть прервано и рассмотрена альтернативная терапия в зависимости от стадии заболевания.
Хирургическое вмешательство может быть предпочтительным методом, и проводиться немедленно. В противном случае вместо облучения может быть назначена химиотерапия, достижения которой преследует цели, сходные с лучевой терапией. В паллиативной терапии (при неоперабельных опухолях) неудачное облучение также может быть прервано. Часто в этих случаях побочные эффекты лучевой терапии перевешивают успех проводимого лечения.
О лучевой терапии рака кишечника
Стадии рака кишечника
После выявления злокачественного новообразования в области прямой кишки проводятся дополнительные исследования, чтобы выяснить, распространились ли раковые клетки на другие области тела. Выделено четыре стадии злокачественных образований в области кишечника:
I стадия – первичной опухолью поражена подслизистая и слизистая оболочка кишечника.
II (a, b) стадия – поражено меньше 50% просвета кишки. Очаг не пророс в стенку кишечника. При II-a стадии метастазы в лимфатических узлах отсутствуют. Для II-b стадии характерно прорастание всей стенки без выхода за пределы кишки; метастазы также отсутствуют.
III (a, b) стадия – большая часть полуокружности кишки поражена, опухоль прорастает всю стенку. При III-a стадии лимфоузлы не поражены, а при III-b стадии отмечается множественное метастазирование в регионарные лимфатические узлы.
IV стадия – злокачественное новообразование достигает больших размеров и прорастает в соседние органы. В регионарных лимфоузлах отмечается множественное метастазирование.


Когда следует начать лучевую терапию при онкологии кишки
Лучевая терапия может быть проведена до операции, после хирургического вмешательства или в качестве отдельной терапии. Каждый вариант имеет свои нюансы.
Неоадъювантная лучевая терапия
Цель облучения до операции при раке кишечника:
уменьшение диаметра и снижение опухолевой массы;
облегчение операции и уменьшение рецидивов.
В сочетании с химиотерапией опухолевые клетки становятся более чувствительными и восприимчивыми к рентгеновским лучам. Кроме того, лучевая терапия рака кишечника перед операцией приводит к тому, что после удаления опухоли частота рецидивов возникает на 50% реже.
Адъювантная лучевая терапия
После хирургического вмешательства облучение используется только при колоректальном раке прямой кишки. В большинстве случаев лучевая терапия проводится вместе с химиотерапией. После проведенной операции говорят об адъювантной радио-химиотерапии, которая направлена на уничтожение метастазов, а также отдельных оставшихся раковых клеток в организме и кишечнике, что исключает рецидивы.
Облучение без операции
Применение лучевой терапии без хирургического вмешательства, как правило, проводится не в лечебных целях. На продвинутых стадиях, когда опухоль трудно оперировать или она имеет большие размеры, облучение назначается для облегчения боли и устранения других симптомов рака. Лучевая терапия уменьшает объем злокачественного новообразования и продлевает выживание.
В редких случаях, при хорошей реакции рака толстой кишки на облучение, может быть сделана операция с удалением опухоли. Проведенная без операции лучевая терапия при раке кишечника может облегчить пищеварительный дискомфорт, стабилизировать метастазы в кости, чтобы не было переломов, и улучшить множество других симптомов, связанных с болезнью.
Как подготовиться к лучевой терапии
Подготовка к облучению включает беседу с лечащим врачом, который предупреждает о возможных последствиях и дает рекомендации. Пациенткам детородного возраста следует предохраняться от беременности, поскольку лучевая терапия может навредить плоду. При наличии кохлеарного имплантата, имплантируемого сердечного устройства или кардиостимулятора следует заранее уведомить об этом врача.
Основные подготовительные меры к процедуре облучения:
- полноценное и сбалансированное питание;
- соблюдение питьевого режима;
- отказ от курения и употребления спиртных напитков.
Перед проведением лучевой терапии пациенту очищается кишечник. Дополнительные вопросы, касающиеся подготовке к облучению, можно задать лечащему врачу.


Процедура лучевой терапии при раке кишечника
Облучение обычно проводится в несколько сеансов. Предварительно врач с помощью визуализации (КТ, МРТ) находит поле воздействия. Важно определение правильной дозы облучения и продолжительности процедуры. У онкологических больных в планирование входит тип опухоли. Доза подбирается по возможности таким образом, чтобы эффективно разрушать пораженную ткань, но как можно меньше воздействовать на окружающие структуры.
При проведении неоадъювантной лучевой терапии при раке прямой кишки соблюдается ряд правил:
при стандартном фракционировании доза составляет от 2,0 до 2,5 Гр каждый день;
если есть метастазы, то доза увеличивается до 40 Гр;
при полноценной терапии охватываются не только участки опухоли, но и регионарные лимфатические узлы.
Операция проводится через 4-5 недель после облучения. Для крупного фракционирования на пациента приходится по 5 Гр единоразово до достижения показателей в 25 Гр на один участок. Хирургическое вмешательство в этом случае показано через 2 дня.
При адъювантном облучении (после операции) дозировка приближена к разметке от 2,0 до 2,5 Гр. В неделю необходимо проведение 5 сеансов до достижения от 40 до 60 Гр. Если возникают послеоперационные осложнения, то радиотерапию откладывают на 10 суток, пока нежелательные последствия не будут полностью устранены.
Побочная реакция лучевой терапии
Функция облучения заключается в лечении злокачественных клеток так называемым ионизирующим излучением, что останавливает процессы деления и способствует их разрушению. Поскольку злокачественные клеточные структуры иногда находятся между здоровыми тканями, а излучение не ограничивается только опухолью, реакции и побочные эффекты на рентгеновские лучи возникают в месте облучения, а также во всем организме.
Прямые побочные эффекты сразу после лечения включают:
рвоту и тошноту;
покраснение кожи в месте облучения.
В частности, от облучения страдают слизистые оболочки и другие ткани, которые быстро и часто делятся. Это приводит к воспалению слизистой оболочки кишечника и пищевода.
Наиболее важной мерой для минимизации острых побочных реакций, вызванных лучевой терапией при раке кишечника, является фракционирование дозы облучения. Под этим термином понимается разделение лучевой терапии на множество сеансов, чтобы дать тканям время для регенерации. После облучения, по возможности, следует соблюдать покой и щадящий режим. Организму требуется много энергии, чтобы реагировать на стимулы лучевой терапии.
Для сведения к минимуму раздражения кожного покрова при проведении радиотерапии, следует:
Носить свободную одежду.
Защищать кожу от воздействия солнечных лучей.
Не использовать косметические средства.
Чтобы предотвратить инфекции и боль в кишечнике, можно предварительно проконсультироваться с диетологом. При лучевой терапии также могут потребоваться противовоспалительные препараты. Если потребление пищи слишком сильно ограничено из-за боли, можно также временно принимать болеутоляющие средства.
Как правило, после облучения часто происходит образование соединительных тканей. В результате также повышается чувствительность и возникает чрезмерная хрупкость, что является серьезным препятствием при последующих операциях. В кишечнике это может привести к значительным дисфункциям в долгосрочной перспективе из-за различных повреждений слизистых оболочек, мышц и нервных тканей. Из-за пространственной близости к другим органам брюшной полости и половой системе, лучевая терапия может привести к повреждению органов верхней части живота, мочевого пузыря и нарушению фертильности.
Редким осложнением лучевой терапии на кишечнике может быть вторая опухоль. Из-за изменения структуры клеток во время облучения может развиться еще один злокачественный участок спустя длительный промежуток времени.


Реабилитация после лучевой терапии
Восстановительные мероприятия после облучения при раке кишечника включает в себя различные меры, такие как физиотерапия с водными и тепловыми процедурами, медицинская гимнастика и физические упражнения. Профилактикой, в том числе и против других заболеваний служит тренировка здоровья. Она включает в себя, например, силовые виды спорта, отказ от курения и здоровое питание (диетотерапия).
О возможных душевных и социальных последствиях онкологического заболевания должны заботиться опытные психоонкологи (психосоциальные онкологи): специально обученные в этой области врачи или психологи сопровождают, консультируют и лечат пострадавшего и его близких. Пациентам с раком кишечника, получившим местное облучение, должна быть предложена специализированная реабилитация, которая проводится в стационарных условиях или амбулаторно.
Цели проводимых восстановительных процедур после лучевой терапии при онкологии прямой кишки:
лечение дисфункций мочевого пузыря и кишечника, эректильных нарушений;
восстановление физической и душевной работоспособности, а также способности к участию в нормальной общественной жизни;
сохранение или восстановление трудоспособности.
Принятые меры улучшают общее самочувствие и повышают (связанное со здоровьем) качество жизни. Так называемое нейрогенное недержание мочи из-за радиационного повреждения нервов, питающих мочевой пузырь, встречается крайне редко. В таком случае назначается медикаментозная вспомогательная терапия. Другие примеры возможных недугов, требующих специального лечения, включают инфекции мочевыводящих путей, воспаление прямой кишки (проктит), рубцовые боли, гормональный дефицит, истощение (синдром усталости) и нарушения сна.
Врачебный контроль позволяет предотвратить развитие возможных осложнений и своевременно купировать кровотечение, которое может возникнуть после операции. Боль и дискомфорт устраняются с помощью анальгетиков. Если у врача возникают сомнения по поводу эффективности облучения, тогда назначается курс химиотерапии, направленный на остановку прогрессирования заболевания.
В медицинском центре проводится лучевая терапия опухолей прямой кишки, которая подразумевает использование ионизирующего излучения для уничтожения злокачественных клеток. Чаще всего облучение объединяется с химиотерапией (препарат капецитабин и 5-ФУ). Цитостатические средства повышают чувствительность раковых клеток к радиационному воздействию.
Сканирование проводится в соответствии с рекомендациями европейских сообществ медицинской визуализации
Заключение
В основу медицинской лучевой терапии легло так называемое ионизирующее излучение частиц и их уничтожающее воздействие на живые клетки. Высокодозированная радиация способствует повреждению наследственного материала клеточных структур – как здоровых, так и злокачественных. В отличие от нормальных клеток, раковые не способны восстанавливаться после этого – они погибают.
Целью облучения при раке кишечника может быть:
- лечение (при возможности излечить онкологического больного);
- облегчение (снятие внешних симптомов рака, если злокачественный процесс зашел слишком далеко).
При этом облучение может проводиться самостоятельно или в сочетании с химиотерапией (в качестве радио-химиотерапии). Иногда лучевая терапия также назначается перед операцией с целью уменьшения злокачественного новообразования. Облучение также может иметь смысл после оперативного удаления опухоли для уничтожения остаточных раковых клеток (адъювантная лучевая терапия).
То, что нужно учитывать во время и после лучевой терапии, во многом зависит от типа степени прогрессирования заболевания. Следует поговорить с лечащим врачом о том, какие действия недопустимы во время и после лучевой терапии. В долгосрочной перспективе важно обратить внимание на развитие хронических побочных эффектов.
При любом лечении онкологического процесса с помощью облучения существует риск того, что возникнет рецидив. Этот риск хоть и невелик, но присутствует. Вторая опухоль также может развиться через годы или даже десятилетия после лучевой терапии. Поэтому рекомендуется проводить регулярные контрольные осмотры. Лучевая терапия в наши дни является широко распространенным и отлично зарекомендовавшим себя методом лечения.
Рак прямой кишки – одна из самых серьезных болезней нашей цивилизации, которая занимает 4 место среди всех онкологических патологий и 2-е место среди опухолей желудочно-кишечного тракта.
Рак прямой кишки – что это такое?
Это злокачественное онкологическое заболевание происходит из эпителия прямой кишки. Этой опухоли присущи характерные черты любого злокачественного образования – быстрый рост, прорастание в соседние ткани, метастазирование.
Подвержены болезни мужчины и женщины в равной степени. Рост числа заболевших отмечается с 45 лет, а пик заболеваемости приходится на 75-летних.
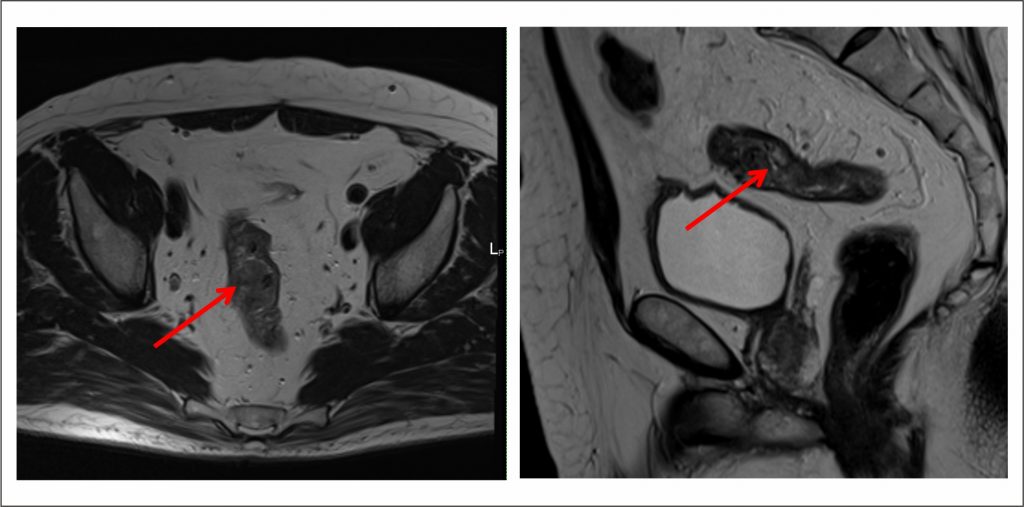
О заболевании
Слизистая оболочки конечного участка толстой кишки покрыта цилиндрическим эпителием с большим количеством желез. Их клетки продуцируют слизь. Под влиянием факторов риска появляются патологические клетки с бесконтрольным делением и утратой механизма апоптоза – запрограммированной гибели. Постепенно из них формируется опухоль прямой кишки.
Предположительно установлены причины рака прямой кишки:
- Неправильное питание.
Преобладание в рационе мясной пищи, животных жиров с одновременным дефицитом растительной клетчатки ухудшает прохождение кала, способствует запорам и развитию колоректальных опухолей. - Роль наследственности — замечена при возникновении некоторых форм новообразований.
- Предраковые патологии — полипы, болезнь Крона, неспецифический язвенный колит.
- Иммунодефицитные состояния, карцинома половых органов или молочной железы у женщин.
Виды рака прямой кишки
Тип опухоли определяется ее локализацией:
- Аноректальное расположение характерно для 5-8% случаев.
- Ампулярное встречается чаще других, до 80%. Это патология в самой широкой части кишки.
- Надампулярная локализация до 12% больных.
Характер роста опухоли может быть:
- экзофитный – растет в просвет кишечника;
- эндофитный – прорастает толщу стенки, инфильтрирует ее, может охватывать циркулярно;
- смешанный рост.
По гистологической картине новообразование бывает:
- железистый рак (аденокарцинома);
- солидный;
- перстневидно-клеточный;
- скирр;
- плоскоклеточный.
Симптомы рака прямой кишки, первые признаки
Развитие опухолевого процесса вызывает отдаленные признаки рака прямой кишки:
- слизь и кровь в кале;
- гнойные выделения;
- чувство переполненного кишечника;
- вздутие живота;
- боль в области прямой кишки;
- хроническая усталость, утомляемость;
- анемия;
- потеря веса.
На начальных стадиях проявления болезни может не быть. При выявлении анемии неизвестного происхождения стоит искать причину скрытого кровотечения. Возможно, это рак.
Поздние стадии характеризуются поражением других органов:
- прорастание в соседние органы, образование межорганных свищей;
- гнойно-воспалительные процессы – парапроктит, флегмона малого таза;
- перфорация опухоли надампулярной локализации с развитием перитонита;
- кровотечение.
Как выглядит рак прямой кишки – фото
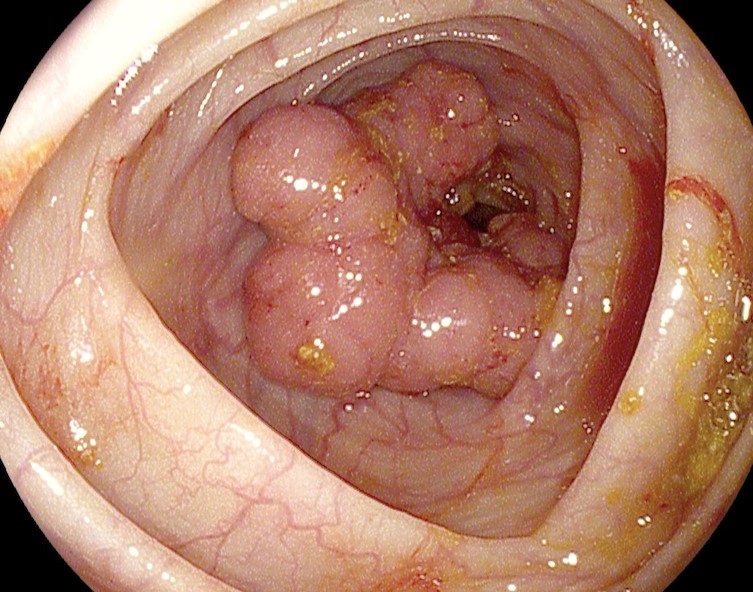
На фото рака прямой кишки можно заметить, что он значительно сужает просвет кишечника. Это является причиной запоров, переполненного живота, метеоризма.
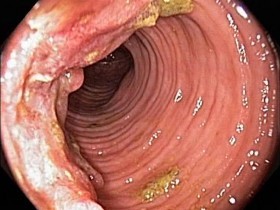
На этом фото карцинома растет инфильтративно, охватывая стенку.
Диагностика
После обращения к врачу, определяют симптомы, которые беспокоят пациента и позволяют предположить болезнь ректального отдела.
Общий анализ мочи и крови отражают состояние организма, наличие воспаления, анемию, работу почек и мочевого пузыря
Этот метод позволяет выявить опухоли аноректальной локализации. Определяют состояние сфинктера, слизистой оболочки.
Для обследования внутренней поверхности прямой кишки в более удаленных участках:
— ректороманоскопия – изучение кишечника с помощью жесткой трубки с оптическим прибором на конце;
— колоноскопия – исследование с помощью гибкого эндоскопа, позволяет обследовать весь кишечник.
Из подозрительных и измененных участков берут части тканей, которые изучаются на предмет раковых клеток или диспластических предраковых процессов.
Для дифференциальной диагностики рака, обнаружения на ранней стадии изменений, которые могут привести к онкологии.
Для определения распространенности злокачественного процесса. Можно выполнять абдоминально – через брюшную стенку, и трансректально – через анальное отверстие.
Часто возникает сочетание опухолей кишечника с гинекологическими карциномами – раком тела матки, яичников, а также молочной железы.
С применением контрастного вещества. На снимках заметны дефекты наполнения кишечника, патологические разрастания тканей, стенозы, вызванные новообразованием.
Выявляет даже небольшие по размеру патологические очаги, метастазы и инвазию опухоли в соседние органы, ее топографическое положение относительно других структур. Метод безопасен, не создает радиационную нагрузку, в отличие от КТ.
Стадии рака прямой кишки
Течение ракового процесса при отсутствии должного лечения прогрессирует. Стадия определяется по степени поражения самого кишечника, прорастанием ее через стенку, наличием метастазов в лимфоузлах, отдаленных поражениях других органов.
В связи с этим опухоли делят на 4 стадии. Такое распределение универсально для любых злокачественных опухолей.
1 стадия – опухоль небольших размеров, растет на слизистом слое, не поражает соседние органы и лимфоузлы.
2 стадия делится на А и Б. 2А – это поражение от трети до половины окружности кишечной трубки, но растет строго в стенке или просвете, метастазов нет. 2Б – размер очага такой же, но есть метастазы в околокишечных лимфоузлах.
3А – опухоль занимает более половины окружности кишки, прорастает через все слои и околокишечную клетчатку. Могут быть единичные метастазы в ближайших лимфоузлах.
3Б – любой размер опухоли, метастазы в отдаленных лимфоузлах, принимающих лимфу от ректальной области.
4 стадия – метастазы распространяются по внутренним органам и отдаленным лимфатическим узлам. Размер первичной опухоли может быть любой.
Методы лечения рака прямой кишки
Небольшой размер опухоли и ее прорастание только через слизистый и подслизистый слой прямой кишки, не затрагивая мышечный и серозный, позволяет выполнить хирургическое удаление самой опухоли. Иногда возможно проведение операции через кишку с помощью колоноскопа.
Если она проросла в мышечный слой, то показана резекция прямой кишки или экстирпация (полное удаление органа). Также удаляется параректальная клетчатка и лимфоузлы, в которых в 20% случаев уже обнаруживаются метастазы. Для проведения операции используют два доступа – лапаротомия (рассечение брюшной стенки) и лапароскопия (операция с помощью видеооборудования через несколько проколов на животе).
Тип операции выбирается исходя из локализации опухоли. Высокое расположение позволяет провести удаление новообразования и временно вывести конец кишки на брюшную стенку – сформировать колостому для дефекации. Такая манипуляция нужна, если пока сшить между собой концы кишки невозможно. Вторым этапом через некоторое время восстанавливают целостность кишечника.
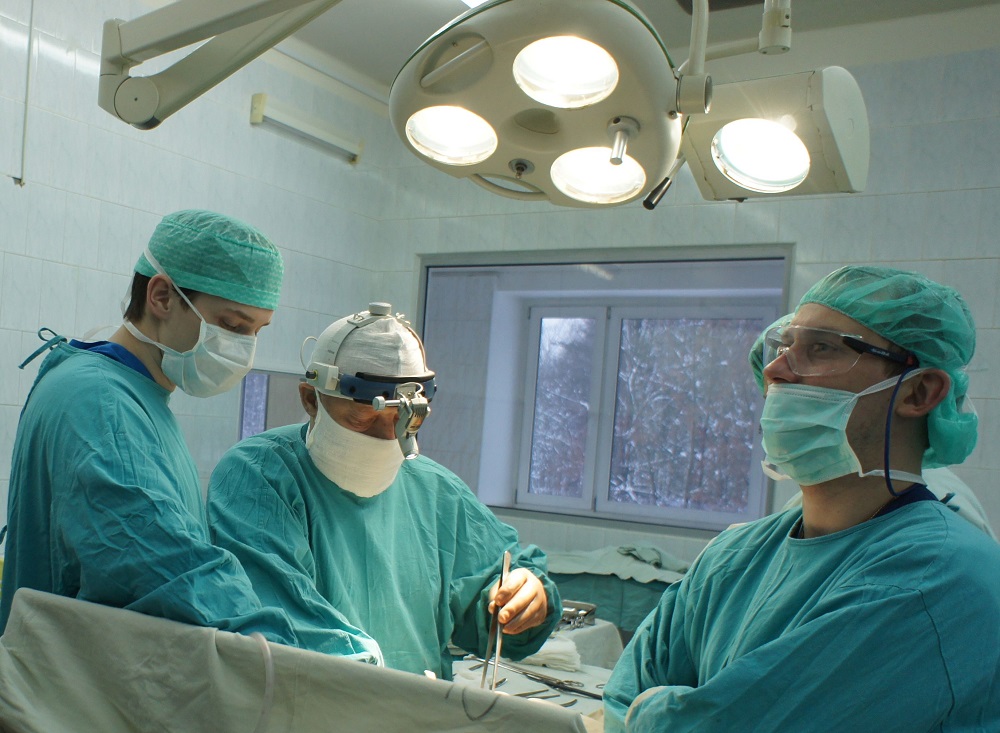
При низком расположении опухолевого процесса, если ниже ее не осталось здоровых тканей, проводят удаление пораженного участка и анального отверстия, накладывают колостому на брюшную стенку.
Прогноз выживаемости
После проведения радикальной операции выживаемость в течение 5 лет колеблется в пределах 34-68%. На исход лечения влияет стадия, на которой была диагностировна опухоль, состояние самого пациента, его возраст, сопутствующие заболевания.
В зависимости от стадии опухолевого процесса, пятилетняя выживаемость определена следующими цифрами:
- 1 стадия – до 77%;
- 2 стадия – до 73%;
- 3 а стадия – 46%;
- 3 б стадия – 43%.
4 стадия не рассматривается в данной статистике. Радикальные операции зачастую провести невозможно, т.к. метастазы опухоли диссеминрованы по всему организму. Летальный исход зависит от общего состояния больного.
Противопоказания
Операция противопоказана при следующих условиях:
- тяжелые хронические заболевания пациента – артериальная гипертензия, ишемическая болезнь сердца, когда невозможно дать наркоз;
- преклонный возраст пациента;
- запущенные стадии рака.
При распространенном процессе с метастазированием во многие органы применяют паллиативные резекции, направленные на облегчение состояния больного. Симптоматические операции – наложение обходных анастомозов, чтобы разгрузить кишечник и избежать осложнений на последних стадиях рака.
Лечение до и после операции
Химиотерапия и лучевая терапия показаны для больных с опухолями 2 и выше стадиями.
Если до операции были выявлены метастазы в нескольких лимфоузлах, а опухоль проросла мышечный слой, то на этапе подготовки к операции проводят лучевую терапию коротким курсом в течение 5 дней. Это позволяет уничтожить ранние метастазы, уменьшить размер самого образования.
Лечение рака прямой кишки после хирургического вмешательства проводится после получения патоморфологических данных об удаленных тканях. Решается вопрос о проведении облучения или его сочетании с химиотерапией. Лучевая терапия после операции уничтожает оставшиеся клетки в зоне первичной опухоли и предупреждает ее рецидив. У неоперабельных больных она облегчает состояние.
Чувствительность к химиотерапии выявляется у 30% больных. Ее назначают с лечебной целью для уничтожения метастазов.
Также химиотерапию проводят адьювантно – для предупреждения распространения карциномы, если выявлялось поражение нескольких лимфоузлов. Этот способ терапии улучшает качество и продолжительность жизни пациентов с метастазами. Применяют препараты платины, 5-фторурацил, лейковарин, фолинат кальция. Лекарства вводятся внутривенно капельно, курсами по несколько дней. Также применяют химиотерапию в сочетании с лучевой до проведения операции при местнораспространенной форме рака. Такое комбинированное лечение проводят в течение 1-1,5 месяца, а после окончания облучения через 6 месяцев выполняют операцию.
Читайте также:

