Лимфомы при вич инфекции реферат
Обновлено: 05.07.2024
ВИЧ-инфекция — один из факторов, который во много раз повышает вероятность развития рака. Выяснили, какие именно онкозаболевания чаще всего могут возникать при положительном ВИЧ-статусе, как их вовремя обнаружить, и на какие факторы риска еще нужно обратить внимание людям, живущим с ВИЧ.
Мишень вируса
Главная мишень вируса — CD4-Т-лимфоциты. Они передают сигнал другим клеткам, которые защищают организм от рака. В результате вмешательства вируса количество CD4-T-лимфоцитов постепенно уменьшается. Критически низкий уровень этих клеток - одна из причин отсутствия согласованной работы между звеньями иммунитета и главный механизм, приводящий к развитию СПИДа.
СПИД-индикаторные опухоли
Иммунитет человека с ВИЧ-инфекцией перестает контролировать процессы избыточного клеточного деления и злокачественной трансформации клеток. Вместе с уменьшением количества CD4-T-лимфоцитов происходит накопление раковых клеток. В результате у человека развиваются несколько видов опухолей, которые называют СПИД-индикаторными: появление такого вида рака с очень большой вероятностью означает наличие у человека СПИДа.
Однако повышается риск появления не только СПИД-индикаторных опухолей, но и тех видов рака, которые развиваются из-за потери иммунного контроля над несколькими онкогенными инфекциями: вирусом герпеса человека 8 типа (ВГЧ-8), вирусом папилломы человека (ВПЧ), вирусами гепатита В и С (ВГВ, ВГС), вирусом Эпштейна-Барр (ВЭБ) и другими.
Все эти состояния развиваются у людей с ВИЧ-инфекцией преимущественно на фоне снижения количества CD4-T-лимфоцитов до уровня менее 200 клеток/мкл (при разбросе в норме от 500 до 1100 клеток), но также могут возникать при нормальном или близком к нормальному уровню CD4-T-лимфоцитов.
Саркома Капоши
Саркома Капоши (СК) — СПИД-индикаторная опухоль, при которой происходит злокачественная трансформация клеток лимфатических и кровеносных сосудов. Риск развития СК у пациентов с ВИЧ-инфекцией увеличивается в несколько сотен раз. Различные белки ВИЧ-1 способны усиливать воспаление и нарушать регуляцию в эндотелиальных клетках. Это приводит к тому, что саркома Капоши может развиться до того, как уровень CD4-T-лимфоцитов упадет ниже 200 клеток/мкл. Еще одно обязательное условие для возникновения СК — наличие в организме вируса герпеса человека 8 типа.
Саркома Капоши развивается в виде папулы, пятна, узелка, бляшки коричневого, розового, красного или темно-красного цвета от нескольких миллиметров до нескольких сантиметров в диаметре. Обычно высыпания концентрируются на ногах, голове, шее, на слизистой оболочке — в области неба, десен, конъюнктивы.
До эры внедрения лекарств от ВИЧ — антиретровирусной терапии (АРТ) 5-летняя выживаемость (с момента диагностики опухоли) пациентов с саркомой Капоши составляла менее 10%. Применение АРТ значительно улучшило ситуацию — сейчас речь идет о 74%, — а также позволило снизить риск развития СК.
Более половины случаев СК (56%) диагностируются сейчас в локальной форме — до того, как опухоль распространится на лимфатические узлы, слизистую ЖКТ, печень, селезенку и другие органы. Прием антиретровирусной терапии помогает значительно замедлить прогрессию болезни и предотвратить распространение СК по всему организму.
Однако, человеку с ВИЧ и его амбулаторному врачу-инфекционисту необходимо учитывать несколько факторов риска развития этой опухоли:
- Этническая принадлежность: люди еврейского или средиземноморского происхождения, а также экваториальные африканцы;
- Мужской пол;
- Иммунодефицит: Люди с уровнем CD4-клеток менее 200 кл/мкл, те, кто перенес трансплантацию органов или костного мозга или постоянно принимает глюкокортикостероиды;
- Сексуальная ориентация: мужчины, имеющие секс с мужчинами(МСМ), подвержены более высокому риску развития СК.
Опухоли, связанные с ВПЧ
К онкологическим заболеваниям, ассоциированным с вирусом папилломы человека, относятся инвазивный рак шейки матки (ИРШМ), сквамозный (чешуйчатый) рак головы/шеи, рак анального канала, вульвы и влагалища. СПИД-индикаторной из них является только ИРШМ.
Распространенность генитальной онкогенной инфекции ВПЧ среди женщин, живущих с ВИЧ, в целом выше, чем у остального населения.
Вирус папилломы человека способен к самопроизвольной элиминации — исчезновению из организма. У ВИЧ-положительных женщин этот процесс занимает больше времени, что увеличивает вероятность появления патологических изменений в шейке матки.
Продолжительный прием АРТ приводит к более низкой распространенности ВПЧ высокого риска и поражений шейки матки и даже предотвращает новые случаи ИРШМ.
Раннее начало антиретровирусной терапии, приверженность лечению обеспечивают снижение вирусной нагрузки — количества вируса в крови. Эти меры очень эффективны в отношении местного иммунитета слизистой оболочки и профилактики ИРШМ.
Скрининг ИРШМ заключается в проведении ПАП-теста и ВПЧ-теста (ПЦР). Женщины с ВИЧ-инфекцией в возрасте от 21 до 29 лет должны пройти ПАП-тест во время первичной диагностики ВИЧ, затем — через 12 месяцев, если анализ не показал патологии. Некоторые эксперты рекомендуют делать следующий ПАП-тест через 6 месяцев после первого. Если результаты трех последовательных мазков без отклонений, повторные тесты следует проводить каждые 3 года. ВПЧ-тест не рекомендуется подключать к ПАП-тесту до 30 лет — высока вероятность положительного результата, при этом оснований для активных действий нет. Лечения ВПЧ не существует, а для развития РШМ требуется, как правило, от 10 лет.
Также для предотвращения ИРШМ девочкам с сопутствующей ВИЧ-инфекцией старше 9 лет и до 26 лет крайне рекомендуется вакцинация от ВПЧ-инфекции (вакцины: 2-валентный Церварикс, 4-валентный Гардасил, в Европе/США - 9-валентный Гардасил-9). Кроме ИРШМ и дисплазии вульвы и влагалища у женщин, вакцинация предотвращает развитие рака анального канала. У ВИЧ+ гетеросексуальных мужчин и МСМ риск этого вида рака возрастает в 19 раз.
О чем еще нужно знать
У пациентов с ВИЧ-инфекцией повышается риск развития:
Гепатоцеллюлярная карцинома
К факторам риска развития ГЦК у пациентов с ВИЧ относятся: цирроз печени, ожирение, диабет, возраст старше 60 лет, мужской пол.
Скрининг ГЦК проводится с помощью анализа крови на альфа-фетопротеин (АФП), который может продуцироваться раковыми клетками, или инструментальных методик диагностики — УЗИ, КТ, МРТ.
В последние годы всё чаще используется фиброскан для оценки стадии фиброза и близости к циррозу, независимому фактору риска ГЦК.
Предотвратить появление гепатоцеллюлярной карциномы можно с помощью своевременной вакцинации и ревакцинации от вирусного гепатита В и контроля вирусной нагрузки.
Неходжкинские лимфомы (НХЛ)
Несмотря на появление АРТ, НХЛ остаются актуальной проблемой для людей, длительное время живущих с ВИЧ. Хотя в большом количестве случаев неходжкинские лимфомы являются СПИД-индикаторными, они способны развиваться при нормальном уровне CD4-клеток и являются одной из наиболее частых причин смерти среди ВИЧ-положительных.
Общая выживаемость у пациентов с этим диагнозом низкая: более половины умирают в течение пяти лет от момента постановки диагноза
Отсюда возникают факторы риска развития НХЛ при ВИЧ-инфекции:
- наличие ко-инфекции вирусными гепатитами В, C, H.pylori;
- наличие вирусной нагрузки вируса Эпштейна-Барр или цитомегаловируса;
- наличие аутоиммунных заболеваний до постановки диагноза ВИЧ-инфекция;
- наличие специфических изменений в протеинограмме до или во время ВИЧ-инфекции;
- наличие минимальной вирусной нагрузки ВИЧ, несмотря на АРТ;
- снижение CD4-Т-лимфоцитов.
К скринингу неходжкинских лимфом относятся мониторинг вирусной нагрузки ВЭБ, ВГС, ВГВ и проведение инструментальной диагностики (КТ, МРТ, УЗИ, ФГДС).
С помощью контроля факторов риска и своевременного скрининга можно не только найти опухоль на ранней стадии, но и предотвратить заболевание.
Если рак все же обнаружили, ни в коем случае нельзя прерывать антиретровирусную терапию — она проводится по жизненным показаниям, что означает высокую вероятность неблагоприятного исхода противоопухолевой терапии без сопутствующего противовирусного лечения.
Для цитирования: Пивник А.В., Вукович А.М., Кремнева Н.В. и др. Лимфома Ходжкина у ВИЧ-инфицированных пациентов. Клиническая онкогематология. 2021;14(1):63–8.
РЕФЕРАТ
Цель. Оценить клинико-лабораторные особенности уникальной категории больных с сочетанием ВИЧ-инфекции, гепатита С или В и лимфомы Ходжкина (ЛХ).
Материалы и методы. В статье представлены данные о 85 больных с ВИЧ-инфекцией и ЛХ, которые наблюдались в отделении гематологии и вторичных иммунодефицитных заболеваний ГБУЗ МКНЦ им. А.С. Логинова ДЗМ с 2002 по 2019 г. (отсутствуют данные за 2008–2010 гг.). Распределение заболевших по полу было примерно равное, медиана возраста пациентов составила 35 лет (диапазон 20–74 года).
Результаты. Гистологический вариант ЛХ — преимущественно смешанно-клеточный с большим числом положительных тестов на вирус Эпштейна—Барр. Более 80 % пациентов с сопутствующей ВИЧ-инфекцией поступали с III–IV стадией ЛХ. Большинство из них получали высокоактивную антиретровирусную терапию (ВААРТ) еще до постановки диагноза ЛХ. Отличительной особенностью ВИЧ-инфицированных пациентов с ЛХ было высокое (в сравнении с больными с ВИЧ-инфекцией и другими вариантами лимфом) содержание лимфоцитов CD4+. Этот феномен рассматривается в рамках воспалительного синдрома восстановления иммунитета (ВСВИ). Разгадка этого феномена, возможно, положит начало решению проблемы возникновения и развития ЛХ. Вирусная нагрузка была умеренной или неопределяемой. Коинфицирование вирусами гепатита С и/или В имело место у 75 % больных. Противовирусная терапия по поводу сопутствующего гепатита С назначалась одновременно с ВААРТ. Все больные получали противоопухолевое лечение по программам АBVD, BEACOPP-14, BEACOPP-escalated, DHAP, ESHAP. По показаниям назначалась лучевая терапия. ВААРТ и препараты прямого действия при гепатите С принимались одновременно с противоопухолевым лечением. Тяжелых побочных реакций не наблюдалось. Летальность в группе больных с ЛХ и сопутствующими ВИЧ-инфекцией и/или вирусными гепатитами еще до начала противоопухолевого лечения ЛХ составила 8 %. В группе больных с такой комбинацией сопутствующих вирусных инфекций, но получавших противоопухолевую терапию по поводу ЛХ, летальность была 10 %. Причиной смерти служила IVB стадия ЛХ в сочетании с вирусным циррозом печени, агранулоцитозом и сепсисом.
Заключение. Неизлечимые в прошлом заболевания, такие как ЛХ и гепатит С, сегодня удается излечить. Нарушенный иммунитет при ВИЧ-инфекции можно успешно стабилизировать с помощью ВААРТ.
Ключевые слова: лимфома Ходжкина, ВИЧ-инфекция, воспалительный синдром восстановления иммунитета (ВСВИ).
При ВИЧ лимфома — одно из самых частых злокачественных процессов и развивается буквально в 200 раз чаще, чем в прочих популяциях взрослых. При носительстве вируса иммунодефицита появление клинических признаков лимфомы свидетельствует о переходе инфекционного заболевания в терминальную стадию, когда значительно снижается численность иммунных клеток. Среди всех больных СПИД, страдающих злокачественными новообразованиями, пятая часть приходится на пациентов с лимфопролиферативным процессом.
Какие лимфомы развиваются при ВИЧ
Лимфомы многообразны, их десятки, но при вторичном иммунном дефиците возникают только несколько разновидностей.
Как правило, из десяти ВИЧ-пациентов с лимфопролиферативным процессом диагностируется:
- крупноклеточная В-лимфома — у половины;
- лимфома Беркитта — у трети;
- первичная лимфома ЦНС — головного мозга — только одна;
- болеет высоко агрессивной плазмобластной лимфомой тоже один.
По российской статистике на одного больного лимфомой Ходжкина приходится 13 страдающих другими неходжкинскими вариантами, не столь благоприятными по прогнозу.
На фоне нормального иммунитета — без признаков дефицита лимфома Беркитта чаще развивается в детском возрасте, взрослых пациентов с таким вариантом очень немного. Так же очень нечасто в клинической практике встречается и первичное поражение головного мозга.
При СПИД и Т-клеточные лимфомы — большая редкость, хотя именно Т-клетки становятся местом внедрения и воспроизводства вируса иммунодефицита.
Чем отличается течение лимфом при СПИД
Замечено, что СПИД-лимфомы агрессивнее аналогичных процессов у не инфицированных, ярче их клинические проявления и больше вероятность рецидива после успешной терапии.
Особенность лимфопролиферативных злокачественных процессов при ВИЧ и в преимущественно нетипичной локализации, когда опухолью поражена не только лимфатическая система, но и другие органы. У большинства пациентов скорость замещения опухолью нормальных тканей так высока, что болезнь диагностируется уже в продвинутой стадии.
Чаще всего при СПИД-лимфоме поражается желудочно-кишечный тракт, легкие, печень. Поражение лимфоидного аппарата кишечника, слизистая оболочка которого изобилует фолликулами, у больного без дефицита манифестирует переход давнего злокачественного процесса в стадию лейкоза, у ВИЧ-инфицированных с этого симптома может начинаться заболевание.
Для не компрометированных ВИЧ онкогематологических пациентов совсем не характерно изначальное поражение костного мозга или выстилающих внутренние полости серозных оболочек — плевры, брюшины и перикарда, что довольно часто отмечается у инфицированных в дебюте болезни.
Как лечат лимфомы при ВИЧ
Тактику лечения злокачественной лимфомы определяет агрессивность процесса, который на раннем этапе может проявляться многообразием клинических симптомов с интоксикацией в виде высокой температуры, сильнейшей слабости и ночной потливости.
Все страдающие злокачественными новообразованиями ВИЧ-пациенты должны получать противовирусную терапию (ВААРТ), но у некоторых её приходится откладывать из-за необходимости спасения жизни, которой угрожает генерализованный злокачественный процесс, с помощью химиотерапии. Первый курс химиотерапии, как правило, оказывает позитивное действие, и тогда присоединяют ВААРТ.
Если состояние пациента и скорость прогрессии лимфопролиферативного заболевания позволяют, лечение начинается именно с ВААРТ, как минимум, двухнедельного курса до начала химиотерапии. Противовирусные препараты прописываются с перспективой пожизненного приёма.
При СПИД лимфомы лечатся также, как и у обычных пациентов, но не без особенностей. СПИД проявляется не только снижением иммунных клеток, но и развитием на этом фоне инфекций и воспалительных процессов, причиной которых становятся не патогенные для обычных людей микроорганизмы. Оппортунистические заболевания протекают тяжело, трудно лечатся и часто рецидивируют, что накладывает ограничения на схемы противоопухолевой терапии.

Какая химиотерапия проводится при СПИД-лимфоме
При злокачественных лимфомах рекомендуется проводить стандартную высокодозную химиотерапию с последующей пересадкой донорских стволовых клеток. Лучевая терапия не помощник химиотерапии, поскольку не повышает эффективность лечения ВИЧ-инфицированных.
Начать химиотерапию можно при наличии в миллилитре крови более двухсот CD4-лимфоцитов. Для применения в схемах химиотерапии ритуксимаба важно содержание CD4-лимфоцитов и отсутствие носительства хронического гепатита В.
Соблюдение стандартных доз цитостатиков и интервалов между инъекциями — залог успешности лечения. Недостаточность популяции клеток крови в процессе курсовой химиотерапии часто приводит к тяжёлой гематологической токсичности, поэтому невозможно обойтись без стимуляторов кроветворения и даже переливания компонентов крови.
В настоящее время, развитие неходжкиновских лимфом (НХЛ) у ВИЧ-инфицированных лиц, рассматривается как одно из проявлений СПИДа. Введение в практику методов активной антиретровирусной терапии (ААРТ) привело к снижению частоты заболевания СПИДом и сопутствующими патологиями, включая некоторые виды НХЛ. Раньше риск развития лимфом у ВИЧ-инфицированных больных был в 60 раз выше, чем у неинфицированных.
По-видимому, снижение частоты заболеваемости лимфомами непосредственно связано с восстановлением подавленного иммунитета.
К этой категории относятся болезнь Ходжкина, лимфомы узлов, первичная лимфома ЦНС и первичная эффузионная лимфома. Обычно эти лимфомы представлены диффузными иммунобластными или мелкоклеточными лимфомами (похожими на лимфому Беркитта), а также другими диффузными крупноклеточными лимфомами.
У больных также может развиваться Ki-1 анапластическая крупноклеточная лимфома, состоящая из В-клеток. В настоящее время иммунобластные лимфомы стали встречаться реже, в то время как число случаев лимфомы Беркитта и болезни Ходжкина не уменьшилось. Развитие первичной лимфомы ЦНС и эффузионной лимфомы связано с инфекцией ВЭБ. В клетках эффузионной лимфомы всегда обнаруживается геном ННV8.
Обычно НХЛ развиваются у больных СПИД по прошествии 1-2 лет после заболевания, и при очень низком содержании в крови клеток, несущих маркер CD4. У большинства больных опухолевый процесс носит распространенный характер и сопровождается поражением внутренних структур. Поражение ЦНС наблюдается в 40% случаев, костного мозга — в 35%, желудочно-кишечного тракта — в 25%.
Остальные органы и структуры поражаются реже. Мелкоклеточные лимфомы как правило развиваются в ЦНС и в костном могзе, а крупноклеточный тип — в органах желудочно-кишечного тракта. Опухоли, вызванные ВЭБ, особенно часто возникают в мозговых оболочках, костном мозге, носовых синусах и яичках. В этих случаях необходимо обследовать ЦНС. Показано, что по мере увеличения продолжительности жизни больных СПИДом (после лечения антибиотиками), у одной трети из них развиваются НХЛ.
Все более важную роль, особенно у наркоманов, начинает играть сопутствующая инфекция HTLV-1. При лекарственном лечении выживаемость больных увеличивается. Гематологическую токсичность можно снизить при введении гранулоцитарного колониеобразующего фактора, но подавление иммунитета остается серьезной проблемой.
У больных СПИДом эффективность лечения относительно невелика, и их средняя выживаемость составляет порядка 6 месяцев. К числу факторов неблагоприятного прогноза относятся заболевание СПИДом до диагносцирования НХЛ, плохое общее состояние больного, низкий уровень клеток, обладающих антигеном CD4, а также обширное распространение опухолевого процесса.
Если лимфомы развиваются у незараженных СПИДом больных с нормальной иммунной системой, то назначение им химиотерапевтических препаратов в полной дозе, приводит к более продолжительной ремиссии заболевания.
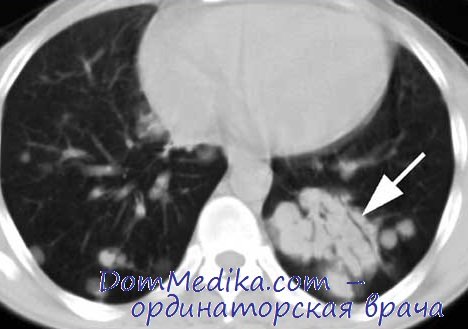
КТ органов грудной клетки при лимфоме у больного ВИЧ
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
АРВТ — антиретровирусная терапия
ВИЧ — вирус иммунодефицита человека
ЛБ — лимфома Беркитта
ЛУ — лимфатические узлы
НХЛ — неходжкинские лимфомы
СПИД — синдром приобретенного иммунодефицита
Вторичные заболевания у больных инфекцией, вызванной вирусом иммунодефицита человека (ВИЧ), включают не только поражения инфекционной природы (среди которых первое место по числу заболевших и летальных исходов занимает туберкулез), но и ряд опухолей. Так, неходжкинские лимфомы (НХЛ) регистрируют у больных ВИЧ-инфекцией в 200—600 раз чаще, чем в общей популяции, а на поздних стадиях болезни (синдром приобретенного иммунодефицита — СПИД) НХЛ регистрируют в 3% случаев [1]. Основную долю (70—90%) НХЛ составляют В-клеточные лимфомы: диффузная крупноклеточная лимфома высокой степени злокачественности (40—60%) и лимфома Беркитта — ЛБ (30—40%) [1, 2]. Некоторые подтипы злокачественных лимфом рассматривают в качестве оппортунистических, поскольку они развиваются только на фоне тяжелого иммунодефицита [3]. ЛБ и лимфогранулематоз могут проявляться даже в отсутствие выраженного снижения числа лимфоцитов CD4. Для них характерны агрессивный рост, поздняя диагностика (диагноз часто устанавливают только на поздней стадии заболевания, когда есть экстранодальные очаги), плохой ответ на лечение, неблагоприятный прогноз [4]. Клиническая симптоматика включает увеличение лимфатических узлов — ЛУ (плотные, неподвижные, безболезненные), лихорадку, ночные поты и потерю массы тела. К моменту установления диагноза у многих больных имеется поздняя стадия лимфомы [5] и, даже несмотря на применение антиретровирусной терапии, прогноз остается неблагоприятным [6].
Мы представляем спектр вторичных поражений, которые регистрируются в последние годы у больных ВИЧ-инфекцией, находящихся в заключении, а также приводим клинический пример развития пока еще редкого для подобных мест поражения — ЛБ.
В 2014 г. на диспансерном учете в исправительном учреждении Оренбурга находились 110 ВИЧ-инфицированных осужденных мужчин, возраст которых составил от 21 года до 55 лет. К моменту поступления в исправительное учреждение 86% пациентов нигде не работали, 4% имели первую судимость, 78% — вторую, 18% — 3 судимости и более. Потребителями инъекционных наркотиков были 99 (90%) человек. У пациентов установлены следующие клинические стадии ВИЧ-инфекции: III — у 58, IVА — у 32, IVБ — у 18, IVВ — у 2 больных, т. е. поздние стадии болезни имелись у 47,3% больных. У 42 пациентов число лимфоцитов CD4 достигало более 500 в 1 мкл. У 68 больных число лимфоцитов CD4 в крови составило менее 500 в 1 мкл, а среди них у 9 отмечено очень низкое содержание клеток CD4 (от 59 до 182 в 1 мкл). У пациентов с низкими параметрами иммунитета наблюдали наиболее тяжелые и разнообразные проявления вторичных поражений, среди которых — туберкулез легких (у 18), бактериальная пневмония (у 14), опоясывающий лишай (у 6), орофарингеальный кандидоз (у 10), стрептодермия (у 2), рак гортани (у 1), серозный менингит невыясненной этиологии (у 2) и др. Сопутствующий сифилис регистрировали у 3 пациентов. Антиретровирусную терапию (АРВТ) получали 28 пациентов, остальные, имевшие показания к ее началу, категорически отказывались от терапии. Редким вторичным поражением, впервые выявленным в данном учреждении, была Л.Б. Приводим это клиническое наблюдение.

Внешний вид больного ЛБ. а — май 2014 г.; б — июль 2014 г.
Таким образом, в исправительном учреждении Оренбурга в 2014 г. находились почти 50% пациентов с развернутыми стадиями ВИЧ-инфекции, у которых регистрировали различные вторичные/оппортунистические поражения. Большинство имеющих показания у началу АРВТ больных отказывались от лечения. Редким вторичным поражением являлась ЛБ, которая развилась у пациента на фоне глубокой иммуносупрессии.
Читайте также:

