Кондуктометрический метод анализа реферат
Обновлено: 02.07.2024
Проводящие измерения начались еще в XVIII веке, когда Андреас Баумгартнер заметил, что соленые и минеральные воды из Бад-Гаштайна в Австрии проводят электричество. Таким образом, использование этого метода для определения чистоты воды, которая часто используется сегодня для проверки эффективности систем очистки воды, началось в 1776 году. Так и началась история кондуктометрического метода анализа.
Фридрих Кольраушпродолжил развитие этой науки в 1860 годах, когда применил переменный ток к воде, кислотам и другим растворам. Примерно в это же время Уиллис Уитни, который изучал взаимодействия комплексов серной кислоты и сульфата хрома, нашел первую кондуктометрическую конечную точку. Эти находки завершились потенциометрическим титрованием и первым инструментом для объемного анализа Робертом Берендом в 1883 году при титровании хлорида и бромида HgNO3. Таким образом, современный кондуктометрический метод анализа основан Берендом
Кондуктометрический метод анализа основан на измерении электрической проводимости растворов и установления зависимости ее от концентрации.
Метод применим для определения концентрации растворов солей, кислот, оснований, для контроля состава промышленных растворов.
-низкочастотное кондуктометрическое титрование
-высокочастотное кондуктометрическое титрование
· Теоретические основы метода
Проводники электрического тока делятся:
-проводники 1 рода - это металлы, обладающие электронной проводимостью
- проводники 2 рода – это электролиты, обладающие ионной проводимостью
Электролиты – это вещества, молекулы или кристаллы которых распадаются на ионы, под воздействием молекул растворителя или высокой температуры (диссоциация)
В кондуктометрии рассматриваются именно проводники второго рода.
Для электролитов, также, как для металлов справедлив закон Ома:
· сила тока в проводнике прямо пропорциональна напряжению на его концах (разности потенциалов) и обратно пропорциональна сопротивлению этого проводника.

Где: I-сила тока,А
U-разность потенциалов между электродами,В
R-сопротивление проводника, Ом
Основной константой, характеризующей электрические свойства веществ, является электрическое сопротивление

R = p ,
l-длина (расстояние между электродами),м
S- площадь сечения проводника,м 2 ,см 2
p-удельное сопротивление,Ом*см/см 2 Удельным сопротивлением называется сопротивление столба исследуемого вещества длиной в 1 см и площадью сечения 1 см 2
Единица измерения электрической проводимости- сименс,См
1 сименс - это электрическая проводимость проводника, между концами которого создается
напряжение 1В при силе тока 1А
Электрическая проводимость (W) – величина, обратная электрическому сопротивлению проводника (R)

W =
Величина, обратная удельномуэлектрическому сопротивлению, называется удельной
Удельная электрическая проводимостьравна электрической проводимости 1 м 3 раствора, находящегося между параллельными электродами площадью 1 м 2 при расстоянием между ними 1м.

Для характеристики качественных и количественных характеристик растворов применяют эквивалентную электропроводность

Эквивалентной электропроводностью называется электрическая проводимость раствора электролита толщиной 1 м, находящегося между одинаковыми электродами с такой площадью, чтобы объем жидкости, заключенный между ними, содержал 1 моль химического эквивалента растворенного вещества.
Эквивалентная электропроводность измеряется в См ∙ моль –1 ∙ м 2 или Ом –1 ∙ моль–1 ∙ м 2 . В справочной литературе эквивалентную электропроводность часто приводят в единицах измерения См ∙ моль –1 ∙ см 2 или Ом –1 ∙ моль –1 ∙ см 2 . (При этом удельная электропроводность ϰ выражается в Ом –1 ∙ см –1 или См ∙ см –1 , С- молярная концентрация эквивалента в моль/см 3 ).
· Закон Кольрауша
В бесконечно разбавленном растворе эквивалентная электропроводность достигает предела и не зависит от концентрации, т.к в растворах слабых электролитов наступает полная диссоциация (α==1), в растворах сильных электролитов исчезает межионное взаимодействие
Эквивалентная электропроводность бесконечно разбавленных растворов (λ∞) называется предельной электропроводностью
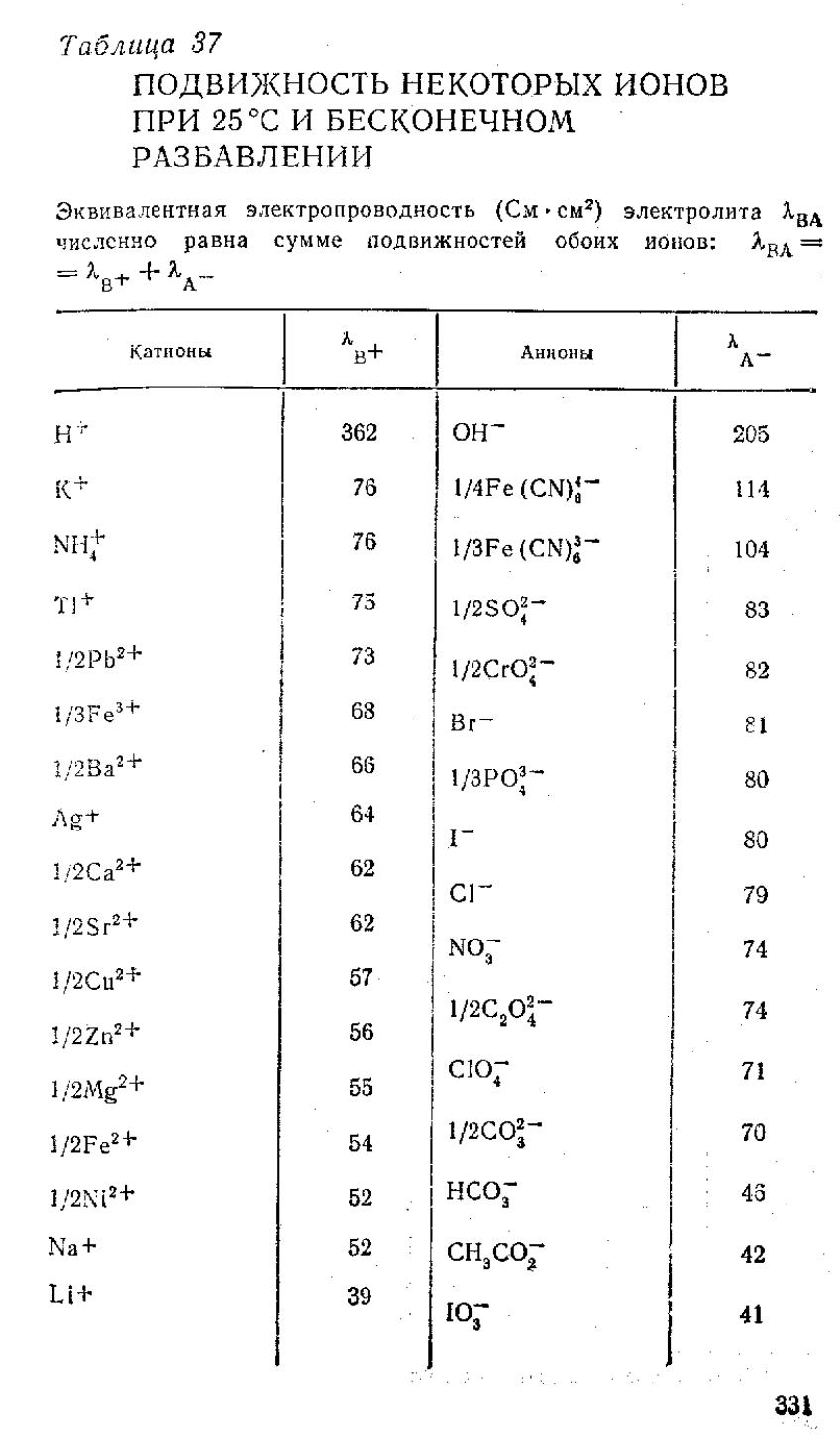
Кольрауш установил, что при таком разведении катионы и анионы проводят электричество независимо друг от друга, т.к. силы взаимодействия между ними отсутствуют. В этом случае эквивалентная электропроводность раствора будет равна сумме электропроводностей катионов (λк) и анионов (λа)
λ∞ = λк + λа
На основании этого закона можно рассчитать любого раствора с известной концентрацией
Значения подвижностей ионов приводятся в справочной литературе
Электропроводность раствора зависит:
-от природы вещества
Зависимость удельной электропроводности электролитов от концентрации
По величине эквивалентной электропроводности можно рассчитать:
-растворимость веществ и другие величины
· Измерение электропроводности
Аппаратурой для измерения сопротивления и следовательно электропроводности является мостовая схема Уитстона на приборе Кольрауша
Приборы для измерения электропроводности - кондуктометры
Принцип действия этих приборов основан на измерении электропроводимости анализируемых растворов, т. е. на кондуктометрическом методе. Применяются измерительные ячейки, состоящие из двух электродов, помещенных в анализируемый раствор на определенном расстоянии друг от друга. Сопротивление ячейки определяется только электропроводимостью раствора.
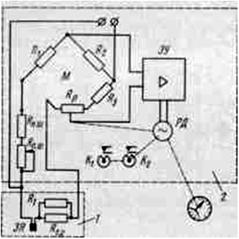
Принципиальная схема кондуктомера
Прибор состоит из двух основных узлов: преобразователя (1) и измерительного устройства (2).
Преобразователь включает электрохимическую ячейку ЭЯ, температурно-компенсирующее сопротивление Rt. с и шунтирующее сопротивление RT, служащее для настройки схемы.
Измерительное устройство- уравновешенный мост переменного тока - включает мостовую схему М, электронный усилитель ЭУ и реверсивный двигатель РД, воздействующий на движок реохорда Rv.
Сопротивления RH.ш и Rn. ш служат для настройки в процессе работы. Действует прибор следующим образом. Изменение концентрации раствора вызывает изменение сопротивления между электродами измерительной ячейки ЭЯ, что приводит к разбалансу моста, и на входе усилителя появляется сигнал, пропорциональный изменению концентрации раствора. Усиленный сигнал воздействует на реверсивный двигатель РД, перемещающий движок реохорда в направлении ликвидации разбаланса. Контакты К1 и К2 сигнализируют о максимальном и минимальном значении концентрации раствора.
Кондуктометрия (от англ. conductivity — электропроводность и метрия) — совокупность электрохимических методов анализа, основанных на измерении электропроводности растворов.
Кондуктометрия применяется для определения концентрации растворов солей, кислот, оснований, для контроля состава некоторых промышленных растворов.
Оглавление
Введение…………………………………………………………. 3стр.
Основные понятия и физико-химические основы………………………………4стр.
Контактные кондуктометрические приборы……………………………………15стр.
Бесконтактная низкочастотная кондуктометрия……………………………..16стр.
Бесконтактная высокочастотная кондуктометрия…………………………..19стр.
Измерительные схемы высокочастотных бесконтактных
кондуктометров………………………………………………………………………………..22стр.
Интегральный метод измерения электрической проводимости…..24стр.
Литература…………………………………………………………………………………. 28стр.
Файлы: 1 файл
Кондуктометрический метод.doc
на тему: Кондуктометрический метод.
Оценка за реферат _____________________
Студент А. А. Арефьев Преподаватель Н. В. Евреинова
- Введение………………………………………………………… . . 3стр.
- Основные понятия и физико-химические основы………………………………4стр.
- Контактные кондуктометрические приборы……………………………………15стр.
- Бесконтактная низкочастотная кондуктометрия…………………………….. 16стр.
- Бесконтактная высокочастотная кондуктометрия………………………….. 19стр.
- Измерительные схемы высокочастотных бесконтактных
кондуктометров………………………………………… ……………………………………..22стр. - Интегральный метод измерения электрической проводимости…..24стр.
- Литература…………………………………………………… ……………………………. 28стр.
Кондуктометрия (от англ. conductivity — электропроводность и метрия) — совокупность электрохимических методов анализа, основанных на измерении электропроводности растворов.
Кондуктометрия применяется для определения концентрации растворов солей, кислот, оснований, для контроля состава некоторых промышленных растворов.
Кондуктометрический анализ основан на изменении концентрации вещества или химического состава среды в межэлектродном пространстве; он не связан с потенциалом электрода, который обычно близок к равновесному значению. Кондуктометрия включает прямые методы анализа (используемые, например, в солемерах) и косвенные (например, в газовом анализе) с применением постоянного или переменного тока (низкой и высокой частоты), а также хронокондуктометрию, низкочастотное и высокочастотное титрование.
2. Основные понятия и физико-химические основы
Метод измерения электрической проводимости растворов электролитов (кондуктометрия) широко используют в лабораторной и производственной практике для химического анализа, физико- химических исследований и автоматического контроля ряда технологических параметров.
При растворении электролиты диссоциируют с образованием ионов. Одной из количественных характеристик этого процесса является степень диссоциации α, которая определяется отношением числа молекул п, распавшихся на ионы, к общему числу растворенных молекул (ионизированных п и неионизированных па): α=п/М=п(п+па).
В зависимости от значения α вещества подразделяют на неэлектролиты, сильные и слабые электролиты. Так, если вещество не диссоциирует, т;е. α =О, то оно не является электролитом. Если α близко к единице, то раствор является сильным электролитом. для слабых электролитов О
Способность вещества проводить электрический ток характеризуется его удельной электрической проводимостью численно равной проводимости слоя вещества, расположенного между противоположными гранями куба с ребром в 1 см. Удельная проводимость является индивидуальной характеристикой вещества и ее значения табулированы.
Электрическая проводимость вещества есть величина, обратная электрическому сопротивлению R. Если отрезок проводника длиной l и площадью поперечного сечения s обладает сопротивлением R, то его удельное электрическое сопротивление . Соответственно удельная электрическая проводимость раствора, дл я измерения проводимости обычно используют электролитическую измерительную ячейку, которая представляет собой сосуд, содержаший два или более электрода и заполненный анализируемым раствором.
В кондуктометрии отношение называют постоянной электролитической ячейки. Постоянная κ ячейки определяется эффективной площадью электродов и эффективным расстоянием между ними. Значение существенным образом зависит от конфигурации сосуда ячейки и характера распределения силовых линий поля в ее межэлектродном пространстве. В связи с этим вычислить эффективные значения 1 и s практически не возможно, и значение k определяют обычно экспериментально по эталонным растворам. Для этого ячейку заполняют растворами с известной удельной проводимостью измеряют и по уравнению (25.1) вычисляют среднее значение постоянной ячейки.
для разбавленных бинарных водных растворов электролитов удельная электрическая проводимость
где С и z концентрация и валентность растворенного вещества;
подвижность соответственно катионов и анионов.
Подвижность иона представляет собой произведение его абсолютной скорости на число Фарадея F. Под абсолютной скоростью иона подразумевается скорость иона в стационарном состоянии при градиенте потенциала, равном единице.
В кондуктометрии часто оперируют понятием эквивалентной электрической проводимости λ, которая определяется как проводимость слоя электролита толщиной 1 см, помещенного между одинаковыми электродами такой площади, чтобы объем электролита, заключенный между ними, содержал 1 моль растворенного вещества. Эквивалентная и удельная электрические проводимости связаны соотношениями
где C - концентрация электролита,моль/мл; V- объем электролита (мл), содержащий при данной концентрации 1 моль растворенного вещества.
Учитывая выражение (25.2), для эквивалентной проводимости имеем
для всех растворов электролитов эквивалентная проводиность растет с разбавлением вследствие увеличения степени диссоциации. Предельного значения λ достигает при полной диссоциации, т. е. при бесконечном разбавлении. Наличие функциональной зависимости
обусловило широкое использование методов кондуктометрии для определения концентрации электролитов. Однако в широком диапазоне концентраций уравнение (25.2) перестает быть справедливым и зависимость существенно усложняется, Характерные зависимости для некоторых растворов электролитов (рис.25.2) показывают, что однозначная зависимость между электропроводимостью и концентрацией может быть получена в случае, если кондуктометрические измерения проводят в диапазоне концентраций, не охватывающих область экстремума зависимости . Если в растворе находится смесь различных невзаимодействующих между собой электролитов, то электрическая проводимость раствора подчиняется закону аддитивности, т. е.
где, удельная проводимость смеси, состоящей из n компонентов;
-удельная проводимость i-го компонента в смеси;
Рис. 1. Схема двухэлектродной электролитической ячейки
Из этого следует, что кондуктометрический метод не является избирательным и пригоден в основном для измерения концентрации бинарных и псевдобинарных растворов.
Электрическая проводимость жидкости существенным образом зависит от температуры. для водных растворов электролитов повышение температуры на 1 приводит к возрастанию электрической проводимости на 1—2,5 %; поэтому в кондуктометрических приборах предусматривают автоматическую температурную коррекцию показаний, либо исследуемый раствор в процессе измёрений термостатируют.
Электрическая проводимость жидкости возрастает с темгтературой по экспоненциальному закону
где А и В — постоянные; Т — абсолтная температура.
В узком температурном интервале справедливо линейное приближение
где — электрическая проводимость при температуре соответственно ; α — температурный коэффициент электрической проводимости.
При контактных кондуктометрических измерениях с использованием двухэлектродных электролитических ячеек на результат измерения проводимости существенно влияют процессы, протекающие на межфазной поверхности электрод-раствор электролита. Электроды ячейки в рассматриваемом случае играют двоякую роль: они служат для подвода рабочего тока и для снятия падения напряжения, создаваемого в анализируемом растворе. Из этого следует, что, используя закон Ома, надежные данные по электрической проводимости можно получить при неизменности амплитуды подводимого к ячейке тока, а также при зависимости падения напряжения на электродах ячейки только от свойств раствора. Протекание электродных процессов препятствует выполнению этих условий.
Известно, что при погружении металлического электрода в раствор своей соли на границе металл-раствор возникает скачок потенциала. Появление этого скачка объясняется тем, что из металла в раствор переходят положительные ионы металла, в результате чего на поверхности электрода накапливается отрицательный заряд. Через некоторое время между металлом и раствором устанавливается разность потенциалов, препятствующая дальнейшему переходу катионов металла в раствор. Это состояние нужно рассматривать как динамическое равновесие, при котором на электроде одновременно и с одинаковой скоростью идут процессы перехода ионов из металла в раствор и из раствора в металл.
Значение равновесного скачка потенциала Е, зависящего от природы и активности катионов в растворе, для одного электрода определяется уравнением Нернста:
где - составляющая межфазной разности потенциалов, которая определяется свойствами электрода и не зависит от концентрации ионов в растворе; R - универсальная газовая постоянная; Т - абсолютная температура; n - валентность металла; F - число Фарадея (заряд моля ионов); - активная концентрация ионов металла в растворе.
При наложении разности потенциалов от внешнего источника равновесие на межфазной поверхности электрод - раствор нарушается. На одном электроде скорость разряда ионов становится больше скорости перехода ионов из металла в раствор, на другом, наоборот, скорость растворения металла превышает скорость разряда.
При протекании через электрод постоянного или переменного тока потенциал его изменяется. Процесс изменения потенциала электрода при прохождении через него тока называется поляризацией. Поляризация электрода имеет формальное сходство с процессом заряжения конденсатора, так как в обоих случаях изменение количества электричества приводит к изменению разности потенциалов. По аналогии с емкостью конденсатора вводят понятие о поляризационной емкости электрода. При поляризации различают два вида тока: стационарный ток, который поддерживает неравновесную разность потенциалов, и ток заряда, идущий на изменение зарядов двойного слоя. Ток заряда не является стационарным, так как он прекращается после изменения потенциала. Из этого следует, что поляризационная емкость в общем случае состоит из двух слагаемых: емкости двойного электрического слоя и так называемой псевдоемкости, обусловленной затратами количества электричества на поддержание неравновесного потенциала, т. е. на электрохимическую реакцию.
Рис. 2. Зависимость удельной электрической проводимости водных растворов от их концентрации при температуре 20 °С
В соответствии с этим импеданс электрода принято представлять виде параллельного соединения — импеданса двойного слоя и импеданса, обусловленного электрохимической реакцией (фарадеевский импеданс). На схеме замещения электрохимической ячейки (рис.3): Сдс — емкость двойного электрического слоя; Rs — поляризационное сопротивление; Cs — псевдоемкость; С — емкость, обусловленная диэлектр ическими свойствами раствора; R — омическое сопротивление раствора.
Емкость двойного электрического слоя не зависит от круговой частоты ω в широком диапазоне. Действительные и мнимые компоненты фарадеевского импеданса частотно-зависимы, и их значения убывают с частотой пропорционально . Таким образом, для ослабления влияния составляющих фарадеевского импеданса на результат определения электрической проводимости целесообразно определять при повышенных частотах.
1. Теоретические основы кондуктометрического метода анализа
Кондуктометрические методы анализа основаны на измерении электропроводности исследуемых растворов. Существует несколько методов кондуктометрического анализа:
прямая кондуктометрия – метод, позволяющий непосредственно определять концентрацию электролита путем измерения электропроводности раствора с известным качественным составом;
кондуктометрическое титрование – метод анализа, основанный на определении содержания вещества по излому кривой титрования. Кривую строят по измерениям удельной электропроводности анализируемого раствора, меняющейся в результате химических реакций в процессе титрования;
хронокондуктометрическое титрование – основано на определении содержания вещества по затраченному на титрование времени, автоматически фиксируемого на диаграммной ленте регистратора кривой титрования.
Кондуктометрия относится к наиболее распространенным методам исследования растворов и жидких систем вообще.
проводящими принято условно с χ ~10 -7 Ом -1 ·см -1 и выше;
умеренно проводящими с χ: 10 -7 – 10 -11 Ом -1 ·м -1 ;
непроводящими – χ ниже 10 -11 Ом -1 ·м -1 .
Данная классификация условна.
Основной константой, характеризующей электрические свойства вещества, является удельное электрическое сопротивление, зависящее от природы вещества и от температуры.
Согласно закону Ома удельное электрическое сопротивление (ρ) [Ом·м]:
где R – электрическое сопротивление, ом; S – площадь поперечного сечения, м 2 ; l – длина, м.
Температурная зависимость электрического сопротивления металлов подчиняется закону:
где α – температурный коэффициент.
Электрическая проводимость обусловлена движением заряженных частиц и зависит от количества носителей заряда и их подвижности.
Для разбавленных твердых растворов, их удельное электрическое сопротивление по правилу Маттиссена представлено из двух слагаемых:
где ρ(t) – электрическое сопротивление чистого металла, зависящее от температуры метала; ρ(x) – остаточное электрическое сопротивление, не зависящее от температуры и определяется типом примеси и ее концентрацией.
Эта формула применима при содержании примеси до 1 ат.% Согласно правилу Линде, добавочное электрическое сопротивление, вызываемое содержанием примеси 1 ат.%, пропорционально квадрату разности валентностей чистого металла и примеси (∆z):
где a, b – величины, определяющие свойства металла – растворителя.
Правило Маттиссена достаточно хорошо выполняется для большинства разбавленных металлических расплавов, правилу Линде многие расплавы не подчиняются.
Механизм электрической проводимости в металлических расплавах и твердых металлах принципиально не различается.
Переход металла из твердого в жидкое состояние сопровождается некоторым изменением электрических свойств: при плавлении удельное электросопротивление большинства металлов увеличивается в 1,5÷2 раза. Для некоторых металлов (Bi, Sb, As) характерно аномальное поведение: при плавлении их удельное электросопротивление уменьшается.
Электрическая проводимость оксидных расплавов близка к электропроводимости типичных электролитов (галлогениды щелочных металлов) и зависит от состава шлака и температуры. Это является одним из доказательств ионной теории строения шлаковых расплавов.
Их ионная структура определяет преимущественно ионную проводимость в расплавленном состоянии. Электропроводимость определяется, в первую очередь, размерами катионов и анионов и силами взаимодействия между ними.
Повышение температуры увеличивает электропроводимость оксидных расплавов. При переходе из твердого состояния в жидкое электропроводимость резко возрастает.
Уравнение Я.И. Френкеля характеризует температурную зависимость электропроводимости ионных кристаллов:
Уравнение применимо и для оксидных расплавов, в которых перенос тока осуществляется только катионами (которые много меньше по размеру, чем анионы), т.е. если радиусы анионов велики по сравнению с катионами, и анионы остаются почти неподвижными в электрическом поле.
При соблюдении уравнения Я.И. Френкеля экспертные данные укладываются в прямолинейную зависимость . Отклонения свидетельствуют о структурных изменениях, которые могут быть связаны с разложением комплексных анионов на простые.
Контактные методы измерения электрической проводимости расплавов
В основе лежит закон Ома: на фиксированном участке проводника из жидкого металла, имеющего длину l и площадь поперечного сечения S, определяется электросопротивление R χ .
Из соотношения устанавливают значения удельной электропроводимости металла.
Для определения электросопротивления проводника применяют следующие электрические измерительные схемы:
схема вольтметра-амперметра, в которой при помощи вольтметра измеряют падение напряжения на концах проводника V x , а амперметром – силу тока I. В этом случае значение R x определяют по закону Ома: . Точность метода невысока (≤ 1%) и определяется классом точности приборов.
Компенсационный метод: в цепь включают эталонное сопротивление R э и с помощью потенциометра измеряют падение напряжения на проводнике V x и эталоне V э . Расчет по формуле: более точный метод.
С использованием моста Уитстона или двойного моста Томсона. Точность 0,2–0,3%, но необходимо учитывать контактные сопротивления и сопротивление проводов.
Определение электропроводимости расплавов связано с техническими трудностями: контакт расплава с электродами, подбор материалов.
Конструкции измерительных ячеек с различным расположением калиброванного канала, в котором проводник из жидкого металла, электроды токовые и потенциальные.
Для расчета удельного электрического сопротивления (или электрической проводимости) по измеренному (методом моста или методом вольтметра-амперметра) значению электрического сопротивления расплава необходимо знать константу ячейки. Градуировку ячейки обычно производят водным раствором (при комнатной температуре) или расплавом NaCl или KCl (при 700–900 °С).
Похожие страницы:
Хроматографические методы анализа и их использование в анализе объектов окружающей природной среды
Ионообменная хроматография вредных веществ в анализе объектов окружающей среды
. анионов методом одноколоночной ИХ Глава 2. Примеры использования ионообменной хроматографии в анализе объектов окружающей среды Глава . разделения наиболее распространён кондуктометрический способ детектирования. Кондуктометрические детекторы измеряют .
Методы контроля загрязняющих веществ в объектах окружающей среды
Методы контроля загрязнения окружающей среды
. ОКРУЖАЮЩЕЙ СРЕДЫ Контактные методы наблюдений и контроля за состоянием природной среды дополняются неконтактными (дистанционными), основанными на использовании .
Электрохимические методы анализа и их современное аппаратурное оформление: обзор .
. объектов окружающей среды особенно важны методы автоматизированного мониторинга, и использование ИСЭ . кондуктометрических анализаторах непрерывного действия. Глава 3. Приборы на основе электрохимических методов анализа Вольтамперометрический метод анализа .
Если у вас возникли сложности с курсовой, контрольной, дипломной, рефератом, отчетом по практике, научно-исследовательской и любой другой работой - мы готовы помочь.


| Ион | Эквивалентная электропроводность, λ 0, Ом -1 м 2 г-экв -1 | |
| 18 0 С | 25 0 С | |
| H + | 0,0315 | 0,03497 |
| 1/3 Fe(CN)6 3- | - | 0,01009 |
| 1/4 Fe(CN)6 4- | - | 0,01105 |
| OH - | 0,0174 | 0,01976 |
4. Температура анализируемого раствора оказывает существенное влияние на измеряемые величины удельной электропроводности. В настоящее время не существует способа удовлетворительного описания влияния температуры на электропроводность. Причина такого положения дел кроется в слишком большом влиянии индивидуальной природы растворенных веществ на температурный коэффициент. С уверенностью можно сказать только одно: при повышении температуры на один градус удельная электропроводность раствора в среднем увеличивается на 1–2,5%.
Прямые кондуктометрические измерения
Аналитическое использование кондуктометрии обладает характерными чертами, связанными с низкой селективностью кондуктометрического детектирования. В самом деле, близкие значения эквивалентных электропроводностей ионов не позволяют говорить о том, что какой-либо ион может целиком определять электропроводность всего раствора. Таким образом, измерения электропроводности может приносить реальную аналитическую пользу только в том случае, если соотношение ионов в анализируемой смеси неизменно от пробы к пробе. Это, так называемая, задача определения разбавления исходного раствора. Примерами могут служить анализ промывных вод в ваннах отмывки гальванического производства, контроль за приготовлением технологических растворов в производственных условиях и т.п.
Кондуктометрическое титрование
Несомненно, большими аналитическими возможностями обладает кондуктометрическое титрование. Титрование позволяет восполнить недостаток селективности определения применением селективного к анализируемому иону титранта. Известны примеры кислотно-основного, осадительного, комплексонометрического титрований. Точность кондуктометрического титрования составляет 1%, но если принять меры по термостатированию анализируемого раствора, то точность определения можно в несколько раз увеличить.
Точка эквивалентности на графике находится пересечением двух прямых. Одна прямая (до точки эквивалентности) отражает изменение концентрации анализируемого иона и ионов титранта, а другая (после точки эквивалентности) является следствием увеличения концентрации ионов титранта.
Однако не всегда кривая титрования имеет такой вид. На рис. 2 приведены в качестве примера кривые титрования, полученные в результате различных аналитических определений.
Вид кривых очевидно различен. В связи с этим возникает закономерный вопрос о причинах различий и возможности прогнозирования вида кривой на основании данных о свойствах анализируемого иона и вещества титранта. В большинстве случаев прогноз возможен, поскольку вид кривой титрования определяется разностью эквивалентных электропроводностей анализируемого иона и ионов, составляющих вещество титранта.
Рассмотрим несложный расчет, позволяющий прогнозировать вид кривой титрования. Прежде всего, нужно ясно представить себе перечень ионов, принимающих участие в процессе титрования. Пусть нам предстоит определить хлорид с помощью осадительной реакции с нитратом серебра (рис. 2а):
Cl - + Ag + + NO3 - = AgCl + NO3 - .
Не вызывает сомнения, что в процессе титрования до точки эквивалентности происходит уменьшение ионов Cl - и NO3 - Увеличение концентрации ионов Ag + практически не происходит, так как серебро осаждается ионом Cl - В связи с этим можно утверждать, что динамика электропроводности происходит со скоростью, пропорциональной сумме
| Материал рабочего электрода | Определяемые соединения |
| Стеклоуглерод | Универсальный, но наиболее пригоден для анализа: катехоламинов и их метаболитов, фенолов, хлорфенолов, нафтолов, катехолов, ароматических аминов, нитроароматических соединений, хинонов, полиенов, тиолов, дисульфидов и др. |
| Золото | Алифатические спирты, моносахара, дисахара, олигосахара, алифатические амины, аминоспирты, аминосахара, нитроароматические соединения, аминокислоты, серусодержащие пестициды, этилентиомочевина |
| Платина | Спирты, гликоли, альдегиды, гипохлорит, арсенит, гидразины, ацетилхолин |
| Серебро | Цианид, сульфид, сульфит, тиосульфат, тиоцианат, бромид, иодид, гидросульфид |
| Ртуть | Тиолы, дисульфиды, нитрозамины, восстанавливаемые металлы |
| Медь | Сахара, аминокислоты, пептиды, полипептиды, белки |
| Никель | Сахара, спирты, аминокислоты |
| Палладий | Ароматические углеводороды |
Читайте также:

