Концепция ароматичности хюккеля реферат
Обновлено: 04.07.2024
Правило Хюккеля — ароматической является плоская циклическая сопряженная система, содержащая 4n + 2 (где n = 0,1,2 и т.д.) π-электронов.
Немецким химиком Э. Хюккелем в 1931 на основании квантовой теории были сформулированы требования к ароматической системе.
Критерии ароматичности
- Молекула имеет циклическое строение.
- Все атомы цикла находятся в состоянии sp 2 -гибридизации, образуя плоский σ-скелет молекулы, перпендикулярно к которому располагаются р-орбитали атомов.
- Существует единая замкнутая сопряженная π-электронная система, охватывающая все атомы цикла.
- Число π-электронов, образующих сопряженную систему соответствует формуле 4n+2, где n = 0,1, 2, 3, 4…
Например, для бензола n=1 (6 π-электронов), для нафталина n=2 (10 π-электронов), для фенантрена и антрацена n=3 (14 π-электронов).
Структуры, содержащие в цикле хотя бы один sp 3 -гибридный атом, ароматическими не являются, т.к. циклическое сопряжение отсутствует.
Ароматические соединения
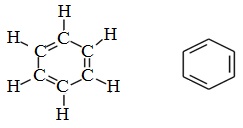
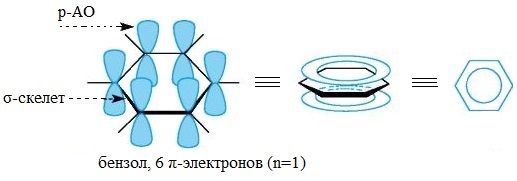
Бензол — плоская циклическая молекула с замкнутой системой сопряжения, в которой участвует секстет π-электронов, что соответствует правилу Хюккеля при n=1 (4⋅n+2=4⋅1+2=6).
Конденсированные ароматические соединения
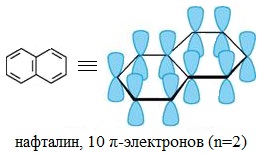
Правило Хюккеля можно применить к плоским конденсированным системам, в которых нет атомов, являющихся общими более чем для двух циклов. К таким системам относятся многоядерные ароматические углеводороды — нафталин, антрацен, фенантрен и т. д.
В этих соединениях все атомы углерода находятся в состоянии sp 2 -гибридизации, циклический σ-скелет плоский, π-электронное облако охватывает все атомы углерода циклов, число π-электронов подчиняется правилу Хюккеля (в нафталине 10, в антрацене и фенантрене 14 электронов).
Небензоидные ароматические системы

Ароматическими могут быть некоторые карбкатионы и карбанионы. В качестве примера можно привести циклопентадиенильный карбанион:
Все атомы углерода в цикле находятся в sp 2 -гибридизации, в молекуле имеется плоский циклический σ-скелет и единая замкнутая сопряженная система, которая образована 6 электронами. Таким образом, циклопентадиенид-анион соответствует всем критериям ароматичности.
Гетероциклические соединения
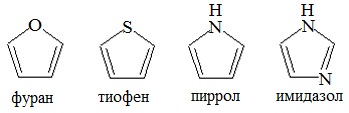
Правило Хюккеля применимо и ко многим гетероциклическим системам. Фуран, тиофен, пиррол, имидазол имеют плоское строение, и пара электронов на p-орбитали sp 2 -гибридизованного гетероатома используется в них для дополнения ароматического секстета. p-Орбитали перпендикулярны плоскости молекул.

Пиридин — ароматический гетероаналог бензола, у которого свободная электронная пара на атоме азота не участвует в сопряжении, и лежит в плоскости молекулы.
π-π сопряжение
Пиридин отвечает критериям ароматичности.
Все атомы цикла sp 2 -гибридизованы, цикл плоский, замкнутая сопряженная система π-π–типа, количество электронов удовлетворяет правилу Хюккеля – 4n+2=6.

Рубрики: ИМЕННЫЕ РЕАКЦИИ

ГОСТ
Для объяснения строения бензола Е. Хюккель использовал метод молекулярных орбиталей и принцип линейной комбиниции атомных орбиталей (ЛКАО). Такой подход получил название расчет по методу МО ЛКАО в $\pi$-электронном приближении Хюккеля, или метод Хюккеля. При нем считается, что каждый атом углерода в $sp2$ гибридном состоянии образует две $C-C$ и одну $C-H$-связь:
Шесть остаточных р-АО атомов углерода образуют соответствующие шесть МО, три из них ($\psi_$) связующие, а три ($\psi_$) разрыхляющие, которым соответствуют шесть молекулярных волновых функций:
Согласно строению бензола по Хюккелю шесть электронов размещаются таким образом, что на орбитали $\Psi 1$, они имеют минимальную энергию ($\alpha + 2\beta$) вследствие отсутствия узловой плоскости, то есть при образовании сплошного $\pi$-облака, которое охватывает все шесть атомов углерода, знаки их функций $\Psi$ одинаковы. Связывающие орбитали $\Psi2$ имеют уже по одной узловой плоскости, и поэтому их энергия больше ($\alpha + \beta$). Еще большая энергия ($\alpha - \beta$) присуща разрыхляющим орбиталям $\Psi 4$ и $\Psi 5$ с двумя узловыми плоскостями, а $\Psi 6$ с тремя узловыми плоскостями имеет максимальную энергию ($\alpha - 2\beta$). В основном состоянии молекулы бензола разрыхляющие орбитали $\Psi 4-6$ - свободные, не занятые.
Готовые работы на аналогичную тему
Энергия электронов. Кулоновские ($\alpha$) и резонансные ($\beta$) интегралы
Необходимо пояснить, что в квантово-механических расчетах в функции $\Psi$ значения $\alpha$ и $\beta$ соответствуют энергии р-электронов и называются кулоновским ($\alpha$) и резонансным ($\beta$) интегралами соответственно. Они измеряются в килоджоулях на моль (кДж / моль) или електроновольтах (эВ), как правило, не рассчитываются вследствие значительных математических затруднений, а рассматриваются как необходимые параметры. Допускают, что значение кулоновского интеграла $\alpha$ равно орбитальной энергии 2р- электрона, а значения резонансного интеграла $\beta$ одинаковы для разных атомов и описывают дополнительное снижение энергии молекулы в результате возможного перехода 2р-электрона от ядра одного атома к другому. Иначе говоря, значение $\beta$ равно энергии взаимодействия двух 2р-атомных орбиталей, как правило, интеграл $\beta$ имеет отрицательный знак (-).
Таким образом, в молекуле бензола происходит делокализация шести р-атомных орбиталей с образованием на их основе стабильного секстета $\pi$-электронов. Такая делокализация приводит ко всем специфическим свойства бензола и к уменьшению свободной энергии по сравнению с гипотетическим 1,3,5-циклогексатриеном с изолированными двойными связями. Значение уменьшения энергии называется энергией сопряжения (делокализацги), или энергией резонанса. Ее можно рассчитать для бензола. Например, энергия шести $\pi$-электронов в бензоле:
$E\pi = 2 (\alpha + 2\beta) + 4 (\alpha + \beta) = 6\alpha + 8\beta$
Для гипотетического циклогексатриена с изолированными тремя $\pi$-связями соответствующая энергия:
$E\pi = 3 \cdot 2 (\alpha + \beta) = 6\alpha + 6\beta$
Разница между ними составляет 2$\beta$. Это и есть энергия сопряжения, или делокализации. Значение $\beta$ рассчитывают, исходя из теплоты гидрирования. Так, при гидрировании циклогексена выделяемая теплота составляет примерно 120 кДж / моль. Тогда как при гидрировании бензола следовало бы ожидать выделения $3 \cdot 120 = 360$ кДж / моль, а выделяется на самом деле примерно 208 кДж / моль. Разница теплот гидрирования составляет 360 - 208 = 152 кДж / моль, что и является той самой энергией сопряжения. Она свидетельствует о значительной термодинамической стабилизации молекулы бензола и дает возможность рассчитать значение $\beta$, равное 152: 2 = 76 кДж / моль.
Правило Хюккеля
Различив в уровнях энергии электронов для бензола можно обобщить и расширить, распространив на другие плоские моноциклические, полностью сопряженные полиены с помощью правила Хюккеля.
Правило Хюккеля (1931 гг.): Замкнутые циклические соединения с $\pi$-звьявкамы проявляют ароматический характер и называются ароматическими при условии, что они имеют плоскую строение и содержат $An + 2\pi$-электронов, где $n$ = 0, 1, 2 и другие целые числа натурального ряда. Для увеличения термодинамической устойчивости все $\pi$-электроны должны находиться только на связывающих молекулярных орбиталях основного состояния молекулы. Например, бензол содержит 6 $\pi$-электронов (обозначены точками) и проявляет типичные ароматические свойства. Правило Хюккеля с некоторым приближением можно применять и к соединениям с двумя или тремя конденсированными бензольными циклами (нафталин, антрацен и т.д.).
Правилу Хюккеля подчиняются не только соединения, которые являются гомологами или производными бензола - так называемые бензольные ароматические соединения, но и те, что не содержат бензольного кольца, в том числе ионы и так называемые небензольные ароматические соединения, например:
Антиароматичные соединения
Соединения, энергия которых значительно возрастает при де локализации $\pi$-электронов, а их количество не соответствует правилу Хюккеля, называются аптиароматичнимы. К ним относятся соединения с $An \pi$-электронами, например циклобутадиен (4 $\pi$-слектроны), цнклооктатетраен (8 $\pi$-электронов) и другие:
Антиароматические соединения (англ. Antiaromatic compounds) - соединения, которые являются системами с незапертой электронной оболочкой из частично заполненными незвьязуючимы орбiталямы, то есть циклических $\pi$-электронная конъюгированная соединение, удовлетворяет правилу 4$n$ ($n$ = 1, 2, 3 . ).
Такая структура возникает в переходных состоянии во время выворачивания цикла, например, циклобутадиена, когда он переходит через плоскую конфигурацию. Она является термодинамически менее стабильной по сравнению с подобным ациклической составом, и структуроизменчивой, а энергетическая щель между высшей занятой и низшей свободной молекулярными орбиталями невелика.
Первый ароматический углеводород - бензол - был выделен М.Фарадеем в 1825 году; Фарадей установил его брутто-формулу - СnHn. Термин "ароматический" возник потому, что многие соединения - бензальдегид, бензиловый спирт, эфиры бензойной кислоты были выделены из различного рода ладанов, ароматических масел и бальзамов. Даже после установления четырехвалентности углерода и введения понятия о кратных связях в алкенах и алкинах, строение бензола и других ароматических углеводородов (аренов) оставалось загадкой, поскольку, являясь формально ненасыщенным соединением, они были удивительно инертны в реакциях присоединения.
В 1865 году А.Кекуле предложил для бензола структурную формулу циклогексатриена-1,3,5:
В этой формуле все атомы углерода эквивалентны. Формула Кекуле объясняет также существование трех дизамещенных производных бензола: орто- (1,2-), мета- (1,3)- и пара (1,4)-:
Несимметричные 1,2-дизамещенные производные бензола, согласно формуле Кекуле, должны были существовать в виде двух различных форм:
Реально существует лишь один орто-изомер. Для того, чтобы устранить это несоответствие, Кекуле предположил, что двойные связи в 1,3,5-циклогексатриене непрерывно перемещаются, и оба изомера быстро превращаются друг в друга (теория "осцилляции валентности"):
Хотя формула Кекуле никак не объясняет отсутствие свойств ненасыщенных соединений у ароматических углеводородов (прим.1) , она используется и в настоящее время.
Пытаясь объяснить свойства бензола особенностями строения, многие ученые предлагали другие структурные формулы. Так, Армстронг и Байер, а также Клаус предполагали, что в молекуле бензола четвертые валентности всех шести атомов углерода направлены к центру и насыщают друг друга; Ланденбург - что углеродный скелет бензола представляет собой призму; Чичибабин - что в бензоле углерод трехвалентен; Тиле - что двойные связи в бензоле не фиксированы, а постоянно перемещаются - "осциллируют"; Дьюар и Хюккель предлагали формулы с малыми циклами и двойными связями:
Данные современных физико-химических исследований однозначно указывают на эквивалентность всех углерод-углеродных связей в бензоле. Согласно этим данным, бензол представляет собой правильный шестиугольник с длиной углерод-углеродной связи 1.40 А (прим.2) и валентным углом 120 о . Образование -связей углерод-углерод можно представить как результат перекрывания sp 2 -гибридных орбиталей углерода, при этом шесть негибридизованных р-орбиталей шести атомов углерода образуют замкнутую -систему за счет бокового попарного перекрывания. Образующийся при этом секстет -электронов обусловливает особые свойства и стабильность бензола.
Структурную формулу бензола было бы логичнее изображть в виде правильного шестиугольника, в котором сплошное кольцо символизирует секстет -электронов:
Эта формула часто употребляется в химической литературе. Однако, с целью сохранения обычных представлений о четырехвалентности углерода, химики до сих пор пользуются и формулой Кекуле, отчетливо сознавая ее достоинства и недостатки.
Циклические ароматические фрагменты входят в число многих важных биологически активных соединений. Ниже приведена формула одной из природных -аминокислот - тирозина - являющейся ароматическим соединением:
Функционально замещенные ароматические углеводороды давно и широко используются в медицине. Так, сложные эфиры пара-аминобензойной кислоты (ПАБК) являются местноанестезирующими средствами (анестезин, новокаин и т.п.):
Еще одним большим классом лекарственных препаратов являются сульфаниламидные средства - производные сульфаниловой кислоты:
Оценка энергии молекулы бензола путем определения теплоты гидрирования (прим.3) показывает, что последняя составляет 206 кДж/моль, что существенно меньше, чем утроенное значение теплоты гидрирования изолированной двойной связи циклогексена (119 кДж/моль х 3 = 357 кДж/моль). Отсюда следует, что молекула бензола обладает меньшей энергией, чем ее следовало бы ожидать для циклогексатриена. Разность указанных значений составляет (357-206) = ~ 150 кДж/моль и называется энергией стабилизации, энергией делокализации или энергией резонанса.
Очевидно, делокализация -электронов в бензольном кольце, приводящая к неразличимости -связей, дает выигрыш энергии по сравнению с состоянием, когда эти связи локализованы. Реакции, приводящие к нарушению системы -связей, приводят к потере этого выигрыша и поэтому затруднены. Этим и объясняется устойчивость бензола к действию большинства восстановителей, окислителей и электрофильных реагентов.
Таким образом, ароматичность можно определить как особую стабилизацию делокализованной циклической -cистемы.
II.1.Концепция ароматичности Хюккеля
Устойчивость соединения к действию окислителей или других электрофильных реагентов зависит от реакционной способности последних и особенностей строения субстрата. В связи с этом долгое время понятие ароматичности формулировалось не всегда однозначно. В 1931 году на основании представлений квантовой механики Э.Хюккель дал определение, позволяющее производить отнесение той или иной системы к ароматическим.
Правило Хюккеля: ароматической является плоская моноциклическая сопряженная система, содержащая (4n + 2) -электронов (где n = 0,1,2. ).(прим.4) Так, для бензола число -электронов равно 6; таким образом он удовлетворяет Хюккелевскому критерию атоматичности (n = 1). Число (4n + 2) называется Хюккелевским числом электронов (прим.5) .
Следует отметить, что в образовании сопряженной системы электронов могут участвовать не только -электроны, но и неподеленная электронная пара или пустая р-орбиталь, следовательно, ароматическими могут быть не только нейтральные, но и заряженные частицы - катионы и анионы. Так, были получены устойчивые катион тропилия и анион циклопентадиенилия:
Нетрудно видеть, что число -электронов в обеих этих системах равно шести, как и в случае бензола (4n+2; n = 1).
Чтобы лучше понять причины большей устойчивости бензола по сравнению с другими непредельными системами, рассмотрим его с позиции теории молекулярных орбиталей.(прим.6) При этом будем учитывать только валентные р-электроны, находящиеся на молекулярных -орбиталях.
В теории молекулярных орбиталей предполагается, что электроны в молекуле принадлежат не отдельным атомам, и не отдельной химической связи, а всей молекуле. Уровни энергии, на которых располагаются электроны, называются молекулярными орбиталями (МО). Каждая молекула имеет определенное количество МО (определяемое числом и природой атомов, входящих в состав молекулы), которые могут быть свободными или занятыми. Заполнение орбиталей электронами происходит, начиная с наиболее низкой по энергии МО; на каждой орбитали может находиться не более двух электронов; два электрона, находящиеся на одной орбитали, имеют антипараллельные (противоположно направленные) спины.
Молекулярные орбитали делятся на связывающие, несвязывающие и антисвязывающие (разрыхляющие). Если заполнение орбитали энергетически выгодно (то есть энергия молекулы понижается при помещении электрона на данную орбиталь), то такая МО называется связывающей; если, наоборот - заполнение орбитали энергетически невыгодно (то есть энергия молекулы повышается при помещении электрона на данную орбиталь), то это антисвязывающая МО; если же при заполнении орбитали нет ни выигрыша, ни проигрыша в энергии, говорят о несвязывающей МО. Таким образом, оценив характер заполненных МО, можно судить об устойчивости молекулы.
Cогласно теории МО, шесть атомных р-орбиталей атомов углерода комбинируются с образованием шести молекулярных -орбиталей, из которых три связывающие, а три - разрыхдя.щие. На рисунке ниже показаны симметрия и узловые свойства молекулярных -орбиталей бензола. Связывающая МО 1 c самой низкой энергией не имеет узлов и охватывает все шесть атомов углерода. За ней следуют две вырожденные по энергии связыывающие МО 2 и 3, каждая из которых имеет по одному узлу. Узел на орбитали 2 перпендикулярен узлу на орбитали 3. Так как в бензоле имеется шесть -электронов, каждая из связывающих МО 1, 2 и 3 занята парой электронов с противоположными спинами. Остальные три МО бензола - 4 * , 5 * и 6 * - разрыхляющие орбитали, вакантные в основном состоянии. Орбитали 4 * и 5 * вырождены и имеют по два узла; орбиталь 6 * имеет три узла.
Для оценки устойчивости циклических полностью сопряженных полиенов удобно пользоваться простым мнемоническим приемом, известным под названием круг Фроста. Для этого правильный многоугольник, с числом углов, равным количесву атомов углерода в цикле, вписывают в круг таким образом, чтобы одна из вершин находилась в самой низшей точке круга. Точки, в которых вершины многоугольника касаются круга, считают уровнями энергии молекулярных -орбиталей. При этом оценка уровней энергии -орбиталей сводится к решению простой чисто геометрической задачи.
Горизонтальный диаметр обозначает несвязывающий уровень; орбитали, расположенные ниже горизонтального диаметра - связывающие, а расположенные выше - антисвязывающие.(прим.7)
Используем этот подход для оценки прочности бензола и циклобутадиена - систем плоских и сопряженных. На рисунке ниже приведены соответствующие диаграммы уровней энергий их -орбиталей.
Как видно из рисунка, в случае бензола все шесть -электронов располагаются попарно на трех связывающих орбиталях. Три антисвязывающие орбитали бензола в основном электронном состоянии не заняты электронами. Такая система устойчива.(прим.8) В случае же циклобутадиена из четырех -электронов на связывающей орбитали могут быть расположены только два электрона, два же других должны оказаться на несвязывающей орбитали, точнее (по правилу Гунда) - по одному на обеих несвязывающих. Таким образом, циклобутадиен должен представлять собой бирадикал, то есть быть весьма неустойчивым, что и наблюдается на практике (см. раздел II.2).(прим.9)
Аналогично, графическим методом может быть проведена оценка устойчивости других нейтральных и заряженных циклических сопряженных полиенов.
1. Оцените (при помощи круга Фроста) устойчивость следующих циклических сопряженных полиенов: а) циклооктатетраен; б) циклопропенилий-катион; в) циклопропенилий-анион.
Современный подход к проблеме ароматичности основан на применении теории молекулярных орбиталей. Впервые такой подход применительно к циклическим, полностью сопряженным плоским полиенам был сформулирован Э.Хюккелем в 1931 г. и известен как метод молекулярных орбиталей Хюккеля (МОХ). Его основы были изложены ранее в главе 2. Напомним, что в методе МОХ учитываются только валентные p-электроны, находящиеся на молекулярных -орбиталях. Уровни энергии циклических плоских сопряженных полиенов задаются уравнением Еj=+ тj, где Ej - энергия j-го уровня; - кулоновский интеграл; - резонансный интеграл; а тj - коэффициент, определяемый выражением, похожим на соответствующее выражение для нециклических сопряженных полиенов, приведенное в гл.2 (ч.1):


N - число атомов углерода в цикле.
Для оценки уровней энергии орбиталей циклических сопряженных полиенов в рамках метода МОХ удобно воспользоваться простым мнемоническим приемом, известным под названием круг Фроста. Для этого правильный многоугольник с числом углов, равным количеству атомов углерода в цикле, вписывают в круг с диаметром 4 таким образом, чтобы одна из вершин находилась в самой низшей точке круга. Эта точка круга соответствует уровню энергии +2, верхняя точка круга Фроста соответствует уровню энергии -2. Точки касания круга других вершин многоугольника определяют уровни энергии -орбиталей циклического сопряженного полиена. Оценка уровней энергии -орбиталей в этом случае сводится к решению простой, чисто геометрической задачи.
Рассмотрим с помощью круга Фроста прежде всего уровни энергии бензола, а затем и некоторых других циклических сопряженных полиенов - циклобутадиена и циклооктатетраeна. На рис. 12.2 приведены диаграммы уровней энергии -орбиталей бензола, циклобутадиена и 1,3,5,7-циклооктатeтраeна.
В бензоле имеются три связывающие и три разрыхляющие -орбитали. Все три связывающие -орбитали бензола полностью заняты, и на каждой из них размешаются по два электрона с антипараллельными спинами.

Рис. 12.2.Диаграммы уровней энергии для бензола, циклобутадиена и циклооктатетраена
Для плоского квадратного циклобутадиена расчет по Хюккелю или использование круга Фроста приводят к триплетному основному состоянию и нулевой энергии делокализации, так как энергия -электронов на одной связывающей и двух несвязывающих орбиталях (см. рис. 12.2) равна 2(, т.е. такая же, как и для двух независимых двойных связей. Рассмотрим, что предсказывает теория Хюккеля для плоского циклооктатетраена, содержащего восемь -электронов. Три -орбитали циклооктатетраена являются связывающими, три - разрыхляющими и две - несвязывающими, т.е. они имеют ту же энергию (), что и исходные атомные орбитали. Шесть -электронов попарно размещаются на трех связывающих орбиталях, но оставшиеся два -электрона должны располагаться на несвязываюших орбиталях. В соответствии с правилом Гунда эти электроны по одному заполняют две вырожденные несвязывающие орбитали, причем их спины параллельны. Следовательно, метод МОХ предсказывает, что плоский сопряженный циклооктатетраен должен быть триплетным бирадикалом. Известно, что триплетные бирадикалы относятся к числу крайне нестабильных частиц, легко претерпевающих дальнейшие превращения. Согласно экспериментальным данным, сопряженный циклооктатетраен имеет неплоское строение с чередующимися двойными и одинарными связями и существует в форме двух взаимно превращающихся друг в друга конформаций ванны:

Для того чтобы избежать уменьшения термодинамической стабильности при делокализации -электронов, циклооктатетраену энергетически выгоднее принять строение неплоского полиена. Неплоский полиен вообще не может обладать ароматическими свойствами и не подчиняется правилу ароматичности Хюккеля для плоских моноциклических сопряженных полиенов (см. ниже). Циклооктатетраен представляет собой типичный ненасыщенный углеводород, в котором чередуются двойные и одинарные связи. Циклооктатетраен нeплоский, потому что он неароматичен. Распространенное обратное утверждение (неароматичен, потому что неплоский) неверно, поскольку в этом случае причина и следствие меняются местами. Таким образом, теория Хюккеля обнаруживает глубокое различие в электронной конфигурации четырех-, шести- и восьмиэлектронных -систем и поддерживает концепцию ароматического секстета л-электронов.

Читайте также:

