Карбонат кальция реферат по химии
Обновлено: 03.07.2024
Карбонат кальция (углекислый кальций) —неорганическое химическое соединение, соль угольной кислоты и кальция. Химическая формула — CaCO3.
Карбонат кальция является распространенным минералом. В природе встречаются три полиморфные модификации (минералы с одинаковым химическим составом, но с различной кристаллической структурой): кальцит, арагонит и фатерит (ватерит).
Некоторые горные породы (известняк, мел, мрамор, травертин и другие известковые туфы) практически полностью состоят из карбоната кальция с некоторыми примесями. Кальцит является стабильным полиморфом карбоната кальция и встречается в самом разнообразном геологическом окружении: в осадочных, метаморфических и магматических горных породах. Около 10 % всех осадочных пород составляют известняки, сложенные преимущественно кальцитовыми остатками раковин морских организмов. Арагонит является вторым по устойчивости полиморфом CaCO3 и в основном образуется в раковинах моллюсков и скелетах некоторых других организмов. Также арагонит может образовываться и в неорганических процессах, например в карстовых пещерах или гидротермальных источниках. Фатерит является наименее стабильной разновидностью этого карбоната, и очень быстро превращается в воде либо в кальцит, либо в арагонит. В природе встречается относительно редко, когда его кристаллическая структура стабилизирована теми или иными примесями
Известняки широко распространены в природе. Их огромные залежи, образовавшиеся миллионы лет назад из скелетов морских животных, составляют примерно 20% от общего количества осадочных пород. О месте и роли известняков в истории Земли говорит уже тот факт, что в геологии целая эпоха развития планеты называется меловым периодом.
Образовались известняки в результате не очень сложных, но длительных геохимических процессов. Реки ежегодно выносят в моря многие миллионы тонн извести в виде взвеси и в растворенном виде. При встрече речной воды с соленой морской образуется своеобразный "геохимический барьер", на котором растворимые соединения, в том числе и известь, выпадают в осадок, смешиваясь с илом. Часть бикарбоната кальция остается в растворенном состоянии и постепенно поглощается морскими растениями и животными.
В результате в течение миллионов лет огромное множество раковин погибших моллюсков и кораллов образовало колоссальные скопления углекислого кальция. Так возникли различные известняки, среди которых по породообразующим организмам различают коралловые, ракушечные, нуммулитовые, мшанковые, водорослевые и др.
Ракушечный карбонат кальция (или ракушечник) представляет собой довольно пористую породу, состоящую почти полностью из целых или раздробленных раковин морских организмов. Здесь встречаются раковины моллюсков разных видов, размеров.
Иногда внутренняя поверхность раковин покрыта щетками мелких прозрачных кристалликов кальцита. Если такой образец рассматривать при солнечном свете, то создается впечатление, что в камень вкраплены изысканные драгоценности.
В отличие от ракушечника нуммулитовые известняки состоят в основном из раковин одного вида - вымерших одноклеточных организмов рода нуммулитов, которые жили в позднем мелу в морях Евразии, Африки и Америки. Размеры их раковин колеблются от 1 до 10 см (а иногда и до 16).
Животные же класса мшанковых, напротив, характеризуются микроскопическими размерами: их длина доходит до 1 мм. Наибольшего разнообразия эти щупальцевые организмы достигали в палеозое, о чем свидетельствуют известняки с их окаменелостями.
Эти и другие разновидности известняков дают богатейший материал не только для геологии, но и для других наук, изучающих историю Земли: палеонтологии, палеоботаники и пр.
По форме слагающих компонентов выделяют также известняки оолитовые (гранулы 0,2-2 мм) и пизолитовые (гранулы и конкреции более 2 мм).
Интереснейшими проявлениями карбоната кальция являются сталактиты и сталагмиты. Эти пещерные образования, которые терпеливо создает природа, не только потрясают воображение, но и способны навевать поэтические настроения, как, например, у Сюлли-Прюдома:
Если присмотреться, то можно увидеть, что поверхность сталактитов из-за проступающих в некоторых местах мелких кристалликов кальцита кажется сахаристой, а под бугристо-сахаристой корочкой карбонатной породы обнаруживаются прозрачные, солнечно-желтоватые, иногда с радужной поверхностью кристаллы кальцита.
Иногда из этой грубой, "невзрачной" известняковой породы выкристаллизовываются роскошные каменные цветы. В трещинах, прожилках, жеодах можно обнаружить кристаллы кальцита, сросшиеся в пучки, напоминающие хризантемы, георгины, гвоздики. А на изломе внешне ничем не примечательного известнякового камня вдруг "расцветает" изысканная кальцитовая "ромашка". Схожесть с цветами усиливается окраской кальцитовых кристаллов, которые в зависимости от примесей могут быть коричневыми, желтыми, бежевыми, красными, розовыми, белыми или бесцветными.
Карбонат кальция многолик. Карбонат кальция вездесущ. А потому говорить о нем можно бесконечно. Каждый его образец, любой обломок при внимательном рассмотрении может стать объектом не только серьезного научного исследования, но и поэтического, художественного творчества. И в любом случае - лишний раз продемонстрировать бесконечное разнообразие природы.
Природный карбонат кальция - древнейший строительный отделочный камень, который отличают высокая прочность, долговечность, исключительные декоративные и экологические качества, чистота цвета, однородность структуры, простота обработки и монтажа, эффективная теплоизоляция, доступная стоимость.
Карбонат кальция - широко распространенная порода, состоящая из минерала кальцита. Она легко определяется по бурно протекающей реакции с HCl. Цвет желтоватый, серый, белый, черный. Известняки бывают органогенного и химического происхождения.
Органогенные известняки состоят из остатков организмов. Последние редко сохраняются полностью, чаще они раздроблены, а также изменены последующими процессами. Степень сохранности их указывает на условия отложения осадка и последующей истории формирования породы. Если возможно, следует определить, остатками каких организмов представлен карбонат кальция, по ним и дается название. Если организмы не определены и карбонат кальция состоит из целых раковин, его называют карбонат кальция-ракушечник, а если из битых - детритусовый карбонат кальция.
Разновидностью органогенного карбоната кальция является мел, состоящий главным образом из мельчайших раковин и порошкового кальцита. Мел - белая землистая порода, широко используемая в качестве сырья.
Известняки химического происхождения встречаются в виде плотных известняков; оолитовых известняков; известкового туфа.
Известняки применяются в качестве строительного материала в цементной промышленности, в металлургии. В размолотом виде карбонат кальция используется как удобрение.
А в природе известняки залегают мощными пластами - иногда до тысячи метров толщиной. Используют их во многих отраслях народного хозяйства: в качестве флюса в черной металлургии, для изготовления портландцемента, при производстве минеральных удобрений, соды, в стекольной промышленности и в строительстве - для кладки и облицовки стен.
Минерал, основный карбонат меди. Образует зелёные массы натёчной формы с радиально-волокнистым строением. Кристаллы мелкие, имеют столбчатый, пластинчатый, игольчатый вид. Красивейший поделочный камень насыщенно зеленого цвета.
Из примесей наибольшее значение имеет Fe; меньше Mn, Ca. Используют для производства огнеупоров и вяжущих материалов, в химической промышленности. Может быть бесцветный, белый, серо-белый, желтоватый, коричневый, сиреневато-розовый.
В ряде случаев включает примеси глинистых минералов, доломита, кварца, реже гипса, пирита и органических остатков, которые определяют название известняков. Обычно светло-серого цвета. Имеет универсальное применение в промышленности, сельском хозяйстве и строительстве.
Исландский шпат CaCO3
Кристаллы ромбической формы. Строение делает этот камень простым в обработке. Высокое двойное лучепреломление света. Кристаллы имеют различную окраску, преимущественно бледного с примесями. Используется в оптических и оптоэлектронных системах
Цвет — бесцветный или белый, желтоватый, буроватый (за счёт примеси гидроксидов железа и глинистых частиц). Спайность совершенная. Широко используется в строительстве. Ассоциируется с кальцитом, обладающим сходными диагностическими признаками
Цвет желтовато-белый, серый, красновато-коричневый, бледно-зелёный, иногда белый. Важная руда для получения железа. Присутствует практически во всех разновидностях окисленных железистых кварцитов. Используется в горном деле, как утяжелитель буровых растворов, и металлургической промышленности.
Метаморфическая горная порода, состоящая только из кальцита с примесями других минералов. Имеет различную окраску в зависимости от примесей. Используется для строительства.
Мраморный оникс CaCO3
Своеобразная разновидность мрамора с полосами. Образовался вследствие слияния и наслаивания расплавившихся горных пород. Полосы в камне бывают разного характера. Очень популярный поделочный камень.
Лазурит на карбонате 2CuCO3-Cu(OH)2
Представляет собой голубой карбонат меди, сопутствует малахиту и имеет сходное с ним происхождение. По химическому составу лазурит представляет собой водный карбонат меди. Минерал синего цвета со стеклянным блеском, хрупкий.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Муниципальное бюджетное образовательное учреждение
«Многоликий карбонат кальция: в природе,
Воскубенко Олеся Сергеевна, 8Б класс
1.3.1.История открытия и происхождения названия кальция………..… 5
1.3.2.Нахождение кальция в природе………………………………..…… 5
1.3.3. Основные характеристики карбоната кальция………………….….7
1.3.4. Химические свойства карбоната кальция…………………………. 8
1.3.5. Применение карбоната кальция в промышленности……………. 8
1.3.6. Применение карбоната кальция в быту……………………….…..10
1.3.7. Применение карбоната кальция в медицине……………………. 11
1.3.8. Карбонат кальция в природе………………………………….…. 12
Говорят, что карбонат кальция является одним из самых наиболее используемых материалов в жизни человека. Он охватывает не только промышленности, но медицину, быт и многие другие сферы деятельности. К тому же, обладает интересным химическими свойствами и является абсолютно безопасным для человека. Действительно ли это так?
1. Выяснить, какую роль в жизни человека и окружающей среде играет карбонат кальция.
2. Практически подтвердить и опровергнуть химические свойства карбоната кальция, а именно его взаимодействие с кислотами.
1. С помощью опытов сделать выводы о химической активности карбоната кальция в составе веществ.
2. При помощи дополнительных источников литературы выяснить, каким образом карбонат кальция влияет на организм человека.
1.3 Основная часть
1.3.1. История открытия и происхождение названия кальция
Вплоть до конца XVIII века химики считали известь простым телом. В 1789 году А. Лавуазье предположил, что известь, магнезия, барит, глинозём и кремнезём — вещества сложные.
Раньше всего состоялось знакомство человека с известью. Весь мел и известняк - один из наиболее распространенных на Зеле горных пород. Тысячи лет назад люди уже возводили стены из камней, скрепленных известняковым раствором.
Третий шаг сделал Лавуазье. Он доказал, что известь – это окисел еще не выделенного нового металла.
1.3.2. Нахождение в природе
Из-за высокой химической активности кальций в свободном виде в природе не встречается.
На долю кальция приходится 3,38 % массы земной коры (5-е место по распространенности после кислорода, кремния, алюминия и железа). Содержание элемента в морской воде — 400 мг/л.
Рисунок 1 - Кальций в атмосфере аргона

1.3.3. Основные характеристики карбоната кальция
Карбонат кальция — неорганическое химическое соединение, соль угольной кислоты и кальция. Химическая формула - CaCO3. В природе встречается в виде минералов — кальцита и арагонита, является главной составной частью известняка, мрамора, мела, входит в состав скорлупы яиц, одно из самых распространенных на Земле соединений. Нерастворим в воде и этаноле. Карбонат кальция представляет собой твердые белые кристаллы без запаха и вкуса нерастворимые в воде, этаноле и легко растворимые в кислотах с выделением углекислого газа.
Рисунок 2 – Кальций в чистом виде

Температура плавления карбоната кальция: (кальцит) 825° C, (арагонит) 1339° C. Температура разложения карбоната кальция: 900-1000° C.
Получение карбоната кальция: Карбонат Кальция получают взаимодействием известкового молока с углекислотой или хлоридом кальция (СаСl2 ) с карбонатом натрия (Na2CO3) в водном растворе.
1.3.4. Химические свойства карбоната кальция
При нагревании до 900−1000 °C разлагается на оксид — углекислый газ CO2 и оксид — негашёную известь CaO :

\longrightarrow CaO+CO_\uparrow >>> Растворяется в воде при избытке углекислого газа, образуя кислую соль — гидрокарбонат кальция Ca(HCO3)2 :
![]()
+CO_+H_O\longrightarrow Ca(HCO_)_>>> Благодаря именно этой реакции образуются сталактиты, сталагмиты и прочие красивые природные формы и образуются карстовые пещеры.
При обжиге с температурой около 1500 °C с углеродом, например, в форме кокса, образует карбид кальция и угарный газ:

1.3.5. Применение карбоната кальция в промышленности
Очищенный от примесей карбонат кальция широко используется в бытовой и пищевой промышленности, при производстве пластмасс, красок, резины, бытовой химии и в строительстве.
В огромных количествах карбонат кальция используют при производстве стеклянных бутылок, так как кальций является одним из основных элементов, необходимых при создании стекла.
В пищевой промышленности часто используется и пищевой добавки Е-170. Е-170 Карбонат кальция - безопасная пищевая добавка природного происхождения. Эта безопасная пищевая добавка природного происхождения используется как пищевой краситель, стабилизатор, разделитель, питание для дрожжей, регулятор кислотности.
В пищевой промышленности E-170 используют в составе и для:
- консервированного питания для детей
- концентрированного молока и сливок
- некоторых видов твердых сыров
- какао-порошке, а также шоколаде
- для обработки виноградного сока
- декорирования пищевых продуктов
При употреблении продуктов с карбонатом кальция следует помнить о рекомендуемой врачами дневной дозе: от 1,2 до 1,5 г в день. В продуктах питания содержание добавки Е-170 в разы меньше, что говорит о том, что краситель Е-170 можно отнести к безопасным пищевым добавкам. В противном случае карбонат может вызвать молочно-щелочной синдром или гиперкальциемию.
При производстве косметических средств используются некоторые свойства карбоната, например.
- Карбонат кальция абсорбирует излишки кожного сала, не нарушая при этом защитных свойств кожи.
- Карбонат кальция регулирует кислотность продукта, абсорбирует излишки воды, предотвращает образование комков в косметике. Придает средству белоснежный оттенок.
- В составе зубной пасты может не только очищает зубы, но и придавать им блеск.
Производство пластмасс является одним из основных потребителей карбоната кальция. Изделия из видов пластмасс, содержащих это вещество, используются повсеместно – трубы, кафельная плитка, линолеум, ковровые покрытия и т.д.
В строительстве карбонат в значительных количествах входит в состав шпатлевок и герметиков.

Карбонат кальция (углекислый кальций) — неорганическое химическое соединение, соль угольной кислоты и кальция. Химическая формула CaCO3 .
В природе встречается в виде многочисленных минералов, например, кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора, мела, входит в состав скорлупы яиц птиц.
Нерастворим в воде и этаноле.
Содержание
Применение
Используется как белый пищевой краситель E170. Являясь основой мела, используется для письма на досках. Используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве.
Массовое производство/использование


Очищенный от примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, в качестве наполнителя при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве.
При производстве бумаги карбонат кальция применяют одновременно в качестве отбеливателя, наполнителя, а также раскислителя.
Используется при производстве силикатного стекла, — материала для производства оконного стекла, стеклянных бутылок, стекловолокна.
Применяется при производстве предметов гигиены (например, зубной пасты), в медицине.
В пищевой промышленности часто используется в качестве препарата препятствующего слеживанию и для препятствования слипания в комки сухих молочных продуктах.
При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (синдром Бернетта). Рекомендован при болезнях костных тканей.
Производители пластмассы — одни из основных потребителей чистого карбоната кальция (более 50% всего потребления). Используемый в качестве наполнителя и красителя, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т. п.), полиолефинов. Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т.п. Карбонат кальция составляет порядка 20% красящего пигмента, используемого при производстве красок.
В строительстве
Строительство — ещё один из основных потребителей карбоната кальция. Например, в качестве наполнителя шпаклёвок и герметиков.
Также карбонат кальция является важным составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви.
Карбонат кальция широко применяется для раскисления кислых почв.
Нахождение в природе

Карбонат кальция находится в минералах в виде полиморфов:
Тригональная кристаллическая структура кальцита является наиболее распространенной.
Минералы карбоната кальция находятся в следующих горных породах:

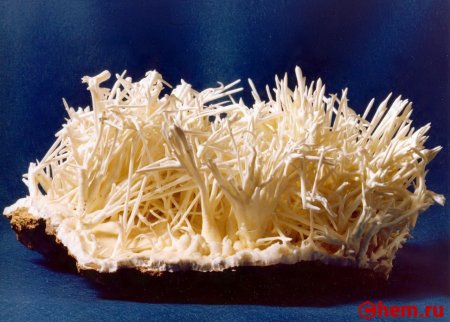


Геология
Залежи карбоната кальция в виде меловых пластов — отложений известковых раковин моллюсков, в основном, мелового периода является распространенным минералом на всех континентах.
В природе встречаются три кристаллические модификации (минералы с одинаковым химическим составом, но с различной кристаллической структурой): кальцит, арагонит и фатерит (ватерит).
Некоторые горные породы (известняк, мел, мрамор, травертин и другие известковые туфы) практически полностью состоят из карбоната кальция с различными примесями.
Кальцит является устойчивой кристаллической модификацией карбоната кальция и встречается в самых разнообразных геологических условиях: в осадочных, метаморфических и магматических горных породах.
Около 10 % всех осадочных пород составляют известняки, сложенные преимущественно кальцитовыми остатками раковин морских организмов. Арагонит является второй по распространённости кристаллической модификацией CaCO3 и в основном формируется в раковинах моллюсков и скелетах некоторых других организмов.
Также арагонит может образовываться и в неорганических процессах, например в карстовых пещерах или гидротермальных источниках.
Фатерит является наименее стабильной разновидностью этого карбоната, и очень быстро превращается в воде либо в кальцит, либо в арагонит. В природе встречается относительно редко, когда его кристаллическая структура стабилизирована теми или иными примесями.
Получение
Подавляющее количество карбоната кальция, добывающееся из полезных ископаемых, используется в промышленности. Чистый карбонат кальция (например, для производства продуктов питания или использования в фармацевтических целях), может быть изготовлен из природного минерала с малым количеством вредных примесей, например, из мрамора.
В лаборатории карбонат кальция может быть приготовлен предварительным гашением оксида кальция — негашеной извести. При этом образуется гидроксид кальция, и затем в суспензию продувается углекислый газ для получения карбоната кальция:
Химические свойства
При нагревании до 900—1000 °C разлагается на кислотный оксид — углекислый газ CO2 и основный оксид — негашёную известь CaO:
Растворяется в воде при избытке углекислого газа образуя кислую соль — гидрокарбонат кальция Ca(HCO3)2:
Из-за этой реакции образуются сталактиты, сталагмиты. Природные подземные воды, обильные углекислом газом, растворяют плохо растворимый карбонат кальция с образованием много лучше растворимого в воде гидрокарбоната кальция, при выделении подземной воды в виде капель с потолков пещер при попадании в воздух с низкой концентрацией углекислого газа происходит обратная реакция превращения гидрокарбоната кальция в плохо растворимый осадок карбоната кальция, образующего красивые природные формы в пещерах, и из-за этого же механизма образуются карстовые пещеры.
При обжиге с температурой свыше 1500 °C с углеродом, например, в форме кокса, образует карбид кальция и угарный газ:

. В природе встречается в виде минералов — кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора. Нерастворим в воде и этаноле.
Содержание
Применение
Используется как белый пищевой краситель Е170. Являясь основой мела, используется для письма на досках. Используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве.
Массовое производство/использование


Очищенный от посторонних примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве. Производители бумаги используют карбонат кальция одновременно в качестве отбеливателя, наполнителя (заменяя им дорогостоящие волокна и красители), а также раскислителя. Производители стеклянной посуды, бутылок, стекловолокна используют карбонат кальция в огромных количествах в качестве источника кальция — одного из основных элементов, необходимых для производства стекла. Широко используется при производстве продукции личной гигиены (например, зубной пасты), и в медицинской промышленности. В пищевой промышленности часто используется в качестве антислеживающего агента и разделителя в сухих молочных продуктах. При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (синдром Бернетта). Рекомендован при болезнях костных тканей.
Производители пластмассы — одни из основных потребителей карбоната кальция (более 50 % всего потребления). Используемый в качестве наполнителя и красителя, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т. п.), полиолефинов. Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т. п. Карбонат кальция составляет порядка 20 % красящего пигмента, используемого при производстве красок.
Строительство
Строительство — еще один из основных потребителей карбоната кальция. Шпатлевки, различные герметики — все они содержат карбонат кальция в значительных количествах. Также, карбонат кальция является важнейшим составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви.
Карбонат кальция также широко используется в очистительных системах, как средство борьбы с загрязнением окружающей среды, при помощи карбоната кальция восстанавливают кислотно-щелочной баланс почвы.
Нахождение в природе

Карбонат кальция находится в минералах в виде полиморфов:
Тригональная кристаллическая структура кальцита является наиболее распространенной.
Читайте также:

