Идеал газ реферат казакша
Обновлено: 02.07.2024
Идеальный газ — математическая модельгаза, в которой предполагается, что потенциальной энергией молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Модель широко применяется для решения задач термодинамики газов и задач аэрогазодинамики. Например, воздух при атмосферном давлении и комнатной температуре с большой точностью описывается данной моделью. В случае экстремальных температур или давлений требуется применение более точной модели, например модели газа Ван-дер-Ваальса, в котором учитывается притяжение между молекулами.
Различают классический идеальный газ (его свойства выводятся из законов классической механики и описываются статистикой Больцмана) и квантовый идеальный газ (свойства определяются законами квантовой механики, описываются статистиками Ферми — Дирака или Бозе — Эйнштейна).
Газовые законы - законы термодинамических процессов, протекающих в системе с неизменным количеством вещества при постоянном значении одного из параметров: закон Шарля, закон Гей-Люссака, закон Бойля-Мариотта, а также закон Авогадро, закон Дальтона.
Уравнение состояния идеального газа (уравнение Менделеева - Клапейрона ) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
· p — давление,
· Vμ — молярный объём,
· T — абсолютная температура,
· R — универсальная газовая постоянная.
Так как , где где ν — количество вещества, а , где m — масса, μ — молярная масса, уравнение состояния можно записать:
та форма записи носит имя уравнения (закона) Менделеева — Клапейрона .
Уравнение можно записать в виде:
Последнее уравнение называют объединённым газовым законом . Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
— закон Бойля — Мариотта.
ЗАКОН БОЙЛЯ — МАРИОТТА, один из основных газовых законов, который описывает изотермические процессы в идеальных газах. Его установили учёные Р. Бойль в 1662 г. и Э. Мариотт в 1676 г. независимо друг от друга при экспериментальном изучении зависимости давления газа от его объема при постоянной температуре.
Согласно закону Бойля-Мариотта при постоянной температуре Т объем V данной массы m идеального газа обратно пропорционален его давлению р , т. е.:
pV = const = С приT=const иm=const
Постоянная С пропорциональна массе газа (числу молей) и его абсолютной температуре. Другими словами: произведение объема данной массы идеального газа на его давление постоянно при постоянной температуре. Закон Бойля — Мариотта выполняется строго для идеального газа. Для реальных газов закон Бойля — Мариотта выполняется приближенно. Практически все газы ведут себя как идеальные при не слишком высоких давлениях и не слишком низких
 |
температурах.
Закон Бойля — Мариотта следует из кинетической теории газов, когда принимается допущение, что размеры молекул пренебрежимо малы по сравнению с расстоянием между ними и отсутствует межмолекулярное взаимодействие. При больших давлениях необходимо вводить поправки на силы притяжения между молекулами и на объем самих молекул. Как и уравнение Клайперона, закон Бойля — Мариотта описывает предельный случай поведения реального газа, более точно описываемый уравнением Ван-дер-Ваальса. Применение закона приближенно можно наблюдать в процессе сжатия воздуха компрессором или в результате расширения газа под поршнем насоса при откачке его из сосуда.
Термодинамический процесс, котроый происходит при постоянной температуре называется изотермическим. Изображение его на графике называется изотермой.(см. график изотермического процесса)
Французский ученый Ж. Гей-Люссак в 1802 году нашел экспериментально зависимость объема газа от температуры при постоянном давлении. Данные лежат в основе газового закона Гей-Люссака.
Формулировка закона Гей-Люссака следующая: для данной массы газа отношение объема газа к его температуре постоянно, если давление газа не меняется. Эту зависимость математически записывают так:
V/ Т =const, если P=const и m=const
Данный закон приближенно можно наблюдать, когда происходит расширение газа при его нагревании в цилиндре с подвижным поршнем. Постоянство давления в цилиндре обеспечивается атмосферным давлением на внешнюю поверхность поршня. Другим проявлением закона Гей-Люссака в действии является аэростат. Закон Гей-Люссака не соблюдается в области низких температур, близких к температуре сжижения (конденсации) газов.
Закон справедлив для идеального газа. Он неплохо выполняется для разреженных газов, которые по своим свойствам близки к
 |
идеальному. Температура газа должна быть достаточно велика.
Французский ученый Ж. Шарль в 1787 году нашел экспериментально зависимость давления газа от температуры при постоянном объеме. Данные лежат в основе газового закона Шарля.
Формулировка закона Шарля следующая: для данной массы газа отношение давления газа к его температуре постоянно, если объем газа не меняется. Эту зависимость математически записывают так:
 |
P /Т= const , если V = const и m = const
Данный закон приближенно можно наблюдать, когда происходит увеличение давления газа в любой емкости или в электрической лампочке при нагревании. Изохорный процесс используется в газовых термометрах постоянного объема. Закон Шарля не соблюдается в области низких температур, близких к температуре сжижения (конденсации) газов.
Закон справедлив для идеального газа. Он неплохо выполняется для разреженных газов, которые по своим свойствам близки к идеальному. Температура газа должна быть достаточно высокой. Процесс должен проходить очень медленно
Газовые законы - законы термодинамических процессов, протекающих в системе с неизменным количеством вещества при постоянном значении одного из параметров: закон Шарля, закон Гей-Люссака, закон Бойля-Мариотта, а также закон Авогадро, закон Дальтона.
1. Вукалович М.П., Новиков И.И. - Термодинамика. М: Машиностроение, 1972
2. Грабовский Р.И. Курс физики. М: Высшая школа, 1974
4. Коротков П.Ф. Молекулярная физика и термодинамика - 2e изд., MФТИ, 2004
6. Якунин В. И., Учебное пособие для изучающих физику в средней школе., Тамбов, ТИПКРО, Тамбовский областной физико-математический лицей, 1994

*Білімділік: Макроскопиялы? параметрлерді? (p,V,T) арасында?ы байланысты сипаттайтын математикалы? ?рнек-идеал газ к?йіні? те?деуін беру ж?не изопроцестердегі газ за?дарын Менделеев-Клапейрон те?деуі ар?ылы шы?арып алу
*Дамытушылы?: О?ушылар?а ?ылыми ба?дар беріп, білімге ?ылым?а ?мтылдыру, молекулалы? физика саласы туралы білімдерін тияна?тау, ойлау ?абілеттерін, ?ызы?ушылы?ын арттыру.
*Т?рбиелік: О?ушыларды отан с?йгіштікке, азаматты? ?асиеттерін ?алыптастыру?а баулу, о?ушыларды шы?армашылы??а ?йрету.
1-топ – қысым
2-топ – кинетикалық энергия
3-топ – жылдамдық
4-топ – масса

Сабақтың тақырыбы
Менделеев-Клапейрон теңдеуі

Сабақтың мақсаты:
- Білімділік:Макроскопиялық параметрлердің (p,V,T) арасындағы байланысты сипаттайтын математикалық өрнек-идеал газ күйінің теңдеуін беру және изопроцестердегі газ заңдарын Менделеев-Клапейрон теңдеуі арқылы шығарып алу
- Дамытушылық:Оқушыларға ғылыми бағдар беріп, білімге ғылымға ұмтылдыру, молекулалық физика саласы туралы білімдерін тиянақтау, ойлау қабілеттерін, қызығушылығын арттыру.
Менделеев Дмитрий Иванович
- Атақты рессей химигі, энциклопедист, қоғам қайраткері, Петербургтегі ғылым Академиясының корреспондент-мүшесі.
- Дмитрий Ивановичтің ғылыми жұмыстары жалпы химия, физика, химиялық технология, ауыл шаруашылығы, метеорология, география, метрология салаларына жатады.
- 1874 жылы идеал газ күйінің теңдеуін шығарды
Бенуа Поль Эмиль Клапейрон 1799 – 1864 жж
Бұл теңдеу кез-келген химиялық құрамы бар идеал газ теңдеулері үшін орындалады. Газ құрамын анықтайтын бір ғана шама, ол мольдік масса.
Күй теңдеуі арқылы, идеал газдың сығылу және ұлғаю, қыздыру және суыту процестерін түсіндіруге болады.

Изопроцестер
Роберт Бойль
Изотермиялық процесс
Бойля-Мариотта заңы
Тұрақты температурада берілген газ массасы үшін қысым мен көлемнің көбейтіндісі тұрақты болады.
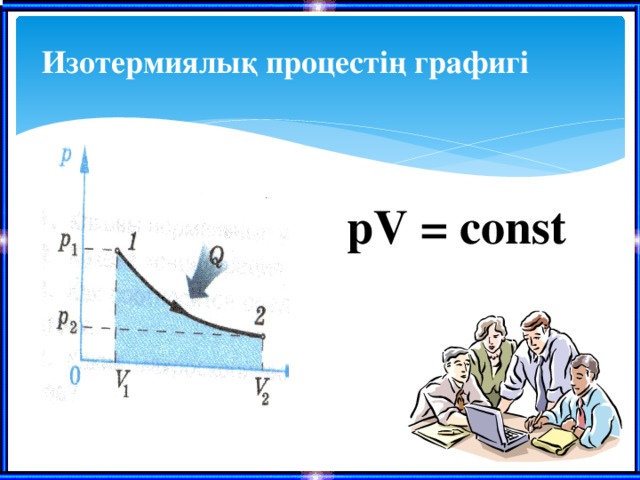
Изотермиялық процестің графигі

Жозеф Луи Гей-Люссак
Изобаралық процесс
Гей-Люссак заңы
Тұрақты қысымдағы берілген газ массасы үшін газ көлемнің оның термодинамикалық температураға қатынасы тұрақты болады.
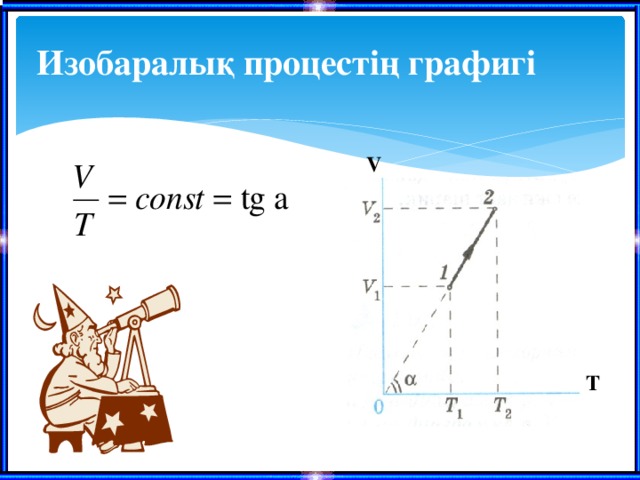
Изобаралық процестің графигі

Жан Александр Сезар Шарль 1746 – 1823 гг.
Изохоралық процесс
Шарль заңы
Тұрақты көлемдегі берілген газ массасы үшін газ қысымының оның термодинамикалық температураға қатынасы тұрақты болады.

Саба? та?ырыбы: § 4.5. Идеал газ. МКТ негізгі те?деулері.
Саба? ма?саты:
- О?ушылар?а идеал газ, МКТ негізгі те?деуі, энергетикалы? температура, Больцман т?ра?тысыны? физикалы? ма?ынасы, молекулаларды? хаосты ?оз?алысыны? орташа кинеткиалы? энергиясыны? ж?йе температурасымен байланысы туралы т?сінік беру.
- О?ушыларды ?з бетімен ?ылыми ой ?орытындыларын жасай білуге да?дыландыру.
- ?ылыми д?ниетанымын ?алыптастыру, жауапкершілікке, е?бек?орлы??а т?рбиелеу.
Саба? т?рі: аралас
Саба? ?дісі: баяндау, с?ра?-жауап.
??рал-жабды?тар: компьютер, видеопроектор, видеомагнитафон.
Саба? барысы:
І. ?йымдастыру кезе?і.
ІІ. О?ушыларды? ?й тапсырмасын ?алай ме?гергендерін тексеру.
- Макроскопты? дене дегеніміз не?
- Макроскопты? параметрлер дегеніміз не?
- Температураны? физикалы? ма?ынасы ?андай?
- ?андай к?й жылулы? тепе-те?дік деп аталады?
- ?андай дене термометрлік дене деп аталады?
- ?здері?е белгілі термометрлік шкалаларды ата?дар.
- ?андай термометрлерді білесі?дер?
- Температураны? абсолют нолі дегеніміз не?
ІІІ. Жа?а саба?.
Идеал газ дегеніміз – молекулалары шексіз аз к?лем алатын серпімді шариктер болып табылатын ж?не ?зара ?рекеттесуі тек оларды? бір-бірімен тікелей немесе ыдысты? ?абыр?асымен со?ты?ысуы кезінде ?ана білінетін газ болып табылады.
Макроденені? к?йі мен онда?ы микроб?лшектерді? ?асиеттеріні? арасында?ы газды? ?зі т?р?ан ыдысты? ?абыр?аларына т?сіретін орташа ?ысымын есептеу ар?ылы та?айында?ан тиімді.
МКТ негізгі те?деуі
Б?л те?деу:
- Макро ж?не микрод?ниелерді байланыстырып т?рады.
- Т?жірибе ар?ылы алын?ан барлы? газ за?дарын теориялы? жолмен алу?а м?мкіндік береді.
- Микро?лемде ?тіп жат?ан процестер жайлы а?парат береді.
Негізіг те?деуді былай да жазу?а болады:
Осыдан газ ?ысымыны? бірлік к?лемдегі молекулаларды? ілгерілмелі ?оз?алысыны? орташа кинетикалы? энергиясына, я?ни кинетикалы? энгергияны? ты?ызды?ына пропорционал екені шы?ады.
МКТ негізгі те?деуіні? та?ы бір т?рін алу ?шін ж?ргізілген т?жірибе.
–Больцман т?ра?тысы.
Больцман т?ра?тысы энергетикалы? температураны Кельвинмен ?лшенетін абсолют температурамен байланыстырады.
Газ молекулаларыны? хаосты ?оз?алысыны? орташа кинетикалы? энергиясы абсолют температура?а пропорционал.
Бірдей температура мен ?ысым кезінде газды? те? к?лемдеріндегі молекулалар саны бірдей .

Менделеев-Клапейрон теңдеуі молекулалары бір-бірімен әсерлеспейтін және нүкте деп қарастырылатын идеал газдардың күйін анықтайды. Нақты газдардың молекуларының өлшемдері болады және олар бір-бірімен өзара әсерлеседі.
Содержимое разработки
С.Ж. АСФЕНДИЯРОВ АТЫНДАҒЫ
ҚАЗАҚ ҰЛТТЫҚ МЕДИЦИНА УНИВЕРСИТЕТІ

КАЗАХСКИЙ НАЦИОНАЛЬНЫЙ МЕДИЦИНСКИЙ
УНИВЕРСИТЕТ ИМЕНИ С.Д.АСФЕНДИЯРОВА
ASFENDIYAROV KAZAKH NATIONAL
MEDICAL UNIVERSITY
Тақырыбы: Нақты газдар
Нақты газдар
Менделеев-Клапейрон теңдеуі молекулалары бір-бірімен әсерлеспейтін және нүкте деп қарастырылатын идеал газдардың күйін анықтайды. Нақты газдардың молекуларының өлшемдері болады және олар бір-бірімен өзара әсерлеседі. Нақты газдардың күйін анықтайтын теңдеуді алу үшін голланд ғалымы Ван-дер-Ваальс Менделеев-Клапейрон теңдеуіне молекулаларды өлшемдерін және өзара әсерлесуін ескеретін түзету енгізді. Бұл алынған теңдеу нақты газдардың күй теңдеуі немесе Ван-дер-Ваальс теңдеуі деп аталады. Мөлшері 1 моль нақты газ үшін Ван-дер-Ваальс теңдеуі келесі түрде жазылады:

,
мұндағы:-Ван-дер-Ваальс тұрақтылары, өлшем бірліктері , .
Бірінші жақша ішіндегі түзетуі молекулалардың арасындағы тартылыс күшінің әсерінен пайда болады. Оны кейде ішкі қысым деп атайды. түзетуі молекулалардың өлшемдерін ескереді. Кез-келген мөлшердегі нақты газ үшін Ван-дер-Ваальс теңдеуі екенін ескере отырып келесі түрде жазылады:
немесе .
Нақты газдардың ішкі энергиясы өрнегімен анықталады, мұндағы - молекулалардың қосынды кинетикалық энергиясы, -молекулалардың қосынды өзара әсерлесу энергиясы. энергиясын анықтайық. Ол үшін молекулалардың арасындағы тартылу күшінің жұмысы энергиясының кемуіне тең екенін ескереміз, яғни . Молекулалардың арасындағы тартылу күші ішкі қысыммен сипатталады. Сондықтан және .

Молекулалардың қосынды кинетикалық энергиясы олардың қозғалысына тәуелді болады.
Сондықтан Ван-дер-Ваальс газының 1 молінің ішкі энергиясы

,

мұндағы: .
Читайте также:

