Хронопатология обмена железа в формировании анемического синдрома реферат
Обновлено: 30.06.2024
Благодаря биоритмам обеспечивается внутреннее движение, развитие организма, его устойчивость к воздействию факторов окружающей среды. Это осуществляется за счет ритмичного чередования процессов анаболизма и катаболизма. Борьба противоположностей, обуславливающая движение (развитие), лежит в основе адаптационных процессов, обеспечивающих синхронизацию физиологических функций организма с разнообразными изменениями окружающей среды. Исследование биоритмов позволяет оценивать реактивность, функциональное состояние и адаптационные возможности организма.
Биоритмы характеризуются широким диапазоном периодов — от миллисекунды до нескольких лет. В связи с этим различают низко-, средне- и высокочастотные биоритмы. К низкочастотным относятся биоритмы с периодами больше 3 суток: циркасептанные (7±3 сут.), циркадисептанные (14±3 сут.), циркавигинтанные (21±3 сут.), циркатригинтанные (30±5 сут.), цирканнуальные (1 год±2 месяца). В эту группу можно включить макроритмы, обусловленные циклами солнечной активности с периодами 2 года, 3 года, 5 лет, 8 лет, 11 лет, 22 года, 35 лет. Среднечастотные ритмы — это ритмы от 0,5 часов до 3 суток. Они делятся на ультрадианные (от 0,5ч. до 20 ч.), циркадиан-ные (от 24 ч. до 28 ч.), инфрадианные (от 28 ч. до 3 суток). К высокочастотным относятся биоритмы с периодами меньше 0,5 ч. (ЧСС, ЭКГ, ЭЭГ и т. д.).
Ведущее место среди биоритмов занимают циркадианные (лат. circa — около, dies — день) — суточный ритм с периодом около 24 ч.
Актуальность проблемы
Дефицит железа - одна из актуальных проблем современной медицины. Занимая первое место среди основных заболеваний, железодефицитная анемия и другие анемические синдромы охватывают 30% населения планеты. В таких группах риска как беременные и кормящие женщины, дети раннего возраста и подростки частота распространения железодефицитной анемии достигает 80%. За последние 10 лет в среднем по России заболеваемость с дефицитом железа и его латентными формами среди беременных женщин возросла в 7,3 раза и составила 39,7%, в некоторых областях - в 7,7 раза (39,4%).
Осложняя течение гестационного периода и родов, железодефицитная анемия - часто в сочетании с гестозами (40%) - занимает ведущее место среди факторов риска перинатальной, неонатальной и младенческой смертности. У беременных с анемическим синдромом каждый третий ребенок рождается в асфиксии и с дефицитом массы тела, а каждый второй - с явлениями внутриутробного инфицирования.
При дефиците железа, еще до возникновения анемии, развиваются клинические проявления тканевого гипосидероза. Замедление умственного и психомоторного развития — типичное проявления сидеропении в раннем детском возрасте. Несмотря на лечение и коррекцию железодефицитных состояний, эти нарушения сохраняются довольно долго: в пятилетнем возрасте дети по-прежнему имеют низкие показатели умственного и психомоторного развития.
Необходимость хронобиологического подхода к разработке проблемы мотивирована не только отсутствием данных о временной организации метаболизма железа и функции фагоцитов, но и важностью выяснения механизмов нарушения обмена микроэлемента у взрослых и детей.
Исследования и результаты
Известно, что наибольшей чувствительностью к действию экзо- и эндогенных факторов обладает циркадианная организация функциональной системы. Исследование пространственно-временной организации (ПВО) функциональных систем в норме и патологии - наиболее современное направление, открывающее перспективы для разработки критериев донозологической диагностики различных патологических состояний.
Доказательства циркадианной организации эритропоэза и обмена железа и обнаружение инверсии ритма сидеремии при анемических состояниях позволили обосновать информативность биоритмологических критериев ранней диагностики нарушения обмена железа.
В настоящее время работами ряда учёных доказано, что многие процессы обмена веществ имеют чётко выраженные суточные (циркадные) колебания, которые можно выявить по изменению в суточном цикле ряда ингредиентов, содержащихся в крови. Так, например, содержание белка в сыворотке крови может колебаться с максимумом в 20 часов и значительным снижением к 2-м часам ночи. В сыворотке крови здоровых людей значительно повышается днём содержание общего холестерина с последующим снижением в ночные и ранние утренние часы.
Непостоянно в течение суток и содержание неорганических компонентов, в частности, уровень натрия у человека велик в 16 часов и значительно снижается к 4-м часам ночи. Сведения о суточном ритме обмена железа в организме человека и, как отражении этого ритма, суточном изменении (динамике) содержания железа в сыворотке крови, в литературе практически отсутствуют или очень краткие.
Вместе с тем, сывороточное железо – это важный клинический показатель, низкий уровень которого (ниже 8,1 ммоль/л) свидетельствует о снижении запасов этого микроэлемента в организме и недостаточности процессов кроветворения.
Актуальность проблемы
Дефицит железа - одна из актуальных проблем современной медицины. Занимая первое место среди основных заболеваний, железодефицитная анемия идругие анемические синдромы охватывают 30% населения планеты. В таких группах риска как беременные и кормящие женщины, дети раннего возраста и подростки частота распространения железодефицитной анемии достигает 80%. За последние 10 лет в среднем по России заболеваемость с дефицитом железа и его латентными формами среди беременных женщин возросла в 7,3 раза и составила 39,7%, в некоторых областях -в 7,7 раза (39,4%).
Осложняя течение гестационного периода и родов, железодефицитная анемия - часто в сочетании с гестозами (40%) - занимает ведущее место среди факторов риска перинатальной, неонатальной и младенческой смертности. У беременных с анемическим синдромом каждый третий ребенок рождается в асфиксии и с дефицитом массы тела, а каждый второй - с явлениями внутриутробного инфицирования.
Придефиците железа, еще до возникновения анемии, развиваются клинические проявления тканевого гипосидероза. Замедление умственного и психомоторного развития — типичное проявления сидеропении в раннем детском возрасте. Несмотря на лечение и коррекцию железодефицитных состояний, эти нарушения сохраняются довольно долго: в пятилетнем возрасте дети по-прежнему имеют.
Чтобы читать весь документ, зарегистрируйся.
Связанные рефераты
Хронопатология обмена железа в формировании анем
. работа студента на тему: «Хронопатология обмена железа в.
обмен железа
. университет Министерства здравоохранения и социального развития России «Кафедра.
Обмен железа у детей
Обмен и функции железа в организме человека
. Железо (Fe) В организм человека железо поступает с пищей. Пищевые продукты.
Как предупредить развитие синдрома диабетической
. Как предотвратить развитие синдрома диабетической стопы? Правила.

2. Воробьев А.И. Городецкий В.М., Шулутко Е.М., Васильев С.А. Острая массивная кровопотеря. – М.: ГЭОТАР-МЕД, 2001. – 175 с.
6. Наглядная гематология / Перевод с англ. Под редакцией проф. В.И. Ершова. – 2-е изд. – М.: ГЭОТАР-Медиа, 2008. – 116 с.: ил.
8. Папаян А.В., Жукова Л.Ю. Анемии у детей: руководство для врачей. – СПб.: ПИТЕР. – 2001 год – 384 с.
9. Патофизиология: учебник: в 2 т./под ред. В.В. Новицкого, Е.Д. Гольдберга, О.И. Уразовой. – 4-е изд. – ГЭОТАР-Медиа, 2010. – Т.2. – 848 с.: ил.
11. Патофизиология: курс лекций/ [Порядин Г. В. и др.]; под ред. Г. В. Порядина. – М. : ГЭОТАР-Медиа, 2012. – 592 с.
14. Садчиков Д.В., Хоженко А.О., Черная А.В. Количественные и качественные изменения клеточных элементов системы крови при тяжелой постгеморрагической анемии (обзор). – Саратовский научнор-медицинский журнал, 2011. – Т.4. – №4. – С.809-813.
15. Третьякова О.С. Постгеморрагические анемии в педиатрической практике. – Здоровье Украины. – 2012. – №8. – С.37-44.
Анемии – состояния, характеризующиеся уменьшением содержания гемоглобина в общем объеме крови, а также как правило, и в единице объема крови.
Анемии следует отличать от гидремии, при которой абсолютное содержание гемоглобина в общем объеме крови не изменяется.
В большинстве случаев патологии анемии характеризуются и эритропенией, в связи с чем анемия может проявляться одновременным уменьшением содержания в единице объема крови и гемоглобина, и эритр оцитов.
Анемии в ряде случаев могут быть отнесены к самостоятельным нозологическим формам патологии, в других – являются лишь симптомом какого-то заболевания.
Касаясь механизмов развития и происхождения анемий, следует отметить, что они могут носить наследственный, врожденный характер, однако в большинстве случаев анемии являются вторичными, или приобретенными.
В зависимости от патогенеза выделяют три основные группы анемий:
1. Постгеморрагические (острые и хронические).
2. Гемолитические (врожденные и приобретенные).
3. Дизэритропоэтические, обусловленные нарушением костномозгового кроветворения.
В процессе установления патогенеза и проведения дифференциальной диагностики анемий используют нередко следующие показатели состояния периферической крови:
– размер и форму эритроцитов;
– наличие регенераторных форм.
В связи с этим принято различать следующие виды анемий:
1. Нормохромные (цветовой показатель 0,85-1,05).
2. Гиперхромные (цветовой показатель больше 1,05).
3. Гипохромные (цветовой показатель меньше 0,85).
Следует отметить, что в ряде случаев цветовой показатель дает возможность дать ориентировочную оценку происхождения анемии. Так, к числу гиперхромных анемий относятся В12-дефицитные, фолиеводефицитные анемии. Ж елезодефицитные анемии, в частности постгеморрагические,- гипохромные. В то же время метапластические, гемолитические анемии могут носить нормохромный характер.
В зависимости от регенераторной активности костного мозга выделяют следующие виды анемий:
4. Арегенераторные (гипо-, апластические анемии).
Для гиперрегенераторных анемий характерно наличие ретакулоцитарных кризов, когда содержание ретикулоцитов в периферической крови может достигать нескольких процентов. При этом отмечается поя вление в периферической крови эритрокариоцитов. К категории гиперрегенераторных анемий относят некоторые формы гемолитических анемий, к числу гипорегенераторных – В12-дефицитные, фолиеводефицитные, железодефицитные анемии.
При гипо- и арегенераторных фор мах анемий количество ретикулоцитов может быть сниженным или вообще не определяться в крови, одновременно возра стает уровень дегенеративных форм эритроцитов.
В зависимости от размеров эритроцитов выделяют следующие формы анемий:
1. Нормоцитарные (7,2-8,3мкм).
2. Микроцитарные (меньше 7,2 мкм).
3. Макроцитарные (9-12 мкм).
4. Мегалоцитарные (12-15 мкм).
Макроцитоз, мегалоцитоз отмечаются при В 12-, фолиеводефицитных анемиях; микроцитоз – при врожденных гемолитических анемиях; нормоцитарные анемии могут быть различного происхождения.
В зависимости от характера кроветворения анемии делят на две группы:
1. С нормобластическим типом кроветворения, для которого характерна последовательность дифференцировки элементов эритроцитарного ряда, включающая следующие этапы: эритробласт – пронормоцит – базофильный нормоцит – полихроматофильный нормоцит – оксифильный нормоцит, ретикулоцит – эритроцит;
2. С мегалобластическим типом кроветворения, включающ им следующие этапы дифференцировки: промегалобласт – базофильный мегалобласт – полихроматофильный мегалобласт – оксифильный мегалобласт – мегалоцит.
Использование приведенных выше классификаций анемий в клинической практике, безусловно, облегчит правильную постановку диагноза, а также даст возможность объективной оценки тяжести течения заболевания и его прогноза.
Постгеморрагические анемии. Различают острую и хроническую постгеморрагическую анемию.
Причины кровопотерь весьма разнообразны: травмы, оперативные вмешательства, поражение сосудистой стенки при язвенной болезни, опухолевом и туберкулезном процессе, мет ро- и меноррагии, спонтанные кровотече ния или слегка индуцированные при врожденно й или приобретенной недостаточности коагуляционного, тромбоцитарного звеньев системы гемостаза и т.д.
У но ворожденных причинами кровопотерь могут быть родовая травма ., трансплацентарная кровопотеря, кровотечение из сосудов пуповины , наследственные геморрагическ ие диатезы, коагулопатии, тромбоцитопении. У девочек возможны ювенильные кровотечения. Чем младше ребенок, тем чувствительнее он к кровопотере.
Реакция взрослого человека на кровопотерю определяется двумя основными факторами: объемом и скоростью кровопотери.
Одномоментная кровопотеря у взрослого человека в объеме 10-15 % всей массы крови не вызывает обычно развит ия шокового синдрома и соответственно тяжелых нарушен ий гемодинамикн. Меж ду тем быстрая пот еря крови новорожденным в таком же объеме может привести к развитию шока.
Для оценки степени кровопотери рекомендуют использовать следующую формулу:
где П – кровопотеря, в %; К – ко эффициент, равный 27 при желудочно-кишечной кровопотере; 33 – при полостных кровотечениях; 24 – при ранениях конечностей; 22 – при пораже нии грудной кл етк и; ШИ – шоковый индекс, равный отношению частоты пульса к систолическому давлению.
Касаясь значимости объема кровопотери, необходимо отметить, что выход из сос у дис то го русла до 20-25 % объема ц иркулирующей крови мало опасен и хорошо компенсируется за сч ет включен ия экстр енных механ измов адаптации, при чем в случае потери до 500 мл крови, что составляет в среднем 10 % ОЦК, клиническ ие проявления могут отсутствовать, иногда возникает умерен ная тахикардия.
При кровопотере объемом от 500 до 1200 мл (10-20 % ОЦК) возникает прогрессирующая тах икардия, снижа ется артериальное давление, появляются пр изнаки вазоконстрикции.
Потеря 25-35 % ц иркулирующей кров и (1200-1800 мл) сопровождается выраженными расстро йствами центральной, органно-тканевой и микрогемоциркуляцин. При этом отмечаются выраженная тахикардия (пульс с выше 120/мин), нарастающая гипотензия, потливость, бледность кожных покровов, беспокойство, слабость, олигурия.
При потере более 40 % объема циркулирующей крови возникает выраженная гипотензия, артериальное давление падает ниже 70 мм рт. ст., прогрессирующая тахикардия (пульс свыше 150/мин), бледность кожных покровов, холодный пот, беспокойство, слабость, олигурия.
Быстрая потеря 50 % крови от общего объема является, как правило, летальной. Потеря такого же объема крови в течение нескольких дней при маточном, желудочном, кишечном кровотечении, как правило, компенсируется при хорошей корригирующей терапии.
Следует отметить высокую чувствительность детского организма к потере крови. Уменьшение объема циркулирующей крови у ребенка на 15-20 % может привести к развитию шока с потерей сознания. У взрослого же человека уменьшение объема циркулирующей крови на 25 % может протека ть в ряде случаев без выраженной гипотензии.
В развитии постгеморрагической анемии следует выделить три стадии: начальную, компенсаторную и терминальную. Причем, характер изменений со стороны периферической крови при постгеморрагической анемии определяется не только тяжестью кровопотери, но и стадией развития постгеморрагической анемии.
Начальная стадия характеризуется уменьшением объема цир кулирующей крови – гиповолемией, при этом в единице объема крови не возникает существенных изменений содержания гемоглобина, количества эри троцитов. Однако снижение объема циркулирующей крови сопровождается уменьшением венозного возврата в сердце, снижением ударного и минутного объема крови, что приводит к развитию циркуляторной гипоксии. Таким образом, гемическая гипоксия при кровопотере всегда сочетается и с циркуляторной.
Возникновение гипоксии, гиповолемии, метаболического ацидоза инициирует ра звитие механизмов срочной адаптации. Одним из мобильных звеньев адаптации является активация симпатоадреналовой системы, что приводит к развитию комплекса защитно-приспособительных реакций. Во-первых, возникает рефлекторный спазм периферических сосудов, или рефлекторно-сосудистая компенсация постгеморрагической анемии, направленная на адаптацию емкости сосудистого русла к объему циркулирующей крови и предотвращение развития шокового синдрома. Однако даже при максимальном спазме сосудов емкость сосудистого русла может уменьшиться лишь на 15-20 % . Активация симпатоадреналовой системы в этот период анемии приводит к рефлекторному учащению сердечных сокращений.
Изучение гематологических показателей в период рефлекторно-сосудистой компенсации может выявить лишь незначительное снижение уровня гемоглобина и эритроцитов, отсутствие выраженных изменений гематокрита.
В условиях гипоксии, гиповолемии активируется ренин-ангиотензиновая система, усиливается освобождение минералокортикоидов, что приводит к усилению реабсорбции натрия в почечных канальцах, повышению осмотического давления в плазме крови, стимуляции выброса антидиуретического гормона и усилению факультативной реабсорбции воды в дистальных почечных канальцах. Жидкость поступает в кровеносные капилляры по градиенту осмотического давления. Развив ается так называемая гидремическая компенсация спустя 1-3 суток после кровопотери. для этого периода характерно уменьшение количества эритроцитов и гемоглобина в единице объема крови и во всем объеме крови. Анемия носит нормохромный характер.
Возникновение гипоксии при постгеморрагической анемии стимулирует продукцию эритропоэтина. по физико-химическим свойствам эритропоэтин представляет собой кислый термостабильный гликопротеин. Мономерная форма белка эритропоэтина имеет ММ от 23000 Д до 32000 Д. Однако в натуральном виде гормон представляет собой димер с ММ от 46000 Д до 60000 Д; содержание белка в нем составляет около 65,5 °/о ; углеводов – около 30 %. Считают, что эритропоэтин образуется в различных клетках нефрона, а также в печени и селезенке.
Существует точка зрения, что эритропоэтин почечного происхождения неактивен, его именуют эритрогенином. В процессе взаимодействия почечного эритрогенина со специализированными белками плазмы крови α2-глобулиновой фракции, вырабатываемыми в печени, образуется активная форма эритропоэтина.
Под влиянием эритропоэтина эритропоэтинчувствительные клетки дифференцируются в эритробласты и далее – до зрелых эритроцитов, которые выходят в сосудистое русло и компенсируют утраченные при кровопотере клетки. Возникает период костномозговой компенсации, выраженный обычно уже спустя 45 дней после кровопотери. При этом в периферической крови появляются молодые, не донас ыщенн ые гемоглоб ином формы эритроцитов – ретикулоциты, оксифильные, полихроматофильные, базофильные нормоциты, т. е. клетки, характеризующие регенераторную активность костного мозга. Анемия приобретает гипохромный характер. Одновременно в периферическую кровь из костного мозга поступают и другие клеточные элементы. Признаком достаточно выраженной регенераторной способности костного мозга является возникновение нейтрофильного лейкоцитоза со сдвигом влево.
Стимуляторами костномозговой компенсации после кровопотери являются и такие гормоны адаптации, как катехоламины, глюкокортикоиды. Однако их стимулирующий эффект на кроветворение опосредуется, по-видимому, за счет первичной активации синтеза под влиянием этих гормонов эритропоэтина.
Параллельно с костномозговой компенсацией развертывается белковая компенсация за счет активации синтеза в печени различных плазменных белков, в частности, плазменных белковых факторов свертывания крови. Следует отметить, что активация протеосинтеза наблюдается уже через несколько часов после кровотечения и регистрируется в течение последующих 1,5-3 недель и более в зависимости от объема кровопотери и состояния реактивности организма.
Вышеописанная стадийность развития свойственна острым постгеморрагическим анемиям. Все постгеморрагические анемии – острые и хронические – являются железодефицитными, поэтому характеризуются комплексом метаболических и функциональных расстройств, обусловленных недостаточностью железа.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Анемии: причины появления, симптомы, диагностика и способы лечения.
Определение
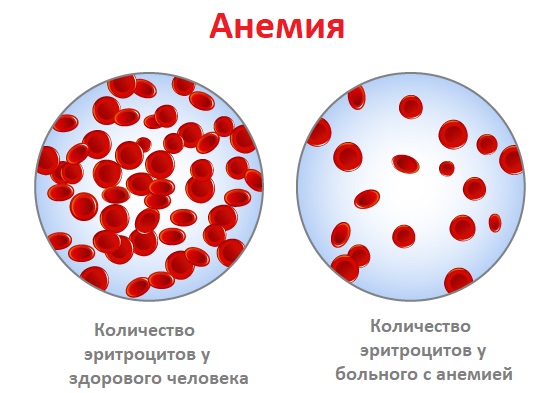
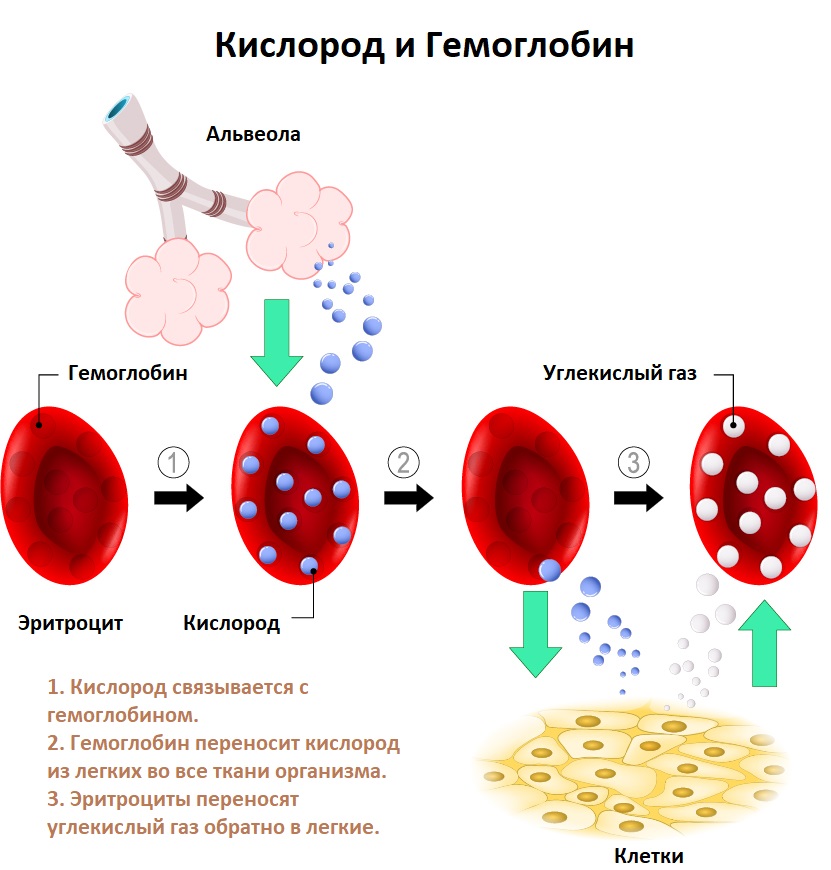
Анемия – это уменьшение содержания гемоглобина и/или снижение количества эритроцитов в единице объема крови, приводящее к снижению снабжения тканей кислородом.
Анемия встречается при ряде заболеваний (язвы и полипы желудочно-кишечного тракта, хроническая болезнь почек, онкологические, инфекционные заболевания, глистные инвазии и др). Чем ниже уровень гемоглобина, тем тяжелее протекает анемия.
Причины появления анемии
Анемия может возникнуть в результате нарушения образования эритроцитов, повышенного их разрушения или потери эритроцитов с кровью.
Статистика утверждает, что самой распространенной является анемия, возникшая после кровопотери (острой или хронической). Острой считается кровопотеря с объемом крови более 500-700 мл (у взрослых), которая происходит в течение короткого промежутка времени. Потеря крови может быть видимой (кровотечение из ран, кровавая рвота, маточное, носовое кровотечения) и первоначально скрытой (кровотечения в кишечник, в полость живота и/или плевры, большие гематомы).
Хронические кровопотери развиваются в результате незначительных, но длительных потерь крови (обильные и длительные менструации, язва желудка, рак, геморрой, проведение процедур гемодиализа и др.). С течением времени незначительные кровопотери приводят к истощению запасов железа в организме, когда количество теряемого организмом железа превышает его поступление с пищей. В результате дефицита железа нарушается синтез гемоглобина.
Дефицит железа может возникнуть из-за снижения всасывания железа в результате различных заболеваний двенадцатиперстной кишки и начальных отделов тонкой кишки (энтеритов, опухолей, состояний после оперативных вмешательств на данном участке кишечника). Состояния, приводящие к снижению уровня белков крови, являющихся переносчиками железа (нефротический синдром, нарушение белково-синтетической функции печени, синдром нарушенного всасывания, алиментарная недостаточность), также могут привести к его снижению и, как следствие, к анемии.
Железодефицитные анемии, связанные с исходно недостаточным уровнем железа (недостаток железа у матери в период беременности), наблюдаются у новорожденных и детей младшего возраста.
Анемии вследствие нарушенного кроветворения возникают:
- при недостаточном поступлении в организм или нарушении всасывания в желудочно-кишечном тракте компонентов, необходимых для образования эритроцитов (витамина В6, витамина В12, фолиевой кислоты и др.);
- поражении клеток костного мозга - предшественников эритроцитов токсическими веществами, ионизирующей радиацией;
- образовании вторичных очагов опухолевых клеток в костном мозге (метастазировании);
- нарушении синтеза небелковой части гемоглобина (гема) и накоплении его токсичных продуктов;
- нарушении регуляции образования эритроцитов (уменьшении продукции гормона, стимулирующего рост и размножение эритроцитов (эритропоэтин) или воздействии ингибиторов).
Развитие наследственных гемолитических анемий связано с генетическими дефектами (нарушением активности ферментов эритроцитов, нарушением структуры или синтеза гемоглобина, дефектами мембран эритроцитов).
Приобретенные гемолитические анемии могут быть обусловлены разрушением эритроцитов в результате воздействия на них антител, механических повреждений оболочки эритроцитов, химических повреждений эритроцитов, недостатка витаминов, разрушения эритроцитов паразитами.
Классификация анемий
1. Анемии, связанные с кровопотерей:
- анемии, связанные с нарушением образования гемоглобина;
- анемии, связанные с нарушением синтеза ДНК и РНК;
- анемии, связанные с нарушением процессов деления эритроцитов;
- анемии, связанные с угнетением пролиферации (размножения) клеток костного мозга.
- наследственные гемолитические анемии;
- приобретенные гемолитические анемии.
Существуют общие (неспецифические) проявления анемии и признаки, которые специфичны для определенного вида анемий.
Отсутствие этих признаков не исключает наличие анемии, поскольку при легкой и среднетяжелой форме заболевания, а также его медленном развитии клиническая картина может быть смазанной.
Клинические проявления недостатка железа в организме: сухость кожи, нарушение целостности эпидермиса, ломкость ногтей, волос, изъязвления и трещины в углах рта, мышечная слабость. Может наблюдаться чувство жжения языка, извращение вкуса в виде неукротимого желания есть мел, зубную пасту, землю, сырую крупу, сырое мясо, а также пристрастие к некоторым запахам (ацетона, бензина).
Дефицит витамина В12 также может проявляться поражением желудочно-кишечного тракта (атрофическим гастритом) и неврологической симптоматикой (парестезиями, нарушением чувствительности, онемением конечностей). При крайне тяжелом течении заболевания наблюдаются психические нарушения, бред, галлюцинации, приобретенное слабоумие и др.
Клиническая картина дефицита фолиевой кислоты очень похожа на дефицит витамина В12, но при фолиеводефицитных состояниях отсутствует неврологическая симптоматика и редко возникает воспаление языка. Дефицит фолиевой кислоты приводит к обострению шизофрении, учащению и утяжелению приступов эпилепсии.
Для гемолитических анемий характерны желтушность кожных покровов и слизистых, увеличение размера селезенки, склонность к образованию камней в желчных путях.
При массивном гемолизе эритроцитов (гемолитическом кризе) кроме анемии, желтухи и ухудшения общего состояния могут наблюдаться тошнота, рвота, расстройство сознания, судороги, развитие острой почечной и/или сердечно-сосудистой недостаточности.
При апластической анемии, которая возникает на фоне угнетения пролиферации клеток костного мозга, происходят кровоизлияния (преимущественно в области бедер, голеней, живота, в местах инъекций образуются гематомы). Часто диагностируются бронхиты, пневмонии.
Диагностика анемии
Анемия может возникать под влиянием самых разнообразных факторов. Чаще всего встречаются дефицитные анемии (железодефицитные, B12-дефицитные, фолиеводефицитные и др.).
Большую роль в выявлении причины анемии играют сведения, полученные при опросе пациента: возраст, наличие профессиональных вредностей, характер диеты, наличие сопутствующих заболеваний, прием лекарственных препаратов, информация о наследственности и др. Не менее важны данные осмотра: изменение цвета и состояния кожи; увеличение лимфатических узлов, печени, селезенки; наличие поражения нервной системы.
Первый этап диагностики анемии обычно включает следующие исследования:
-
клинический анализ крови: определение концентрации гемоглобина, количества эритроцитов, лейкоцитов, величины гематокрита и эритроцитарных индексов (MCV, RDW, MCH, MCHC), лейкоцитарной формулы и СОЭ (с микроскопией мазка крови при наличии патологических сдвигов);
Одно из основных лабораторных исследований для количественной и качественной оценки всех классов форменных элементов крови. Включает цитологическое исследование мазка крови для подсчета процентного содержания разновидностей лейкоцитов и определение скорости оседания эритроцитов.
Читайте также:

