Ферменты модель ключ замок реферат
Обновлено: 04.07.2024
Предложена Эмилем́ Фи́шером в 1890 г. Согласно его модели, субстрат строго соответствует активному центру фермента, как ключ — замку. Субстрат связывается с ферментом с помощью гидрофобных связей, электростатических взаимодействий, водородных связей и др. Даже малое несоответствие пространственной конфигурации химических групп субстрата расположению радикалов аминокислот в активном центре может привести к стерической некомплементарности и к возникновению сил отталкивания.
Б Модель индуцированного соответствия
2.7 Термодинамика ферментативных реакций
Направление химической реакции определяется изменением стандартной свободной энергии (ΔG°) — разностью между энергиями субстратов и продуктов реакции.
Если ΔG отрицательно, то реакция протекает самопроизвольно и сопровождается уменьшением свободной энергии. Такие реакции называют экзергоническими́ . Если при этом абсолютное значение ΔG велико, то реакция идёт практически до конца, и её можно рассматривать как необратимую.
Если ΔG положительно, то реакция будет протекать только при поступлении свободной энергии извне; такие реакции называют эндергоническими́ . Если абсолютное значение ΔG велико, то система устойчива, и реакция в таком случае практически не осуществляется. При ΔG, равном нулю, система находится в равновесии.
Термодинамика ферментативных реакций 47
В биологических системах термодинамически невыгодные (эндергонические) реакции могут протекать лишь за счёт энергии экзергонических реакций. Такие реакции называют энергетически сопряжёнными. Многие из этих реакций происходят при участии аденозинтрифосфата (АТФ), играющего роль сопрягающего фактора.
Для примера рассмотрим реакцию глюкозы и кислорода. Они способны реагировать с образованием углекислого газа и воды:
Глюкоза + O 2 → 6CO 2 + 6H 2 O
Однако глюкоза химически стабильна на воздухе (реакция не идёт), несмотря на то, что эта реакция термодинамически вероятна, иными словами спонтанна , поскольку изменение свободной энергии Гиббса для этой реакции G° = −2880 кДж/моль = 689 ккал/моль. То, что эта реакция термодинамически выгодна, не означает, что она мгновенна. Чтобы произошла эта реакция, необходим
приток энергии извне.
Количество энергии, необходимое для того, чтобы началась реакция, называется энергией активации . Ферменты катализируют реакции, снижая энергию активации G° ‡ (или активационную энергию ) — энергию, необходимую для того, чтобы реакция началась и было достигнуто переходное состояние . Важной особенностью ферментов является их более высокое сродство к соединениям, уже находящимся в переходном состоянии.
Итак, ферменты ускоряют химические реакции, но не меняют константу равновесия реакции, т.е. изменение свободной энергии. Скорость реакции зависит от свободной энергии активации , т.е. энергии, требуемой для того, чтобы началась реакция. Ферменты снижают активационную энергию, делая реакцию более вероятной и, следовательно, чаще протекающей, отсюда и ускорение реакции. Все вышесказанное проиллюстрировано на графиках (см. Рис. 33 ▼ ).
Рис. 33. График изменения свободной энергии реакции (слева) и снижение энергии активации ферментом (справа).
Как биологические катализаторы, ферменты ведут самые разные реакции - от метаболических процессов в нашем организме до реакций, позволяющих вирусам размножать- ся у нас в клетках. Существует две модели ферментных реакций, разработанные за прошлый век. Обе модели пытаются объяснить, почему тот или иной фермент специфичен для реакции, которую он катализирует.
Немецкий биохимик Герман Эмиль Фишер, похоже, имел примечательную слабость к горячим напиткам: его интересовали пурины в чае, кофе и какао. Как-то раз он добавил к смеси сахара и молоко в виде лактозы. Окольными путями это привело его к изучению ферментов. В 1894 году он доказал, что реакции гидролиза, в которых происходит распад лактозы на два составляющих ее сахара, можно катализировать ферментом, и в тот же год опубликовал статью, в которой обрисовал теорию работы фермента.

Ключ-замок
Показать им всем
От Фишера ускользнуло одно наблюдение: у всех ферментов единое происхождение — все они белки, состоящие из аминокислот. А вот Джеймсу Самнеру, еще одному харизматичному химику, это стало очевидно, однако доказательство далось ему нелегко. Самнер был человеком упрямым: несмотря на ампутацию левой руки, случившуюся из-за неудачного инцидента на охоте, еще в юности, он решил, что добьется успехов в спорте, и выиграл кубок Корнеллского преподавательского теннисного клуба. Его упрямство, судя по всему, распространялось и на его исследовательские труды: несколько человек советовали ему перестать глупить и бросить попытки выделить фермент, но он продолжил двигаться к цели — и через девять лет ее достиг.

В 1926 году Самнер стал первым человеком, кристаллизовавшим фермент, — он выделил уреазу из бобов канавалии мечевидной. (Уреаза — фермент, из-за которого в человеческом желудке процветает Helicobacter pylori, а из-за этих бактерий приключается язва. Фермент расщепляет мочевину, pH повышается, и среда делается для этих бактерий приятнее.) Самнеру никто не верил, что уреаза — белок, и он взялся доказать всеобщую неправоту: опубликовал десять статей на заданную тему, просто чтобы все поняли наверняка и бросили спорить. И конечно, Нобелевская премия, врученная Самнеру, его точку зрения поддержала дополнительно.
Лучшее соответствие

Активный центр
Активный центр фермента - участок, удерживающий субстрат, именно здесь происходит реакция между ферментом и субстратом. Этот участок может состоять всего из нескольких аминокислот. Все, что меняет структуру активного центра, влияет и на особенности соединения фермента с субстратом, и вероятность успешного протекания реакции при этом уменьшается. К примеру, повышение или понижение pH среды - это увеличение или уменьшение концентрации ионов водорода, а ионы водорода взаимодействуют с группами в аминокислотах в активном центре и меняют его устройство. Любая молекула, химически связываясь с ферментом так, что активный центр блокируется, называется конкурентным ингибитором, поскольку соперничает с молекулой субстрата.
Молекулы, связывающиеся с ферментом не в активном центре, но все же меняющие при этом его структуру, называются неконкурентными ингибиторами. Генетические изменения тоже могут влиять на действие ферментов, особенно если такие изменения происходят в порядке аминокислот в активном центре. К примеру, болезнь Гоше - это мутация, при которой меняется устройство активного центра фермента глюкоцереброзидазы, в результате чего в организме накапливается избыток субстрата (глюкоцереброзида). Впрочем, заменить порченый фермент можно: по всему миру проходят лечение примерно 10 000 человек, страдающих болезнью Гоше, - им заменяют фермент.
Ферменты в промышленности
Ферменты применяются в самых разнообразных отраслях промышленности. Биоактивные моющие средства содержат ферменты, разрушающие вещества в составе пятен на тканях, и тем сберегают энергию, необходимую для очистки одежды от грязи. Пищевая промышленность применяет ферменты в превращениях одних сахаров в другие. Загвоздка лишь в том, что ферменты - это белки, и их действие ограничено довольно узким диапазоном внешних условий, и потому температуру, давление и кислотность среды приходится жестко контролировать.
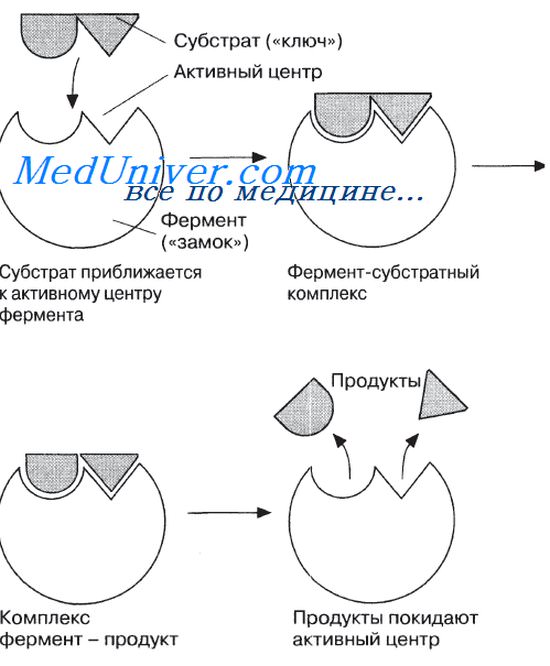
Механизм действия ферментов. Работа ферментов.
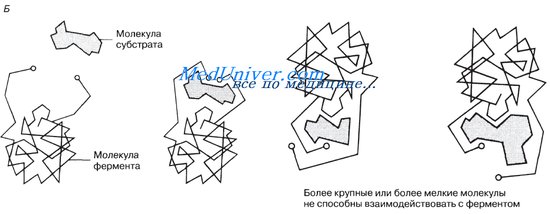
Ферменты обладают очень высокой специфичностью. Фишер (Fischer) в 1890 г. высказал предположение, что эта специфичность обусловливается особой формой молекулы фермента, точно соответствующей форме молекулы субстрата (или субстратов).
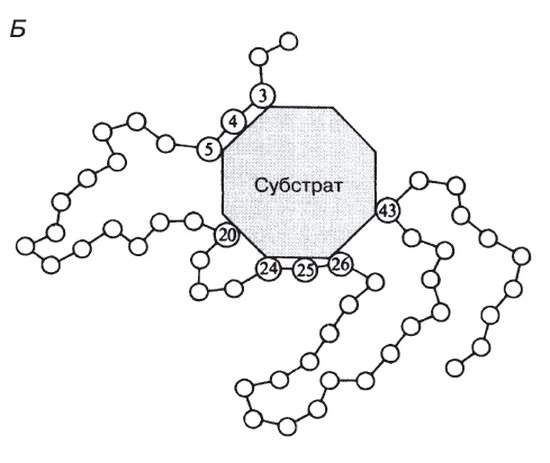
Молекулы большей части ферментов во много раз крупнее, чем молекулы тех субстратов, которые атакует данный фермент. Активный же центр фермента составляет лишь очень небольшую часть его молекулы, обычно от 3 до 12 аминокислотных остатков. Роль остальных аминокислот, составляющих основную массу фермента, заключается в том, чтобы обеспечить его молекуле правильную глобулярную форму, которая, как мы увидим далее, очень важна для наиболее эффективной работы активного центра фермента.
Образовавшиеся продукты по форме уже не соответствуют активному центру фермента. Они отделяются от него (поступают в окружающую среду), после чего освободившийся активный центр может принимать новые молекулы субстрата.
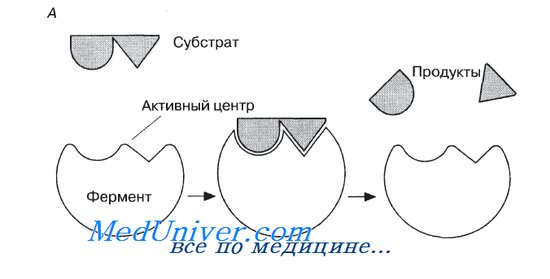
Подходящей аналогией в этом случае может служить перчатка, которая при надевании на руку соответствующим образом изменяет свою форму. По мере выяснения отдельных деталей механизма различных реакций в эту гипотезу вносятся уточнения.
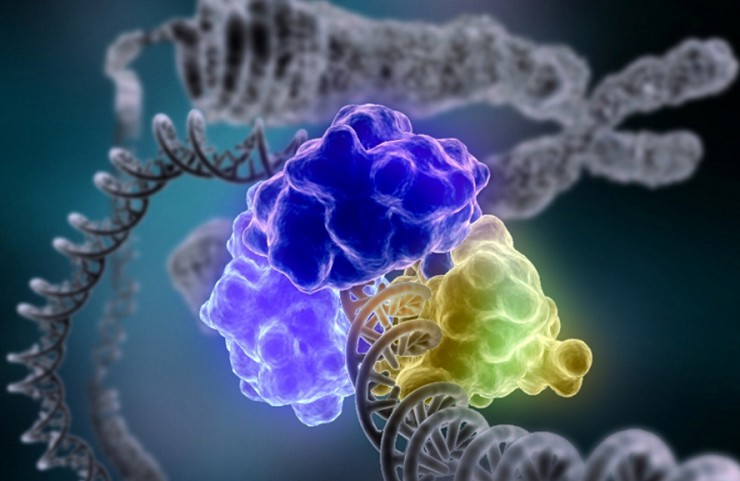
Представление о том, как работает фермент, можно получить с помощью рентгеноструктурного анализа и компьютерного моделирования. Рисунок иллюстрирует это на примере фермента лизоцима.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.


БИОЛОГИЯ ЕГЭ 2021 - 2022 | Онлайн-школа Breeze запись закреплена

ФЕРМЕНТЫ И ГИПОТЕЗА КЛЮЧ - ЗАМОК

ФЕРМЕНТЫ - биологические катализаторы, ускоряющие химические реакции в живых системах.
СВОЙСТВА ФЕРМЕНТОВ:
Ферменты обладают специфичностью.
Каждый фермент действует только на определенное вещество - субстрат. То есть они могут ускорять только одну реакцию или реакции одного типа. Реагенты в такой реакции называются субстратами, а получающиеся вещества — продуктами.
Ферменты активны в определенной среде – каждый фермент свой оптимальный диапазон pH и при определенной температуре.
При повышении температуры скорость реакции, катализируемой данным ферментом, сначала увеличивается, а затем уменьшается, так как с повышением температуры растёт вероятность денатурации белка, поэтому активность фермента снижается.

Любой фермент имеет активный центр – это особый участок в структуре фермента, к которому присоединяется молекула субстрата.

ГИПОТЕЗА ГЛАСИТ: субстрат подходит к ферменту, как ключ подходит к замку. Избирательность действия фермента связана со строением его активного центра.
Фермент ваимодействует с субстратом и образует короткоживущий фермент-субстратный комплекс.
По завершении реакции, фермент-субстратный комплекс распадается на продукты и фермент. Фермент в итоге не изменяется: по окончании реакции он остается таким же, каким был до неё, и может теперь взаимодействовать с новой молекулой субстрата.
Читайте также:

