Фелиноз реферат по инфекционным болезням
Обновлено: 28.06.2024
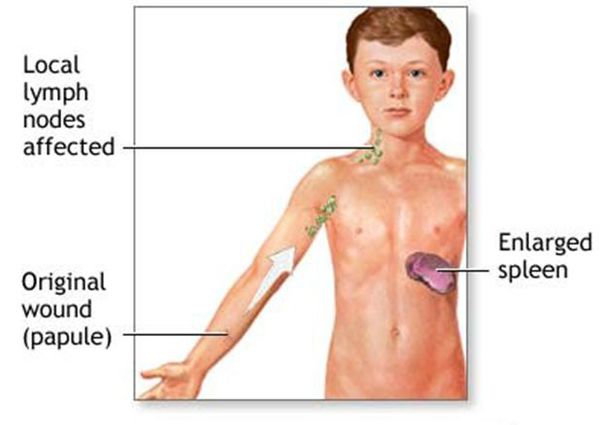
Фелиноз — инфекция из группы бартонеллеза, характеризующаяся лихорадкой, интоксикацией, лимфаденитом, увеличением печени и селезенки, анемией, тенденцией к затяжному течению. Возбудитель — грамотрицательная палочка Bartonella henselae. Источник инфекции — кошка. Инкубационный период — от нескольких дней до месяца. Обычно первым манифестным симптомом является регионарный лимфаденит, который сопровождается повышением температуры, ознобами, интоксикацией.
При осмотре на месте бывшей царапины отчетливо виден первичный аффект в фазе обратного развития — плотная папула, эрозия или уже пигментация. Генерализованная инфекция проявляется длительной изнуряющей лихорадкой — от субфебрилитета до эпизодов повышения температуры до 38° и выше с колебаниями в течение суток, усилением симптомов интоксикации, полиморфной сыпью, стойким лимфаденитом, анемией.
Течение болезни принято считать доброкачественным, однако часто она принимает затяжное течение, с рецидивами в течение 1-2 лет. Ввиду неопределенности клинической картины с преимущественной манифестацией различных синдромов пациент обследуется у хирурга, дерматолога, фтизиатра, гематолога, онколога. Увелигение печени и селезенки приводит больного в отделение гепатитов. Н.И. Михайловская наблюдала семейную вспышку бартонеллеза.
Девочка К. направлена в отделение гепатитов в возрасте 3 года 4 месяца по поводу увеличения печени. Заболела в первых числах января 2000 года — лимфаденит, субфебрилитет с двумя эпизодами стойкого повышения температуры до 38°, снижение аппетита. При поступлении 16.02 общее состояние ребенка средней тяжести. Бледна, кожа с восковидным оттенком, на лице — высыпания типа эритемы. Двусторонний подчелюстной, правосторонний шейный, двусторонний паховый лимфаденит.
Лимфатические узлы болезненные, малоподвижные, разных размеров (до 5 см в диаметре) и степени плотности — создавалось впечатление текущего процесса. На лице, тыльной стороне рук — следы царапин. Печень на 2—2— 1 см выступала из подреберья, плотновата, безболезненна.
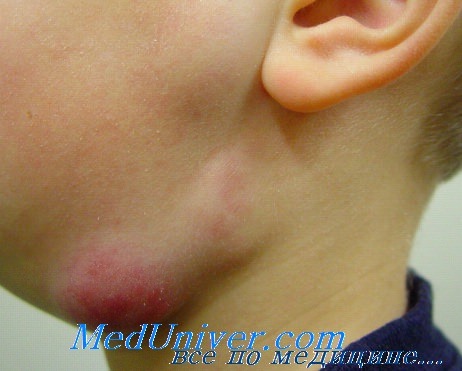
Из анамнеза выяснено, что мама девочки, С., 40 лет, с первых чисел декабря 1999 года обследована терапевтом, фтизиатром, гематологом, онкологом, хирургом по поводу лимфаденита, субфебрилитета с периодическим повышением температуры до 38° в течение 10—12 дней, анемии. Наряду с рутинными исследованиями повторно выполнена диагностическая пункция лимфатических узлов, стернальная пункция.
Старший в семье мальчик Ф., 14 лет, в течение 10 дней находится на стационарном лечении в хирургическом отделении по поводу высокой лихорадки и гнойного локтевого лимфаденита слева. В течение двух месяцев у мальчика периодически повышалась температура, беспокоили боли в подмышечной и локтевой областях слева, головная боль, ознобы. За месяц до заболевания мамы и Димы домой из деревни привезли котенка. Второго котенка подарили соседям, которые остаются здоровыми.
Клинически: желтухи, диспептических явлений у больных не было. Печень увеличена у всех, до 2—3—3 см выступала из подреберья, плотноватой консистенции, чувствительна при пальпации. Умеренное (до 2 норм) повышение активности ACT, диспротенемия. У девочки: билирубин—15,8 мкмоль/л, прямой — 2,6 мкмоль/л, тимоловая проба — 3,1 ед, сулемовая—1,8 мл, АЛТ — 0,2 ммоль/л, ACT — 0,6 ммоль/л, холестерин — 4,1 ммоль/л, сахар — 3,1 ммоль/л, b-липопротеиды — 3,8 г/л, а-амилаза—15 мг, щелочная фосфатаза — 2,9 ммоль. Анализ мочи — без особенностей, диастаза — 32 единицы.
У всех больных были выраженными изменения в клинических анализах крови — анемия, лейкоцитоз, ускорение СОЭ, тромбоцитопения.
У мамы: Эр —3 000 000, НВ —86!! г/л, тромбоциты —160 000, лейкоциты — 5 300, СОЭ —5 мм/час (ранее — лейкоцитоз до 17 000, СОЭ до 32 мм/час). У Димы НВ — 98 г/л, лейкоциты—14 600, СОЭ — 27 мм/час. У Полины: Эр — 3 600 000, НВ— 108 г/л, тромбоциты— 186 000, лейкоциты— 8800, э 3 п 3 с 30 л 62 м, 2 СОЭ — 14 мм/час, ретикулоциты — 5 %. Диагноз фелиноза сомнений у нас не вызывал, однако вся семья дополнительно обследована, исключены вирусные гепатиты, кишечные инфекции, туляремия, иерсиниозы, псевдотуберкулез. Anti-HIV не обнаружены, RW отрицательна.
У всех обнаружены антитела к хламидийному антигену: в титрах 1:80 у мамы и мальчика, 1:160 у девочки. При исследовании сыворотки крови девочки К. Российским Центром по риккетсиозам, в лаборатории экологии риккетсий НИИЭМ им. Н. Ф. Гамалеи от 25.02.2000 года реакция с бартонеллой Квинтана (возбудителем Волынской лихорадки) положительна в титре 1:160 при диагностическом титре 1:40.
В семье К-вых у мамы отмечался левосторонний подчелюстной, правосторонний околоушный и паховый лимфадениты. У сына — левосторонний локтевой и подмышечный лимфадениты. У дочери двусторонний подчелюстной, правосторонний шейный лимфаденит. Все лимфоузлы были увеличены в размерах, неоднородной эхогенности за счет гиперэхогенных участков внутри. У мамы и у дочери визуализировались конгломераты лимфоузлов с плотными капсулами, у сына — гигантских размеров локтевой лимфоузел размерами 4,5/1,5 см, с эхогенными включениями на резко гипоэхогенном фоне. На эхограмме — конгломераты подчелюстных лимфоузлов у ребенка девочки К., 3 лет.
Больные получали цефазолин в/м, диазолин, преднизолон по схеме, панангин, витамины, ферменты, физиотерапевтические процедуры, симптоматические средства, дети — и ИФН (х2|3 в свечах (виферон). У мамы — выздоровление в течение б месяцев. У мальчика на месте послеоперационного шва — склерозирование, затруднение движения в локтевом суставе в течение года.
У девочки — рецидивирующее течение, с эпизодами высокой лихорадки, высыпанием полиморфной сыпи.
Что такое болезнь кошачьих царапин (фелиноз)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Агапова Сергея Анатольевича, дерматолога со стажем в 39 лет.
Над статьей доктора Агапова Сергея Анатольевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
Болезнь кошачьих царапин (лихорадка от кошачьих царапин, фелиноз или регионарный небактериальный лимфаденит) — это острая бактериальная зоонозная инфекция, передающаяся преимущественно от кошек. Она характеризуется региональным лимфаденитом (воспалением лимфоузлов), кожной сыпью и иногда поражением глаз, нервной системы и внутренних органов. [1]
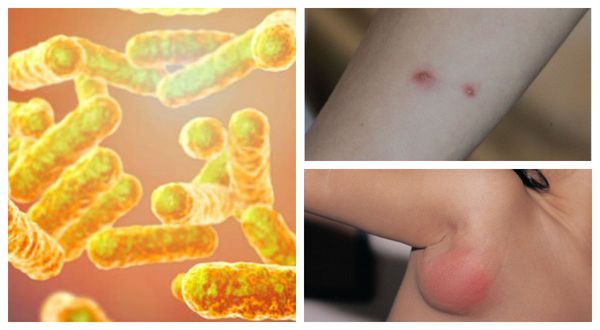
Причиной заболевания является инфицирование бактерией Bartonella henselae (бартонелла хенсели), которая была выделена у людей и млекопитающих и представляет собой мелкую плеоморфную, факультативную, грамотрицательную и внутриклеточную бациллу.
Источники инфекции
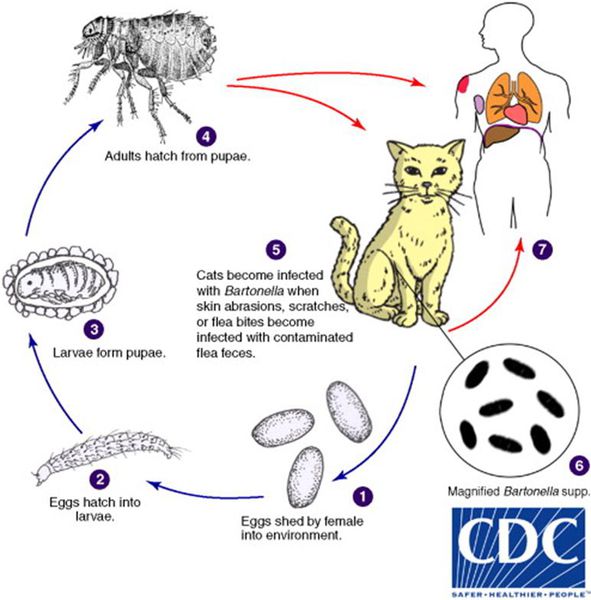
Кошки являются естественным резервуаром и переносчиком B. henselae, при этом сами животные от этого не страдают. В ряде исследований, проведённых в США, у 28% обследованных кошек были обнаружены антитела против причинной бактерии, причём из них 56% котят моложе года и 34% кошек от года и старше обладали иммунитетом к бациле. Также исследование показало, что у бездомных кошек (61%) B. henselae в крови выявлялись гораздо чаще, чем у домашних (21%). [2]
Котята моложе 12 месяцев в 15 раз чаще передают инфекцию, чем взрослые кошки, из-за наличия бактерии B. henselae в крови и большей склонностью к нанесению царапин.
Передача инфекции между кошками происходит при укусах кошачьей блохи Ctenocephalides felis или заглатывании их продуктов жизнедеятельности. Поэтому люди, у которых дома есть хотя бы один котёнок с блохами, имеют в 29 раз больше шансов заразиться бацилой, чем те, у чьих животных в шерсти не было блох. [3]
Собаки также являются источником заражения, но гораздо реже, чем кошки — всего в 5% случаев. [4] Также сообщается о единичных случаях возникновения заболевания при контактах людей с морскими свинками, кроликами и обезьянами. [1]
Помимо прочего, доказана роль в передачи инфекции иксодового клеща Ixodes ricinus (собачий клещ), который часто нападают и на людей. [5] Описан случай семейного заражения бартонеллами при их укусах. [6]
Варианты передачи инфекции человеку при укусах кошачьих блох и от человека к человеку не подтверждены. [2]
Пути передачи инфекции:
- Царапины. 75-90% пациентов с фелинозом незадолго до появления заболевания отмечали поверхностную травму кожи при контакте с кошкой. Дело в том, что блохи, находясь на животном, выделяют экскременты, которые содержат бактерии. Когда кошка царапает свою кожу (например, при почёсывании), её коготь загрязняется отходами жизнедеятельности, и в дальнейшем при нанесении травмы человеку происходит передача инфекции. [1]
- Укусы и ослюнения травмированной кожи — связаны с нахождением бактерий в слюне животных. [1]
Распространенность заболевания в мире и в Российской Федерации не известна. Заболеваемость в США среди амбулаторных пациентов составляет приблизительно 9,3 случая на 100 000 человек в год, причём ежегодно регистрируется до 20 000 новых случаев. [7] Примерно 70-90% случаев заболевания происходят в осенние и ранние зимние месяцы. Предполагается, что сезонность связана с повышением рождаемости котят в середине лета и с увеличением заражённости блохами. [8]
Группы риска
Заболевания чаще встречается у людей моложе 18 лет (от 55 до 80% случаев). Это связывают с тем, что именно дети и подростки чаще всего играют с котятами. [9]
Также стоит отметить, что заболевание чаще встречается у мужчин, чем у женщин, в соотношении 3:2. Одной из гипотез, объясняющих более высокую заболеваемость среди мужчин, является тенденция к более грубой игре с котятами и кошками и, следовательно, повышенному риску укусов и царапин. [1]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы болезни кошачьих царапин
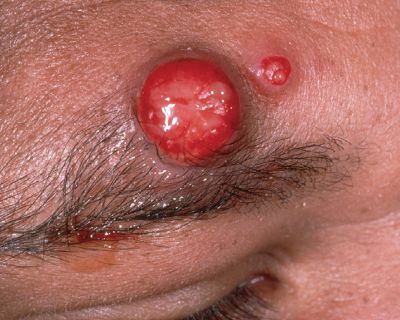
Первичный очаг (инокуляция) — наблюдается в 90% случаев и возникает на месте зажившей царапины. В основном располагается на кистях и предплечьях, реже на лице, туловище и ногах. Вначале отмечается эритематозное пятно, которое существует совсем недолго и трансформируется в плоскую папулу синюшно-красного или телесного цвета с чёткими неровными границами. Размером возникшая папула может быть от нескольких мм до 1-2 см в диаметре. Иногда несколько папул расположены линейно по ходу царапины. В некоторых случаях в основании папулы имеется болезненный инфильтрат до 3-5 см в поперечнике. У отдельных пациентов вместо папул возникают пузыри или пустулы. Примерно в половине случаев в последующем формируется эрозивный или язвенный дефект, заживающий с образованием рубца. [10]
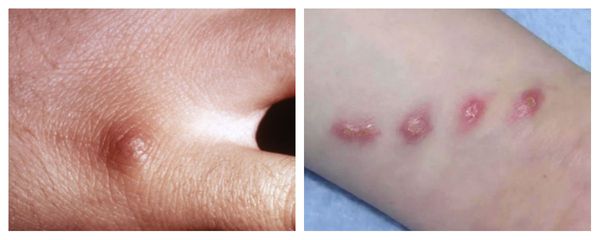
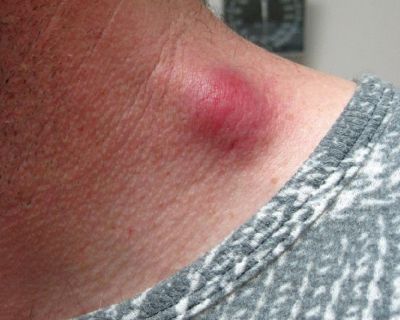
Региональный лимфаденит — основной симптом заболевания. При классической болезни кошачьих царапин регионарная лимфаденопатия возникает через 1-3 недели после появления первичного очага и продолжается до нескольких месяцев. У 85% пациентов поражается одна группа лимфоузлов: чаще всего подмышечные и эпитрохлеарные (46%), в области головы и шеи (26%), а также в паховой области (17,5%). В большинстве случаев воспаляются одиночные лимфоузлы, реже множественные, они могут располагаться как в границах одной анатомической области, так и в нескольких (генерализованная лимфаденопатия — редкое явление).
Поражённый лимфатический узел плотный, подвижный, при пальпации умеренно болезненный, в диаметре может достигать 1-5 см. Кожа над ним гиперемированна. В 10-50% случаев происходит спаивание лимфоузлов с окружающими тканями, их нагноение с образованием густого жёлто-зелёного гноя и последующим вскрытием с образованием язвенного дефекта. [11]
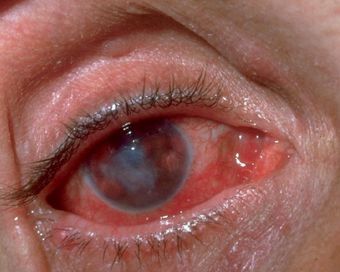
Окулогландулярный синдром Парино — одновременное образование одностороннего гранулематозного конъюнктивита (возникновение гранулём в виде жёлто-белых узелков от 1 до 5 мм) и увеличенного лимфатического узла перед ушной раковиной на той же стороне лица. Встречается в 2-8% случаев и связан с попаданием на конъюнктиву глаза слюны заражённых животных или фекалий блох. Конъюнктивит в течение нескольких недель регрессирует без рубцевания. [12]
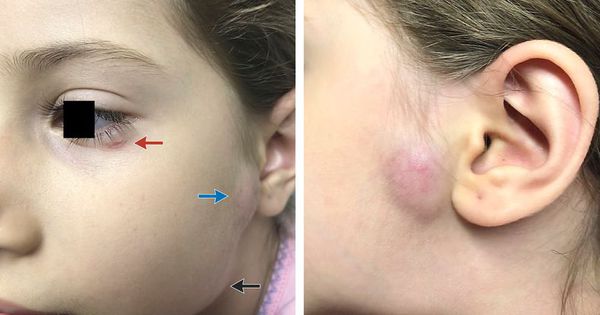
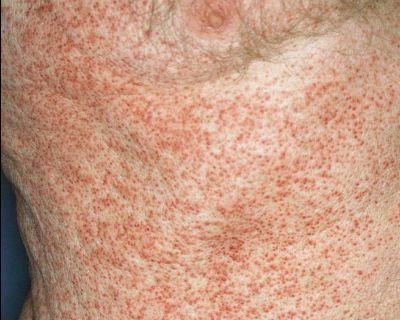
Генерализованная сыпь — скарлатино-, кореподобная или уртикарная сыпь на туловище, реже на конечностях. Наблюдается на фоне общих проявлений. В редких случаях возникает пятнисто-папулёзная сыпь или элементы по типу узловатой эритемы. Высыпания держатся от 2-5 дней до 2-5 недель. [10]
Патогенез болезни кошачьих царапин
При попадании в организм иммунокомпетентных пациентов Bartonella в местах инокуляции (заражения) вызывает гранулематозный и лейкоцитарно-лимфоцитарный ответ. Инфекция распространяется через лимфатические пути, вызывая воспаление в лимфатических узлах. В некоторых случаях происходит проникновение бактерий в кровь с развитием бактериемии и поражения нервной системы и внутренних органов.
Основным вирулентным агентом считается белок наружной мембраны OMP 43 кДа, который способен связывать эндотелиальные клетки.
Как показывают исследования, B. henselae проявляет более низкую биологическую активность по сравнению с классическими грамотрицательными микробами, что объясняет выживание, внутриклеточный рост и размножение бактерий внутри фагоцитарных клеток.
У пациентов с ослабленным иммунитетом (в частности, ВИЧ-инфицированных) ответ организма на заражение может привести к бациллярному ангиоматозу (избыточному разрастанию сосудов). Стимулировать ангио пролиферацию (появление новых кровеносных сосудов) бактерия B. henselae способна благодаря функции белка адгезина А, который может сцеплять поверхности клеток. [13]
Классификация и стадии развития болезни кошачьих царапин
Международная классификация болезней 10 пересмотра кодирует заболевание как A28.1 Лихорадка от кошачьих царапин.
Клиническая классификация предполагает выделение трёх форм болезни: [10] [14]
- классическая форма (кожно-железистая) — поражение кожи и лимфатических узлов;
- атипичные формы:
- глазной вариант (окуло-гландулярная форма) — поражение глаз;
- неврологический вариант (нейро-гландулярная форма) — поражение нервной системы;
- висцеральный вариант — поражение печени, селезёнки, сердца, реже лёгких и кишечника;
- бациллярный ангиоматоз — тяжёлое течение заболевания у лиц с ослабленным иммунитетом.
Стадии развития заболевания:
- инкубационный период — длится от 5 до 60 дней (в среднем — две недели);
- инокуляция — появление первичного очага, который существует на протяжении нескольких недель;
- стадия регионального лимфаденита — наступает через 1-3 недели после появления первичного очага и длится от нескольких недель до нескольких месяцев;
- регрессирование симптомов — может продолжаться около 3-6 месяцев, иногда дольше.
Осложнения болезни кошачьих царапин
Бациллярный ангиоматоз
Наблюдается у людей с ВИЧ-инфекцией, после трансплантации сердца и почек и очень редко — у иммунокомпетентных лиц. Характеризуется длительной лихорадкой, болями в суставах, снижением массы тела и спленомегалией (увеличением селезёнки). На фоне этих проявлений возникает сыпь в виде: множественных распространённых ангиоматозных (сосудистых) и подкожных узлов, папул, похожих на пиогенную гранулёму, и эритематозных инфильтрированных бляшек диаметром от 1 мм до нескольких см. Течение тяжёлое, часто с летальным исходом. [15]
Подострый эндокардит
У части пациентов наблюдается поражение одного или несколько сердечных клапанов, эндокарда на внутренней поверхности стенок сердца или межжелудочковой перегородке, причем культуральное исследование крови не выявляет бактерий. [16] Это осложнение может сопровождаться повышением температуры, сердечной недостаточностью и одышкой.
Офтальмологические осложнения
Поражения глаз отмечаются у 2-6% пациентов и включают:
- нейроретинит — воспаление сетчатки глаза и зрительного нерва;
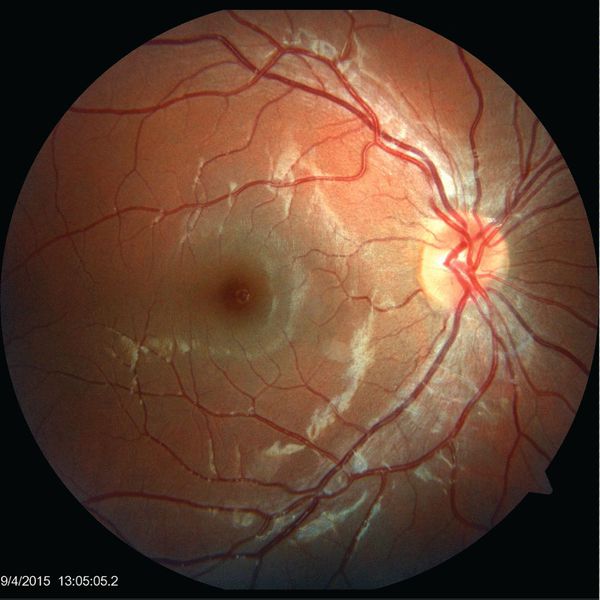
- папиллит — воспаление части зрительного нерва;
- неврит зрительного нерва;
- очаговый или многоочаговый ретинохориоидит — воспаление сосудистой оболочки глаза и сетчатки;
- панувеит — воспаление всех частей сосудистой оболочки галаза;
- окклюзию вен и артерий сетчатки, приводящую к её отслоению. [17]
Неврологические осложнения
Нарушения центральной нервной системы встречаются у 1-2% пациентов и включают атаксию, паралич черепных нервов и деменцию у пожилых людей. У детей обычно возникает энцефалит или асептический менингит. [18]
Гранулематозный гепатит и спленит (острое воспаление селезёнки)
Поражение печени и селезёнки, сопровождается генерализованной лимфаденопатией, длительной волнообразной лихорадкой, повышением уровней аминотрансфераз и множественными и диффузными гипоэхогенными зонами, определяемыми во время ультразвукового исследования и томографии. [19]
Диагностика болезни кошачьих царапин
Постановка диагноза основывается на данных анамнеза (наличие контакта с кошкой), клинических данных (присутствие первичного очага и регионального лимфаденита) и, при необходимости, данных лабораторных исследований:
- Общий анализ крови — при болезни кошачьи царапин обнаруживаются лейкоцитоз, лимфоцитоз и повышенная СОЭ.
- Полимеразная цепная реакция (ПЦР) — определение ДНК возбудителя на основе материала, взятого из первичного очага поражения или при биопсии лимфатического узла и крови. Специфичность данного обследования составляет почти 100%, но его чувствительность колеблется от 43% до 76%. [20]
- Культуральное исследование — посев материала из очагов поражения, аспирата из лимфатических узлов и крови. Специфичность анализа — 100%, чувствительность — 70-80%. [2] Метод требует специальных сред и времени (более трёх недель).
- Серологическое исследование — определение антител к B. henselae в крови методом ИФА (иммуноферментного анализа). Титры IgG менее 1:64 свидетельствуют о том, что у пациента нет текущей инфекции. Титры от 1:64 до 1:256 предполагают возможное наличие инфекции — рекомендовано повторное тестирование через 10-14 дней. Титры, превышающие 1:256, указывают на присутствие активной или недавней инфекции. Положительный тест на IgМ предполагает острое заболевание. [21]
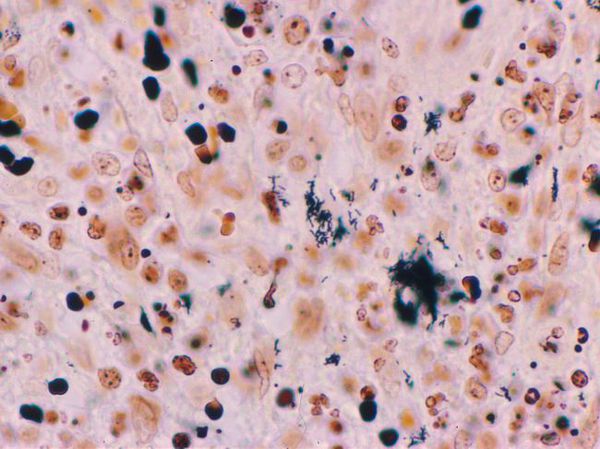
- Биопсия материала из первичного очага поражения — показывает выраженные очаги некроза в дерме, окружённые эпителиоидными и гигантскими клетками и эозинофилами. При окраске по Уортину — Старри определяются мелкие бактерии разной формы.
- Рентгенологическое исследование лимфатических узлов, УЗИ и томография печени и селезёнки — проводятся по показаниям.
- Исследование на ВИЧ-инфекцию и подсчёт количества СD4 клеток в крови — проводят при подозрении на бациллярный ангиоматоз.
Дифференциальная диагностика проводится со следующими заболеваниями:
- бактериальный гнойный лимфаденит, вызванный другими микроорганизмами;
- инфекция, вызванная атипичными микобактериями; ;
- споротрихоз;
- туляремия; ;
- саркоидоз;
- злокачественные новообразования.
Лечение болезни кошачьих царапин
Иногда в случаях стандартного течения заболевания применяют тепловой местный компресс или прибегают к физиотерапевтическому воздействию на область изменённых лимфоузлов (диатермии и УВЧ-терапии). Однако особого терапевтического эффекта эти метода не оказывают, так как большинство случаев фелиноза проходят самостоятельно, без лечения. Поэтому при классической форме болезни никаких действий предпринимать не нужно.
У некоторых пациентов могут развиться осложнения от распространения процесса. В таком случае рекомендовано назначение азитромицина, при применении которого лимфаденит регрессирует быстрее по сравнению с отсутствием лечения: [22]
- для взрослых и детей с весом > 45,5 кг: 500 мг в день, затем по 250 мг в течение четырёх дней;
- для детей с весом ≤ 45,5 кг: 10 мг/кг в первый день, затем по 5 мг/кг в течение четырёх дней.
При необходимости и наличии осложнений могут применяться другие антибиотики: пенициллины, тетрациклины, цефалоспорины и аминогликозиды и их комбинации.
Если есть нагноение, который сопровождается общими симптомами и лихорадкой, то показана аспирация гноя. Это позволит облегчить течение заболевания.
Прогноз. Профилактика
Прогноз благоприятный: при отсутствии осложнений заболевание спонтанно регрессирует без лечения в течение 3-4 месяцев. Тяжёлые формы заболевания встречаются крайне редко.
Меры профилактики, рекомендованные Центрами по контролю и профилактике заболеваний США: [23]
Фелиноз (болезнь от кошачьих царапин, доброкачественный лимфоретикулёз, гранулёма Молляре) - острое инфекционное заболевание, возникающее после укусов или царапин кошек. Протекает с образованием первичного аффекта в виде нагнаивающейся папулы с последующим развитием регионарного лимфаденита и синдрома интоксикации.
Краткие исторические сведения
А. Дебре и К. Фошей (1932), затем В. Молляре с соавт. (1950) описали доброкачественно протекающую лимфаденопатию, возникавшую после царапин кошек. Возбудителем заболевания вначале считали вирус, в 1963 г. В.И. Червонский с соавт. отнёс его к группе хламидий. В 1983 г. в США P. Yep с соавт. установил его принадлежность риккетсиям. Позднее возбудитель выделили в отдельный род Rochalimea, названный в честь известного бразильского риккетсиолога Э. да Роха-Лимы.
Этиология
Возбудитель заболевания - мелкая грамотрицательная бактерия Rochalimea henselae рода Rochalimea грибы Rickettsieae семейства Rickettsiaceae. Бактерии отличает выраженный полиморфизм, они способны расти на специальных питательных средах, что отличает их от прочих риккетсий. Паразитирует у кошек, собак, грызунов, обезьян. Не выдерживает нагревания, но хорошо сохраняется при низких температурах.
Эпидемиология
Резервуар и источник инфекции - кошки, в отдельных случаях - собаки. Предположительно, в распространении инфекции определённое значение могут иметь мелкие грызуны и обезьяны. От человека человеку возбудитель не передаётся. Сами кошки остаются здоровыми; считается, что возбудитель входит в состав нормальной микрофлоры полости рта кошек.
Механизм передачи - контактный. Возбудитель проникает через повреждённую кожу (укусы, царапины или имевшиеся до контакта с кошкой микротравмы). Иногда слюна кошек попадает на конъюнктиву, что ведёт к развитию глазных форм болезни.
Естественная восприимчивость людей не изучена.
Патогенез
Возбудитель проникает в организм человека через повреждённые кожные покровы и иногда слизистые оболочки (царапины, нанесённые когтями кошек, или их укусы). В половине случаев в месте его внедрения образуются папулы, впоследствии нагнаивающиеся. Из ворот инфекции риккетсии лимфогенно диссеминируют в регионарные лимфатические узлы. Под их воздействием в лимфатических узлах образуются воспалительные инфильтраты с гиперплазией ретикулярных клеток, а в дальнейшем гранулёмы, напоминающие бруцеллёзные, а также звездообразные абсцессы с образованием свищей. Впоследствии возможно регрессирование воспалительного процесса со склерозированием лимфатических узлов. При гематогенном диссеминировании риккетсии попадают в различные паренхиматозные органы, где формируются аналогичные гранулёмы. Токсины возбудителей и продукты распада тканей обусловливают развитие интоксикации и аллергических реакций.
Клиническая картина
Инкубационный период. Варьирует от 3 до 10 дней, но в отдельных случаях может затягиваться до 1,5 мес.
Начальный период
На месте зажившей царапины или укуса часто возникает первичный аффект в виде красноватых папул, не причиняющих значительного беспокойства больному и часто остающихся незамеченными.
Период разгара
Позднее папулы могут нагнаиваться, изъязвляться и покрываться корочками, после отторжения которых не остаётся рубцов. Через 2-3 нед после возникновения первичного аффекта развивается регионарный лимфаденит, наиболее часто в подмышечных впадинах и на шее, реже в паховых и бедренных областях. В 80% случаев отмечают увеличение одного лимфатического узла. Иногда лимфатические узлы приобретают значительные размеры, при пальпации они слегка болезненны, плотные. Явления периаденита не наблюдают. Проявляются симптомы интоксикации в виде повышения температуры тела, недомогания, головной боли, снижения аппетита. Длительность температурной реакции с проявлениями интоксикации варьирует от 1 до 3 нед. В ряде случаев могут возникнуть полиморфная аллергическая сыпь на коже, микрополилимфаденит, увеличиваются печень и селезёнка.
Период реконвалесценции
Характеризуется исчезновением признаков интоксикации, постепенным рассасыванием, склерозированием или нагноением лимфатических узлов с последующим их вскрытием.
Фелиноз также может протекать в виде атипичных форм. Одна из них проявляется в виде одностороннего конъюнктивита с образованием язв и узелков на конъюнктиве и увеличением околоушных и подчелюстных лимфатических узлов. В редких случаях возникает нейроретинит, обычно односторонний, проявляющийся отёком диска зрительного нерва, образованием пятен звездообразной формы и узелков на сетчатке, ангиоматозными изменениями под ней. При этом полностью сохраняется острота зрения. При наличии гранулематозных изменений в печени развивается печёночная пурпура.
Дифференциальная диагностика
Заболевание следует отличать от туляремии, чумы, инфекционного мононук-леоза, лимфом различной этиологии и других заболеваний, сопровождающихся лимфаденопатией. Для фелиноза характерны образование первичного аффекта с последующим развитием синдрома интоксикации и регионарного лимфаденита, чаще всего с увеличением одного лимфатического узла без явлений периаденита. Большое значение имеют данные эпидемиологического анамнеза: контакте кошками, нанесение ими царапин, укусов или ослюнение.
Лабораторная диагностика
У части больных в гемограмме отмечают эозинофилию и повышение СОЭ. Серологическую диагностику проводят с помощью РСК. Возможна постановка кожно-аллергических проб со специфическими аллергенами; они положительны у 90% больных, но проявляются лишь на 3-4-й неделе от начала болезни. В последнее время применяют ИФА с антисывороткой и ПЦР. При гистологическом исследовании биоптатов лимфатических узлов можно обнаружить возбудитель.
Осложнения
Осложнения крайне редки. Известно возникновение серозных менингитов, энцефалитов и энцефаломиелитов.
Лечение
Для лечения неосложнённого фелиноза применяют эритромицин по 500 мг 4 раза в сутки, доксициклин по 100 мг 2 раза в сутки или ципрофлоксацин по 500 мг 2 раза в сутки. Курс лечения составляет 10-14 дней. Альтернативные препараты - тетрациклины, азитромицин, хлорамфеникол, офлоксацин в средних терапевтических дозах. Эффективность перечисленных препаратов проявляется далеко не всегда. Назначают симптоматические средства, витамины, антигистаминные препараты. Показаны нестероидные противовоспалительные препараты (индометацин, вольтарен и др.). При размягчении лимфатического узла делают его разрез или пункцию для удаления гноя.
Профилактические мероприятия
Специфическая профилактика не разработана. Меры личной профилактики сведены к ограничению контакта с кошками. Мероприятия в эпидемическом очаге не регламентированы.
Несмотря на то что первое клиническое описание болезни кошачьей царапины (БКЦ) было дано R. Debre и соавт. более 50 лет назад, до сих пор вопрос об этиологии этого заболевания остается предметом дискуссий и специальных исследований.
Несмотря на то что первое клиническое описание болезни кошачьей царапины (БКЦ) было дано R. Debre и соавт. более 50 лет назад, до сих пор вопрос об этиологии этого заболевания остается предметом дискуссий и специальных исследований. Поскольку выделить возбудитель от больных не удавалось в течение длительного времени, первоначально предполагалась вирусная или хламидийная этиология заболевания. Первые убедительные сведения об идентификации возбудителя БКЦ были получены только в 1983 г., когда исследователи, используя метод окраски по Warthin-Starry (метод серебрения), обнаружили в ткани пораженных лимфатических узлов у 29 из 34 больных БКЦ мелкие полиморфные грамотрицательные бациллы, которые удалось культивировать лишь в 1988 г. Именно этот микроорганизм первоначально был признан возбудителем БКЦ и получил название Alipia felis.
Тем не менее многочисленные последующие исследования не подтвердили четкой взаимосвязи развития БКЦ с A. felis: в большинстве случаев у больных в пораженных тканях не только не обнаруживался указанный возбудитель, но и в сыворотке крови не выявлялись антитела к нему. Более того, из ткани пораженных лимфоузлов был изолирован еще один возбудитель — Bartonella henselae. Методом ПЦР с применением специфических праймеров к Bartonella spp. и A. felis у больных, у которых кожный тест на БКЦ оказался положительным, было установлено, что в 96% случаев у них обнаруживалась ДНК Bartonella, тогда как ДНК A. felis не выявлялась ни в одном случае (A. Bergmans et al., 1995). Сходные данные, подтверждающие ключевую роль B. henselae в развитии БКЦ, были получены и другими исследователями при использовании непрямой реакции флюоресцирующих антител.
В то же время первоначальный факт обнаружения A. felis в пораженных лимфатических узлах игнорироваться не должен. На сегодняшний день некоторые исследователи допускают, что A. felis способен вызывать заболевание, которое по своей клинической картине может напоминать БКЦ.
Болезнь кошачьей царапины (лимфоретикулез доброкачественный) относится к группе бартонеллезов и характеризуется как нетяжелое самокупирующееся заболевание с развитием одностороннего лимфаденита, регионарного по отношению к месту инокуляции возбудителя, и только в редких случаях возможна диссеминация возбудителя с поражением центральной нервной системы и висцеральных органов.
B. henselae характеризуется как небольшая плеоморфная, грамотрицательная бацилла, весьма требовательная к условиям культивирования (растет только на средах с 5% кровяного агара при температуре от 35 до 37°С, с 5—10% углекислого газа и 40-процентной влажностью). Кроме этого, колонии первичной культуры растут медленно и становятся видимыми только после 9—15 дней роста. При последующем пассаже рост колоний ускоряется. Идентификация выделенного возбудителя проводится с использованием специфических антисывороток, определением профиля жирных кислот клеточной стенки или молекулярно-генетическим методом. С помощью этого метода было идентифицировано два генотипа B. henselae, хотя до сих пор четкой зависимости между генотипами возбудителя и особенностями клинического течения вызываемых ими заболеваний не установлено.
B. henselae на сегодняшний день рассматривается как основной возбудитель БКЦ, однако у 5—15% больных с диагнозом, установленным на основании клинико-эпидемиологических данных, даже с помощью существующих современных методов лабораторной диагностики этиологическое значение B. henselae в развитии заболевания не подтверждается.
Один из необъяснимых парадоксов, связанных с B. henselae: в последние годы установлено, что данный возбудитель ответственен за развитие не только БКЦ, но и некоторых других заболеваний.
БКЦ имеет широкое географическое распространение и встречается практически повсеместно. Основным естественным резервуаром B. henselae являются кошки, инфицированность которых в значительной степени определяет распространенность БКЦ (K. M. Zangwill et al., 1993). По данным некоторых исследователей, у более чем 50% домашних и диких кошек обнаруживается бактериемия, обусловленная B. henselae. В ходе исследования, проведенного в США, установлено, что наиболее высокий процент инфицированности кошек и, соответственно, заболеваемости БКЦ среди людей регистрируется в южных штатах. Большинство исследователей подчеркивают особую роль котят в передаче возбудителя, указывая, что у взрослых кошек редко выявляется бактериемия B. henselae за счет наличия у них специфических антител, свидетельствующих о длительности их инфицирования. Особенностью течения бартонеллеза у кошек является его продолжительность (месяцы, годы) и бессимптомность (даже в случае подтверждаемой бактериемии).
В циркуляции B. henselae среди кошек исключительную роль играют блохи (Ctenocephalides felis). Экспериментальным путем было установлено, что при отсутствии блох инфицирования здоровых кошек не происходит.
B. henselae обнаруживается в кишечнике блох и их испражнениях в течение 9 дней после инфицирования, что свидетельствует о его репликации и персистенции в организме блох. Кроме этого, экспериментально была установлена возможность инфицирования кошек путем внутрикожной инокуляции инфицированных испражнений блох, в то же время оральное введение кошкам инфицированных блох и их испражнений к сероконверсии не приводило. Роль блох в передаче возбудителя от кошек к человеку в настоящее время категорически не отрицается. В последние годы исследователями в США и Италии (Y. O. Sanogo et al., 2003) молекулярно-генетическими методами было продемонстрировано, что ДНК B. henselae может обнаруживаться в иксодовых клещах, хотя их роль в качестве вектора передачи возбудителя БКЦ по-прежнему не изучена.
Эпидемиологические исследования показывают, что в сыворотке крови около 20% владельцев кошек и 3–4% общей популяции людей обнаруживаются антитела к B. henselae. Семейные случаи заболевания БКЦ не столь типичны и регистрируются менее чем у 5% пациентов. Хотя БКЦ может развиваться в любом возрасте, чаще заболевают молодые люди (до 18 лет).
Передача возбудителя БКЦ реализуется главным образом контактным путем через царапины, укусы или слюну инфицированных кошек. Подъем заболеваемости, как правило, отмечается с конца лета, что объясняется особенностями жизненного цикла у кошек и блох.
Поскольку возбудитель БКЦ был идентифицирован относительно недавно, многие аспекты, касающиеся патогенеза заболевания, до сих пор недостаточно изучены. Характер развивающегося инфекционного процесса, обусловленного действием B. henselae, в значительной степени зависит от иммунного статуса человека: в тех случаях, когда заболевание развивается у иммунокомпетентных пациентов, диссеминация возбудителя отсутствует, и процесс преимущественно ограничивается локальными или регионарными поражениями. В частности, БКЦ в большинстве случаев проявляется развитием регионарной лимфаденопатии. Поражение висцеральных органов описано только в отдельных случаях (Dunn et al., 1997), а бактериемия у иммунокомпетентных пациентов регистрируется исключительно редко (Slater et al., 1990). Напротив, у иммунокомпрометированных пациентов для инфекции B. henselae типично развитие бактериемии и других системных поражений, включая бациллярный ангиоматоз и бациллярный пелиозный гепатит, а у лиц с врожденными и приобретенными аномалиями клапанов сердца — эндокардит (Raoult et al., 1996).
Гистологические изменения в пораженных лимфатических узлах характеризуются пролиферацией гистиоцитов и B-лимфоцитов, приводящей к образованию гранулем с последующей нейтрофильной инфильтрацией и развитием центрального или звездчатого некроза.
Хотя B. henselae и считается одним из наиболее вероятных возбудителей БКЦ, тем не менее, согласно современным наблюдениям, данный возбудитель ответственен за развитие ряда других патологических состояний человека (табл. 1). При этом иммунный статус больных рассматривается как ключевой фактор, определяющий характер формирующегося заболевания, хотя известны случаи, когда даже у лиц с ВИЧ-инфекцией в стадии СПИДа БКЦ протекала в типичной форме.
Инкубационный период у больных с БКЦ может варьировать в достаточно широких пределах — от 3 до 20 дней и более, составляя в среднем 1–2 нед. Хотя общепринятой клинической классификации БКЦ нет, чаще всего выделяют типичную и атипичные формы заболевания (табл. 2), что определяется по доминирующему в клинической картине болезни синдромокомплексу.
В типичных случаях БКЦ проявляется развитием первичного аффекта и регионарного (к месту входных ворот инфекции) лимфаденита. Локализация первичного аффекта определяется местом первичной инокуляции возбудителя, а именно местом нанесения кошкой царапин и укусов. По истечении нескольких дней (от 3 до 10), когда нанесенные кошкой повреждения кожи уже заживают, в месте входных ворот формируется папула, которая, как правило, трансформируется в везикулу и далее в пустулу, а после вскрытия — в язвочку, покрытую корочкой. В некоторых случаях пустула может подсыхать без образования язвочки. В диаметре размер формирующейся папулы, как правило, составляет от 1–2 до 5 мм. Частота выявления первичного аффекта у больных БКЦ, по данным различных исследователей, может колебаться от 25 до 94%. Кожные проявления сохраняются в течение 1—3 нед и спонтанно разрешаются.
Регионарный лимфаденит является одним из наиболее постоянных и характерных клинических признаков БКЦ (табл. 3) и сохраняется в течение длительного времени: от 7 до 60 дней, а в отдельных случаях до 1 года и даже 3 лет. В большинстве случаев лимфаденит разрешается в течение 1—4 мес. Нередко он оказывается практически единственным проявлением БКЦ. В большинстве случаев (85%) у больных выявляются одиночные лимфатические узлы, реже множественные, в границах одной анатомической области. Несмотря на то что у больных регистрируется увеличение лимфатических узлов, осуществляющих дренаж места первичной инокуляции возбудителя, развитие лимфангоита не характерно для БКЦ. У 1/3 пациентов могут определяться увеличенные лимфатические узлы разных анатомических областей, хотя генерализованная лимфаденопатия встречается достаточно редко. Размером увеличенные лимфатические узлы чаще бывают от 1 до 5 см, в некоторых случаях до 8—10 см. При пальпации лимфатические узлы умеренно болезненные. Хотя они и не спаяны с окружающими тканями, нередко определяется гиперемия кожных покровов над ними. В 10—50% случаев у больных БКЦ развивается нагноение пораженных лимфатических узлов с образованием густого желто-зеленого гноя. В отдельных случаях при посеве гноя на питательные среды удается получить рост стафилококков и другой флоры, хотя роль условно-патогенной флоры (суперинфекция) в нагноении пораженных лимфатических узлов пока не установлена.
Общее состояние больных в большинстве случаев остается удовлетворительным. Только в трети случаев у больных отмечается повышение температуры тела свыше 38,3°С, которое сохраняется около недели и лишь иногда может затягиваться до месяца и более. Среди других клинических проявлений БКЦ могут отмечаться: слабость и недомогание (30%), головная боль (14%), тошнота и рвота (15%), спленомегалия (11%). В случае длительного течения заболевания у больных может наблюдаться потеря веса. Нередко заболевание приобретает волнообразное течение.
Поражение нервной системы (неврологический вариант) у больных БКЦ выявляется редко (~2% случаев), хотя диапазон клинических проявлений весьма разнообразен: у больных могут выявляться радикулиты, полиневриты, миелит, энцефалопатия, энцефалит, менингит и церебральная атаксия. Характерным признаком поражения нервной системы при БКЦ является то, что они развиваются спустя 1—6 нед (чаще 2–3 нед) от момента появления лимфаденопатии. Для развития энцефалита и менингита типично внезапно возникающее ухудшение состояния больного, сопровождающееся лихорадкой, головной болью, спутанностью сознания и дезориентацией. В некоторых случаях состояние может прогрессивно ухудшаться, вплоть до развития комы. В ликворе у таких больных определяется мононуклеарный плеоцитоз. Только в отдельных случаях у больных после перенесенного энцефалита могут отмечаться резидуальные явления.
Некоторые авторы (P. M. Delahoussaye, B. M. Osborne, 1990), указывая на возможность поражения печени и селезенки при БКЦ, выделяют висцеральный вариант заболевания, для которого характерны длительная волнообразная лихорадка, увеличение размеров печени и селезенки, повышение в сыворотке крови уровней аминотрансфераз, с определением при УЗИ и компьютерной томографии множественных, диффузных, гипоэхогенных дефектов. Довольно часто у таких больных отмечается генерализованная лимфаденопатия.
Кроме этого, в более редких случаях у больных БКЦ могут выявляться абсцесс селезенки, плеврит, эндокардит, пневмония, узловатая эритема, тромбоцитопеническая пурпура, остеомиелит (B. Dzelalija et al., 2001, C. V. Hulzebos et al., 1999).
В типичных случаях первичная диагностика БКЦ не представляет больших сложностей, поскольку основывается на характерных клинико-эпидемиологических данных (табл. 4).
Определенные сложности имеются при лабораторной верификации диагноза, что связано с отсутствием соответствующей лабораторной базы. В зарубежной практике длительное время в качестве основного диагностического критерия БКЦ использовался кожный тест, в котором в качестве аллергена применялся термоинактивированный пунктат, полученный из лимфоузлов больных с установленным (в соответствии с принятыми критериями) диагнозом БКЦ. По данным многих авторов, результативность такого теста достигала 95—98%, однако из-за риска передачи гемоконтактных инфекций использование данного теста ограничено, а кожного теста с использованием очищенных антигенов B. henselae пока не описано.
Микробиологические исследования в широкой практике не применяются ввиду длительности (от 2 до 6 нед) и сложности проведения анализа.
Достаточно информативным способом установления диагноза является биопсия папул и/или пораженных лимфатических узлов с последующим гистологическим исследованием (окрашивание срезов гематоксилин-эозином и серебром — метод Warthin-Starry), позволяющим выявить характерные гистологические признаки поражения и скопление мелких плеоморфных бактерий.
В последние годы большое внимание уделяется разработке специфических иммунологических (ИФА) и молекулярно-генетических (идентификация гена 16S рибосомальной РНК B. henselae) методов обнаружения возбудителя БКЦ в биопсийном материале больного, хотя пока для широкой практики они по-прежнему недоступны.
Дифференциальный диагноз необходимо проводить с заболеваниями, сопровождающимися развитием лимфаденопатии (табл. 5).
Несмотря на то что в редких случаях отмечаются варианты тяжелого течения БКЦ, у иммунокомпетентных лиц прогноз заболевания благоприятный. Повторных случаев и летальных исходов не описано.
Многочисленные клинические наблюдения показывают, что в большинстве случаев БКЦ протекает как самокупирующаяся инфекция, и применение антибактериальной терапии не оказывает существенного влияния на ее течение. Традиционные рекомендации по применению эритромицина (эритромицин-тева, зинерит) и доксициклина (юнидокс солютаб, медомицин, вибрамицин, тетрадокс) основаны на эффективности этих препаратов у больных с ВИЧ-инфекцией при развитии бациллярного ангиоматоза, вызываемого Bartonella quintana, тогда как у больных БКЦ терапевтическая эффективность указанных препаратов не подтверждена ни в одном исследовании. Весьма противоречивыми остаются данные по соответствию чувствительности in vitro возбудителя БКЦ к антибактериальным препаратам и их клинической эффективности. Единственным антибактериальным препаратом, клиническая эффективность которого была установлена в ходе рандомизированного плацебо-контролируемого исследования, является азитромицин (сумамед, хемомицин, азивок, сумазид), назначаемый в течение 5—10 дней. В неконтролируемых исследованиях (A. M. Margileth, 1992) из 18 антимикробных препаратов клиническая эффективность была установлена только при применении рифампицина (бенемицин, р-цин), ципрофлоксацина (ципросан, цифран, ципрова), гентамицина (гентамицин К, гентамицина сульфат) и триметопримсульфаметоксазола (бактрим, септрин). Антибактериальные препараты при БКЦ следует применять у иммунокомпрометированных лиц и при тяжелом течении заболевания, сопровождающегося поражением нервной системы и висцеральных органов.
В случае выявления флуктуации в пораженном лимфатическом узле требуется его пункция и аспирация гноя, что ускоряет последующий процесс склерозирования и рубцевания ткани лимфатического узла и влияет в конечном итоге на выздоровление пациента.
По вопросам литературы обращайтесь в редакцию.
В. А. Малов, доктор медицинских наук, профессор
А. Н. Горобченко, кандидат медицинских наук, доцент
ММА им. И. М. Сеченова, Москва
Несмотря на то что первое клиническое описание болезни кошачьей царапины (БКЦ) было дано R. Debre и соавт. более 50 лет назад, до сих пор вопрос об этиологии этого заболевания остается предметом дискуссий и специальных исследований.
Несмотря на то что первое клиническое описание болезни кошачьей царапины (БКЦ) было дано R. Debre и соавт. более 50 лет назад, до сих пор вопрос об этиологии этого заболевания остается предметом дискуссий и специальных исследований. Поскольку выделить возбудитель от больных не удавалось в течение длительного времени, первоначально предполагалась вирусная или хламидийная этиология заболевания. Первые убедительные сведения об идентификации возбудителя БКЦ были получены только в 1983 г., когда исследователи, используя метод окраски по Warthin-Starry (метод серебрения), обнаружили в ткани пораженных лимфатических узлов у 29 из 34 больных БКЦ мелкие полиморфные грамотрицательные бациллы, которые удалось культивировать лишь в 1988 г. Именно этот микроорганизм первоначально был признан возбудителем БКЦ и получил название Alipia felis.
Тем не менее многочисленные последующие исследования не подтвердили четкой взаимосвязи развития БКЦ с A. felis: в большинстве случаев у больных в пораженных тканях не только не обнаруживался указанный возбудитель, но и в сыворотке крови не выявлялись антитела к нему. Более того, из ткани пораженных лимфоузлов был изолирован еще один возбудитель — Bartonella henselae. Методом ПЦР с применением специфических праймеров к Bartonella spp. и A. felis у больных, у которых кожный тест на БКЦ оказался положительным, было установлено, что в 96% случаев у них обнаруживалась ДНК Bartonella, тогда как ДНК A. felis не выявлялась ни в одном случае (A. Bergmans et al., 1995). Сходные данные, подтверждающие ключевую роль B. henselae в развитии БКЦ, были получены и другими исследователями при использовании непрямой реакции флюоресцирующих антител.
В то же время первоначальный факт обнаружения A. felis в пораженных лимфатических узлах игнорироваться не должен. На сегодняшний день некоторые исследователи допускают, что A. felis способен вызывать заболевание, которое по своей клинической картине может напоминать БКЦ.
Болезнь кошачьей царапины (лимфоретикулез доброкачественный) относится к группе бартонеллезов и характеризуется как нетяжелое самокупирующееся заболевание с развитием одностороннего лимфаденита, регионарного по отношению к месту инокуляции возбудителя, и только в редких случаях возможна диссеминация возбудителя с поражением центральной нервной системы и висцеральных органов.
B. henselae характеризуется как небольшая плеоморфная, грамотрицательная бацилла, весьма требовательная к условиям культивирования (растет только на средах с 5% кровяного агара при температуре от 35 до 37°С, с 5—10% углекислого газа и 40-процентной влажностью). Кроме этого, колонии первичной культуры растут медленно и становятся видимыми только после 9—15 дней роста. При последующем пассаже рост колоний ускоряется. Идентификация выделенного возбудителя проводится с использованием специфических антисывороток, определением профиля жирных кислот клеточной стенки или молекулярно-генетическим методом. С помощью этого метода было идентифицировано два генотипа B. henselae, хотя до сих пор четкой зависимости между генотипами возбудителя и особенностями клинического течения вызываемых ими заболеваний не установлено.
B. henselae на сегодняшний день рассматривается как основной возбудитель БКЦ, однако у 5—15% больных с диагнозом, установленным на основании клинико-эпидемиологических данных, даже с помощью существующих современных методов лабораторной диагностики этиологическое значение B. henselae в развитии заболевания не подтверждается.
Один из необъяснимых парадоксов, связанных с B. henselae: в последние годы установлено, что данный возбудитель ответственен за развитие не только БКЦ, но и некоторых других заболеваний.
БКЦ имеет широкое географическое распространение и встречается практически повсеместно. Основным естественным резервуаром B. henselae являются кошки, инфицированность которых в значительной степени определяет распространенность БКЦ (K. M. Zangwill et al., 1993). По данным некоторых исследователей, у более чем 50% домашних и диких кошек обнаруживается бактериемия, обусловленная B. henselae. В ходе исследования, проведенного в США, установлено, что наиболее высокий процент инфицированности кошек и, соответственно, заболеваемости БКЦ среди людей регистрируется в южных штатах. Большинство исследователей подчеркивают особую роль котят в передаче возбудителя, указывая, что у взрослых кошек редко выявляется бактериемия B. henselae за счет наличия у них специфических антител, свидетельствующих о длительности их инфицирования. Особенностью течения бартонеллеза у кошек является его продолжительность (месяцы, годы) и бессимптомность (даже в случае подтверждаемой бактериемии).
В циркуляции B. henselae среди кошек исключительную роль играют блохи (Ctenocephalides felis). Экспериментальным путем было установлено, что при отсутствии блох инфицирования здоровых кошек не происходит.
B. henselae обнаруживается в кишечнике блох и их испражнениях в течение 9 дней после инфицирования, что свидетельствует о его репликации и персистенции в организме блох. Кроме этого, экспериментально была установлена возможность инфицирования кошек путем внутрикожной инокуляции инфицированных испражнений блох, в то же время оральное введение кошкам инфицированных блох и их испражнений к сероконверсии не приводило. Роль блох в передаче возбудителя от кошек к человеку в настоящее время категорически не отрицается. В последние годы исследователями в США и Италии (Y. O. Sanogo et al., 2003) молекулярно-генетическими методами было продемонстрировано, что ДНК B. henselae может обнаруживаться в иксодовых клещах, хотя их роль в качестве вектора передачи возбудителя БКЦ по-прежнему не изучена.
Эпидемиологические исследования показывают, что в сыворотке крови около 20% владельцев кошек и 3–4% общей популяции людей обнаруживаются антитела к B. henselae. Семейные случаи заболевания БКЦ не столь типичны и регистрируются менее чем у 5% пациентов. Хотя БКЦ может развиваться в любом возрасте, чаще заболевают молодые люди (до 18 лет).
Передача возбудителя БКЦ реализуется главным образом контактным путем через царапины, укусы или слюну инфицированных кошек. Подъем заболеваемости, как правило, отмечается с конца лета, что объясняется особенностями жизненного цикла у кошек и блох.
Поскольку возбудитель БКЦ был идентифицирован относительно недавно, многие аспекты, касающиеся патогенеза заболевания, до сих пор недостаточно изучены. Характер развивающегося инфекционного процесса, обусловленного действием B. henselae, в значительной степени зависит от иммунного статуса человека: в тех случаях, когда заболевание развивается у иммунокомпетентных пациентов, диссеминация возбудителя отсутствует, и процесс преимущественно ограничивается локальными или регионарными поражениями. В частности, БКЦ в большинстве случаев проявляется развитием регионарной лимфаденопатии. Поражение висцеральных органов описано только в отдельных случаях (Dunn et al., 1997), а бактериемия у иммунокомпетентных пациентов регистрируется исключительно редко (Slater et al., 1990). Напротив, у иммунокомпрометированных пациентов для инфекции B. henselae типично развитие бактериемии и других системных поражений, включая бациллярный ангиоматоз и бациллярный пелиозный гепатит, а у лиц с врожденными и приобретенными аномалиями клапанов сердца — эндокардит (Raoult et al., 1996).
Гистологические изменения в пораженных лимфатических узлах характеризуются пролиферацией гистиоцитов и B-лимфоцитов, приводящей к образованию гранулем с последующей нейтрофильной инфильтрацией и развитием центрального или звездчатого некроза.
Хотя B. henselae и считается одним из наиболее вероятных возбудителей БКЦ, тем не менее, согласно современным наблюдениям, данный возбудитель ответственен за развитие ряда других патологических состояний человека (табл. 1). При этом иммунный статус больных рассматривается как ключевой фактор, определяющий характер формирующегося заболевания, хотя известны случаи, когда даже у лиц с ВИЧ-инфекцией в стадии СПИДа БКЦ протекала в типичной форме.
Инкубационный период у больных с БКЦ может варьировать в достаточно широких пределах — от 3 до 20 дней и более, составляя в среднем 1–2 нед. Хотя общепринятой клинической классификации БКЦ нет, чаще всего выделяют типичную и атипичные формы заболевания (табл. 2), что определяется по доминирующему в клинической картине болезни синдромокомплексу.
В типичных случаях БКЦ проявляется развитием первичного аффекта и регионарного (к месту входных ворот инфекции) лимфаденита. Локализация первичного аффекта определяется местом первичной инокуляции возбудителя, а именно местом нанесения кошкой царапин и укусов. По истечении нескольких дней (от 3 до 10), когда нанесенные кошкой повреждения кожи уже заживают, в месте входных ворот формируется папула, которая, как правило, трансформируется в везикулу и далее в пустулу, а после вскрытия — в язвочку, покрытую корочкой. В некоторых случаях пустула может подсыхать без образования язвочки. В диаметре размер формирующейся папулы, как правило, составляет от 1–2 до 5 мм. Частота выявления первичного аффекта у больных БКЦ, по данным различных исследователей, может колебаться от 25 до 94%. Кожные проявления сохраняются в течение 1—3 нед и спонтанно разрешаются.
Регионарный лимфаденит является одним из наиболее постоянных и характерных клинических признаков БКЦ (табл. 3) и сохраняется в течение длительного времени: от 7 до 60 дней, а в отдельных случаях до 1 года и даже 3 лет. В большинстве случаев лимфаденит разрешается в течение 1—4 мес. Нередко он оказывается практически единственным проявлением БКЦ. В большинстве случаев (85%) у больных выявляются одиночные лимфатические узлы, реже множественные, в границах одной анатомической области. Несмотря на то что у больных регистрируется увеличение лимфатических узлов, осуществляющих дренаж места первичной инокуляции возбудителя, развитие лимфангоита не характерно для БКЦ. У 1/3 пациентов могут определяться увеличенные лимфатические узлы разных анатомических областей, хотя генерализованная лимфаденопатия встречается достаточно редко. Размером увеличенные лимфатические узлы чаще бывают от 1 до 5 см, в некоторых случаях до 8—10 см. При пальпации лимфатические узлы умеренно болезненные. Хотя они и не спаяны с окружающими тканями, нередко определяется гиперемия кожных покровов над ними. В 10—50% случаев у больных БКЦ развивается нагноение пораженных лимфатических узлов с образованием густого желто-зеленого гноя. В отдельных случаях при посеве гноя на питательные среды удается получить рост стафилококков и другой флоры, хотя роль условно-патогенной флоры (суперинфекция) в нагноении пораженных лимфатических узлов пока не установлена.
Общее состояние больных в большинстве случаев остается удовлетворительным. Только в трети случаев у больных отмечается повышение температуры тела свыше 38,3°С, которое сохраняется около недели и лишь иногда может затягиваться до месяца и более. Среди других клинических проявлений БКЦ могут отмечаться: слабость и недомогание (30%), головная боль (14%), тошнота и рвота (15%), спленомегалия (11%). В случае длительного течения заболевания у больных может наблюдаться потеря веса. Нередко заболевание приобретает волнообразное течение.
Поражение нервной системы (неврологический вариант) у больных БКЦ выявляется редко (~2% случаев), хотя диапазон клинических проявлений весьма разнообразен: у больных могут выявляться радикулиты, полиневриты, миелит, энцефалопатия, энцефалит, менингит и церебральная атаксия. Характерным признаком поражения нервной системы при БКЦ является то, что они развиваются спустя 1—6 нед (чаще 2–3 нед) от момента появления лимфаденопатии. Для развития энцефалита и менингита типично внезапно возникающее ухудшение состояния больного, сопровождающееся лихорадкой, головной болью, спутанностью сознания и дезориентацией. В некоторых случаях состояние может прогрессивно ухудшаться, вплоть до развития комы. В ликворе у таких больных определяется мононуклеарный плеоцитоз. Только в отдельных случаях у больных после перенесенного энцефалита могут отмечаться резидуальные явления.
Некоторые авторы (P. M. Delahoussaye, B. M. Osborne, 1990), указывая на возможность поражения печени и селезенки при БКЦ, выделяют висцеральный вариант заболевания, для которого характерны длительная волнообразная лихорадка, увеличение размеров печени и селезенки, повышение в сыворотке крови уровней аминотрансфераз, с определением при УЗИ и компьютерной томографии множественных, диффузных, гипоэхогенных дефектов. Довольно часто у таких больных отмечается генерализованная лимфаденопатия.
Кроме этого, в более редких случаях у больных БКЦ могут выявляться абсцесс селезенки, плеврит, эндокардит, пневмония, узловатая эритема, тромбоцитопеническая пурпура, остеомиелит (B. Dzelalija et al., 2001, C. V. Hulzebos et al., 1999).
В типичных случаях первичная диагностика БКЦ не представляет больших сложностей, поскольку основывается на характерных клинико-эпидемиологических данных (табл. 4).
Определенные сложности имеются при лабораторной верификации диагноза, что связано с отсутствием соответствующей лабораторной базы. В зарубежной практике длительное время в качестве основного диагностического критерия БКЦ использовался кожный тест, в котором в качестве аллергена применялся термоинактивированный пунктат, полученный из лимфоузлов больных с установленным (в соответствии с принятыми критериями) диагнозом БКЦ. По данным многих авторов, результативность такого теста достигала 95—98%, однако из-за риска передачи гемоконтактных инфекций использование данного теста ограничено, а кожного теста с использованием очищенных антигенов B. henselae пока не описано.
Микробиологические исследования в широкой практике не применяются ввиду длительности (от 2 до 6 нед) и сложности проведения анализа.
Достаточно информативным способом установления диагноза является биопсия папул и/или пораженных лимфатических узлов с последующим гистологическим исследованием (окрашивание срезов гематоксилин-эозином и серебром — метод Warthin-Starry), позволяющим выявить характерные гистологические признаки поражения и скопление мелких плеоморфных бактерий.
В последние годы большое внимание уделяется разработке специфических иммунологических (ИФА) и молекулярно-генетических (идентификация гена 16S рибосомальной РНК B. henselae) методов обнаружения возбудителя БКЦ в биопсийном материале больного, хотя пока для широкой практики они по-прежнему недоступны.
Дифференциальный диагноз необходимо проводить с заболеваниями, сопровождающимися развитием лимфаденопатии (табл. 5).
Несмотря на то что в редких случаях отмечаются варианты тяжелого течения БКЦ, у иммунокомпетентных лиц прогноз заболевания благоприятный. Повторных случаев и летальных исходов не описано.
Многочисленные клинические наблюдения показывают, что в большинстве случаев БКЦ протекает как самокупирующаяся инфекция, и применение антибактериальной терапии не оказывает существенного влияния на ее течение. Традиционные рекомендации по применению эритромицина (эритромицин-тева, зинерит) и доксициклина (юнидокс солютаб, медомицин, вибрамицин, тетрадокс) основаны на эффективности этих препаратов у больных с ВИЧ-инфекцией при развитии бациллярного ангиоматоза, вызываемого Bartonella quintana, тогда как у больных БКЦ терапевтическая эффективность указанных препаратов не подтверждена ни в одном исследовании. Весьма противоречивыми остаются данные по соответствию чувствительности in vitro возбудителя БКЦ к антибактериальным препаратам и их клинической эффективности. Единственным антибактериальным препаратом, клиническая эффективность которого была установлена в ходе рандомизированного плацебо-контролируемого исследования, является азитромицин (сумамед, хемомицин, азивок, сумазид), назначаемый в течение 5—10 дней. В неконтролируемых исследованиях (A. M. Margileth, 1992) из 18 антимикробных препаратов клиническая эффективность была установлена только при применении рифампицина (бенемицин, р-цин), ципрофлоксацина (ципросан, цифран, ципрова), гентамицина (гентамицин К, гентамицина сульфат) и триметопримсульфаметоксазола (бактрим, септрин). Антибактериальные препараты при БКЦ следует применять у иммунокомпрометированных лиц и при тяжелом течении заболевания, сопровождающегося поражением нервной системы и висцеральных органов.
В случае выявления флуктуации в пораженном лимфатическом узле требуется его пункция и аспирация гноя, что ускоряет последующий процесс склерозирования и рубцевания ткани лимфатического узла и влияет в конечном итоге на выздоровление пациента.
По вопросам литературы обращайтесь в редакцию.
В. А. Малов, доктор медицинских наук, профессор
А. Н. Горобченко, кандидат медицинских наук, доцент
ММА им. И. М. Сеченова, Москва
Читайте также:

