Экогеохимия элементов 6 группы побочной подгруппы реферат
Обновлено: 05.07.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Доц. Гарибян Ирина Ивановна
Лекция по химии
Общая характеристика металлов побочной подгруппы V группы и их свойства
Общая характеристика металлов побочной подгруппы VI группы и их свойства
Общая характеристика металлов побочной подгруппы VII группы и их свойства
Общая характеристика металлов побочной подгруппы VIII группы и их свойства
сформировать целостное представление о металла побочных подгрупп V - VIII групп, умение использовать знания в составлении уравнений химических свойств этих металлов
ОБЩАЯ ХАРАКТЕРИСТИКА МЕТАЛЛОВ
ПОБОЧНОЙ ПОДГРУППЫ V ГРУППЫ.
Эту подгруппу составляют элементы ванадий V и его электронные аналоги – ниобий Nb , тантал Та и синтезированный нильсборий Ns . Электронная структура их атомов выражается формулой ( n -1) d 3 ns 2 , где n - номер внешнего слоя и ли номер периода, в котором находится элемент.
При возбуждении атома внешние s -электроны распариваются, поэтому ванадий и его аналоги могут проявлять валентность, равную двум. Для этих элементов возможны также трёх- и четырёхвалентные состояния, но более характерным является пятивалентное состояние, отвечающее максимальному числу неспаренных электронов на валентных энергетических подуровнях. В ряду V – Nb – Ta устойчивость соединений с низшей валентностью элемента падает, а с максимальной - возрастает. Ванадий, ниобий и тантал – металлы серого цвета. Чистые металлы ковки. В свободном состоянии ванадий, ниобий и тантал весь стойки к химическим воздействиям и обладают высокими температурами плавления. Они вместе с хромом, вольфрамом относятся к тугоплавким металлам. Ванадий растворяется в плавиковой кислоте и в кислотах, являющихся сильными окислителями (концентрированная серная H 2 SO 4 , HNO 3 кислоты, царская водка). Например:
3 V + 5 HNO 3 = 3 HVO 3 = 5 NO ↑ + H 2 O
Ниобий и тантал взаимодействуют только с плавиковой кислотой в присутствии окислителей. Растворы щелочей на ванадий, ниобий и тантал не действуют, но в расплавах NaOH и KOH в присутствии кислорода они растворяются:
4 V + 5 O 2 + 12 KOH = 4 K 3 [ VO 4 ] + 6 H 2 O
Важнейшей областью применения ванадия является металлургия специальных сталей. Ниобий – один из компонентов многих жаростойких сплавов. Из тантала делают нагреватели высокотемпературных печей.
ОБЩАЯ ХАРАКТЕРИСТИКА МЕТАЛЛОВ
ПОБОЧНОЙ ПОДГРУППЫ VI ГРУППЫ.
К ним относятся – хром Cr , молибден Mo , вольфрам W .
В их атомах не достроен d - подуровень предпоследнего уровня. Электронная структура их атомов выражается формулой … ( n -1) d 4 ns 2 . У атомов хрома и молибдена происходит провал одного s – электрона с внешнего слоя на предвнешний. Однако их соединения одновалентны неизвестны. Все эти металлы проявляют степень окисления (+6), устойчивы также соединения молибдена и вольфрама со степенью окисления (+4). Для хрома типичны степени окисления (+3) и (+6). Хром, молибден и вольфрам – голубовато- серебристые и серовато – белые металлы. При нагревании они реагируют с галогенами, кислородом, серой, азотом, фосфором, углеродом, кремнием, бором. Образуют сплавы со многими металлами, главным образом, с тяжёлыми.
Химические свойства
В ряду Cr – Mo – W химическая активность падает.
С увеличением степени окисления элементов у их оксидов и гидроксидов закономерно происходит ослабление основных свойств и усиление кислотных. Высшим оксидам RO 3 соответствуют кислоты H 2 RO 4 .
Хром - серебристо-белый с голубоватым оттенком металл, встречается в природе в виде хромита железа Fe(CrO 2 ) 2 и хромата свинца PbCrO 4 . Электронная конфигурация атома хрома
Cr 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1
Хром получают восстановлением:
Химические свойства
Хром при обычных условиях очень инертный, а при нагревании взаимодействует со многими неметаллами:
При непосредственном взаимодействии с кислородом получается оксидная плёнка.
4 Cr + 3 O 2 = 2 Cr 2 O 3 .
При высокой температуре хром реагирует с водой:
Хром не растворяется в концентрированных серной и азотных кислотах на холоде (пассивирует), но растворяется в них при нагревании:
Хром также взаимодействует с растворами соляной и серной кислоты разбавленными:
Cr + 2H С l = CrCl 2 + H 2
ОБЩАЯ ХАРАКТЕРИСТИКА МЕТАЛЛОВ
ПОБОЧНОЙ ПОДГРУПППЫ VII ГРУППЫ.
К ним относятся - марганец Mn , технеций Tc , рений Re . Их атомы имеют на последнем уровне по два электрона и по пять электронов на d - орбиталях предпоследнего электронного уровня. Электронная структура их атомов может быть выражена формулой ( n -1) d 5 s 2 . Низшая валентность марганца и его аналогов равна двум, что отвечает возбуждению внешних s – электронов. Марганец в свободном состоянии в природе не встречается. На его долю приходится 0,1% массы земной коры. Технеций в земной коре практически не содержится. Рений – редкий элемент. Большое практическое значение имеет марганец.
Физические свойства
В компактном состоянии это серебристо-белые, тугоплавкие металлы, похожие по внешнему виду на железо или платину.
Химические свойства
1. В ряду Mn – Tc – Re химическая активность понижается. Mn – металл средней активности, в ряду напряжений стоит до водорода и растворяется в соляной и серной кислотах:
Mn + 2 H + → Mn 2+ + H 2
2. Re и Tc стоят в ряду активности металлов после водорода. Они реагируют только с азотной кислотой:
3Tc + 7HNO 3 → 3HTcO 4 + 7NO + 2H 2 O
Марганец - Mn
Электронная конфигурация валентного слоя
Алюмотермия: 3 MnO 2 + 4 Al → 2 Al 2 O 3 + 3 Mn
Химические свойства
Марганец взаимодействует с растворами кислот:
Концентрированная азотная и серная кислоты пассивируют марганец, однако при нагревании реакция идёт с азотной кислотой:
ОБЩАЯ ХАРАКТЕРИСТИКА МЕТАЛЛОВ
ПОБОЧНОЙ ПОДГРУППЫ VIII ГРУППЫ.
К ним входят три "триады" элементов: первую триаду образуют железо, кобальт, никель, вторую - рутений, родий, палладий , третью- осмий, иридий, платина . На внешних орбиталях этих элементов содержится не более двух электронов, следовательно, для них не характерно присоединение электронов, что свидетельствует об их металлическом характере.
Железо – самый распространённый после алюминия металл на земном шаре. Его масса составляет 4% всей массы земной коры. Железо - металл серебристого цвета, довольно мягкий и пластичный. Соединения Fe 2+ довольно легко окисляются до Fe 3+ :
4 Fe ( OH ) 2 + O 2 + 2 H 2 O = 4 Fe ( OH ) 3
Fe 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2
Металл средней активности, восстановитель.
Основные степени окисления –(+2), (+3)
Получение : Восстановлением оксидов при высокой температуре с помощью окиси углерода, кокса, водорода:
Для железа наиболее характерной степенью окисления является (+3), возможна и (+2), мало встречается (+6).
В ряду активностей металлов железо стоит левее водорода и вытесняет его из кислот:
При нагревании железо растворяется в кислотах – сильных окислителях. При высокой температуре (800 0 С) железо разлагает воду (промышленный способ получения водорода):
Железо реагирует с активными неметаллами:
Железо вытесняет менее активные металлы из растворов их солей:
Качественные реакции на ионы Fe 2+ и Fe 3+ :
FeCl 3 + 3K C NS = Fe(CNS) 3 + 3KCl
Химические свойства
На воздухе (ржавление):
4 Fe + 3 O 2 + 6 H 2 O → 4 Fe ( OH ) 3
Железо реагирует с неметаллами при нагревании:
Железо легко растворяется в соляной и разбавленной серной
В концентрированных кислотах–окислителях железо растворяется только при нагревании
Платиновые металлы. Все платиновые металлы относятся к числу малораспространённых элементов. В природе они встречаются только в самородном состоянии. К ним относятся: 1) легкие платиновые металлы – рутений Ru , родий Rh , палладий Pd , и 2) тяжелые платиновые металлы - осмий, иридий Ir , платина Pt ,
Элементы платиновой группы в свободном виде представляют серебристо-белые, достаточно тугоплавкие металлы.
Все они, кроме осмия, не окисляются на воздухе и очень стойки против действия многих химических реагентов. В соединениях платиновые металлы проявляют различные степени окисления и сильно выраженную склонность к образованию комплексных соединений.
Однако многие ученые предполагают, что в живом организме не только присутствуют все химические элементы, но каждый из них выполняет какую-то биологическую функцию. Вполне возможно, что эта гипотеза не подтвердится. По мере того как развиваются исследования в данном направлении, выявляется биологическая роль все большего числа химических элементов.
Содержание работы
1.Введение…………………………………………………………………..……..3
2.Общая характеристика, краткие сведения об истории открытия
элементов и их распространенности в природе………. ………………. ……5
3. Свойства простых веществ: реакции с кислотами……………………….…..14
4. Важнейшие соединения хрома (III) и их химические свойства………..…..17
5. Соединения Ме (VI): молибденил- и вольфрамил-ионы; галогениды и оксигалогениды, оксиды, анионные комплексы………………………………20
6. Окислительные свойства хроматов и дихроматов……………………….…29
7. Медико-биологическое значение соединений хрома,
молибдена, вольфрама……………………………………………………….…..31
8.Заключение…………………………………………………………….……….34
9.Список используемой литературы……………………………..……………..35
Файлы: 1 файл
химия реферат.docx
Государственное бюджетное образовательное учреждение
Реферат по дисциплине Химия
на тему: «Химия и биологическая роль
Выполнила:
студентка 17 группы
педиатрического факультета
Петрова С. В.
Проверила:
к. б. н., доцент кафедры
химии и фармацевтической химии
Иванова А. И.
Оренбург 2010
Содержание
1.Введение…………………………………………………… ……………..……..3
2.Общая характеристика, краткие сведения об истории открытия
элементов и их распространенности в природе………. ………………. ……5
3. Свойства простых веществ: реакции с кислотами……………………….…..14
4. Важнейшие соединения хрома (III) и их химические свойства………..…..17
5. Соединения Ме (VI): молибденил- и вольфрамил-ионы; галогениды и оксигалогениды, оксиды, анионные комплексы………………………………20
6. Окислительные свойства хроматов и дихроматов……………………….…29
7. Медико-биологическое значение соединений хрома,
9.Список используемой литературы……………………………..…………….. 35
Введение
Мнение о том, что в организме человека можно обнаружить, практически все элементы периодической системы Д. И. Меделеева, становится привычным.
Однако многие ученые предполагают, что в живом организме не только присутствуют все химические элементы, но каждый из них выполняет какую-то биологическую функцию. Вполне возможно, что эта гипотеза не подтвердится. По мере того как развиваются исследования в данном направлении, выявляется биологическая роль все большего числа химических элементов.
Имеются данные, что содержание некоторых элементов в организме меняются с возрастом. Так, содержание кадмия в почках и молибдена в печени к старости повышается. Максимальное содержание цинка наблюдается в период полового созревания, затем оно понижается и в старости доходит до минимума.
Однако необходимо помнить, что для организма вреден не только недостаток, но и избыток биогенных элементов, так как при этом нарушается гомеостаз. Например, при поступлении избытка марганца с пищей в плазме повышается уровень меди, а в почках он снижается. Повышение содержания молибдена в продуктах питания приводит к увеличению количества меди в печени. Избыток цинка вызывает угнетение активности железосодержащих ферментов (антагонизм Zn и Fe).
Среди d-элементов жизненно необходимы в основном элементы четвертого периода: марганец, железо, цинк, медь, кобальт. В последнее время установлено, что несомненна физиологическая роль и некоторых других d-элементов этого периода: титана, хрома, ванадия.
d-элементы пятого и шестого периодов, за исключением молибдена, не проявляют выраженной положительной физиологической активности.
Молибден же входит в состав ряда окислительно-восстановительных ферментов (например, ксантиноксидазы, альдегидоксидазы)и играет большую роль в протекании биохимических процессов. Широко используют различные элементы и их соединения в качестве лекарственных средств.
Организм человека состоит на 60% из воды, 34% приходится на органические вещества и 6% - на неорганические. В неорганических веществах организма человека обязательно присутствуют 22 химических элемента: Ca, P, O, Na, Mg, S, B, Cl, K, V, Mn, Fe, Co, Ni, Cu, Zn, Mo, Cr, Si, I, F, Se. Я остановлюсь на элементах шестой побочной подгруппы (подгруппа хрома): Cr,Mo и W.
Общая характеристика, краткие сведения об истории открытия элементов и их распространённости в природе
Шестую побочную подгруппу (подгруппу хрома) составляют элементы: хром, молибден, вольфрам. Содержание их в природе невелико, относятся они к редким металлам. Благодаря целому ряду полезных химических и физических свойств эти элементы широко используют в машиностроении и химической технологии.
Конфигурация валентных электронов Cr и Мо –(n-1)d5 ns1,W-5d46s2/.
Cумма валентных электронов хрома, молибдена, вольфрама равна 6, что и определило их положение в VIБ группе. Как у большинства d-элементов, предпоследний электронный слой неустойчив. У Cr и Мо-13 электронов, у W-12. Поэтому валентность хрома, молибдена и вольфрама непостоянна. По этой же причине соединения металлов группы VIБ характеризуется набором степеней окисления от +2 до +6.Наиболее устойчивы соединения со степенью окисления +3 и +6.
Соединения молибдена и вольфрама более устойчивы со степенью окисления +6.Молибден со степенью окисления проявляет слабые окислительные свойства, восстанавливаясь до +5. Окислительные свойства практически не проявляются в аналогических соединениях вольфрама, что соответствует общей закономерности для d-элементов: c увеличением порядкового номера элемента в группе увеличивается устойчивость соединений с высшей степенью окисления.
В свойствах элементов этой группы проявляются закономерности, характерные для всех d-элементов. Незначительное увеличение орбитального радиуса молибдена (по сравнению с хромом) и небольшое
уменьшение орбитального радиуса вольфрама (вследствие лантаноидного сжатия) определяют следующие свойства: в группе сверху вниз энергия ионизации увеличивается, что ведет к уменьшению металлических и восстановительных свойств элементов. Поэтому самым активным является хром, он проявляет и более сильные восстановительные свойства.
Химия хрома, молибдена и вольфрама, как и у других d-элементов представлена большим числом комплексных соединений, для которых наиболее характерно координационное число 6, что соответствует sp3d2-гибридизации.
Элементы группы VIБ, в отличие от других d-элементов ,образуют кислородные полимерные соединения сложного состава .Склонность к полимеризации у Cr(VI) слабо выражена и сильнее проявляется у Мо(VI) и W(VI).Образование полимерных ионов обьясняется большой энергией связи М-О и способностью мономерных ионов МоО42- и WO42- образовывать полимерные кристаллы.
История открытия молибдена и его распространение в природе
Минерал, которым писали, попал в лабораторию другого большого химика, Карла Вильгельма Шееле. Первое, что он сделал, это исследовал, как на этот минерал действуют крепкие кислоты. В концентрированной азотной кислоте минерал растворился, но при этом в колбе выпал белый осадок. Высушив его и исследовав, Шееле установил, что особая белая земля обладает свойствами кислотного окисла.
Лишённый чувств зависти, беззаветно преданный науке, Шееле с волнением ждал результата. И когда опыты завершились получением неизвестного металла, Шееле написал Гьельму: «Радуюсь, что мы теперь обладаем
Это было в 1790 г. Новый металл получил имя – чужое имя, потому что латинское molibdaena происходит от древнегреческого названия свинца – μολνβδος. В этом есть парадокс – трудно найти металлы более несхожие чем молибден и свинец.
Но металл полученный Шееле и Гьельмом, не был чистым: при прокаливании с углем трёхокиси молибдена МоО3 невозможно получить чистый Мо, т.к. он реагирует с углем, образуя карбид.
Уже после смерти обоих первооткрывателей их знаменитый соотечественник Берцелиус восстановил молибденовый ангидрид не углем, а водородом, получил чистый молибден, установил его атомный вес и подробно исследовал его свойства.
Молибден принадлежит к малораспространённым элементам. Среднее содержание его в земной коре составляет ~3•10-4% (по массе). Концентрация молибдена в рудах незначительна. Эксплуатируются руды, содержащие десятые и даже сотые доли процента молибдена.
Различают несколько видов молибденовых руд:
1.простые кварцево-молибденовые руды, в которых молибденит залегает в кварцевых жилах.
2.Кварцево-молибдено- вольфрамитовые руды, содержащие наряду с молибденитом вольфрамит.
3.Скарновые руды. В рудах этого типа молибденит часто с шеелитом и некоторыми сульфидами (перит, халькоперит) залегают в кварцевых жилах, заполняющих трещины в скарнах (окременённых известняках).
4.Медно-молибденовые руды, в которых молибденит сочетается с сульфидами меди и железа. Это наиболее важный источник получения молибдена.
Содержание молибдена в биосфере тесно связана с живым веществом и продуктами его распада; среднее содержание Молибдена в организмах 1·10-5%. На земной поверхности, особенно в щелочных условиях, Mo (IV) легко окисляется до молибдатов, многие из которых сравнительно растворимы. В ландшафтах сухого климата Молибден легко мигрирует, накапливаясь при испарении в соляных озерах (до 1-10-3%) и солончаках. Во влажном климате, в кислых почвах Молибден часто малоподвижен; здесь требуются удобрения, содержащие Молибден (например, для бобовых).
В речных водах Молибдена мало (10-7 - 10-8%). Поступая со стоком в океан, Молибден частично накапливается в морской воде (в результате ее испарения Молибдена здесь 1·10-6%), частично осаждается, концентрируясь в глинистых илах, богатых органическим веществом и H2S.
История открытия хрома и его распространенность в природе
Хром был обнаружен в конце XVIII века.
В 1766 году петербургский профессор химии И.Г.Леман описал новый минерал, найденный на Урале на Березовском руднике, в 15 километрах от Екатеринбурга. Обрабатывая камень соляной кислотой, Леман получил изумрудно-зеленый раствор, а в образовавшемся белом осадке обнаружил свинец.
Спустя несколько лет, в 1770 году, Березовские рудники описал академик П.С.Паллас.
Вот как он описывал хром в своих работах:
“Березовские копи, состоят из четырех рудников, которые разрабатываются с 1752 года. В них наряду с золотом добываются серебро и свинцовые руды, а также находят замечательный красный свинцовый минерал, который не был обнаружен больше ни в одном другом руднике России. Эта свинцовая руда бывает разного цвета (иногда похожего на цвет киновари), тяжелая и полупрозрачная. Иногда маленькие неправильные пирамидки этого минерала бывают вкраплены в кварц подобно маленьким рубинам. При размельчении в порошок она дает красивую желтую краску. ”.
Сначала обнаруженный минерал был назван “сибирским красным свинцом”. Впоследствии за ним закрепилось название “крокоит”.
В конце XVIII века образец крокоита был привезен Палласом в Париж.
Этим минералом заинтересовался известный французский химик Луи Никола Воклен. В 1796 году он подверг минерал химическому анализу.
Он проводит анализ минерала в своем отчете: “Все образцы этого вещества, которые имеются в нескольких минералогических кабинетах Европы, были получены из Березовского золотого рудника. Раньше рудник был очень богат этим минералом, однако говорят, что несколько лет назад запасы минерала в руднике истощились, и теперь этот минерал покупают на вес золота, в особенности, если он желтый.
Образцы минерала, не имеющие правильных очертаний или расколотые на кусочки, годятся для использования их в живописи, где они ценятся за свою желто-оранжевую окраску, не изменяющуюся на воздухе.
Красивый красный цвет, прозрачность и кристаллическая форма сибирского красного минерала заставила минералогов заинтересоваться его природой и местом, где он был найден. Большой удельный вес и сопутствующая ему свинцовая руда, естественно, заставляли предполагать о наличии свинца в этом минерале. ”
В 1797 году Воклен повторил анализ. Растертый в порошок крокоит он поместил в раствор углекислого калия и прокипятил. В результате опыта ученый получил углекислый свинец и желтый раствор, в котором содержалась калиевая соль неизвестной тогда кислоты. При добавлении к раствору ртутной соли образовывался красный осадок, после реакции со свинцовой солью появлялся желтый осадок, а введение хлористого олова окрашивало раствор в зеленый цвет. После осаждения соляной кислотой свинца Воклен выпарил фильтрат, а выделившиеся красные кристаллы (это был оксид шестивалентного хрома) смешал с углем, поместил в графитовый тигель и нагрел до высокой температуры. Когда опыт был закончен, ученый обнаружил в тигле множество серых сросшихся металлических иголок, весивших в 3 раза меньше, чем исходное вещество.
Так впервые был выделен новый элемент. Один из друзей Воклена
предложил ему назвать элемент хромом (по-гречески “хрома” - окраска) из-за яркого разнообразного цвета его соединений. Сначала Воклену не понравилось предложенное название, поскольку открытый им металл имел скромную серую окраску и как будто не оправдывал своего имени. Но друзья все же сумели уговорить Воклена и, после того как французская Академия наук по всей форме зарегистрировала его открытие, химики всего мира внесли слово “хром” в списки известных науке элементов.
В 1854 году удалось получить чистый металлический хром электролизом водных растворов хлорида хрома. В металлургии, где расход хрома для легирования сталей очень велик, используют не сам хром, а его сплав с железом - феррохром.


VI группа побочная подгруппа
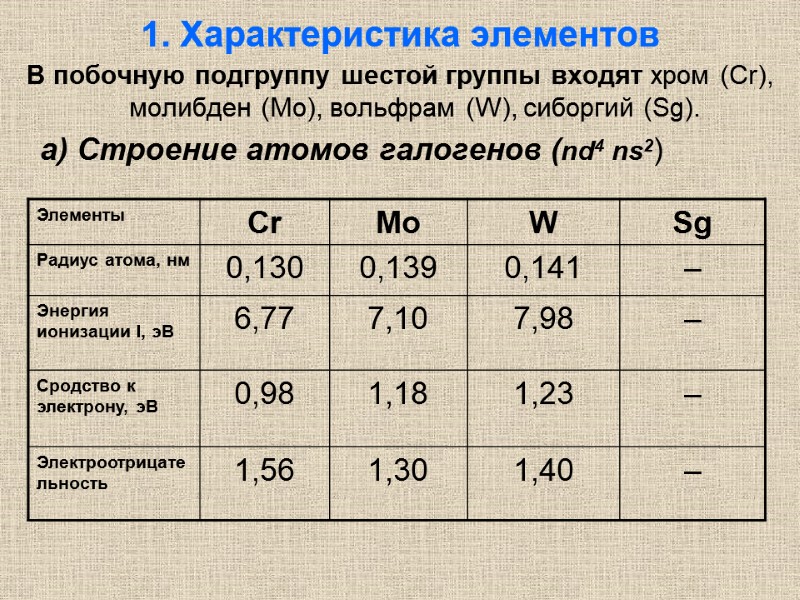
1. Характеристика элементов В побочную подгруппу шестой группы входят хром (Cr), молибден (Мо), вольфрам (W), сиборгий (Sg). а) Строение атомов галогенов (nd4 ns2)

б) Распространенность в природе в) Валентности и степени окисления

2. Простые вещества а) Строение и физические свойства Хром - серебристый Молибден – серо-стальной Вольфрам – серовато-белый блестящий

Способы получения 1.Восстановление оксидов Cr2O3, MoO3 и WO3 Cr2О3 + 2Al 2Cr + Al2O3 MoO3 (WO3) + 3H2 Мо (W) + 3H2О 2. Восстановление галогенидов MoF6 + 3H2 Mo + 6HF 3. Электролизом расплавов 4. Сиборгий получен путем ядерного синтеза

Химические свойства С простыми веществами – с кислородом: 2Мо + 3О2 → 2МоО3 (хром - Cr2О3) – с галогенами: хром – CrHal2, CrHal3; молибден и вольфрам – ЭHal2, ЭHal3, ЭHal4, ЭHal5, ЭHal6 – с серой: ЭхSу – с азотом: Э2N, ЭN – с водородом не реагируют – с углеродом ЭхСу

Со сложными веществами с водой хром – Cr2O3, молибден и вольфрам – ЭО3 с плавиковой и соляной кислотами CrF2 CrCl2 со смесью плавиковой и азотной кислот Н2[ЭF8] с разбавленной серной кислотой CrSO4 с концентрированной серной кислотой Н2ЭО4 (кроме Cr) с азотной кислотой металлы подгруппы не реагируют со щелочами в расплаве в присутствии натриевой селитры

2Сr + 3H2O Cr2O3 + 3H2 Cr + H2SО4(разб.) → CrSО4 + Н2 W + 8HF + 2HNO3 → H2[WF8] + 2NO + 4H2O Mo + 3NaNO3 + 2NaOH → Na2MoO4 + 3NaNO2 + H2O Соединения Бинарные соединения С водородом не дают соединений Оксиды W18O19, Мо17О47, Cr3O8 и т. д. Устойчивы - Cr2O3, а у молибдена и вольфрама – МоО3 и WO3

Оксиды элементов побочной подгруппы VI группы

Получение оксидов 1. Непосредственное взаимодействие металлов с кислородом (Cr2O3, МоО3 и WО3) 2. Разложение кислородсодержащих соединений (NH4)2Cr2O7 → Cr2O3 + N2 + 4H2O 3. Восстановление или окисление других соединений K2Cr2O7 + H2SO4 → 2CrO3 + K2SO4 + H2O 3МоО3 + 2NH3 → 3MoO2 + 3H2O + N2 Химические свойства оксидов Амфотерных Cr2O3 + 2NaOH 2NaCrO2 + H2O Cr2O3 + 6KHSO4 Cr2(SO4)3 + 3K2SO4 + 3H2O

Кислотных CrO3 + H2O → H2CrO4 H2Cr2O7 2KOH + ЭО3 → К2ЭО4 + Н2О Гидроксиды
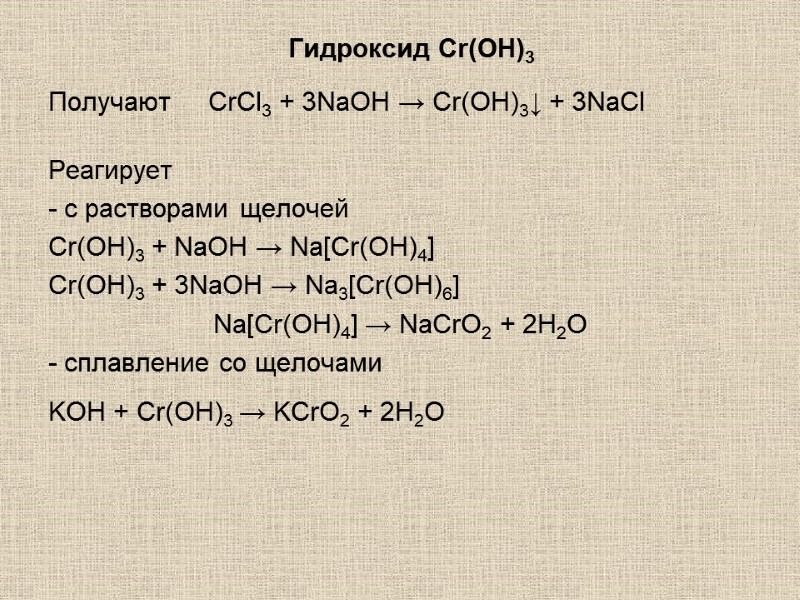
Гидроксид Cr(OH)3 Получают CrCl3 + 3NaOH → Cr(OH)3↓ + 3NaСl Реагирует - с растворами щелочей Cr(OH)3 + NaOH → Na[Cr(OH)4] Cr(OH)3 + 3NaOH → Na3[Cr(OH)6] Na[Cr(OH)4] → NaCrO2 + 2H2O - сплавление со щелочами KOH + Cr(OH)3 → KCrO2 + 2H2O

Хромовая Н2CrO4 и дихромовая Н2Cr2О7 В кислой среде 2CrO42– + 2H+ ⇄ H2O + Cr2O72– В щелочной среде Cr2O72– + 2OH– ⇄ H2O + 2CrO42– Сильные окислители в нейтральной среде K2Cr2O7 + 3(NH4)2S + H2O → 2Cr(OH)3 + 3S + 6NH3 + 2KOH в щелочной среде 2Na2CrO4 + 3(NH4)2S + 2NaOH + 2H2O → 2Na3[Cr(OH)6] + 3S + 6NH в кислой среде K2Cr2O7 + 14HCl → 2CrCl3 + 3Cl2 + 2KCl + 7H2O Применение
Минеральные вещества наряду с белками, жирами, углеводами и витаминами являются жизненно важными компонентами пищи человека, необходимыми для построения структур живых тканей и осуществления биохимических и физиологических процессов, лежащих в основе жизнедеятельности организма. Минеральные вещества участвуют в важнейших обменных процессах организма: водно-солевом и кислотно-щелочном. Многие ферментативные процессы в организме невозможны без участия тех или иных минеральных веществ. Организм человека получает эти элементы из окружающей среды, пищи и воды.
Содержание
Введение
1. Общая характеристика, краткие сведения об истории открытия элементов и их распространённости в природе.
2. Изменение в группе величин радиусов атомов и ионов, потенциала ионизации.
3. Свойства простых веществ: реакции с кислотами.
4. Важнейшие соединения хрома (III) и их свойства.
5. Гидратная изомерия катионов аквакомплексов.
6. Соединения Ме (VI): молибденил- и вольфрамил-ионы; галогениды и оксигалогениды, оксиды,анионные комплексы.
7. Окислительные свойства хроматов и дихроматов.
8. Изополикислоты и гетерополикислоты.
9. Медико-биологическое значение соединений хрома, молибдена, вольфрама.
Заключение
Список Литературы
Прикрепленные файлы: 1 файл
реферат.docx
1. Общая характеристика, краткие сведения об истории открытия элементов и их распространённости в природе.
2. Изменение в группе величин радиусов атомов и ионов, потенциала ионизации.
3. Свойства простых веществ: реакции с кислотами.
4. Важнейшие соединения хрома (III) и их свойства.
5. Гидратная изомерия катионов аквакомплексов.
6. Соединения Ме (VI): молибденил- и вольфрамил-ионы; галогениды и оксигалогениды, оксиды,анионные комплексы.
7. Окислительные свойства хроматов и дихроматов.
8. Изополикислоты и гетерополикислоты.
9. Медико-биологическое значение соединений хрома, молибдена, вольфрама.
Минеральные вещества наряду с белками, жирами, углеводами и витаминами являются жизненно важными компонентами пищи человека, необходимыми для построения структур живых тканей и осуществления биохимических и физиологических процессов, лежащих в основе жизнедеятельности организма.
Минеральные вещества участвуют в важнейших обменных процессах организма: водно-солевом и кислотно- щелочном. Многие ферментативные процессы в организме невозможны без участия тех или иных минеральных веществ. Организм человека получает эти элементы из окружающей среды, пищи и воды. Количественное содержание того или иного химического элемента в организме определяется его содержанием во внешней среде, а также свойствами самого элемента, с учетом растворимости его соединений.
Впервые научные основы учения о микроэлементах в нашей стране обосновал В. И. Вернадский (1960). Фундаментальные исследования были проведены А.П. Виноградовым (1957) - основоположником учения о биогеохимических провинциях и их роли в возникновении эндемических заболеваний человека и животных и В.В. Ковальским (1974) - основоположником геохимической экологии и биогеографии химических элементов. В настоящее время из 92 встречающихся в природе элементов 81 химический элемент обнаружен в организме человека. Минеральные вещества составляют значительную часть человеческого тела по массе (в среднем, в организме около 3 кг золы). В костях минеральные вещества представлены в виде кристаллов, в мягких тканях - в виде истинного либо коллоидного раствора в соединении главным образом с белками. Для наглядности можно привести такой пример: в организме взрослого человека содержится около 1 кг кальция, 0,5 кг фосфора, по 150 г калия, натрия и хлора, 25 г магния, 4 г железа.
Краткая характеристикаVIБ элементов
Вольфрам встречается в природе главным образом в виде окисленных сложных соединений, образованных трехокисью вольфрама WO3 с оксидами железа и марганца или кальция, а иногда свинца, меди, тория и редкоземельных элементов. Промышленное значение имеют вольфрамит (вольфрамат железа и марганца nFeWO4 * mMnWO4 — соответственно, ферберит и гюбнерит) и шеелит (вольфрамат кальция CaWO4). Вольфрамовые минералы обычно вкраплены в гранитные породы, так что средняя концентрация вольфрама составляет 1-2 %.
Читайте также:

